鼠李糖乳杆菌GR-1 介导MAPK 信号通路抗大肠杆菌诱导奶牛子宫内膜上皮细胞炎性损伤
2022-04-26刘佳玮冯晓微焦玉兰靳天雄冯鸣鹊刘明超
刘佳玮,冯晓微,焦玉兰,3,孙 艳,靳天雄,冯鸣鹊,刘 蓓,刘明超,2
(1.河北农业大学 动物医学院,河北 保定 071001;2.河北省兽医生物技术创新中心,河北 保定 071001;3.瑞普(保定)生物药业有限公司,河北 保定 071001)
奶牛子宫内膜炎是一种严重危害奶牛健康的疾病,对奶牛养殖的经济效益影响较大[1]。直接病因是病原微生物的感染,主要有大肠杆菌(Escherichia coli)、链球菌、葡萄球菌、棒状杆菌等[2-3]。这些致病菌容易在奶牛产后侵入子宫,通过分泌黏附素与子宫内膜上皮细胞紧密结合并在此大量繁殖,其释放的毒素和酶类物质被子宫内膜上皮细胞受体识别后,会引起炎症反应。若致病菌未被及时清除,炎症则会持续发展,造成上皮细胞的损伤,物理屏障被破坏,从而导致更多致病菌侵入机体[4],引起子宫甚至全身的疾病。临床上多采用抗生素治疗奶牛子宫内膜炎,但耐药菌株的大量出现使得该方法疗效甚微,同时也提高了治疗成本,因此迫切需要找到更为有效的治疗手段。
益生菌作为抗生素的潜在替代品,可以通过抢占致病菌的黏附位点[5]、合成抑菌物质阻抑病原菌繁殖、调节子宫内pH 值等[6]手段预防及治疗子宫疾病。乳酸菌是生物体内常见的益生菌,有学者从牛子宫内分离得到乳酸菌并将其作用于体外培养的牛子宫内膜上皮细胞,发现乳酸菌具有免疫调节作用[7]。Ametaj 等[8]发现通过阴道灌注乳酸菌,奶牛阴道内的脓性分泌物减少,产奶量提高。Genís 等[9]的研究证明从奶牛阴道内分离得到的乳酸菌可有效降低由大肠杆菌引起的炎症反应,并降低IL-8 和IL-1β mRNA 的表达,相关试验表明乳酸菌对于子宫炎症的治疗效果十分显著。鼠李糖乳杆菌GR-1(Lactobacillus rhamnosusGR-1)是一种乳酸菌,其具有天然的益生特性,在抑制炎症发展方面可以发挥显著的作用[10]。然而与炎症过程相关的分子机制错综复杂,具体通路机制还不是十分明确。因此探索乳酸菌防治奶牛子宫内膜炎的具体通路机制对开发新的奶牛子宫内膜炎防控和治疗手段具有重大意义。
据报道,调节丝裂原活化蛋白激酶(Mitogenactivated protein kinases,MAPK)信号通路是治疗炎症疾病的有效方法。因此本研究利用大肠杆菌刺激原代培养的奶牛子宫内膜上皮细胞(Bovine endometrial epithelial cells,BEECs)建立奶牛子宫内膜炎体外炎性模型,然后利用MAPK 特异性信号通路抑制剂来探究L.rhamnosusGR-1 抗奶牛子宫内膜炎性损伤的具体分子机制,为临床治疗奶牛子宫内膜炎提供理论依据。
1 材料与方法
1.1 生物材料
奶牛子宫取自保定某回民屠宰场(未孕),待牛屠宰后,于冰盒上快速带回实验室进行后续操作。
大肠杆菌(O111:K58(B4),CVCC1450)、鼠李糖乳杆菌GR-1(ATCC55826)均由中国农业大学动物医学院临床营养与免疫实验室惠赠。
1.2 主要试剂
胎牛血清(FBS)购自Gemini 公司;DMEM/F12 培 养 基 购 自Gibco 公 司;Annexin V-FITC 细胞凋亡检测试剂盒,以及SB203580、SP600125、PD98059 等特异性通路抑制剂均购自碧云天生物技术有限公司;LB 肉汤培养基、MRS 肉汤培养基均购自北京奥博星生物技术有限责任公司;p-JNK1、p-p38、p-ERK1/2 一 抗 均 购 自 美 国CST 公 司,GAPDH 一抗购自Proteintech 公司,碱性磷酸酶标记的二抗购自北京博奥森生物技术有限公司;FastKing-RT SuperMix 反转录试剂盒、Superreal PreMix Plus 荧光定量预混试剂盒由天根生化科技有限公司提供;MTT 试剂盒、RIPA 高效细胞裂解液、TriQuick 总RNA 提取试剂等其它常规试剂均购自索莱宝科技有限公司。
1.3 奶牛子宫内膜上皮细胞原代培养
按照王仕宇[11]改进的组织块消化贴壁法,取健康未孕奶牛子宫内膜组织,加入5 mL 含2%双抗、40%胰酶的DMEM/F12 培养基,4 ℃消化12 h,再将组织移至25 cm2细胞培养瓶中,37 ℃、5% CO2的条件下贴壁培养,获得原代奶牛子宫内膜上皮细胞。当细胞长满细胞培养瓶底的80%~90%时,去除培养基,加入2 mL PBS 洗2 次,然后再加入900 µL 胰酶消化3 min,显微镜观察细胞皱缩变圆,轻轻拍打使细胞悬浮后,加入2 mL 完全培养基终止消化,吸至离心管,1 000 r/min 离心5 min,弃去上清液,加入2 mL 完全培养基重悬并计数,按每瓶200 万转移至新细胞瓶中继续培养。
1.4 MTT 法检测细胞增殖
调整细胞浓度至3×105个/mL,按照100 µL/孔将细胞接种于96 孔板中,置于37 ℃、5% CO2的培养箱分别培养12、24、36、48、60 和72 h 后,小心吸去上清,加入90 µL 新鲜培养液,再加入10µL MTT 溶液,继续培养4 h;吸掉上清,每孔加入110 µL Formazan 溶解液,置摇床上低速振荡10 min,在酶标仪490 nm 处测量各孔吸光度。
1.5 实验处理
将处于对数生长期细胞浓度调整至5×105个/mL,按照2 mL/孔将细胞接种于6 孔板中培养24 h,换成无血清培养基过夜。本实验室前期已经成功建立BEECs 炎性模型[12],并确立了提前3 h加入作用浓度为5×106CFU/mL 的L.rhamnosusGR-1,再加入作用浓度为5×105CFU/mLE.coli刺激6 h 的炎性模型方案。试验分为4 个组:对照组(CONT)、E.coli攻毒组(ECOL)、提前3 h加入L.rhamnosusGR-1 单独处理组(LRGR)、提前3 h 加入L.rhamnosusGR-1 预处理再加入E.coli组(LRGR+ECOL)。特异性通路抑制剂作用浓度为10 µmol/L,随L.rhamnosusGR-1 一同加入。
1.6 细胞凋亡检测
当细胞增殖达到90%,去除培养液,利用PBS洗涤3 遍;吸取780 μL Annexin V-FITC 结合液到孔板中,再加入20 μL Annexin V-FITC,混匀;加40 μL 碘化丙啶染色液,混匀。然后用锡纸包盖减少光源照射,室温避光孵育20 min;在倒置荧光显微镜下观察,Annexin V-FITC 是绿色荧光,碘化丙啶(PI)是红色荧光,在1 h 内完成检测。
1.7 Western blot 检测p-JNK1、p-p38、p-ERK1/2蛋白的表达
加入细胞裂解液提取总蛋白,通过BCA 法将蛋白浓度调整一致;在浓缩胶上依次加入5 μL Marker和20 μL 待测蛋白;待蛋白跑至分离胶底部,采用湿式转膜法,将蛋白转至PVDF 膜;浸于5%的脱脂牛奶中封闭1 h;加入p-JNK1、p-p38、p-ERK1/2兔源单克隆抗体(1∶1 000),以GAPDH 鼠源单克隆抗体(1∶1 000)为内参,4 ℃孵育过夜;PBST洗膜4 次,每次5 min;加入与一抗对应的羊抗兔IgG/AP 抗体或羊抗鼠IgG/AP 抗体(1∶1 000),37 ℃、180 r/min,1 h;PBST 洗 膜4 次, 每 次5 min;BCIP/NBT 避光显色;采用image j 软件进行灰度分析。
1.8 实时荧光定量PCR
使 用TriQuick 试 剂 提 取 总RNA, 使 用FastKing-RT SuperMix 试剂盒合成cDNA。根据Superreal PreMix Plus 产品说明书,配置反应体系,引物(见表1)由天一辉远生物科技有限公司合成。采用两步法,扩增条件如下:95 ℃ 15 min 预变性;95 ℃ 10 s 变性,60 ℃ 30 s 退火延伸反应40 个循环。使用罗氏LightCycler 480 实时荧光定量PCR 系统(瑞士罗氏公司)检测各基因Ct 值,以GAPDH为内参基因,采用2-ΔΔCt法计算TNF-α、IL-1β、IL-6 和IL-8 mRNA 的相对表达。

表1 目的基因引物序列、扩增片段长度及序列号Table 1 Target gene primer sequence, amplified fragment length and sequence number
1.9 统计分析
用SPSS 21.0 软件进行单因素方差分析(One Way ANOVA),用LSD 法进行组间多重比较,结果用“平均值±标准误”表示,用GraphPad Prism 8 软件对数据进行作图。P<0.05 表示差异性显著,P<0.01 表示差异性极显著。
2 结果与分析
2.1 细胞形态观察和生长曲线
组织块培养至第2 天,组织块周围有少量细胞爬出,形态呈“放射”状;第8 天细胞基本长满瓶底,大部分呈“铺路石”状;纯化分离后的奶牛子宫内膜上皮细胞可进行传代,与原代细胞生物学特征一致。
从奶牛子宫内膜上皮细胞生长曲线可以看出,12 ~24 h 时间内,细胞生长速度较为缓慢;24 ~60 h 时间段内,细胞生长速度迅速,处于对数生长期;60 ~72 h 时间段内,细胞生长速度比较平缓(见图1),符合正常细胞增殖特性。
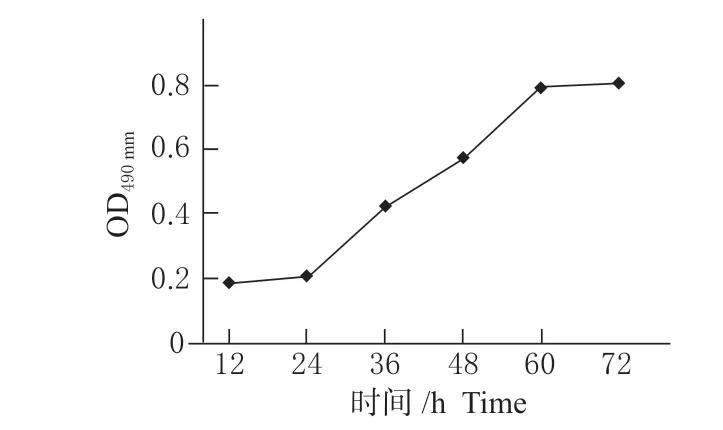
图1 BEECs 生长曲线Fig. 1 Growth curve of BEECs
2.2 L. rhamnosus GR-1 对E. coli 诱导的BEECs凋亡的影响
与对照组相比,E.coli攻毒组的绿色单染数量明显增多,表明E.coli使BEECs 的细胞膜普遍受损,处于凋亡早期;红绿双染数量也明显增多,表明此部分细胞完全丧失细胞膜的完整性,处于凋亡中晚期或者已经坏死。与E.coli攻毒组相比,L.rhamnosusGR-1 预处理组的绿色单染数量和红绿双染数量均有所下降;与对照组相比,L.rhamnosusGR-1 单独处理组绿色单染数量和红绿双染数量没有显著差异(图2)。
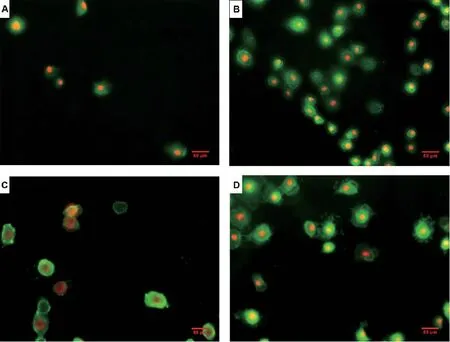
图2 细胞凋亡荧光检测Fig. 2 Fluorescence detection of apoptosis
每组随机选取3 个视野,记录绿色单染数和红绿双染数,计算得出的细胞早期凋亡相对数、死亡相对数(图3)。与对照组相比,E.coli攻毒组的早期细胞凋亡和细胞死亡数极显著增高(P<0.01),L.rhamnosusGR-1 单独处理组与L.rhamnosusGR-1预处理组的细胞凋亡数无显著差异(P>0.05);与E.coli攻毒组相比,L.rhamnosusGR-1 预处理组细胞凋亡数、死亡数均显著降低(P<0.05),L.rhamnosusGR-1 单独处理组细胞凋亡数、死亡数极显著降低(P<0.01)。这表明E.coli可以损伤BEECs 的膜结构,从而导致了细胞凋亡,而L.rhamnosusGR-1 能够保护BEECs,减少E.coli诱导引起的凋亡。
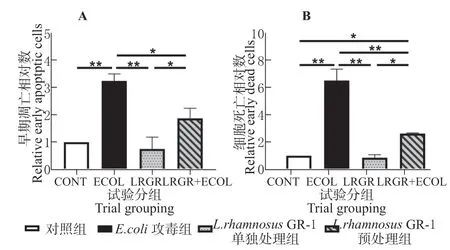
图3 L. rhamnosus GR-1 对E. coli 诱导BEECs 凋亡的影响Fig. 3 The effect of L. rhamnosus GR-1 on the apoptosis of BEECs induced by E. coli
2.3 L. rhamnosus GR-1 对E. coli 诱 导 的BEECs中MAPK 通路的影响
利用Western blot 检测BEECs 中p-p38、p-JNK1和p-ERK1/2 蛋白含量(见图4)。
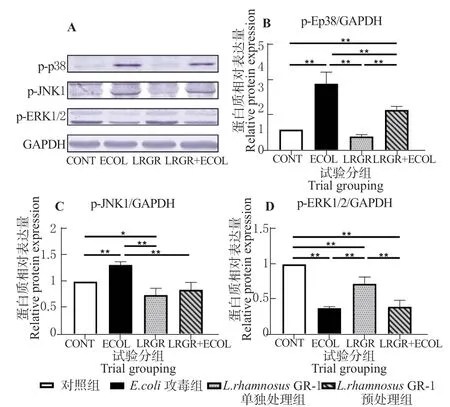
图4 L. rhamnosus GR-1 对E. coli 诱导的BEECs 中MAPK 通路蛋白表达的影响Fig. 4 L. rhamnosus GR-1 effects on MAPK protein expression in E. coli-induced BEECs
与对照组相比,E.coli攻毒组p-p38、p-JNK1蛋白水平极显著升高(P<0.01),p-ERK1/2 蛋白水平极显著降低(P<0.01)。与E.coli攻毒组相比,L.rhamnosusGR-1 预处理组中p-p38、p-JNK1 蛋白水平极显著降低(P<0.01),p-ERK1/2 蛋白水平无显著差异(P>0.05)。与对照组相比,L.rhamnosusGR-1 单独处理组中p-JNK1 和p-ERK1/2 蛋白水平降低(P<0.05 或P<0.01),p-p38 蛋白水平无显著变化(P>0.05)。表明E.coli可以诱导BEECs 中p38、JNK 通路活化,而L.rhamnosusGR-1 可以抑制E.coli诱导的p38、JNK 通路活化。
2.4 L. rhamnosus GR-1 与MAPK 通路抑制剂对E. coli 诱导的BEECs 炎性因子的影响
在L.rhamnosusGR-1 预处理BEECs 3 h 加入E.coli刺激6 h 的基础上,添加MAPK 特异性通路抑制剂,检测细胞中mRNA 的表达(图5)。与对照组相比较,E.coli攻毒组细胞中TNF-α、IL-1β、IL-6 和IL-8 mRNA 表达均显著升高(P<0.05),而L.rhamnosusGR-1 单独处理组的TNF-α、IL-1β、IL-6 和IL-8 mRNA 表达量与空白对照组无显著性差异(P>0.05),表明E.coli可以诱导BEECs 产生炎性因子,L.rhamnosusGR-1 不能刺激BEECs 产生炎性因子;与E.coli攻毒组相比较,L.rhamnosusGR-1 单独处理组及预处理组中的TNF-α、IL-1β、IL-6 和IL-8 mRNA 表 达 显 著 降低(P<0.05), 表明L.rhamnosusGR-1 可以调节E.coli诱导的BEECs 中炎性因子的表达;在添加p38 抑制剂SB203580 和JNK 抑制剂SP600125 后均能引起E.coli攻毒组和L.rhamnosusGR-1 预处理组TNF-α、IL-1β 和IL-6 mRNA 表达水平的显著下降(P<0.05),添加ERK 抑制剂PD98059 后与添加前相比普遍没有显著性差异(P>0.05)。这些结果表明,抑制p38 与JNK 通路可以调节炎性因子的表达,而结合前文中L.rhamnosusGR-1 可以显著抑制E.coli活化JNK、p38 通路的结论,可以得出由E.coli引起的BEECs 炎性反应与MAPK信号通路的活化密切相关,L.rhamnosusGR-1 对炎性因子的调控作用是来自于对JNK 与p38 信号通路的调节。
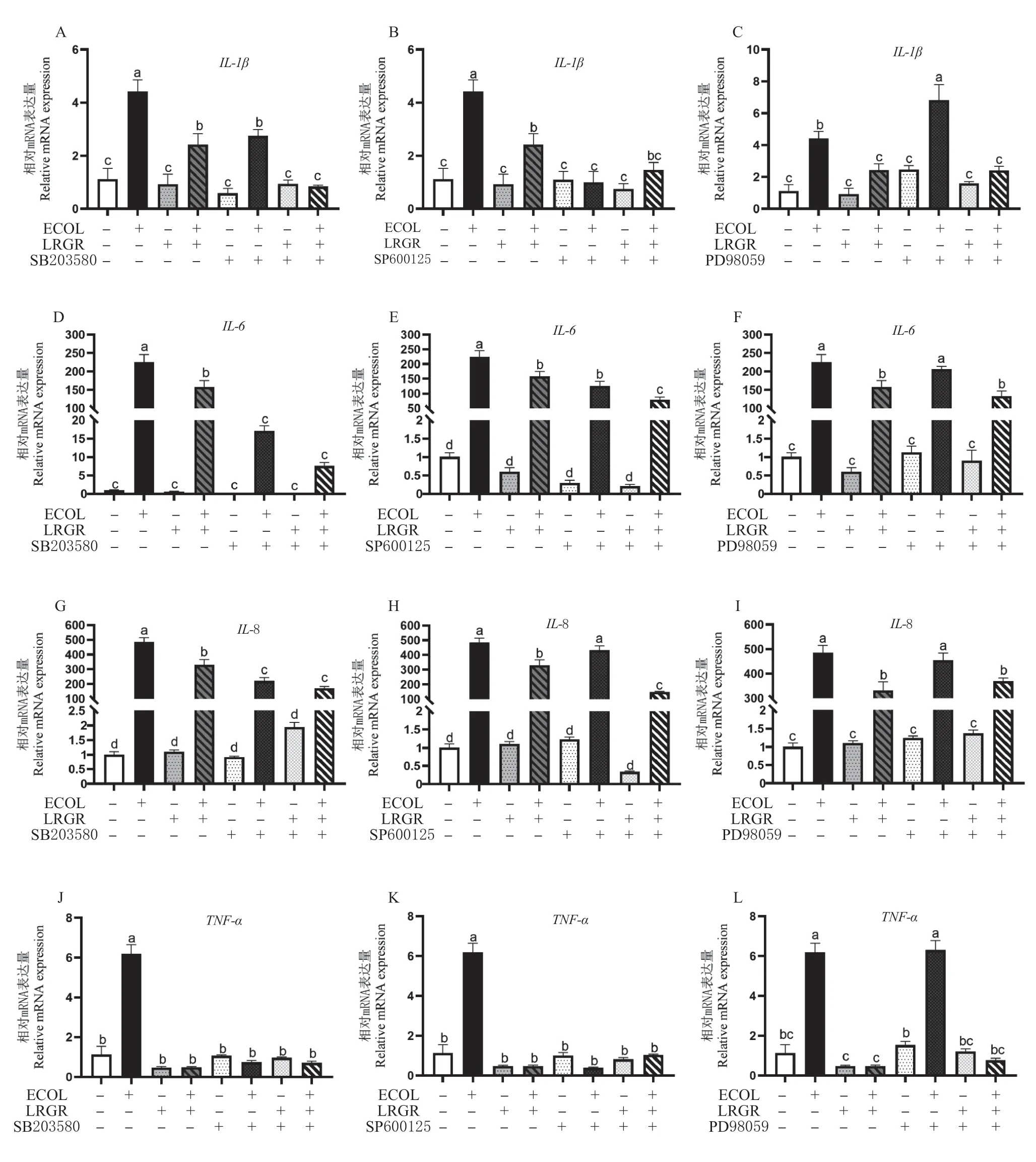
图5 L. rhamnosus GR-1 和MAPK 通路抑制剂(SB203580、SP600125、PD98059)对E. coli 诱导的BEECs 中炎性因子mRNA 表达的影响Fig. 5 L. rhamnosus GR-1 and MAPK pathway inhibitors (SB203580, SP600125, PD98059)effects on the expression of inflammatory factors mRNA in E. coli-induced BEECs
3 讨论与结论
本研究选取的益生菌菌株为L.rhamnosusGR-1,由于具有免疫活性调节的特点而备受关注。Yang 等[13]发现L.rhamnosusGR-1 的上清液可以缓解LPS 引起的炎症和孕鼠流产。Otero 等[14]从健康奶牛生殖道内成功分离到了多株乳酸菌,并且大部分菌株可抑制奶牛子宫内膜炎致病菌的生长,经鉴定,这些乳酸菌菌株中就包括鼠李糖乳杆菌。由此可以看出L.rhamnosusGR-1 对致病菌具有一定的抑制作用,但其具体作用机制还有待进一步研究。
有学者发现乳酸菌L.rhamnosusGG 可以抑制肠上皮细胞的凋亡[15],Liu 等[16]应用E.coli诱导BEECs 构建炎性模型,发现加入L.rhamnosusGR-1 共培养后可以减轻E.coli对细胞超微结构的损伤,表明L.rhamnosusGR-1 对上皮细胞具有保护作用。本研究中,E.coli诱导BEECs 膜结构的损伤导致了细胞凋亡的发生,L.rhamnosusGR-1 能够抑制E.coli诱导的BEECs 的凋亡,进一步证明了L.rhamnosusGR-1 对BEECs 的保护作用。
Toll 样 受 体(Toll like receptor,TLR) 可 特异性识别病原微生物,介导炎症反应。TLR4 是第一个被发现的Toll 样受体。当TLR4 信号通路激活,将信号转导到细胞内,随后与髓样分化因子88(Myeloid differentiation factor 88,MyD88)结合,进而启动下游核转录因子κB(Nuclear factor-κB,NF-κB)及MAPK 等信号通路。其中MAPK 主要分布在细胞质中,是细胞内信号转导的通路,在上皮细胞的免疫中发挥关键作用,是调控炎症过程的关键因子。MAPK 中3 条重要信号途径为氨基末端激酶(JNK)、细胞外信号调节激酶1/2(ERK1/2)和p38 丝裂原活化蛋白激酶(p38 MAPK)。其中ERK 主要介导细胞增殖、分化,JNK 主要介导细胞应激,p38 主要介导炎症反应。Cronin 等[17]利用LPS 刺激奶牛子宫内膜细胞发现MAPK 通路快速磷酸化。Qiao 等[18]发现唾液乳杆菌可以调节产肠毒素大肠杆菌诱导的猪肠道上皮细胞中MAPK 信号通路的表达。本试验结果表明L.rhamnosusGR-1 可以抑制E.coli诱导JNK、p38 通路的活化。对比发现,在本研究中,E.coli未能激活ERK 通路,与对照组相比,E.coli攻毒组显著下降,这表明E.coli可以抑制BEECs 中ERK 通路,而L.rhamnosusGR-1未能调控E.coli对ERK 的抑制作用,这一结论与Qiao[18]在唾液乳杆菌抗ETECK88 诱导的IPEC-J2细胞炎症模型中第6 小时的试验结果一致。
近年来,在奶牛子宫疾病的相关研究中,越来越多的研究表明,MAPK 信号通路是调控炎性反应的潜在靶点[19-20]。本研究发现E.coli会显著增加BEECs 内炎性因子的表达,L.rhamnosusGR-1可显著降低E.coli诱导的BEECs 中炎性因子的表达水平,这些结果证实了L.rhamnosusGR-1 可通过调节炎性因子减少E.coli对BEECs 的损伤。为进一步探索MAPK 通路对促炎细胞因子下调的影响,本研究使用了MAPK 特异性信号通路抑制剂SB203580、SP600125 和PD98059, 特 异 性 信号通路抑制剂可以通透细胞,高选择性的抑制目的信号转导,常被用于信号途径的研究。郭咏梅[21]发现SB203580、SP600125 可以抑制奶牛乳腺上皮细胞中MAPK 信号通路下游因子IL-1 的表达,进而保护细胞免受一氧化氮蓄积的损伤。Qiao[18]发现SB203580 的存在可以降低ETEC K88 诱导的IPEC-J2 细胞IL-1β、IL-8 和TNF-α 的表达水平。本研究发现SB203580、SP600125 可以显著抑制E.coli诱导的BEECs 中炎性因子的表达。以上结果进一步证明了抑制p38 和JNK 信号通路是治疗炎症的有效手段。
综上所述,本研究结果表明,L.rhamnosusGR-1 可通过抑制MAPK 下游的p38 和JNK 信号通路抑制E.coli诱导的BEECs 中TNF-α、IL-1β、IL-6 和IL-8 的表达而发挥抗炎作用,减少E.coli造成的损伤,为今后治疗奶牛子宫内膜炎提供了新的路径。
