甘薯IbERF071基因的克隆及表达特性分析
2022-04-26徐乐陈培茹刘意焦春海雷剑王连军柴沙沙靳晓杰杨园园程贤亮杨新笋张文英
徐乐,陈培茹,,刘意,,焦春海,雷剑,王连军,柴沙沙,靳晓杰,杨园园,程贤亮,杨新笋,张文英
1. 长江大学农学院,湖北 荆州 434025 2. 湖北省农业科学院粮食作物研究所,湖北 武汉 430064
甘薯(Ipomoeabatatas(L.)Lam.)是旋花科(Convolvulaceae)六倍体作物(2n=6×=90,B1B1B2B2B2B2),它不仅营养丰富,而且具有多种保健功能及药用价值,是世界第七大粮食作物、我国第四大粮食作物[1]。近年来,我国甘薯产业规模日益扩大,目前栽培面积和总产量均位居全球首位[2]。然而,甘薯病害的发生制约了甘薯产业的发展。其中,甘薯蔓割病又称镰刀菌枯萎病(Fusariumoxysporumf.batatas),是世界甘薯产区的主要病害之一,严重影响了甘薯的产量和品质[3,4]。因此,研究甘薯抗蔓割病分子机制对于培育甘薯抗蔓割病新品种具有重要的意义。
乙烯应答转录因子(ethylence-responsive element binding factor,ERF)属于AP2/ERF超级家族(AP2/ERF superfamily)中的ERF亚族,含有一个高度保守的由58或59个氨基酸残基组成的AP2结构域,具有典型的螺旋-转角-螺旋结构,保证ERF与GCC-box DNA序列相互作用,参与植物抗病信号传导,是植物中最大的转录因子家族之一[5-7]。大量研究表明,AP2/ERF超级家族中的ERF转录因子在抗镰刀菌枯萎病(真菌病原体)中发挥重要作用。ERF转录因子通过与下游启动子中的顺式作用元件结合,激活下游多个防卫基因如致病相关PR(Pathogenesis-related gene)基因的表达量以增强植物对病原菌的抗性[8]。WANG等[9]研究发现,野生葡萄VaERF20基因在拟南芥植株中可以诱导抗病基因的表达,从而提高植株对丁香假单胞杆菌(Pseudomonassyringaepv.tomato)和灰霉菌(B.cinerea)的抗性;ZHANG等[10]研究发现油桐中异源过表达VmAP2/ERF036,可以增强油桐对茄枯萎病病菌(Fusariumoxysporum)的抗性。ERF1的过表达增强拟南芥对坏死性病原体的抗性,如灰霉菌(B.cinerea)、茄枯萎病病菌[11]。基于AP2/ERF超级家族在调节植物抗病防御过程中的重要作用,已在大豆[12]、苹果[13]、水稻[14]、木薯[15]、棉花[16]、柑橘[17]、本氏烟草[18]、枣[19]等多种植物中进行了研究。目前,关于甘薯中AP2/ERF基因的研究较少。甘薯AP2/ERF基因IbRAP2-12可以提高转基因拟南芥耐盐性和耐旱性的作用[20]。甘薯响应蔓割病菌侵染转录组分析后发现甘薯中大量与乙烯相关基因被上调或下调表达,且上调表达的基因多于下调表达[21]。在干旱、盐胁迫和ABA处理后,甘薯IbERF3基因在根和叶片中表达量都显著上升[22]。IbERF71可与IbMYB340以及IbbHLH2组成复合体与IbANS1启动子结合来共同调节花青素的生物合成[23]。
目前有关ERF转录因子在甘薯抗蔓割病研究中还未见报道。研究以高抗蔓割病甘薯品种‘鄂薯11’为试验材料,克隆获得1个编码乙烯应答的基因IbERF071,并利用生物信息学方法,分析其蛋白理化性质、预测蛋白二级结构及三级结构、比较氨基酸同源性和构建系统发育树,并利用RT-PCR分析IbERF071基因在镰刀菌枯萎病病菌(Fusariumoxysporumf.batatas)、茉莉酸甲酯(MeJA)和乙烯利(ETH)处理下不同时间点的基因表达模式,旨在为进一步探索甘薯IbERF071基因在植物抗病中的功能提供科学依据,为甘薯抗蔓割病品种筛选和育种提供新的种质资源。
1 材料与方法
1.1 试验材料
供试材料为高抗蔓割病甘薯品种‘鄂薯11’,由湖北省农业科学院粮食作物研究所自主选育。
1.2 试验方法
1.2.1 病原菌处理
将镰刀菌枯萎病病菌接种于马铃薯葡萄糖培养基中,置于28℃、200r/min的摇床上避光震荡一周左右,将菌液孢子浓度调至1×107孢子/mL备用。在田间剪取主茎顶部16cm茎段,选取长势一致的健康植株,用装有无菌水的三角瓶(100mL)培养1d,然后转入镰刀菌枯萎病菌液中持续侵染,在光照培养箱中培养(28℃,光周期:16h光照,8h黑暗),处理0、2、4、12、24、48、72h后取甘薯苗的茎部(4cm),液氮速冻后保存于-80℃超低温冰箱备用。
1.2.2 激素处理
在田间剪取长势一致、健康薯苗主茎顶部约16cm茎段,置于1/2霍格兰营养液中生长1周,选取生长状态一致的健康植株,然后分别浸入含有0.1mmol/L茉莉酸甲酯和0.05mmol/L乙烯利的1/2霍格兰溶液中。在光照培养箱中培养(28℃,光周期:16h光照,8h黑暗),处理0、2、4、12、24、48、72h后取甘薯苗的茎部(4cm),液氮速冻后保存至-80℃超低温冰箱备用。
1.2.3 总RNA提取和IbERF071基因克隆
以‘鄂薯11’为材料,使用天漠生物的小量总RNA提取试剂盒提取总RNA,用TransScript®All-in-One First-Strand cDNA Synthesis SuperMix for qPCR(One-Step gDNA Removal)试剂盒(全式金,中国)合成cDNA,-20℃保存备用。在甘薯栽培种六倍体基因组数据库(https://ipomoea-genome.org/)中blast获得该基因的编码区(CDS)序列。利用Premier 5.0软件设计该序列的特异性引物,正向引物序列为5′-ATGTGTGGGGGTGCAATCCT-3′,反向引物序列为5′-TTAGGCACAGCTGGGATTGA-3′。利用PCR扩增试剂盒TaKaRa La Taq®(TaKaRa,日本)进行PCR扩增,扩增体系总体积50μL,包含cDNA模板2μL、2.5mol/L dNTPs 8μL、LATaq聚合酶0.5μL、10×buffer(Mg2+)5μL、10μmol/L正向引物1.0μL、10μmol/L反向引物1.0μL和蒸馏水32.5μL。PCR扩增程序为:94℃预变性5min;94℃变性30s、55℃退火1min、72℃延伸1.5min,共35个循环;72℃延伸10min,4℃保存。PCR扩增产物用质量体积分数1%琼脂糖电泳分离,用DNA回收试剂盒EasyPure®Quick Gel Extraction Kit(全式金,中国)将目的片段回收、纯化;利用pMDTM19-T Vector Cloning Kit(TaKaRa,日本)试剂盒进行载体连接。将连接产物转化DH-5α感受态(全式金,中国),阳性克隆筛选,送至奥科鼎盛生物技术有限公司(武汉)进行测序。
1.2.4 生物信息学分析
利用NCBI的BLASTx(https://blast.ncbi.nlm.nih.gov/Blast.cgi?PROGRAM=blastx&PAGE_TYPE=BlastSearch&LINK_LOC=blasthome)功能,检索与IbERF071基因编码的氨基酸序列的同源序列,利用DNAMAN 6.0软件对同源氨基酸序列进行多重比对;使用MEGA 7.0软件构建同源序列系统进化树(neighbor-joining,bootstrap值为1000);在ExPASy程序(https://web.expasy.org/protparam/)分析IbERF071基因编码的氨基酸序列的分子质量和等电点;用SMART程序(http:∥smart.embl-heidelberg.de/)预测IbERF071基因编码的氨基酸序列的结构域;用SOPMA程序(https://npsa-prabi.ibcp.fr/cgi-bin/npsa_automat.pl?page=npsa_sopma.html)和SWISS-MODEL程序(https://www.swissmodel.expasy.org/)预测IbERF071蛋白的二级和三级结构;用TMpred程序(https://embnet.vital-it.ch/software/TMPRED_form.html)预测IbERF071蛋白的跨膜结构,同时使用Cell-PLoc 2.0程序(http://www.csbio.sjtu.edu.cn/bioinf/Cell-PLoc-2/)预测该蛋白的亚细胞定位。用Plant CARE程序(http://bioinformatics.psb.ugent.be/webtools/plantcare/html/)分析启动子顺式作用元件,并利用GSDS 2.0在线工具(http://gsds.cbi.pku.edu.cn/)绘图。
1.2.5 RT-PCR扩增
利用Primer 5.0软件设计IbERF071基因的荧光定量特异性引物,正向引物IbERF071-F序列为5′-TACCGCCTCCAACTGCTCC-3′,反向引物IbERF071-R序列为5′-TCCCCCAAGGTCGCTGC-3′;以β-Actin基因为内参基因,正向引物序列为5′-AGCAGCATGAAGATTAAGGTTGTAGCAC-3′,反向引物序列为5′-TGGAAAATTAGAAGCACTTCCTGTGAAC-3′。参照PerfectStart®Green qPCR SuperMix试剂盒(全式金,中国)进行PCR扩增,每个样品3次重复。利用BIO-RAD CFX96实时荧光定量PCR仪(BIO-RAD,美国)进行RT-PCR反应。RT-PCR反应体系总体积为10μL,包含cDNA模板1μL、PerfectStart®Tip Green qPCR SuperMix 5μL、10μmol/L正向引物0.4μL、10μmol/L反向引物0.4μL和Nuclease-free water 3.2μL。扩增程序为:94℃预变性30s;94℃变性5s、58℃退火30s,共40个循环。采用2-ΔΔCt法[24]计算各样品中基因的相对表达量。
1.3 数据处理
采用Excel 2016和SPSS 26.0统计分析软件进行数据统计和图表制作。
2 结果与分析
2.1 IbERF071基因的克隆及生物信息学分析
2.1.1IbERF071基因的克隆
以‘鄂薯11’cDNA为模板进行PCR扩增,得到1条CDS序列为864bp的目的片段(见图1),片段长度与预期结果一致,在NCBI在线数据库中对测序序列进行blastp,其与ERF071基因同源性最高,这与NR数据库注释信息吻合,因此将其命名为IbERF071。IbERF071基因共编码287个氨基酸;在其氨基酸序列的第79至第142位包含1个AP2保守结构域和第205至第254位包含1个卷曲螺旋,说明IbERF071转录因子属于AP2/ERF超级家族。
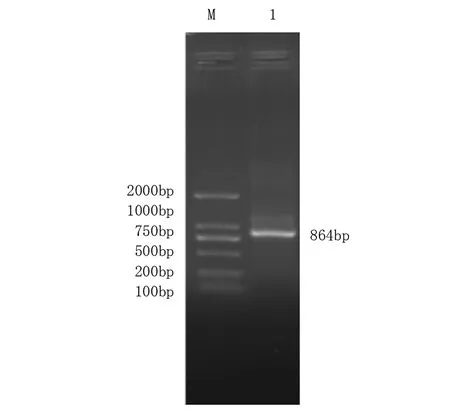
注: M—DNA maker; 1—IbERF071。 图1 甘薯IbERF071基因的PCR扩增结果 Fig.1 Results of PCR amplification of IbERF071 gene from sweet potato
2.1.2 氨基酸序列多重比对和同源性分析
多重比对结果和系统进化分析结果(见图2)表明,甘薯IbERF071基因与牵牛(Ipomoeanil)的氨基酸序列聚为一支、相似度高达89%以上,亲缘关系最近;而与其他物种,如芝麻(Sesamumindicum)、原野菟丝子(Cuscutacampestris)、烟草(Nicotianatabacum)、灯笼椒(Capsiumbaccatum)、油橄榄(Oleaeuropaea)、马铃薯(Solanumtuberosum)、甜瓜(Cucumismel)、番茄(Solanumlycopersicum)和陆地棉(Gossypiumhirsutum)等,它们的ERF蛋白的氨基酸序列明显分离,亲缘关系较远。同时,甘薯IbERF071基因与拟南芥ERF家族成员的系统发育树分析结果(见图3)显示:IbERF071基因在进化关系上与AtERF1G基因(AT1G72360.1)接近。

注:IbERF—甘薯;InERF—牵牛(XP_019163870);CcERF—原野菟丝子(VFQ59607);NaERF—烟草(XP_019247451);OeERF—油橄榄(XP_022891565);SiERF—芝麻(XP_011079624);StERF—马铃薯(NP_001275232);CbERF—灯笼椒(PHT38746);CmERF—甜瓜(NP_001306244);GhERF—陆地棉(XP_040958415.1);SlERF—番茄(AAO34704)。图2 甘薯IbERF071基因氨基酸序列的多重比对及同源性分析Fig.2 Multiple alignment and homology analysis of the amino acid sequence of sweet potato IbERF071 gene

图3 甘薯IbERF071基因与拟南芥AtERFs的系统进化树Fig.3 Phylogenetic tree of sweet potato IbERF071 gene and Arabidopsis AtERFs
2.1.3 IbERF071蛋白结构和理化性质
蛋白质结构预测和理化性质分析结果(见图4)显示,IbERF071蛋白的不稳定指数、脂肪系数和总亲水性平均系数分别为48.26、47.35和-1.003,分子质量为32215.31ku,等电点为5.12,表明IbERF071蛋白是一种不稳定的亲水性蛋白质。该蛋白二级结构的主要元件为随机卷曲和α螺旋,IbERF071蛋白含有61.67%的随机卷曲、26.83%的α螺旋、8.01%的延伸链和3.48%的β转角,它们间次分散在整个蛋白质序列中;在该蛋白质的三级结构中,22%的氨基酸残基结构置信度达到64.06%;亚细胞定位和跨膜结构域的预测结果表明,IbERF071蛋白定位在细胞核中,没有跨膜蛋白且不存在跨膜螺旋区,表明IbERF071蛋白不能进行跨膜运输。

图4 甘薯IbERF071蛋白结构预测结果Fig.4 Prediction result of structure of IbERF071 protein from sweet potato
2.1.4IbERF071基因启动子区的功能分析
利用甘薯栽培种六倍体基因组数据库(https://ipomoea-genome.org/)的序列信息,获得IbERF071基因5′端上游2000bp启动子序列,分析结果表明(图5),IbERF071基因启动子序列包含多种与抗逆相关的顺式作用元件:①典型的真核生物启动子基本元件CAAT-box和TATA-box;②光响应元件G-box、TCCC-motif、Box 4、ATC-motif、ATCT-motif、ACE、AT1-motif和Chs-unit 1m1;③胁迫响应元件MYB、AAGAA-motif、W box和MYB-like sequence;④茉莉酸甲酯响应元件CGTCA-motif和TGACG-motif;⑤低温响应元件MYC;⑥干旱诱导元件ERE;⑦脱落酸效应元件ABRE;⑧植物防御响应元件as-1;⑨水杨酸响应元件TCA element;⑩创伤响应元件WUN-motif;MYB结合位点MBS和缺氧特异性诱导中的类增强因子(ARE)等30种顺式作用元件。

图5 在甘薯IbERF071基因启动子区调控元件的分布顺序Fig.5 The distribution order of regulatory element in promoter region of IbERF071 gene from sweet potato
2.2 甘薯IbERF071基因的表达特异性分析
2.2.1IbERF071基因表达的组织特异性
供试甘薯品种‘鄂薯11’的根、茎、叶中IbERF071基因的相对表达量如图6所示。结果显示,IbERF071基因在根、茎、叶中均有表达,其根中表达量最高,且在根中表达量显著(P<0.05)高于茎、叶,说明IbERF071基因在植物抗病防御过程中具有组织特异性。
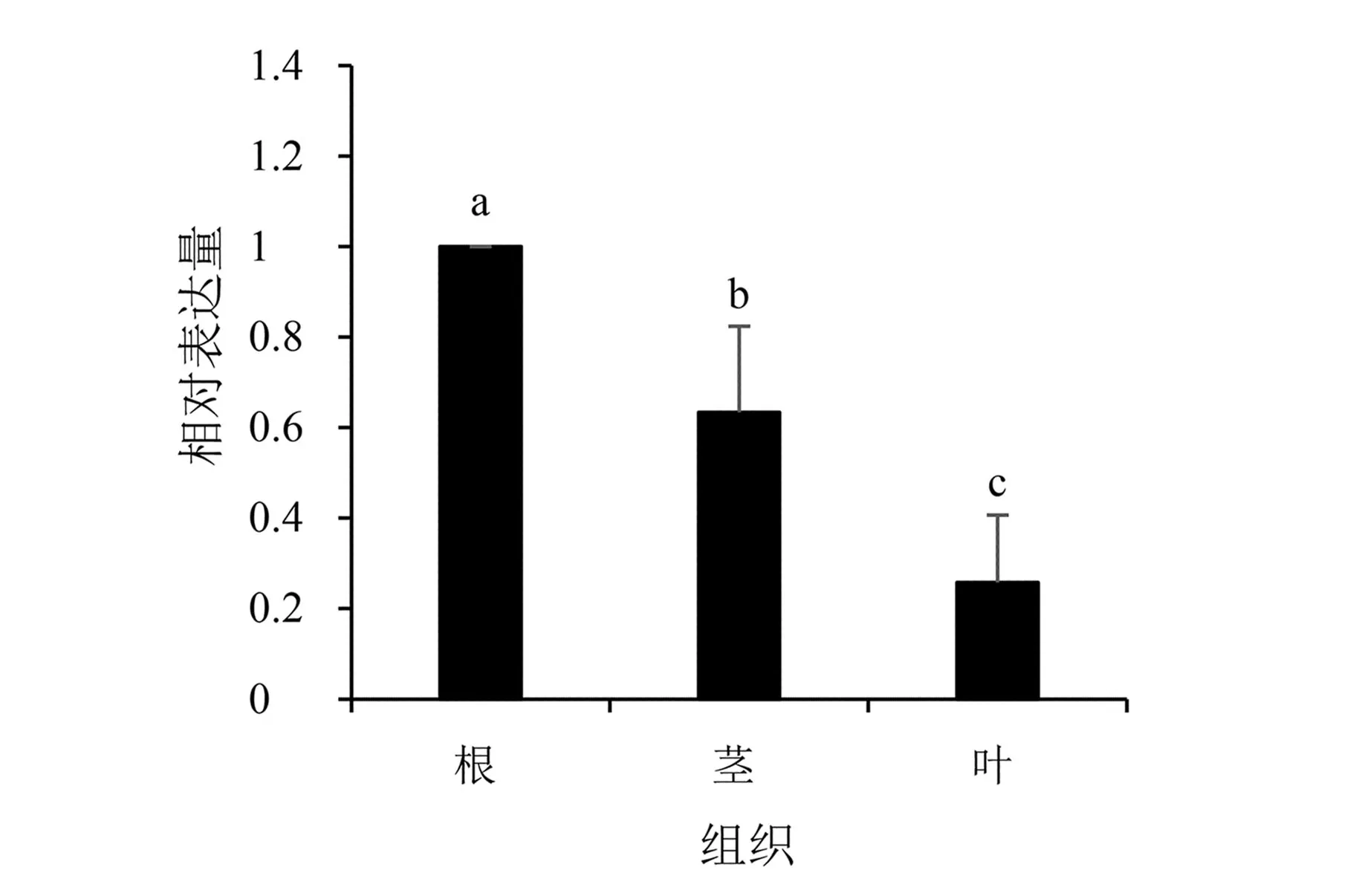
注:不同小写字母表示差异显著(P<0.05),图7、图8同。图6 甘薯不同组织中IbERF071基因表达分析Fig.6 Expression analysis of IbERF071 gene in different tissues of sweet potato
2.2.2 蔓割病菌侵染对IbERF071基因表达的影响
利用RT-PCR技术,检测‘鄂薯11’接种蔓割病菌后IbERF071基因相对表达量的变化。结果(见图7)表明,在蔓割病原菌侵染下,IbERF071基因相对表达量较对照(处理0h)都显著增加且2h时表达量达到峰值,为对照(处理0h)的2.78倍;2~24hIbERF071基因的表达量较胁迫2h后显著降低;随后表达量在24~72h时逐渐稳定且无显著差异。结果表明,IbERF071基因的表达量受到蔓割病菌的侵染影响且在胁迫早期进行响应,推测在甘薯响应蔓割病菌胁迫信号的传导过程中,IbERF071基因在胁迫早期起着重要作用,可作为后续功能分析的候选基因。
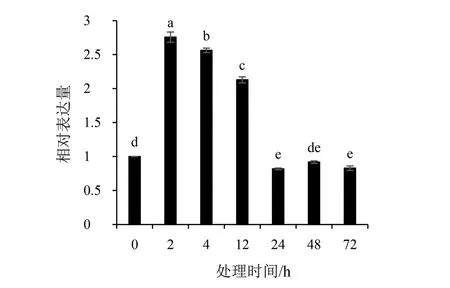
图7 蔓割病原菌侵染下不同胁迫时间IbERF071的相对表达量Fig.7 The relative expression level of IbERF071Fusarium oxysporum f.batatas
2.2.3 植物激素MeJA和ETH诱导IbERF071基因表达
JA和ET信号途径是植物重要的抗病信号传导途径。将16cm的甘薯茎部水培7d后,分别用0.1mmol/L MeJA以及0.05mmol/L ETH进行处理。在0、2、4、12、24、48、72h进行取样并检测茎中IbERF071的相对表达量(结果见图8)。ETH处理48h时IbERF071表达量达到最高,为处理前的5.43倍,而后72h显著下降,处理12h时的表达量显著低于其他处理。MeJA处理12h到24h表达量显著提高,并在72h达最大值,为处理前的6.59倍,其中2、4、48h处理无明显差异。

图8 IbERF071在激素MeJA和ETH处理后在茎中的表达模式Fig.8 The expression mode of IbERF071 in stem induced by hormones MeJA and ETH
3 讨论与结论
甘薯蔓割病是中国南方薯区发生广、危害重的真菌性维管束枯萎病,危害部位最初发生在茎基部,随后地下部蔓茎纵裂,直至枯萎而死;一般减产10%~20%,重者达50%以上[3]。为了找到甘薯生产上蔓割病发生最根本、经济有效的解决方法,挖掘抗病基因、培育甘薯抗病品种是当前最重要的任务之一。
已有研究表明,AP2/ERF转录因子在植物抵抗非生物逆境和生物逆境的过程中都发挥着重要作用[25-28]。ERF家族成员恰好处在植物防御相关信号转导网络的交叉点,通过对下游靶基因的调控发挥在植物逆境胁迫响应的作用,但ERF家族成员在植物响应不同逆境胁迫中的功能不尽相同[29]。该研究从高抗蔓割病甘薯品种‘鄂薯11’中克隆获得的IbERF071基因,通过生物信息学分析,表明该基因CDS序列为864bp,编码287个氨基酸,包含1个AP2保守结构域和1个卷曲螺旋,无跨膜区这与ERF056相似[30]。基于ERF基因编码的氨基酸序列构建的系统进化树中同属种类物种聚在一起,且与牵牛的ERF基因编码的氨基酸序列相似度达到89%以上。IbERF071蛋白序列与拟南芥AtERF家族成员进行聚类分析,结果显示IbERF1071与AtERF071进化关系较近,表明在进化过程中亲缘关系最近,氨基酸序列越相似,可能具有相似的功能。通过二、三级结构分析发现该基因含有61.67%的随机卷曲、26.83%的α螺旋、8.01%的延伸链和3.48%的β转角,这一比例与橡胶草(Taraxacumkok-saghyz)[31]ERF蛋白二级结构的保守性相似,表明不同物种来源的ERF蛋白在二级结构上也具有一定的保守性;在IbERF071基因的启动子区域含有多个激素应答和逆境胁迫应答相关的元件,这表明IbERF071基因可能参与甘薯防御病原体方面发挥重要作用。
植物在受到外界细菌、真菌、病毒等病原菌侵染时,涉及一系列应答基因和信号转导途径,受多种因素的诱导使植物产生抗性,如乙烯(ET)、茉莉酸(JA)、盐碱、涝渍、低温、病原菌侵染等[32-35]。研究发现,IbERF071基因在‘鄂薯11’的根、茎、叶中均可表达,但相对表达量存在明显差异,说明IbERF071基因的表达具有组织特异性,这可能与甘薯不同部位响应植物激素的诱导表达特异性有关。番茄4周幼龄叶片接种灰霉菌后,SlERF.A1基因表达在接种后48h出现最大值,表达量约为对照组的8倍[36]。‘鄂薯11’在接种蔓割病菌后不同胁迫时间的相对表达量也存在差异,0~2hIbERF071基因的表达量与对照组(处理0h)相比显著增加,且2h时达到最高,为对照的2.78倍,表明IbERF071基因的表达量受蔓割病菌的诱导且在胁迫早期进行响应。JA和ET信号途径是调控植物抗病信号传导的主要途径,甘薯蔓割病抗性受JA信号途径的正向调控[37]。JA和ET信号途径均能快速激活乙烯反应基因AtERF1的表达,并在该途径交叉点的下游起作用[38]。荧光定量分析结果表明IbERF071基因受蔓割病病原菌、MeJA和ETH激素诱导表达,进一步推测甘薯IbERF071在甘薯抗蔓割病菌中的功能与JA/ET介导的激素信号转导途径的联系较为密切,是JA/ET抗病信号传导途径中的重要转录因子。今后将利用超表达、基因沉默、基因敲除等分子技术对IbERF071基因进行深入研究,探讨该基因在甘薯抗蔓割病方面的分子防御功能。
