维持性血液透析患者血清RANKL、OPG 及FGF21 与冠状动脉钙化的关系△
2022-04-26谢双燕崔燕海陈芸芝陈雪芹李博厚刘双信何朝生
谢双燕,崔燕海,陈芸芝,陈雪芹,5,李博厚,刘双信,5,何朝生
[1.南方医科大学第二临床医学院,广州 510515;2.广东省人民医院(广东省医学科学院)肾内科,广州 510080;3.广东省人民医院(广东省医学科学院)影像科,广州 510080;4.广东省人民医院(广东省医学科学院),广州 510080;5.华南理工大学医学院,广州 511436]
心血管疾病是维持性血液透析(maintenance hemodialysis,MHD)患者死亡的首要原因,MHD 患者心血管钙化发生率高达80%~90%[1]。作为肿瘤坏死超家族成员,核因子NF-κB 受体活化因子配体(receptor activator of NF-κB ligand,RANKL)和骨保护素(osteoprotegerin,OPG)在骨形成的调节作用已被证实[2]。早期研究已发现,RANKL/OPG系统与血管钙化的发生密切相关[3]。成纤维细胞生长因子21(fibroblast growth factor 21,FGF21)主要在肝脏合成,在慢性肾脏病[4]和冠状动脉粥样硬化性心脏病(冠心病)患者中[5]也表达增加,且体外试验证实FGF21 可通过RANKL/OPG 系统达到抑制血管钙化的作用[6]。但目前关于MHD 患者RANKL/OPG 系统及FGF21 与冠状动脉钙化的关系的研究尚少,且血清RANKL 浓度与血管钙化的关系尚有争议。本研究通过分析探讨MHD患者血清RANKL、OPG、FGF21 浓度与冠状动脉钙化的关系,为MHD 患者血管钙化进展提供关注及随访指标。
1 资料和方法
1.1 一般资料
选取2018 年1 月至2020 年12 月期间在广东省人民医院行血液透析时间>6 个月,并剔除冠状动脉支架植入术、心脑血管事件急性期及恶性肿瘤患者后,参与本研究共178 例MHD 患者及同期健康人群21 例,所有患者及健康人群均知情同意。178 例MHD 患者年龄为(57.9±1.1)岁,中位透析龄为60(25~75)个月。所有研究对象中,原发病为慢性肾炎65 例(36.5%),糖尿病肾病46 例(25.8%),高血压肾病18 例(10.1%),IgA 肾病14 例(7.8%),多囊肾7 例(4%),梗阻肾6 例(3.3%),间质性肾炎3 例,狼疮肾炎2 例,抗中性粒细胞胞浆抗体相关血管炎肾损害2 例,Fabry 病1 例,病因不明14 例。
1.2 临床资料收集
收集患者年龄、性别、血压、透析龄以及血钙、血磷、甲状旁腺激素(PTH)、碱性磷酸酶(ALP)等资料。
1.3 血清RANKL、OPG、FGF21 浓度测定
所有MHD 患者均在2020-12-1 至2020-12-31期间透析前采集静脉血,健康人群晨起空腹采血,离心分离上清,-80 ℃保存,酶联免疫吸附试验法(enzyme-linked immunosorbent assay,ELISA)检测血清RANKL、OPG 及FGF21 浓度;RANKL、OPG 灵敏度1.95 pg/mL,FGF21 灵敏度3.9 pg/mL,试剂盒均购置CUSABIO 公司,按照说明书操作,批内变异系数均小于8%,批间系数均小于10%。
1.4 冠状动脉钙化评分测定及分组
在采血期间的1 年内(202-01-01 至2020-12-31)使用多层螺旋计算机断层扫描(multislice spi⁃ral computed tomography,MSCT)平扫受试者胸部,由专职的放射科医生根据钙化血管进行测量,并通过钙化积分软件得到冠状动脉钙化积分(coronary artery calcification score,CACs)(Agaston评分)[7]。Philip 等[8]发现CACs>400 分时,心血管事件尤其是冠状动脉事件的发生率显著升高。本研究根据Rumberger 冠状动脉钙化分级法将178 例患者分为3组:无钙化组(CACs<10分)37例、轻度钙化组(10 分<CACs<400 分)44 例、重度钙化组(CACs>400 分)97 例。冠状动脉钙化定义为CACs>10 分。
1.5 统计学分析
采用SPSS 26.0 软件进行数据分析。计量资料符合正态分布,以()表示,组间差异采用方差分析;非正态分布计量资料用[M(Q1~Q3)]表示,组间差异采用Mann-WhitneyU检验。计数资料以[n(%)]表示,采用卡方(χ2)检验。相关性分析采用Pearson 或Spearman 秩检验,计算RANKL、OPG 及FGF21 与CACs 的相关系数。采用受试者工作特征曲线(receiver operating characteristic curve,ROC)分析诊断界点。以P<0.05 为差异有统计学意义。
2 结果
2.1 冠状动脉钙化情况
冠状动脉钙化的发生率为79.2%(141/178)。3 组患者性别构成、血清钙和磷、甲状旁腺激素、碱性磷酸酶和血脂浓度比较,差异无统计学意义(P>0.05);与无钙化组患者比较,重度钙化组患者的年龄、透析龄、血肌酐、糖化血红蛋白和OPG 浓度均显著升高,舒张压则降低,差异均有统计学意义(P<0.05),详见表1。
表1 3 组患者临床基本资料比较[,M(Q1~Q3),n(%)]
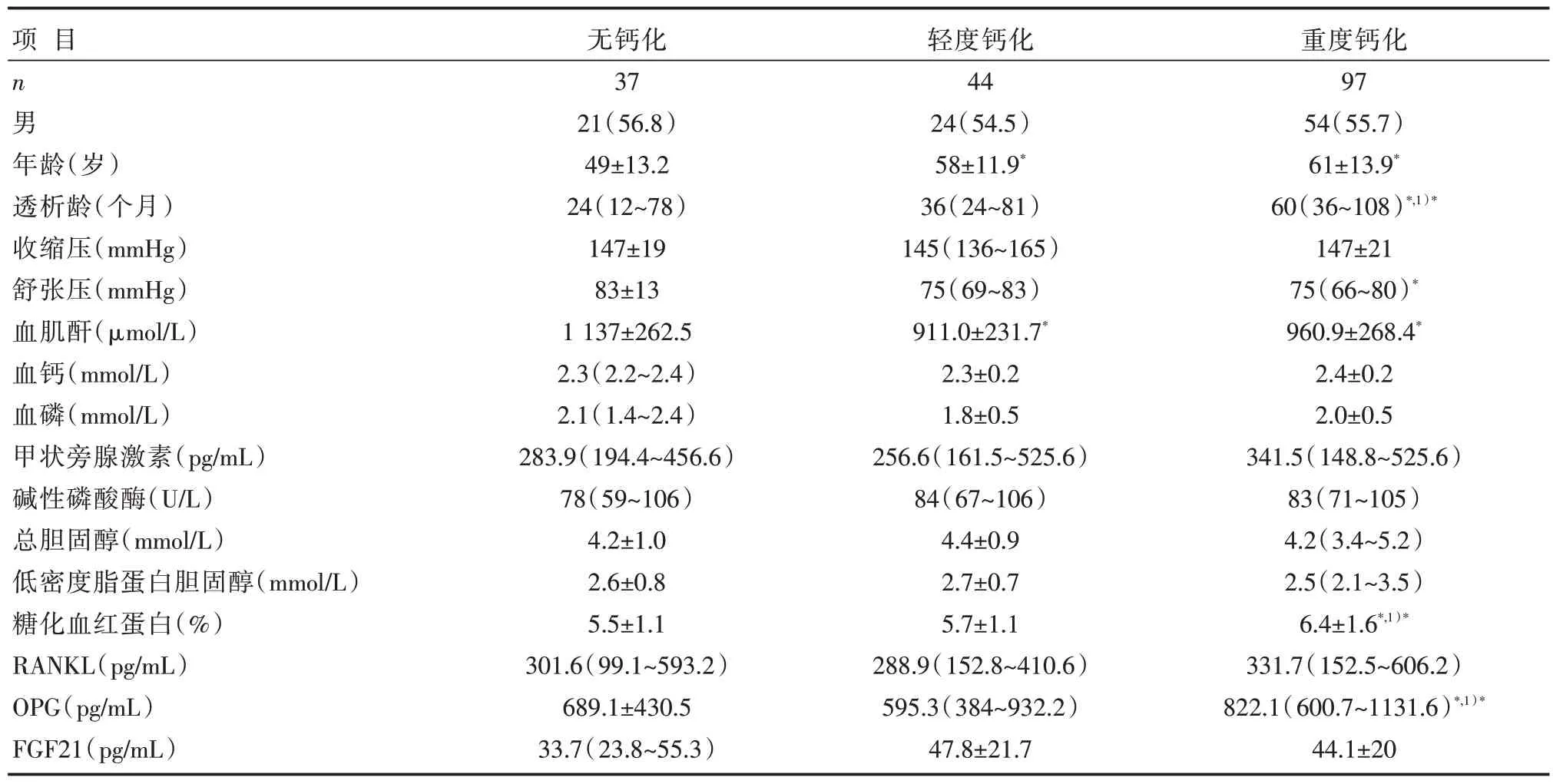
表1 3 组患者临床基本资料比较[,M(Q1~Q3),n(%)]
注:与无钙化组,*P<0.05;与轻度钙化组比较,1)*P<0.05,1 mmHg=0.133 kPa
2.2 血清RANKL、OPG 浓度与其他临床指标的相关分析结果
双变量相关性(Spearman)分析显示,血清RANKL浓度与甲状旁腺激素、碱性磷酸酶成正相关,与血肌酐成负相关;血清OPG 浓度与MHD 患者年龄、透析龄、碱性磷酸酶及糖化血红蛋白成正相关,与血肌酐成负相关,具有统计学意义(表2)。
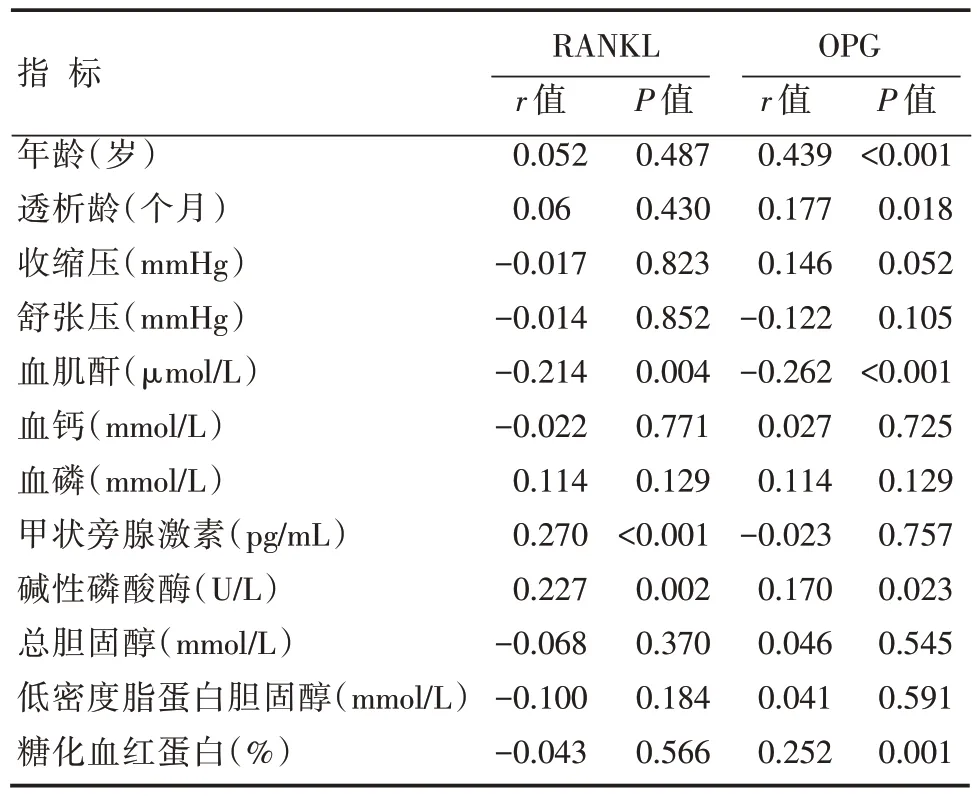
表2 血清RANKL、OPG 与其他临床指标相关性分析
2.3 血清RANKL、OPG 浓度与冠状动脉钙化积分的相关分析结果
Spearman 分析显示血清RANKL 浓度与CACs无关(图1A),且不同钙化分组的RANKL 浓度比较,差别无统计学意义(P>0.05,图2A);Spearman相关分析发现OPG 浓度与CACs 正相关(r=0.217,图1B);重度钙化组的OPG 浓度较轻度钙化组显著升高,差异有统计学意义(P<0.05,图2B)。
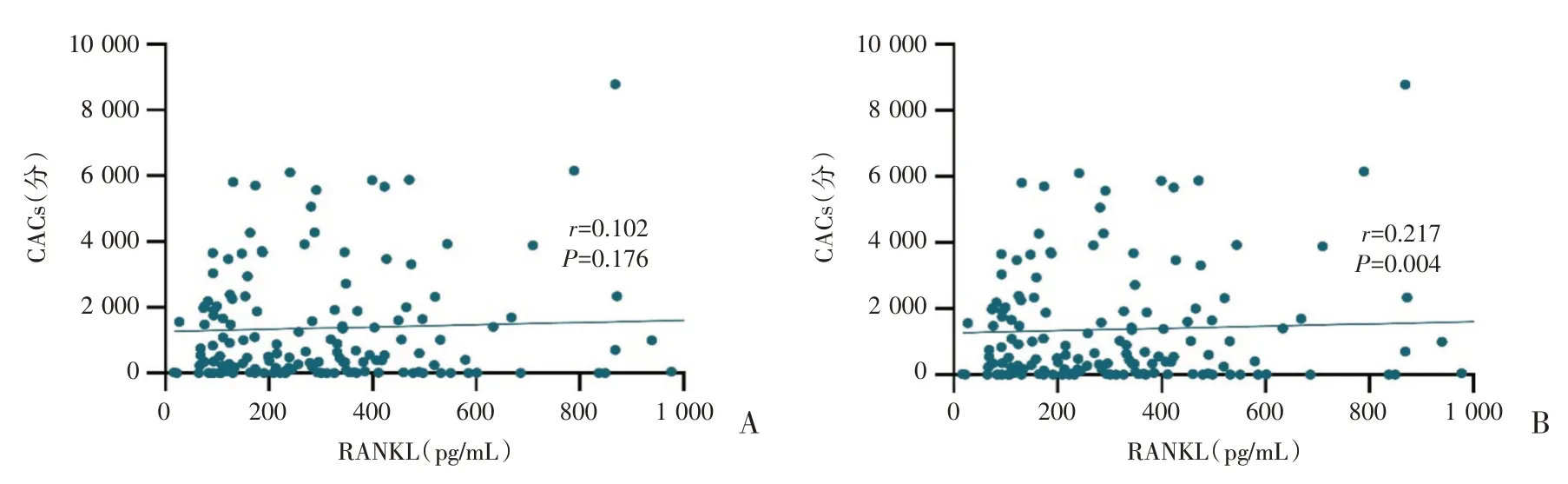
图1 RANKl、OPG 与CACs 的相关散点图(A:血清RANKl 浓度与CACs 的相关散点图;B:血清OPG 浓度与CACs 的相关散点图)
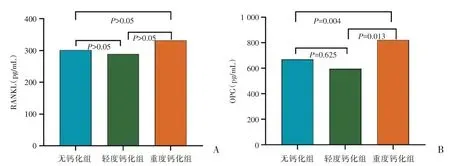
图2 无钙化组、轻度钙化组、重度钙化组患者血清RANKL、OPG 浓度比较的柱状图(A:无钙化组、轻度钙化组与重度钙化组患者的RANKL 浓度比较柱状图;B:无钙化组、轻度钙化组与重度钙化组患者血清OPG 浓度比较柱状图)
2.4 健康对照组及不同钙化组研究对象的血清FGF21 浓度比较
不同钙化分组患者的血清FGF21 浓度比较,差异均无统计学意义(P>0.05),但均高于对照组,且是健康人群的11 倍左右(P<0.001)(图3)。
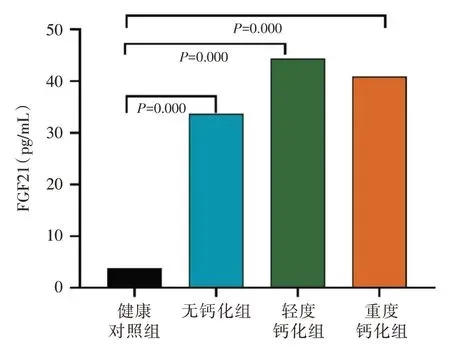
图3 健康对照组及不同钙化组间血清FGF21 浓度比较柱状图
2.5 冠状动脉钙化积分与其他指标的相关性分析结果
双变量相关性分析表明CACs 与MHD 患者年龄、透析龄、糖化血红蛋白正相关,与舒张压及血清肌酐浓度负相关(P<0.05)(表3)。根据CACs=400 分为临界点将178 例MHD 患者分为轻度钙化组、重度钙化组,二分类Logistic 回归分析发现年龄、透析龄和糖化血红蛋白是冠状动脉钙化进展的独立危险因素(图4)。
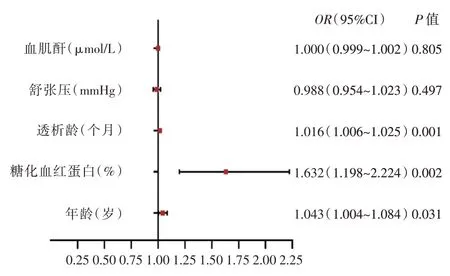
图4 冠状动脉钙化危险因素森林图
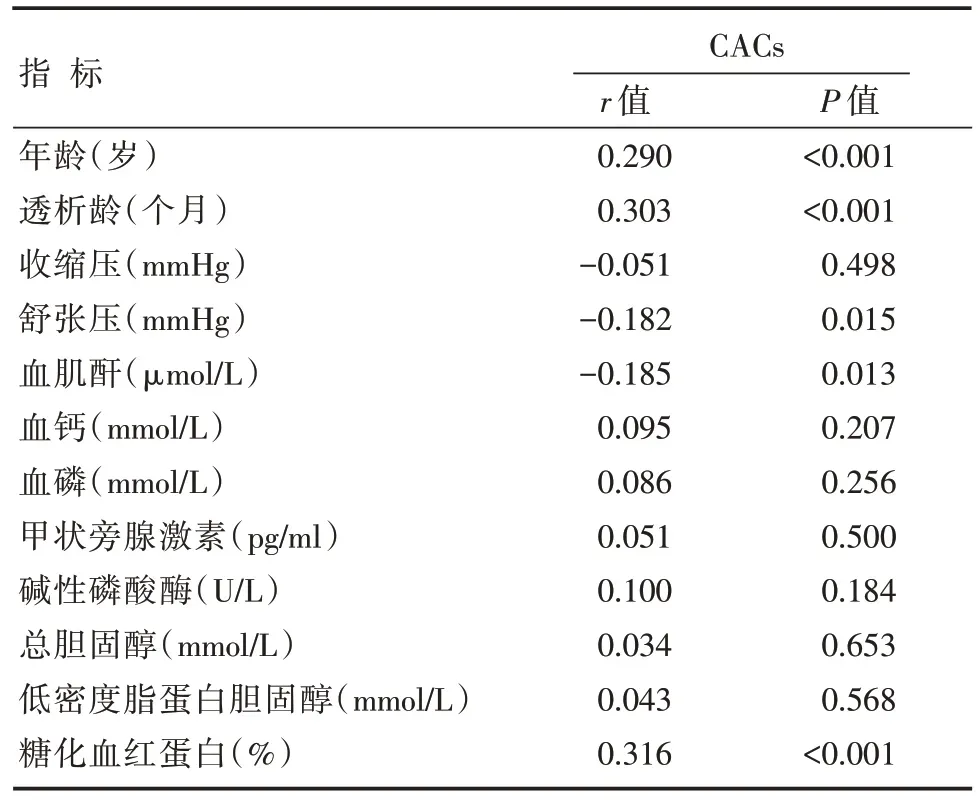
表3 CACs 与其他指标的相关性分析结果
2.6 不同指标对重度冠状动脉钙化诊断的受试者工作特征曲线分析结果
OPG 对重度冠状动脉钙化诊断的ROC 曲线下面积(the area under the curve,AUC)为0.66,其特异度和灵敏度同时达到最高的诊断界点为773.7 pg/mL,此时对重度冠状动脉钙化诊断的敏感度为60.1%,特异度为67.6%;年龄、透析龄和糖化血红蛋白作为冠状动脉钙化进展的独立危险因素,其ROC 的AUC 分别为0.63、0.66、0.67,与OPG 对MHD 重度钙化患者诊断价值相似,而联合OPG、年龄、透析龄及糖化血红蛋白对重度冠状动脉钙化的诊断的AUC 可达0.77,较单独指标而言具有更高的诊断价值(结果见表4,图5)。
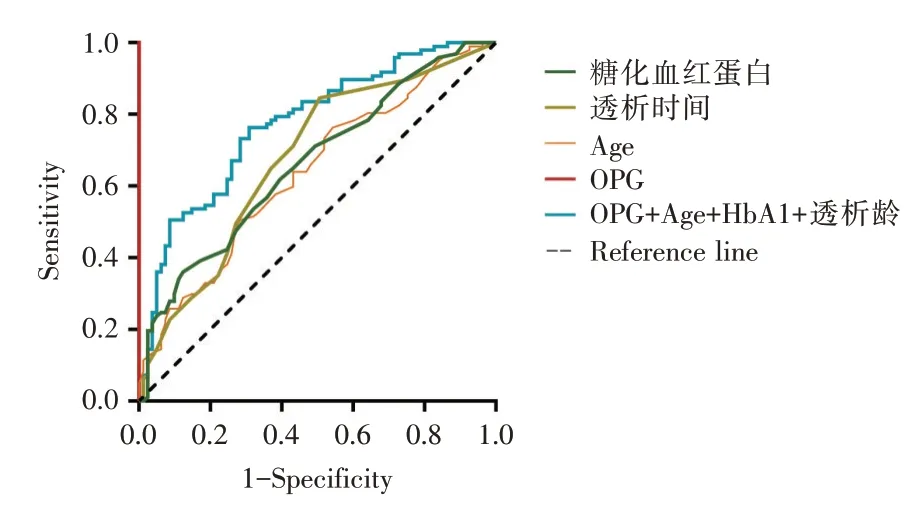
图5 不同指标对重度冠状动脉钙化诊断的ROC 图
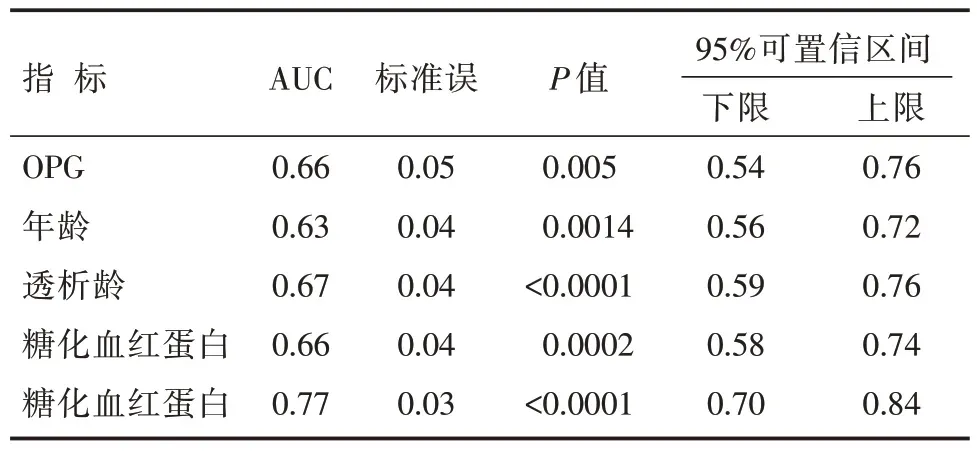
表4 不同指标对重度冠状动脉钙化诊断的ROC分析结果
3 讨论
近年来MHD 患者年病死率仍居高不下,达15%~20%[9],而心血管疾病是MHD 患者死亡的主要原因,Yeboah 等[10]发现冠状动脉钙化对心血管疾病发生有很强的预测价值,因此对MHD 患者冠状动脉钙化的发生、发展进行及早的干预,对减少MHD 患者心血管疾病事件的发生及病死率,提高MHD 生存时间及质量有重大意义。
CACs 是以MSCT 为基础进行检测和定量的,MSCT 作为诊断血管钙化的“金标准”[11],与数字减影血管造影(DSA)在冠状动脉疾病的诊断价值相当[12]。本研究进行冠状动脉钙化定量发现,MHD 患者重度冠状动脉钙化发生率甚至超过50%(54.5%),预示着MHD 患者出现冠状动脉疾病的高风险[8]。
Panizo 等[3]发现RANKL 在血管钙化病变组织中表达增加,直接证明了血管的RANKL 表达增加与血管平滑细胞(VSMC)钙化相关,但同时发现血清RANKL 浓度并未改变。本研究同样发现,血清中RANKL 浓度与CACs 无关,且与传统的血管危险因素年龄、血脂等无关,与其他作者研究结果相似[13]。OPG 主要在成骨细胞表达,拮抗RANKL 作用。早在1998 年的动物试验中就已发现OPG 基因敲除的小鼠具有严重的骨质疏松及动脉钙化,提示OPG/RANKL 系统与血管钙化密切相关[14]。研究发现,OPG 不仅是骨重建的关建因素,同时也是MHD 患者发生CAC 的强预测因子[15],与这些研究类似,本研究结果显示,血清OPG 浓度与CACs 正相关,且与冠状动脉钙化严重程度有关。有趣的是,Marion 等[16]研究发现OPG 浓度在757.7 pg/mL 以上时可预测慢性肾脏病(CKD)患者冠状动脉钙化的发生,而本研究同时发现OPG 浓度在773.7 pg/mL 以上时其诊断敏感度和特异度最高。动物模型研究表明OPG 可抑制血管钙化,其OPG 抑制血管钙化的机制:(1)OPG 抑制骨吸收的同时抑制血管钙化;(2)RANKL 与RANK 结合增加血管平滑细胞钙化,OPG 通过直接抑制RANKL 起到抑制血管钙化作用[3]。因此,对患者血清OPG浓度的随访,可提高对冠状动脉钙化进展的认识,减少MHD 患者心血管事件的发生。
FGF21 作为糖脂代谢的重要调节因子,首先在肝脏组织中被发现,也表达于胰腺、骨骼肌和肾脏组织[17]。在动物模型中已发现FGF21 可通过RANKL/OPG 系统、BMP2/Smad 信号通路抑制血管钙化[6],临床研究也显示冠心病和慢性肾脏病患者血清FGF21 浓度明显升高[4,5]。LEE 等[18]则认为,血清FGF21 浓度与冠状动脉狭窄状态无关,而是与血脂代谢及胰岛素抵抗相关,本研究结果同样显示MHD 患者FGF21 与CACs 及冠状动脉钙化严重程度无关。在本研究中,血清FGF21 浓度较健康人群明显升高,大约11 倍,考虑到本研究对象为MHD 患者,FGF21 浓度的升高可能是由于其高血压、血脂异常及糖尿病等传统冠状动脉钙化危险因素影响更显著。值得注意的是,最近的研究发现:血清FGF21 浓度可作为预测MHD 患者主动脉钙化的指标,同时通过体外实验发现FGF21 可增强甲状旁腺激素对主动脉内皮细胞的钙化作用[19]。
本研究也存在局限性,首先本研究为回顾性研究,所有MHD 患者在研究前都已进行了计算机断层扫描检测,可导致一部分患者因不具备计算机断层扫描检测结果而被排除,造成选择偏差;其次是血清FGF21 在透析患者的冠状动脉钙化及主动脉钙化关系的不同需要进一步研究。
总之,通过对最近提出的预测血管钙化的临床指标:RANKl、OPG 及FGF21 的研究,证实了血清OPG 浓度与MHD 患者冠状动脉钙化严重程度相关,血清OPG 浓度可作为预测冠状动脉钙化进展的临床指标之一;循环中的RANKL 浓度在冠状动脉钙化中未见改变;血清FGF21 浓度与MHD患者冠状动脉钙化及进展无关,但较健康人群明显升高,其机制尚未完全明确,需要进一步探讨及分析。
