接种内生降解菌Stenotrophomonas pavanii DJL-M3对多菌灵胁迫下水稻根际微生态的影响
2022-04-25冯发运岳远浩李俊霞程金金葛静余向阳
冯发运,王 亚,岳远浩,李俊霞,孙 星,程金金,葛静,余向阳,*
1 江苏省农业科学院,农业资源与环境研究所,南京 210014
2 省部共建国家重点实验室培育基地-江苏省食品质量安全重点实验室,南京 210014
3 青岛科技大学,青岛 266042
4 福建农林大学,福州 350002
植物根系是联系植物与土壤微生态环境的纽带,保持根际微生态系统活力对植物主动适应和抵御污染物胁迫意义重大[1]。在水稻等作物栽培管理过程中,大量农药未能起到防治靶标的作用,而是直接散落到环境[2];据研究统计,施入农田的农药有70%进入作物所在土壤[3],随着土壤农药残留累积含量的增加,作物的根际微生态也可能遭受污染物胁迫。多菌灵(Carbendazim,化学名称为N-(2-苯并咪唑基)氨基甲酸甲酯)是我国农业生产中大量使用的一种重要的杀菌剂,近年来在农产品中检出率较高[4—5],其在农田环境和农产品中的残留风险问题也逐渐受到关注。多菌灵在稻田土壤中很难迁移及降解,在水稻收获期前14 d依然能够检出[2]。残留累积于农田环境中的多菌灵污染长期威胁土壤健康,不仅对稻区生态环境中的蚯蚓等有益生物带来毒害[6—7],同时降低了土壤微生物群落的生物量及功能多样性[8],还会通过植物根部、叶部和籽粒累积进入食物链[9],最终污染如糙米、米糠及精白米等农副产品[10—11],对人类和畜禽健康造成危害。因此,探索有效的环境污染修复和农作物中残留消减途径有重要意义。
利用内生降解菌协同提升环境污染物的植物修复效率,降低农作物中农药等有机污染物的残留累积,是农业生态环境治理和农产品质量安全控制领域的一项有益探索工作。利用植物内生菌定殖在植物根表及组织内形成互利共生体系,不仅可降低外界环境及微生物竞争对其污染物降解功能的影响[12],内生菌分泌的植物促生因子还能提高宿主对不利环境胁迫的耐受能力[13],而宿主植物的表型特性又会通过根际互作影响土壤微生态的健康,进一步促进残留有机污染物的降解、维持土壤微生物多样性及稳定性[14]。我们前期研究发现,具有农药降解功能的内生菌定殖水稻后,不仅可促进污染胁迫条件下水稻植株的生长,还可加速植株残留农药的消解,降低稻田土壤、水稻植株以及稻谷中的农药残留量[15—16]。然而,关于接种降解性内生菌对原位土壤微生态影响的研究却鲜有报道。根际微生态尤其是土壤动物及微生物成员对植物接种内生降解菌的响应,是评价内生菌-植物互作模式用作农药污染修复手段安全性与合理性的重要依据。本文以盆栽土培方式模拟水稻大田生长环境,研究内生降解菌StenotrophomonaspavaniiDJL-M3定殖对多菌灵暴露下水稻根际微生态中原生动物(蚯蚓)的胁迫耐受性,根际微生物群落代谢功能多样性和土壤酶活性的影响,结果为全面揭示内生降解菌在农田生态修复中的作用机制提供理论基础。
1 材料与方法
1.1 供试材料
水稻内生菌:分离自水稻植株根部,对多菌灵具有较高耐药性及降解能力,同时具备良好的植物促生长特性,经生理生化试验及16S rRNA 同源化比对分析,鉴定其为寡养单胞菌属(StenotrophomonaspavaniiDJL-M3),该菌株已送中国普通微生物菌种保藏管理中心保存(保藏号:CGMCC No.21198)。
水稻:品种为南粳5055,由江苏省农业科学院提供。
蚯蚓:赤子爱胜蚯蚓(Eiseniafoetida)购自江苏省句容市王军蚯蚓养殖场,每条体重约300 mg,体长约60 mm,经实验室预培养后挑选带环明显,大小基本一致的健康成蚯,试验前清肠24 h。
土壤:采集自江苏省农业科学院水稻田,其基本理化性质为:pH 5.97,总有机质含量66.8 g/kg 干土,氮含量 0.36%,碳含量49.61%,氢含量5.72%,硫含量0.01%,氧含量44.37%。土样自然风干后过50目网筛去除大颗粒石子备用。水稻栽培过程中喷洒无菌水以保持约60%含水量。
多菌灵:多菌灵可湿性粉剂购自江阴福达农化股份有限公司,其有效成分含量为50%。
1.2 试验设计
水稻苗在育秧盘上生长至三叶一心(约15 cm)后选取10株移栽至直径15 cm,高25 cm 的塑料盆钵,每盆含500 g稻田土并均匀放养10只蚯蚓。按表1 的方式设置空白处理组(Control),内生菌接种的多菌灵处理组(CBZ-M3)与未接菌的多菌灵处理组(CBZ)。其中水稻内生多菌灵降解菌DJL-M3预经胰酪胨大豆肉汤培养基(TSB)富集过夜培养后,用无菌磷酸缓冲液PBS(pH 7.0)清洗并重悬成OD600 nm值为1.0的菌悬液,取30 mL 菌液浇灌水稻根部进行接种处理。按照推荐剂量(120 g/hm2)对盆栽水稻喷施多菌灵药剂,于施药后2 h、1 d、3 d、7 d 及14 d采集水稻根际土壤并用液相色谱仪分析不同处理下水稻根际土壤多菌灵的降解规律,获得最终残留含量(14 d)并计算降解半衰期,稻田土壤多菌灵的提取及检测参照刘双双等[10]建立的方法。药剂处理后为了防止蚯蚓逃离,用保鲜膜封住每个盆钵顶部,仅留水稻地上部分于外界,并用移液枪头在保鲜膜上随机扎上气孔。每个处理6个重复。整个试验在温室条件(光照16 h/黑暗8 h,30℃/25℃)下进行,在多菌灵喷施后定期收集根际土壤,进行土壤酶活检测与微生物群落多样性分析,施药两周后结束试验,同时将盆钵土倒置回收试验蚯蚓,统计存活率、测定其解毒酶活性。
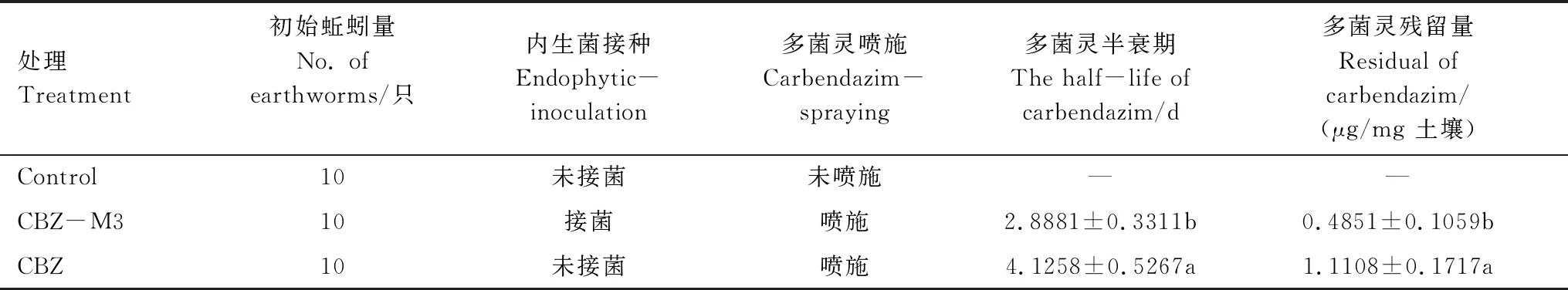
表1 试验水稻处理方式
1.3 水稻根际土壤收集和酶活测定
根际土壤样品的采集参照李依韦等[17]的方法并做适当调整,分别在多菌灵药剂喷施1 d,3 d,7 d和14 d 后在盆钵中随机挑选一株水稻苗整体挖出,首先抖掉与根系结合松散的土壤,然后用毛刷将与根系紧密结合的土壤刷下来装入无菌袋,每个处理中的6盆水稻进行两两随机混合形成3个平行待测样品,并立即进行土壤酶活性的测定。土壤过氧化氢酶(S-CAT)活性采用高锰酸钾滴定法测定;土壤脲酶(URE)活性采用苯酚钠-次氯酸钠比色法测定;土壤蔗糖酶(SAC)活性则采用3,5-二硝基水杨酸(DNS)比色法测定[18]。
1.4 蚯蚓胁迫耐受能力分析
在多菌灵药剂喷施2周后,将盆钵倒置收集蚯蚓,统计每个盆钵中蚯蚓的存活率,并通过检测存活蚯蚓体内丙二醛(Malondialdehyde, MDA)含量、超氧化物歧化酶(Superoxide dismutase, SOD)与乙酰胆碱酯酶(Acetylcholinesterase, AChE)活性来分析多菌灵残留对蚯蚓的过氧化损害程度。其中蚯蚓SOD活力测定采用黄嘌呤氧化酶-羟胺法,MDA含量采用硫代巴比妥酸比色法测定,用蚯蚓体内对三硝基苯(TNB)颜色深浅进行比色定量分析AChE活性。具体酶活测定方法参照南京建成生物工程研究所提供的试剂盒[19]。
1.5 根际土壤微生物群落代谢功能多样性分析
同1.3 方法采集多菌灵暴露14 d后的新鲜水稻根际土壤,并使用BIOLOG公司的ECO生态板分析不同处理下水稻根际土壤中微生物对31种碳源的代谢指纹图谱,接菌液的制备参照赵倩等[20]的方法。接种好的生态板在28℃恒温培养箱(黑暗环境)中连续培养10 d,每隔24 h用酶标仪测定OD590nm下吸光度变化来表征土壤中微生物对各种碳源的代谢活性。土壤微生物群落利用碳源的整体能力用平均颜色变化率(Average Well Color Development, AWCD)表示,微生物群落功能多样性采用香农指数Shannon-wiener Index,优势度指数Simpson Index,均匀度指数Pielou Index和McIntosh Index进行分析[21]。具体计算公式如下:
(1)
H=-∑Pi(lnPi)
(2)
D=1-∑Pi2
(3)
J=H/lnS
(4)
(5)
式中,H为Shannon指数;D为Simpson指数;J为Pielou指数;U为McIntosh指数;Ci为第i个非对照孔的吸光值,R为对照孔的吸光值;Pi表示第i个非对照孔的相对吸光值与所有非对照孔的相对吸光值总和的比值,即Pi=(Ci-R)/∑ (Ci-R);S为被利用的碳源总数;ni表示第i个孔的相对吸光值,即ni= (Ci-R)。
1.6 数据处理
用Windows Microsoft Excel 2003对本试验生物学数据进行初步整理,求和与标准差计算。绘图、显著差异性分析及主成分分析由Origin 2018软件完成。
2 结果与分析
2.1 水稻根际土壤酶活性变化
如图1所示,多菌灵施用显著激活水稻根际土壤中过氧化氢酶的活性,其在药剂喷施后的第1天便达到最高水平,在CBZ组中的酶活力是Control组的2.28倍,DJL-M3接种能够将多菌灵暴露下水稻根际土壤中被激活的过氧化氢酶活力降低41.06%。水稻根际土壤中过氧化氢酶活性随着施药时间推移而降低,但在整个检测周期内CBZ组中过氧化氢酶活性一直显著高于Control组与CBZ-M3组。
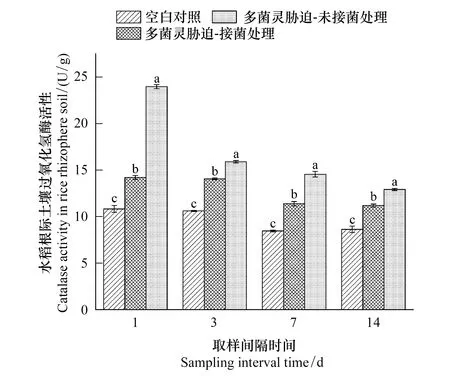
图1 不同处理下水稻根际土壤过氧化氢酶活性
多菌灵在施药后第1天就显示出对土壤脲酶的抑制作用,如图2所示,相比较于Control组,多菌灵胁迫(未接菌)导致水稻根际土壤脲酶活性降低27.56%,而DJL-M3接菌能够缓解多菌灵对根际土壤脲酶的抑制效应,将被抑制的酶活性提升10.76%。CBZ-M3组土壤脲酶活性在第3天便恢复到与Control组差异不显著水平,而此时CBZ组土壤脲酶活性依旧显著低于Control组69.51%,虽然其在第3天后有所提高,但在整个检测周期中一直显著低于其他两个处理组。
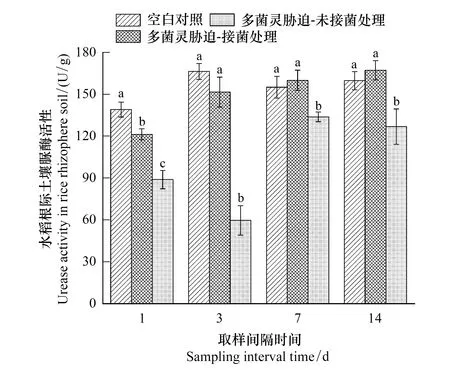
图2 不同处理下水稻根际土壤脲酶活性
如图3所示,多菌灵暴露对水稻根际土壤蔗糖酶的影响与脲酶类似,在多菌灵喷施1 d 后CBZ组中土壤蔗糖酶活性分别较Control组和CBZ-M3组降低82.57%与63.14%,DJL-M3水稻接种能够促进根际土壤蔗糖酶活性的恢复,而CBZ组与Control组的酶活差异在第3天达到最大(89.53%),在14 d 的试验周期中多菌灵胁迫处理组水稻根际土壤蔗糖酶活性一直显著低于Control组水平。
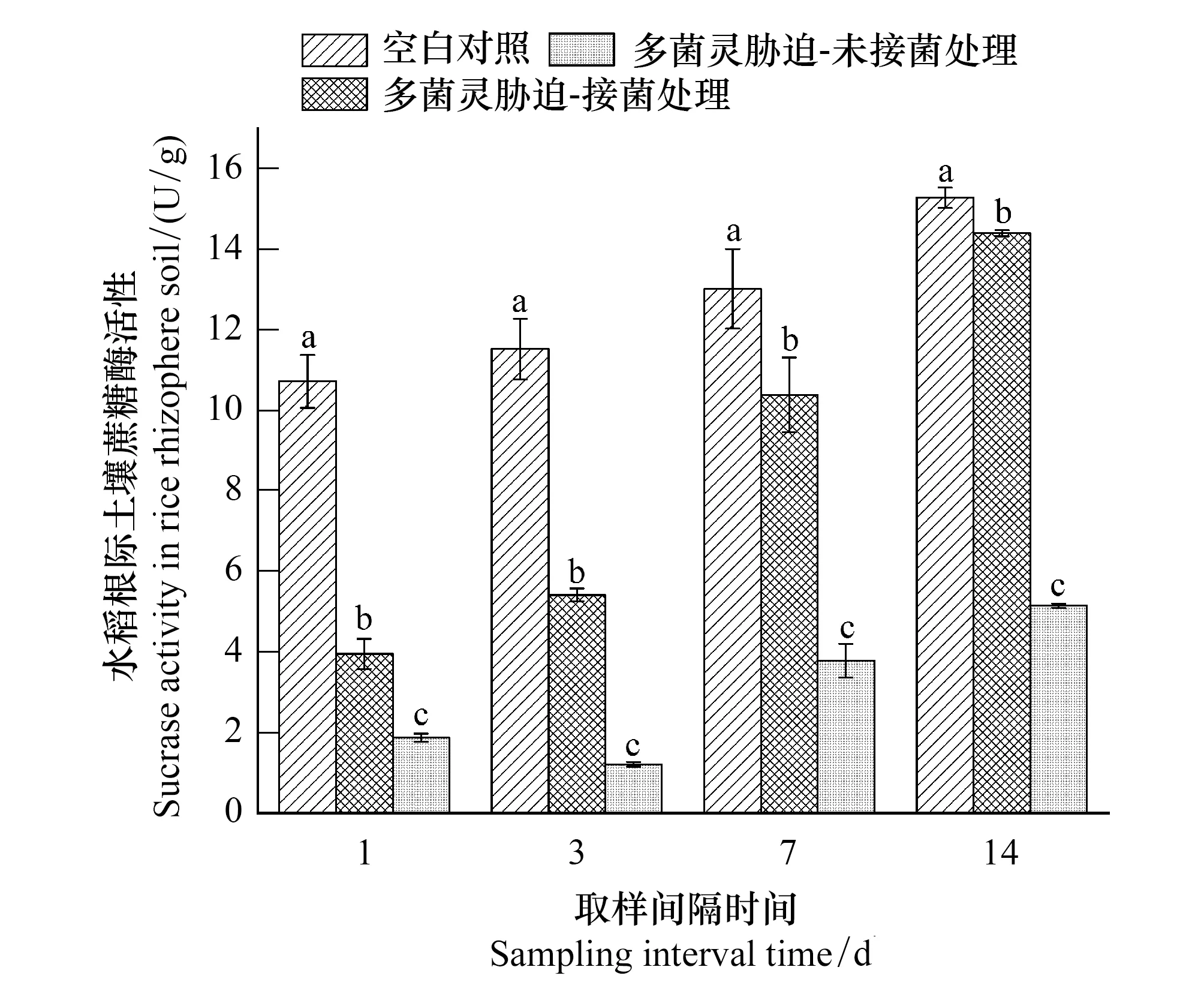
图3 不同处理下水稻根际土壤蔗糖酶活性
2.2 水稻根际土壤中蚯蚓对多菌灵胁迫的耐受性
水稻在喷施多菌灵药剂1 d 后便对根际环境中的蚯蚓造成了胁迫压力,致使蚯蚓出现逃逸现象,而CBZ-M3组则无此现象。在多菌灵喷施两周后将水稻土壤全部倾倒收集蚯蚓,首先观察其形态特征及活性。相比较于Control组,CBZ组中的蚯蚓体色发暗,活动迟缓,体型明显偏瘦偏短,部分蚯蚓个体出现生殖带肿胀、出血及尾部断节现象。而CBZ-M3组的蚯蚓除了体型偏瘦,其他特征与Control组没有显著差异(图4)。进一步统计不同处理组中蚯蚓的存活率及所受氧化胁迫程度 (表2),发现经过14 d 的自然稻田土暴露,多菌灵能够诱导蚯蚓机体积累MDA,而DJL-M3接菌能够显著减少水稻根际蚯蚓体内MDA含量。同样地多菌灵暴露能够显著刺激蚯蚓体内AchE活性,接种内生菌DJL-M3可一定程度上缓解该刺激作用。CBZ组中蚯蚓的T-SOD显著高于Control组,而CBZ-M3组与Control组差异不显著。与蚯蚓氧化胁迫指标相对应的是,CBZ组的蚯蚓存活率显著低于Control组,CBZ-M3组蚯蚓的存活率虽然也低于Control组,但差异并不显著。这些结果表明,多菌灵土壤残留能对水稻根际周遭的蚯蚓造成一定的毒害,诱导氧化损伤而降低其生存能力,在水稻根部接种具多菌灵降解特性的水稻内生菌能够显著缓解根际多菌灵暴露对蚯蚓的胁迫伤害。
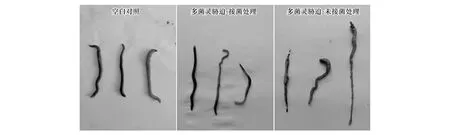
图4 不同处理下水稻根际蚯蚓的表观形态

表2 不同处理方式对蚯蚓存活率及氧化胁迫程度影响
2.3 水稻根际土壤微生物群落结构及多样性
如图5所示,在10 d 的培养周期中,AWCD的最大值及变化速率均呈现Control>CBZ-M3>CBZ 的趋势,多菌灵药剂喷施2 d后,污染土壤微生物AWCD值显著低于未喷施多菌灵的Control组(P<0.05)。说明多菌灵暴露能够显著降低土壤微生物的活性。培养7 d后,各处理组的AWCD值变化率趋于稳定,同一处理组中的AWCD增长已不显著,虽然此时Control组的AWCD值依然高于其他两个多菌灵胁迫处理组,但与CBZ-M3组不具有显著差异性(P>0.05),这表明降解菌DJL-M3接种水稻能在一定程度上提高土壤微生物活性,缓解多菌灵胁迫对水稻根际微生态的负面影响。
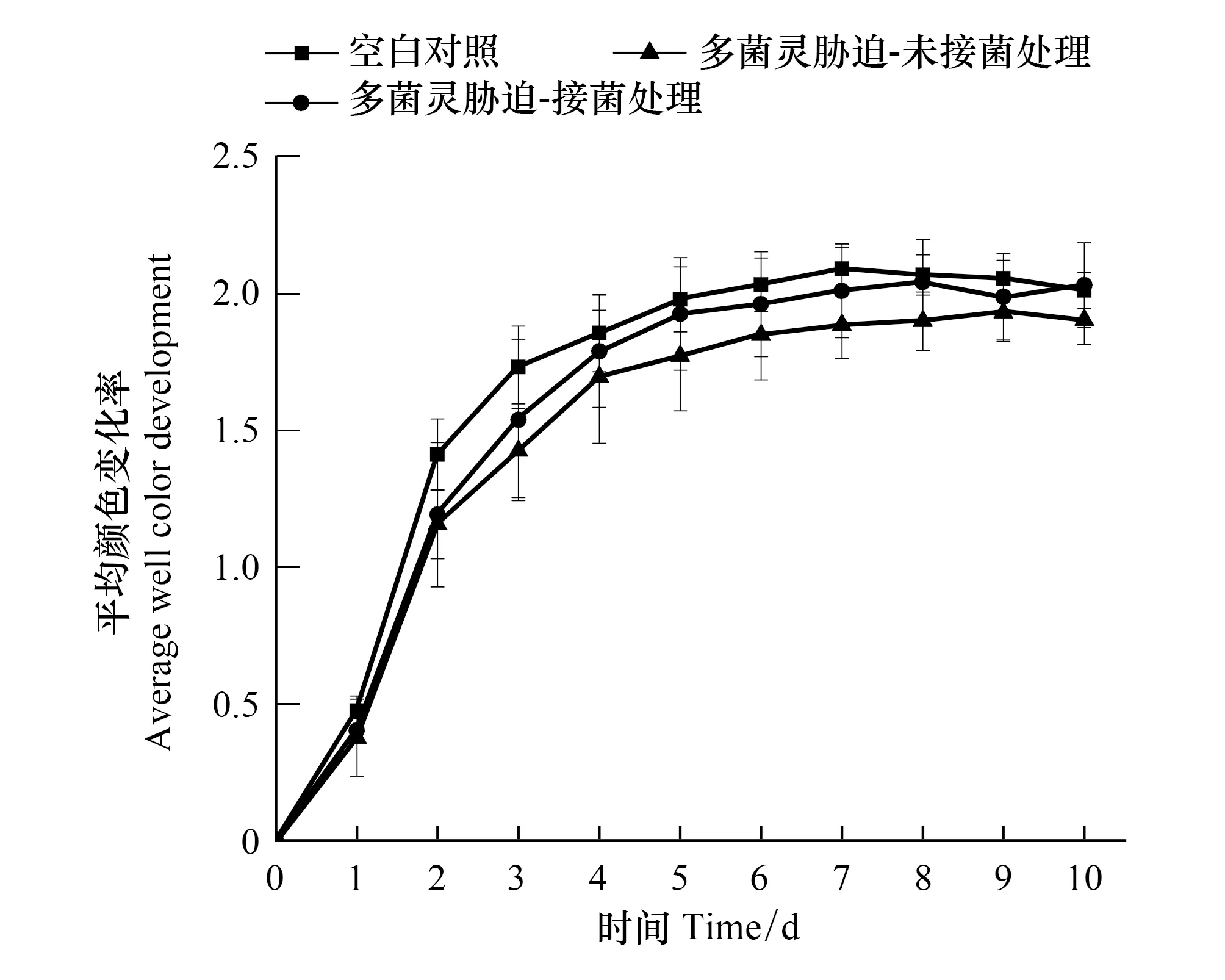
图5 不同处理组中水稻根际土壤微生物的AWCD值变化
我们假设多菌灵暴露7 d后水稻根际微生物群落结构已经稳定,以该时间点所测量的吸光值(OD590 nm)计算各处理组的Shannon指数、Simpson指数、Pielou指数和McIntosh指数分析土壤微生物群落功能多样性,结果如表3所示,多菌灵胁迫对水稻根际土壤Pielou指数没有显著影响,但能显著降低Shannon指数、Simpson指数和McIntosh指数(P<0.05),而接种DJL-M3能够在一定程度上提高Shannon指数和McIntosh指数。

表3 不同处理方式下水稻根际土壤微生物群落功能多样性指数
2.4 水稻根际土壤微生物碳源代谢特征
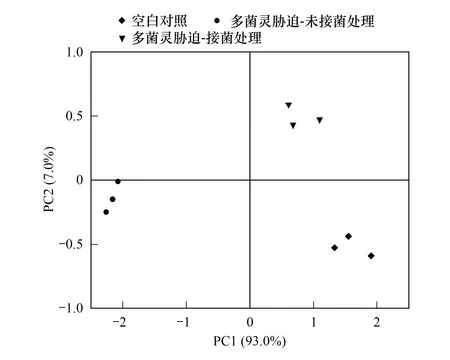
图6 不同处理组中水稻根际土壤微生物碳源代谢主成分分析
为了分析根际微生物群落多样性差异背后特定的碳源代谢情况,同样选取3个处理组土壤在培养7 d后微生物对31种碳源的AWCD值进行主成分(PCA)分析,提取2个主成分,其中第1主成分(PC1)和第2主成分(PC2)的方差贡献率分别为93%和7%,累计贡献率达100%,可以全面反映根际微生物碳源代谢能力的分异特征。结果如图6所示,Control组在PC1上得分最高,而CBZ-M3组在PC2上得分则明显高于其他两组,这说明无论是多菌灵暴露还是外源降解内生菌的引入都会极显著地改变水稻根际微生物组对土壤碳源的代谢能力;Control组和CBZ-M3组都位于PC1轴正方向,它们之间的距离也要比同处于PC1轴与PC2轴负方向的CBZ组要近,这表明Control组和CBZ-M3组的根际微生物对碳源的利用能力更为相似。
为了进一步分析不同处理水稻根际微生物的代谢功能类群,我们将Biolog-ECO 板上31种碳源在7 d测定的AWCD值进行热图绘制,以此表征不同处理水稻根际微生物碳代谢指纹图谱,结果如图7所示。总体上,Control组中根际土壤微生物对碳源的整体利用能力最强,CBZ-M3组次之,CBZ组最弱。在6大类碳源中,多菌灵暴露能够显著降低根际土壤微生物对糖类、氨基酸类、酯类、醇类及酸类中2-羟基苯甲酸的利用能力,对胺类碳源的影响则不显著(P>0.05)。有趣的是,内生菌DJL-M3的引入也会改变水稻根际土壤微生物的碳源代谢特性,其显著提高了糖类中α-D-乳糖、葡萄糖- 1-磷酸盐、α-环状糊精和肝糖,酯类中的吐温80、丙酮酸甲酯以及酸类中D-氨基葡萄糖酸的利用能力,但却显著降低了根际土壤微生物组对L-苏氨酸、D,L-α-磷酸甘油、N-乙酰基-D-葡萄胺及酸类中D-苹果酸的利用能力。
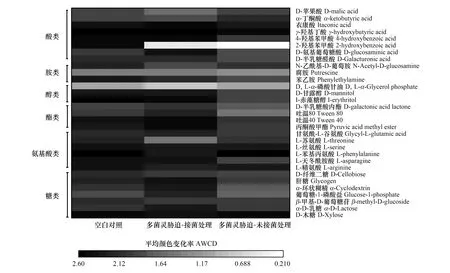
图7 不同处理下水稻根际土壤微生物对31种碳源代谢的指纹图谱
3 讨论
3.1 DJL-M3对多菌灵暴露下水稻根际土壤酶活性的影响
土壤酶是土壤重要组成部分之一,其参与土壤中绝大多数生化过程,包括营养物质转化、能量代谢和污染物净化等[3]。其中,过氧化氢酶主要分解土壤中过度累积的过氧化氢,降低其对植物根系及生物体的毒害作用;脲酶是土壤中唯一一种能将尿素转化为有效氮的酰胺酶,酶促尿素水解成氨,为植物生长提供氮源;蔗糖酶作为评价土壤熟化程度和肥力水平的常规指标之一,其可以把土壤中高分子量的蔗糖转化成能被植物和土壤微生物吸收利用的易溶性营养物质,从而为土壤生物体提供能源及提高土壤生物学活性[22]。在本研究中,我们发现多菌灵喷施刺激了水稻根际土壤中过氧化氢酶的活性,而抑制土壤脲酶和蔗糖酶的活性,该现象与孙佳为等[23]的研究结果基本一致。其原因可能是多菌灵残留对水稻植株及根际微生物群落造成了一定的氧化胁迫,作为应激反应,植株及微生物会表达更高水平的过氧化氢酶以缓解氧化损伤。因为土壤酶主要来自土壤微生物、植物根系分泌以及动植物残体的释放等途径[24],多菌灵污染抑制了根际微生物及土壤动物的活力[8],从而降低土壤脲酶与蔗糖酶的产生。水稻内生菌DJL-M3定殖能够显著缓解多菌灵的胁迫效应,提高土壤脲酶和蔗糖酶活力。这可能是因为DJL-M3直接降解残留于土壤中的多菌灵(表1),从而减少其对水稻根际微生物群落的胁迫压力。与此同时,人工接种降解性内生菌能够缓解高浓度农药对宿主作物的植物毒性,并在胁迫条件下促进植物生长[25]。DJL-M3的优良促生长特性也极有可能提高了水稻对多菌灵污染的应激耐受性,并促进胁迫条件下植株根系的发育,进而提高土壤酶活性。事实上,付风云等[26]的研究已经表明,添加对作物具有促生长功能的微生物有机肥能够显著提高多菌灵胁迫条件下土壤脲酶和蔗糖酶的活性。综上所述,内生菌DJL-M3可能通过直接降低多菌灵残留对水稻植株及根际微生物的胁迫压力,以及提高接种水稻的生理活性来缓解多菌灵暴露对根际土壤酶活力的抑制作用。
3.2 DJL-M3对水稻根际中蚯蚓多菌灵胁迫耐受性的影响
蚯蚓是土壤健康的关键指示生物,其对维持土壤肥力具有重要作用,而农田生态系统中农药残留污染对蚯蚓在个体、细胞和分子等不同生命层面都会产生毒理学作用[19]。郇志博等[27]的研究表明,多菌灵对赤子爱胜蚯蚓具有中等毒性,其能够诱导蚯蚓血细胞产生微核畸变,因此,残留于水稻根际的多菌灵不可避免会对周遭的蚯蚓造成胁迫危害。本研究发现,多菌灵施药后水稻根际土壤中蚯蚓的存活率显著降低,在所有存活蚯蚓体内SOD活性及MDA含量显著高于未施药组,该现象与大多数杀菌剂农药对蚯蚓的生物毒理学研究结果相一致[28—29]。SOD主要参与生物体内氧化与抗氧化平衡,其能够清除因外源胁迫而产生的超氧阴离子自由基(ROS),保护机体细胞免受损伤[30];MDA则是ROS攻击生物膜中不饱和脂肪酸而引发脂质过氧化作用的产物,其含量高低反应机体细胞受自由基攻击的严重程度[31]。多菌灵残留对蚯蚓造成了氧化胁迫,导致其体内MDA水平升高,作为应激反应蚯蚓也会提高其自身SOD活性以期清除机体内过多的自由基,进而缓解氧化胁迫损伤。AchE广泛存在于动物组织中,能够特异性催化乙酰胆碱水解为胆碱和乙酸,维持神经系统的正常生理功能[32]。区别于有机磷类和氨基甲酸酯类农药对蚯蚓AchE的抑制作用[19],我们发现多菌灵残留会刺激水稻根际中蚯蚓的AchE,该现象与杀菌剂丙环唑污染诱导蚯蚓AchE表达相一致[33],虽然鲜有研究能够完全解释该现象,但蚯蚓体内AchE活性与机体受到氧化胁迫而改变的细胞内离子平衡有关[34];除此之外,AchE作为生物靶标在机体经历细胞凋亡或炎症的时候同样会被激活[35]。根据CBZ组中试验蚯蚓的存活率及肿胀的形态,说明多菌灵残留水平已经达到促发蚯蚓产生炎症并诱发个体死亡,从而导致蚯蚓体内AchE出现过度补偿现象[36]。在CBZ-M3处理组中,虽然蚯蚓体内MDA含量依然显著高于Control组,但可能已低于蚯蚓的耐受极限,所以对应的是较低水平的SOD和AchE活性及显著提高的整体存活率。综上所述,内生降解菌DJL-M3能显著缓解多菌灵残留对水稻根际中蚯蚓的氧化胁迫,提高蚯蚓在污染暴露条件下的适应性。
3.3 DJL-M3对多菌灵暴露下水稻根际土壤微生物的影响
土壤微生物同样是土壤生态系统的重要组成部分,是土壤质量和健康状况的重要表征,在推动有机质分解,养分转化与循环、促进植物营养吸收、调节土壤肥力及污染物降解过程中发挥关键作用[37]。研究表明,多菌灵污染会造成土壤微生物数量及呼吸量降低,微生物群落的丰富度、均匀度和优势度受到抑制[38]。这与我们研究结果相一致,虽然施药靶标是水稻植株,多菌灵在喷施过程及施药后依旧进入了水稻根际微环境,对其中的微生物群落造成胁迫,降低其整体活性(图5)。Shannon指数、Simpson指数、Pielou指数和Mclntosh指数可以综合表征土壤微生物群落中物种的丰富度、分布的均匀度以及不同微生物对碳源的利用程度[21]。本研究发现,多菌灵暴露显著降低了根际土壤微生物Shannon、Simpson和Mclntosh指数,这是因为作为广谱性杀菌剂,多菌灵可能会无差别地毒杀水稻根际土壤中的病原菌与有益微生物,从而造成群落多样性的降低[8]。AWCD值是从微生物群落对碳源的相对利用能力来反映土壤微生物的种群数量及结构特征,其值大小与微生物代谢活性水平呈正相关关系[20—21]。肖丽等[39]的研究发现多菌灵污染能够对土壤生物量碳造成抑制作用,这表明其减弱了土壤微生物对碳源的整体代谢活力。在本实验中,接种内生菌DJL-M3能够提高多菌灵暴露下水稻根际土壤微生物的AWCD值及多样性指数,这可能是接种DJL-M3提高了根际残留多菌灵的代谢速率(表1),同时减少的外源污染胁迫维护了原有微生物群落的多样性,而被DJL-M3促生的水稻植株同样可以通过有益的根际互作提高微生物的活力。土壤微生物对不同类型碳源的利用强度可以反映土壤肥力与质量的变化,体现其群落结构在碳素物质转化和能量流动中的协同与竞争作用[40]。因为土壤微生物群落对碳源的利用主要集中在碳水化合物(糖类)、氨基酸和羧酸[20],而多菌灵污染能够降低土壤微生物群落的活力及多样性,进而抑制它们对这类碳源的利用。我们发现接种降解性内生菌DJL-M3同样改变了根际土壤微生物群落对碳源的代谢模式,这可能是由DJL-M3对特殊碳源的偏好性造成;除此之外,内生菌定殖宿主后能够改变宿主植株所在土壤微生物的数量及组成,比如土壤细菌与真菌的比值[41],这同样会影响根际微生物群落对碳源的整体利用方式。在土壤微生物对碳源代谢的主成分分析中,CBZ组的PC值与其他两组的距离要远大于它们之间的距离,这表明多菌灵残留对水稻根际微生态的影响要强于S.pavaniiDJL-M3的引入,这是因为相对于单个菌株的接种,土壤微生物群落具有足够的缓冲能力进行适应和再平衡,多菌灵等农药污染会改变土壤的理化性质与植物生理状况,进而在短期内重塑根际土壤微生物组成及代谢特性[42]。综上所述,多菌灵暴露显著抑制水稻根际土壤微生物对碳源的代谢活性,降低其物种组成多样性与均匀度。接种降解性内生菌DJL-M3能够促进胁迫条件下水稻根际微生物对碳源的整体利用能力,提高微生物群落的多样性并在一定程度上缓解多菌灵对水稻根际微生物群体的胁迫效应,最终将多菌灵胁迫条件下水稻根际微生物碳源代谢特征修复到接近无污染水平。
4 结论
本研究揭示了接种内生降解菌StenotrophomonaspavaniiDJL-M3能在促进水稻根际多菌灵残留降解代谢的同时,缓解多菌灵暴露对土壤微生物群落和蚯蚓的胁迫损害,提高多菌灵污染条件下根际土壤酶活性及微生物群落代谢功能多样性。因此,降解性内生菌在修复多菌灵等农药污染暴露下的水稻根际微生态环境中具有较大的应用潜力。
