MnO2/TiO2改性沸石去除矿井水中Fe2+和Mn2+的试验研究
2022-04-25张春晖王文倩师学璐全炳旭霍倩倩王新玲
张春晖,王文倩,师学璐,全炳旭,杨 博,霍倩倩,王新玲
中国矿业大学(北京)化学与环境工程学院,北京 100083
我国是世界上最大的矿产资源开发利用国之一.仅2019年,煤炭生产就超过38×108t,占全球总产量的47.3%. 煤矿开采过程不仅会消耗大量的水资源,同时也会排放出含有大量重金属污染物的矿井水,如铁、锰、镍、钴等[1]. 超标排放的含重金属矿井水,尤其是高铁锰类矿井水,Fe2+、Mn2+通常共生伴存,常规工艺难以有效去除[2],此类矿井水大量排放会诱发地表水及浅层地下水污染,破坏当地的水生态系统,并对生物及人类健康造成潜在的危害.
去除水中Fe2+、Mn2+的常见方法有氧化法、生物法、吸附法等[3]. 氧化法和生物法工艺技术较为成熟,虽然应用广泛,但其流程复杂,出水水质不稳定,反应条件控制不当还会引发二次污染. 而吸附法操作简单灵活、原料来源广泛[4]. 车诗丽等[5]用NaOH改性活性炭和天然沸石,探究了它们对Mn2+的吸附去除效果,结果表明,改性沸石的去除效果优于活性炭. 利用低成本材料作为去除重金属的潜在吸附剂,对高效治理水环境尤为重要. 沸石材料不仅绿色环保,而且对金属阳离子吸附性能优异,可再生性好,使其在水环境治理方面有着广泛应用[6-9]. 有研究表明,沸石对Fe2+、Mn2+均有较强的吸附能力和离子交换能力[10],通过不同的改性方法还可以不同程度地改变沸石的表面结构,从而增大其比表面积、拓宽孔径[11]. 目前,许多研究者尝试在沸石上负载一种或几种针对特征污染物具有优势吸附特性的物质来提升沸石的吸附效果[12]. 纳米金属氧化物因其具有催化氧化作用[13]、比表面积大[14]等优势,被认为是水中重金属离子的有效吸附剂. 通过沸石负载,不仅可以结合各自的吸附性能,而且可以避免纳米颗粒物的流失.
基于此,该研究以天然沸石作为吸附载体,将纳米MnO2和纳米TiO2负载到天然斜发沸石表面,通过动态过滤和再生试验研究,对改性沸石吸附Fe2+、Mn2+的性能进行探究,并就主要影响因素和反冲洗条件进行分析,为实现Fe2+、Mn2+的协同去除提供一条有效的新途径.
1 材料与方法
1.1 试剂与材料
该试验药品一水合硫酸锰(MnSO4·H2O)购自天津金汇太亚化学试剂有限公司. 高锰酸钾(KMnO4)、无水乙醇(C2H5OH)、硝酸(HNO3)购自国药集团化学试剂有限公司. 钛酸四丁酯(C16H36O4Ti)购自南京化学试剂股份有限公司. 氢氧化钠(NaOH)、乙酸(CH3COOH)、盐酸(HCl)购自河北沧州大化. 七水合硫酸亚铁(FeSO4·7H2O)购自北京化学工业集团有限公司. 所有的化学试剂纯度均为分析纯. 沸石采用天然斜发沸石,购自河南维科特利环保科技有限公司,粒径为0.5~1 mm,孔隙率为48%,沸石过20目筛,去离子水洗涤后备用. 实验室配置溶液所用水均为去离子水.
试验采用的水样是实验室配置的模拟矿井水,参照某煤矿矿井水经混凝沉淀出水后的水质,其水质指标如下:浊度为18.3~23.5 NTU,Mn2+质量浓度为1.88~2.07 mg/L,Fe2+质量浓度为4.82~5.10 mg/L,总硬度为493~567 mg/L,pH为7.21~7.33.
1.2 改性沸石滤料的制备
首先,将摩尔比为2∶3的KMnO4和MnSO4·H2O置于烧杯中,加去离子水,磁力搅拌30 min后转移至高压反应釜内,220 ℃下反应15 h,反应结束后收集黑色沉淀物,去离子水洗涤后放入鼓风干燥箱内,80 ℃下干燥10 h制得纳米MnO2;其次,将摩尔比为1∶2的C16H36O4Ti和C2H5OH混匀,并缓慢加入抑制剂CH3COOH,磁力搅拌40 min后加一定量的沸石和上述样品,用HNO3将溶液pH调至约4,搅拌1 h,并加去离子水搅拌至形成凝胶;最后,将凝胶105 ℃下烘干后置于马弗炉500 ℃煅烧2 h,取出后自然冷却,制得改性沸石材料.
1.3 试验装置与方法
动态过滤试验装置如图1所示,由3个系统组成,即配水系统、过滤系统、反冲洗系统. 其中,过滤柱设计规格为Φ=2 cm的有机玻璃管,柱高150 cm,过滤柱侧壁按不同高度有4个取样口. 该研究设置滤料填充高度为110 cm,为了避免吸附材料的损失,滤料两端各铺5 cm石英砂作为垫层. 进水时,通过蠕动泵控制水流速度,使水样连续流入反应柱;通过用1 mol/L的NaOH或HCl调节改变原水pH;通过向水中加入CaCl2的方式来增加水的硬度.
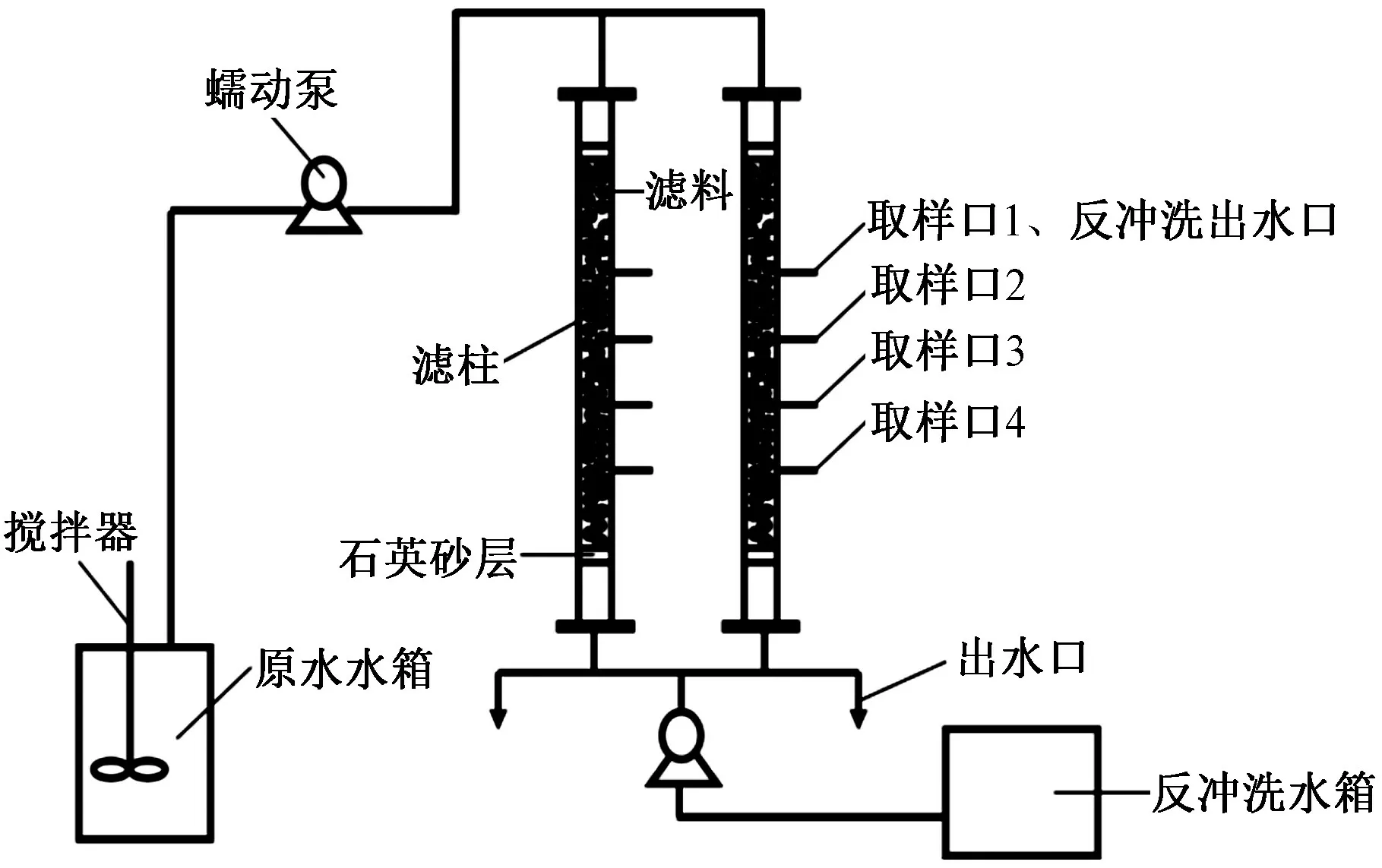
图 1 动态过滤试验装置示意Fig.1 Schematic diagram of dynamic filtration test device
过滤试验完成后,采用脉冲反冲洗的方式,将过滤后的废水用于反冲洗,冲洗水通过蠕动泵从柱底部进入,自下而上对过滤柱进行反冲洗后排出. 为了防止负载氧化物的流失,反冲洗的强度控制在13 L/(m2·s).
1.4 分析方法
该试验采用扫描电子显微镜〔MRC-200,购自孚光精仪(中国)有限公司〕来分析沸石改性前后的微观形貌,结合X射线能谱仪(EMAX,购自HORIBA科学仪器事业部)和X射线衍射仪(Ultima Ⅳ,购自上海力晶科学仪器事业部)分析样品表面的元素构成;采用比表面积分析仪(JW-BK 112,购自北京精微高博科技有限公司)确定待测样品的比表面积和孔径、孔体积的分布情况;使用甲醛缩合法[15]测定天然沸石和改性沸石的阳离子交换容量(CEC).
根据研究需要在取样口收集流出液进行分析,流出液中Fe2+、Mn2+含量分别采用邻菲啰啉分光光度法(HJ-T 345-2007)、甲醛肟风光光度法(HJ/T 344-2007)进行测定. 该试验Fe2+和Mn2+的处理目标均为《生活饮用水卫生标准》(GB 5749-2006)中规定的排放限值(分别为0.3、0.1 mg/L).
2 结果与讨论
2.1 微观形貌及元素组成分析
2.1.1SEM-EDS分析
天然沸石和改性沸石材料的SEM图如图2所示. 由图2(a)(b)可知,天然沸石表面分布着许多空穴结构且呈现出层状颗粒团聚,有明显的晶体结构,表面粗糙. 由图2(c)可以看出,改性后的沸石表面附着较厚的绒状类球体颗粒物,符合Chen等[16]用水热法制得的纳米MnO2的微观形貌特征. 由图2(d)可见,沸石内部存在着大小不一的孔洞结构,推断是由于负载的纳米TiO2在沸石内部形成柱撑结构[17],拓宽了沸石孔道,可以大大提高沸石去除污染物的能力. 结合EDS-Mapping结果(见图3)分析可知,相较于天然沸石,改性沸石表面增加了Mn、Ti等物质的特征峰,表明改性沸石表面附着的绒状颗粒物中掺有大量的Mn、Ti元素,进一步说明这些绒状物为纳米MnO2和纳米TiO2,表明这两种纳米氧化物成功负载到沸石表面,且材料均匀性良好.

图 2 不同放大倍数条件下的沸石SEM图Fig.2 SEM images of zeolites at different magnification
2.1.2XRD分析
分别对天然沸石、改性沸石及吸附目标污染物后的改性沸石进行X射线衍射分析,结果如图4所示. 从图4(a)可知,锰钛改性沸石在2θ为20°和28°处的衍射峰与天然沸石的特征衍射峰对应,说明改性不会破坏沸石的晶体结构,且二者均为钠型沸石结构. 但其与天然沸石相比,在2θ=29.2°、36.8°、42.3°、55.1、18.9°处和2θ=41.9°、57.2°处分别对应新增了TiO2和MnO2的衍射峰,说明经过改性TiO2与MnO2成功负载到天然沸石表面,与EDS分析结果符合. 从图4(b)可知,与未使用的沸石相比,吸附后沸石在2θ为13.8°、20.7°、39.9°、42.5°、50.3°、60.1°、68.6°处出现了新的特征峰,经过与标准图谱比较,这些新增衍射峰归属于铁锰复合氧化物的特征峰,说明沸石对Fe2+、Mn2+具有一定的吸附能力.
2.1.3BET和阳离子交换量分析
沸石改性前后的比表面积、孔径、孔体积及阳离子交换量变化如表1所示. 由表1可知,改性后的沸石比表面积增大410.45%,平均孔体积增大626%,平均孔径增大17.0%,推测是由于负载了比表面积大的纳米锰钛氧化物,有研究表明纳米MnO2[18]、TiO2[19]具有很大的比表面积,且由于量子效应,可为污染物的吸附提供更多的活性位点,且孔径、孔体积的增大,将更有助于金属离子的扩散和吸附. 此外,改性后的沸石阳离子交换容量从126.4 mmol/(100 g)增至132.7 mmol/(100 g),推测是由于焙烧清除了部分孔道杂质[20],使离子交换更容易进行,且改性沸石形成柱撑后也有助于提高吸附效果[17].
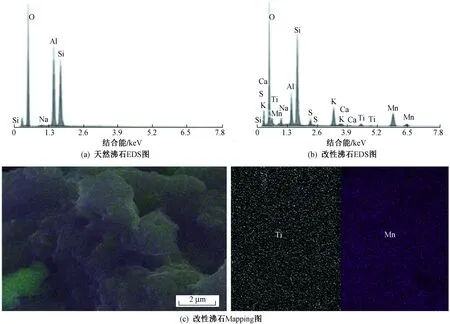
图 3 不同沸石的EDS-Mapping扫描结果Fig.3 EDS-Mapping diagram of different zeolites
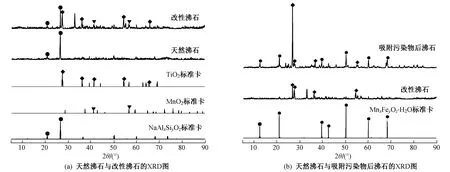
图 4 不同沸石的XRD图谱Fig.4 XRD patterns of different zeolites
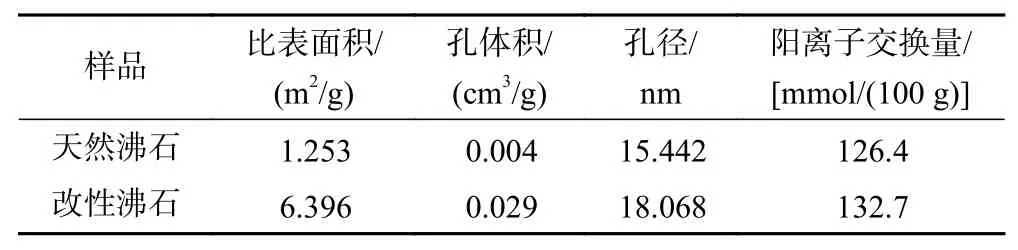
表 1 不同沸石的性能参数对比Table 1 Comparison of performance parameters of different zeolites
2.2 运行参数对污染物去除效果的影响
2.2.1水流速度对污染物去除效果的影响
在pH为9.5,滤层厚度为110 cm,水质硬度为350 mg/L的条件下,通过蠕动泵控制水流速度(6、7、8、9 m/h)研究改性沸石对Fe2+、Mn2+去除效果的影响. 由图5可知,水流速度对动态吸附去除Fe2+、Mn2+均有一定的影响. 随着水流速度的增加,出水水质可达标的时间段缩减,当水流速度为6和7 m/h时,出水Fe2+、Mn2+质量浓度急剧下降,说明水流速度的减慢有利于提高出水水质. 胡建龙等[21]研究表明,滤速的提高会使滤料表面快速达到饱和,致使滤料的吸附能力不能充分发挥.
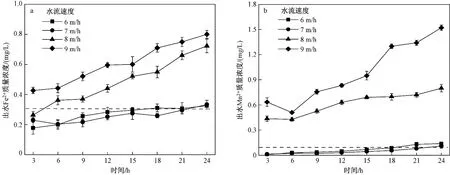
图 5 水流速度对不同污染物去除效果的影响Fig.5 Effect of water flow velocity on removal efficiency of different pollutants
由图5(b)可知,水流速度对Mn2+去除影响较大,分析原因可能是Mn2+比Fe2+难氧化[22-23]. 一般情况下,由于溶解氧的作用,水中大部分Fe2+可以被氧化为Fe3+,进一步水解为Fe(OH)3絮体[22],在过滤过程中被沸石截留去除;而极少部分未被氧化的Fe2+可以被沸石吸附作用而除去. 然而对于Mn2+来说,Mn2+需要被氧化成高价氧化物或氢氧化物才能被除去. 沸石表面负载的纳米MnO2富含羟基活性基团且在沸石表面自催化氧化生成了一层锰质活性滤膜[24],只有在水流速度较低的情况下,才能保证Mn2+被充分氧化.
2.2.2滤层厚度对污染物去除效果的影响
在pH为9.5,水质硬度为350 mg/L,水流速度为7 m/h的条件下,不同滤层厚度的改性沸石对Fe2+、Mn2+去除效果的影响如图6所示. 由图6可知,增加滤层的厚度,曲线从左向右移,出水水质可达标的时间段延长. 可见,随着滤层厚度增加,污染物的去除能力明显增强,这可能由于更高的滤层厚度能提供更多的吸附位点,使吸附有效时间增长,溶液可以和吸附材料充分接触,从而使达标时间段延长. 这与安强等[25]研究结果类似,其利用柚子皮改性生物炭去除水中Mn2+时,也观察到随着滤床高度的增加,吸附饱和时间与床高呈正相关.
2.2.3pH对污染物去除效果的影响
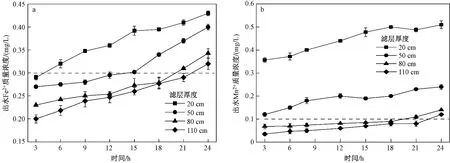
图 6 滤层厚度对不同污染物去除效果的影响Fig.6 Effect of filter layer thickness on removal efficiency of different pollutants
控制pH为单一变量,在水质硬度为350 mg/L、水流速度为7 m/h、滤层厚度为110 cm时,改性沸石对Fe2+、Mn2+去除效果的影响如图7所示. 由图7可见,随着pH的升高,沸石对污染物的去除效果提升.推测是由于溶液pH影响了Fe2+、Mn2+的氧化过程[26],随着溶液pH的升高,改性沸石表面的负电荷OH-增多,可能会与溶液中的阳离子形成羟基配体,加快了Fe2+、Mn2+氧化速率. 与Mn2+相比,pH的变化对Fe2+的去除效果影响较小,这可能是因为在此试验中,被氧化的Fe2+主要以Fe(OH)3沉淀的形式被除去;而对Mn2+来讲,当pH为7.5和8.5时,Mn2+的去除效果明显提高,有研究表明当pH升至8.5以上时,Mn2+的催化氧化才可以顺利发生[27-28],此外,还可能是由于在酸性条件下,Fe2+会与MnO2反应[29],导致对Mn2+的去除效果不佳.
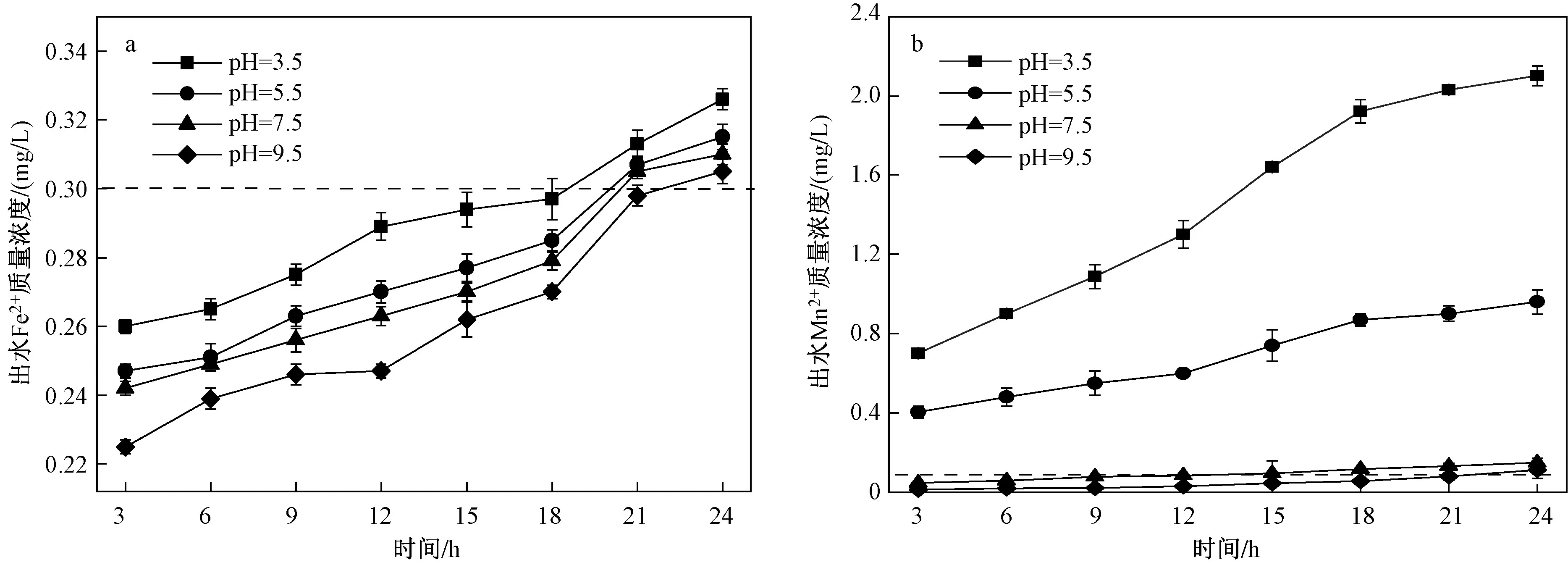
图 7 pH对不同污染物去除效果的影响Fig.7 Effect of pH on removal efficiency of different pollutants
由图7(b)可知,在pH=3.5的酸性条件下,随着过滤的进行,出水Mn2+质量浓度大幅上升,15 h后出水Mn2+质量含量高于原水,可能因为pH过低会影响氢氧化物的形成,同时溶液中的H+和Mn2+会竞争吸附点位,当吸附进行到快饱和状态时,H+还可能会把Mn2+交换出来,导致出水中Mn2+质量浓度增加. 王锦[30]使用天然锰砂和石英砂作为滤料研究Fe2+、Mn2+去除效果时发现,提高pH有利于Fe2+、Mn2+的去除,与该研究结论一致.
2.2.4硬度对污染物去除效果的影响
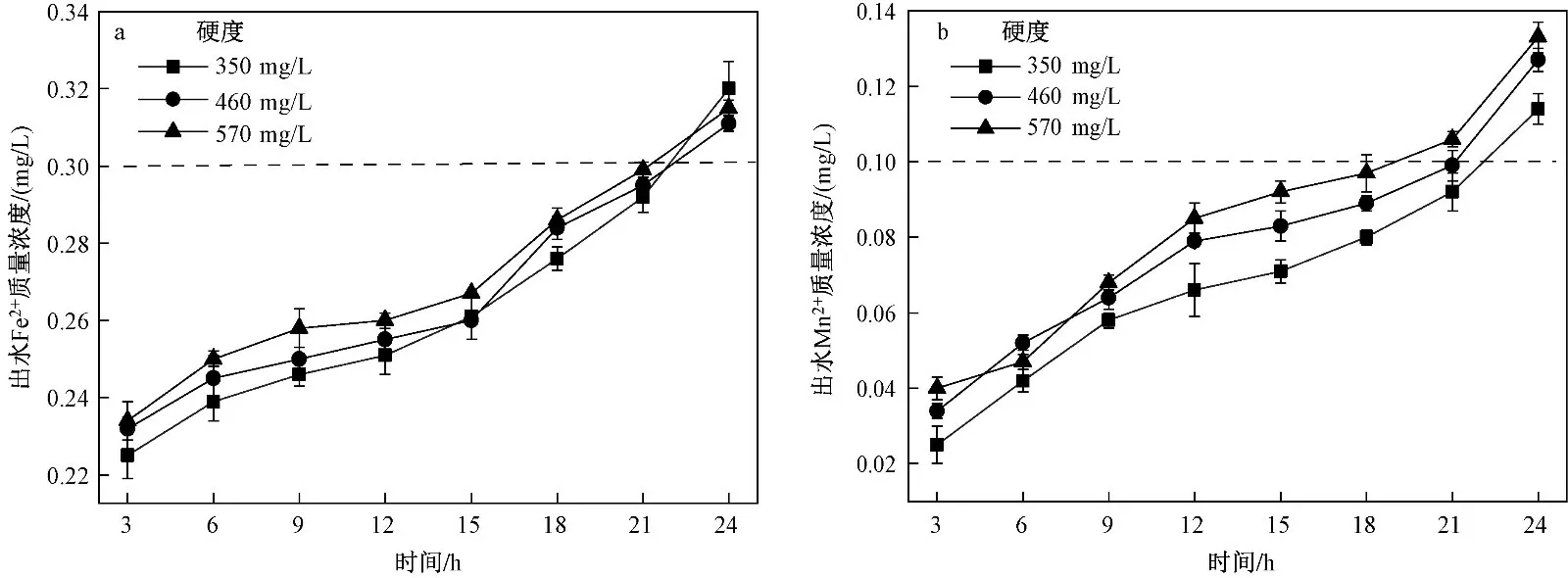
图 8 硬度对不同污染物去除效果的影响Fig.8 Effect of hardness on removal efficiency of different pollutants
控制水的硬度为单一变量,在pH=9.5、水流速度为7 m/h、滤层厚度为110 cm时,改性沸石对Fe2+、Mn2+去除效果的影响如图8所示. 在3种进水硬度条件下,过滤初期对Fe2+、Mn2+的去除影响很小,随着过滤时间的增加,Mn2+的去除效果逐渐下降;水质硬度越大,过滤中后期对除Mn2+影响越大. 沸石对Fe2+、Mn2+的吸附存在离子交换吸附[31-32],水中的Ca2+成为竞争吸附对象,从而影响吸附效果. 过滤初期,吸附位点较多,这种竞争吸附不会过多影响吸附效果,随着过滤的进行,沸石的吸附位点逐渐减少,硬度愈高竞争愈大,对Mn2+的去除效果造成不利影响. 由图8(b)可知,随着硬度的增大,出水Mn2+质量浓度分别在19、20、22 h时水质才开始不达标. 综上,与水流速度、滤层厚度、pH相比,硬度对Fe2+、Mn2+去除效果的影响并不明显. 当硬度小于570 mg/L时,硬度的变化对Mn2+去除效果的影响轻微,因此硬度不是去除Fe2+、Mn2+的主要影响因素.
2.3 Thomas模型拟合及Fe2+、Mn2+去除机制分析
Thomas模型被广泛应用于预测动态吸附试验的速率常数及吸附饱和量[33],该模型可以忽略吸附过程中的内部扩散和外部扩散[34-35],其线性表达式为
这次调查的记录文稿誊写了三份,两份寄到昆明,一份留在县里。1958年夏,郭开云到昆明开会,又被徐嘉瑞留在省文联工作了一个月,对此前的记录文稿进行了整理。而整理的原则,他转述徐嘉瑞的话是:“把重复的、不健康的先删去。”

式中:C0为污染物进水(初始)的质量浓度,mg/L;Ct为t时污染物出水的质量浓度,mg/L;KTh为Thomas模型的速率常数,mL/(min·mg);qe为吸附饱和量,mg/g;m为沸石用量,g;Q为流速,mL/min;t为反应时间,min.
在进水Fe2+、Mn2+质量浓度分别为5、2 mg/L,滤速为7 m/h,pH=9.5,硬度为350 mg/L,滤层厚度为110 cm的条件下,分别使用天然沸石和改性沸石进行动态吸附过滤试验,并利用Origin软件对其进行数据拟合分析,结果如图9所示,相关系数见表2. 从表2可以看出,Thomas模型的线性相关系数(R2)介于0.914~0.977之间,表明Thomas模型能够描述天然沸石和改性沸石对Fe2+、Mn2+动态吸附的动力学特征,且内部扩散和外部扩散不是吸附过程中的限制性因素. 与天然沸石的吸附性能相比,改性沸石的理论吸附量有所提高,且KTh减小,很有可能是由于改性沸石的比表面积增大,吸附点位增加,从而利于增加吸附剂与吸附质的反应停留时间,同时使平衡吸附容量增大[36].
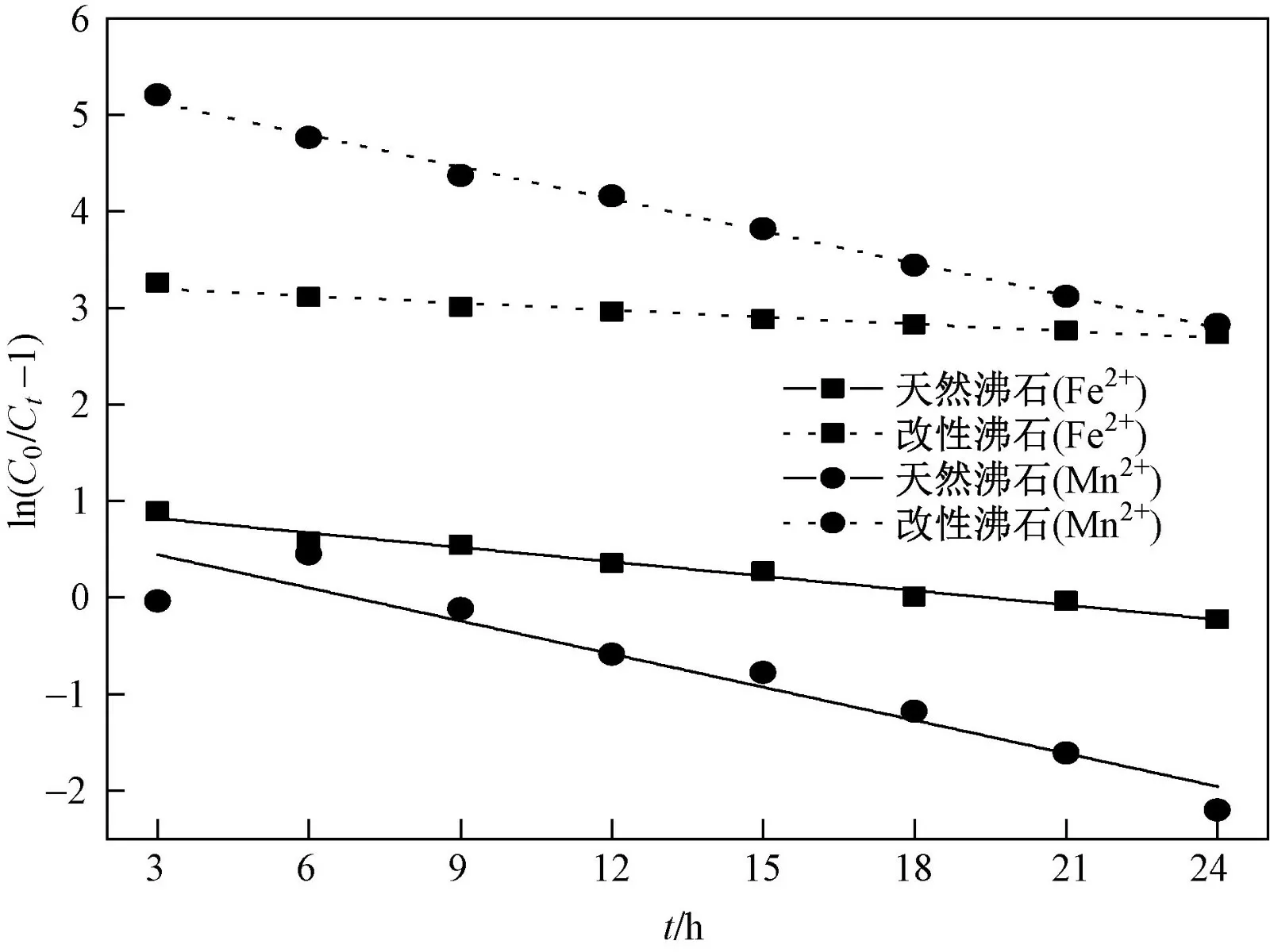
图 9 不同沸石的Thomas模型拟合结果Fig.9 Fitting results of thomas model for different zeolites
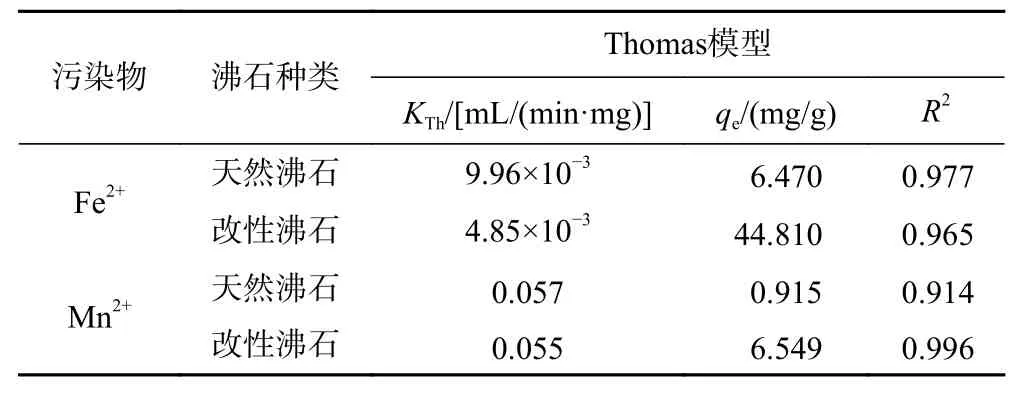
表 2 Thomas模型拟合参数表Table 2 The parameter table of the Thomas model
综上,改性沸石对Fe2+、Mn2+具有一定的去除效果,推测是由于沸石的吸附作用,使Fe2+、Mn2+被吸附到沸石表面并氧化,而Fe2+会被吸附氧化为Fe3+发生团聚,对铁锰的氧化物或氢氧化物截留,其次,Mn2+水解氧化生成具有催化氧化作用的物质,二者经吸附氧化后生成的物质又参与催化氧化反应继续处理Fe2+、Mn2+,因此,在沸石表面发生了自催化氧化反应[7]. 此外,沸石表面的纳米MnO2结合水分子解离出OH-和H+,构成水合金属氧化物,从而使沸石表面羟基化,对水中金属离子也具有较高的络合能力[37],提高了沸石去除污染物的能力. 纳米TiO2在沸石中形成柱撑,会增加沸石的孔径、孔体积、阳离子交换量,同时沸石对Fe2+、Mn2+的表面络合吸附和层间离子交换能力也得到了提高.
2.4 反冲洗对污染物去除效果的影响
从反冲洗开始,10 min内反冲洗水中Fe2+、Mn2+质量浓度变化如图10(a)所示. 由图10(a)可知,出水前4 min,Fe2+、Mn2+质量浓度较高,2 min时达最高,分别为4.79和1.68 mg/L,这表明滤层中截留的大部分Fe2+、Mn2+已经被冲洗出. 随着反冲洗的进行,Fe2+、Mn2+质量浓度持续降低,7 min后反冲洗出水离子质量浓度几乎不再变化. 这说明滤层中截留的污染物在反冲洗前4~7 min内几乎被冲出,因此确定反冲洗时间至少为7 min. 另外,为研究反冲洗后改性沸石对Fe2+、Mn2+去除效果的影响,在反冲洗过程结束后继续进行过滤试验,滤柱进出水Fe2+、Mn2+质量浓度随时间的变化如图10(b)所示. 从图10(b)可以看出,反冲洗后过滤40 min时,出水Fe2+质量浓度基本降至0.3 mg/L,反冲洗后过滤50 min时,出水Mn2+质量浓度也降至0.1 mg/L,沸石对污染物的去除效果良好,说明反冲洗时间和强度合理,没有对沸石结构和性能造成破坏.
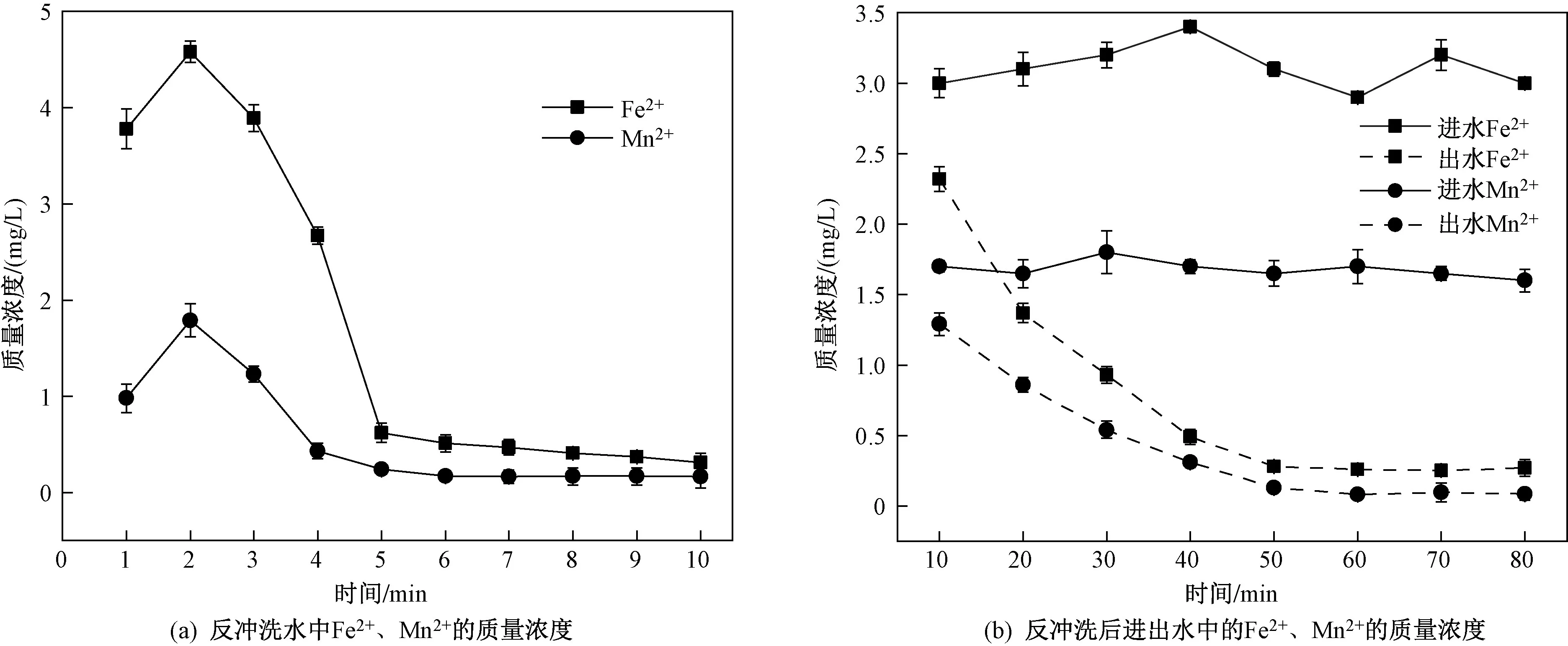
图 10 反冲洗水及其出水中Fe2+、Mn2+质量浓度的变化Fig.10 The change of mass concentration of Fe2+ and Mn2+ in water
3 结论
a) 通过SEM、EDS、XRD、BET微观形貌分析及阳离子交换量测试分析结果表明,天然沸石负载纳米MnO2和TiO2后,沸石表面出现了大量的颗粒绒状物,且呈现出明显的孔结构. 与天然沸石相比,改性沸石的比表面积、孔径、孔体积、阳离子交换量等性能均有提升,有利于Fe2+、Mn2+同步吸附去除. 去除过程不仅包括离子交换、络合的化学吸附,还涉及改性剂MnO2的自催化氧化、Fe(OH)3的截留作用等.
b) 动态吸附试验表明,进水Fe2+、Mn2+质量浓度分别为5 mg/L、2 mg/L,水流速度为7 m/h,进水pH为9.5,水质硬度为350 mg/L,滤层厚度为110 cm时,改性沸石对Fe2+、Mn2+的去除效果最佳,出水Fe2+、Mn2+质量浓度在连续过滤21 h之内基本能够达到《生活饮用水卫生标准》(GB 5749-2006)的限值要求.
c) 反冲洗试验表明,当反冲洗的强度为13 L/(m2·s),持续反冲洗至少7 min后,沸石大部分的吸附能力恢复,再生效果良好,改性沸石可重复使用.
d) 根据Thomas模型拟合参数可知,相关系数R2>0.9,表明该模型能较好地拟合和预测沸石对Fe2+、Mn2+的吸附试验数据. 通过Thomas模型预测,改性后沸石的吸附饱和量增大,速率常数降低.
