高寒半湿润地区不同苜蓿品种越冬期根系生理及构型特征
2022-04-25孙万斌马晖玲周青平陈有军张俊超刘文辉
孙万斌, 马晖玲*, 周青平, 陈有军, 张 伟, 张俊超, 刘文辉
(1.甘肃农业大学草业学院/草业生态系统教育部重点实验室/甘肃省草业工程实验室/中-美草地畜牧业可持续发展研究中心, 甘肃 兰州 730070; 2.西南民族大学青藏高原研究院/四川若尔盖高寒湿地生态系统国家野外科学观测研究站/四川省发改委工程实验室, 四川 成都 610041; 3.青海省青藏高原优良牧草种质资源利用重点实验室青海大学畜牧兽医科学院, 青海 西宁 810016)
青藏高原是我国重要的畜牧业生产基地,也是我国草地畜牧业的重要组成部分。近年来,牧区人口数量不断增加,传统放牧仍为当地主要的草地利用方式,加之全球气候变化的影响,致使天然草地生产力降低和生态环境恶化,极大制约了该地区草地畜牧业的可持续发展[1]。建植优质高产的人工草地,利用现代化草牧业生产方式将是该地区畜牧业发展的必由之路[2]。苜蓿(MedicagosativaL.)是世界范围内的一种品质高、适口性好的饲料作物[3],不仅具有优良的饲用功能,而且在现代草地农作制度中,起到促进农田生态系统物流及能流良性循环、保持耕地水土、提高后茬作物产量的重要生态作用。青藏高原地区冬、春季空气干燥,风蚀作用强烈[4],严酷的自然环境威胁苜蓿越冬,制约着该地区优质苜蓿生产,因此,在该地区进行苜蓿越冬期根系生理及构型特征研究对高寒地区优质苜蓿品种的选择和建植优质苜蓿人工饲草地具有重要意义。
青藏高原地区冬春季空气干燥、气温低、紫外线强烈,导致植物体内活性氧积累,影响正常生理代谢[5]。低温打破活性氧产生和清除之间的平衡,造成活性氧积累,损伤膜系统、蛋白质和核酸。活性氧积累是植物受到低温损伤的重要原因之一[6],而酶类抗氧化系统是植物体内清除活性氧、维持植物细胞内活性氧平衡的重要调节机制[7];植物细胞内的丙二醛是脂质过氧化的产物,在一定程度上可以反映细胞膜脂过氧化的程度[8],累积的丙二醛也会加剧细胞膜脂的损伤;陶雅[9]、南丽丽[10]等人的研究认为可溶性糖含量与苜蓿的抗寒性有关,在抗寒性较强的苜蓿品种根颈中可溶性糖含量处于较高的水平。
苜蓿根系作为主要的越冬器官,可通过改变表型性状和对养分的储备影响紫花苜蓿的抗寒性[11]。刘志英等人[12]的研究认为根颈直径和侧根数是影响紫花苜蓿越冬率的正向贡献因子,并且根系直径等性状并不是决定抗寒能力的主导因子,不同根系性状的紫花苜蓿品种表现出对越冬率的差异化响应;刘香萍[13]认为抗寒和不抗寒品种根部组织结构中木质部分布上的差异与苜蓿的抗寒性存在一定的组织结构适应性关系;也有研究认为分枝型根系比单个直根更能忍受冻拔现象[14]。
在青藏高原海拔3 000 m以上地区,对第一年田间自然越冬苜蓿根部与根颈生理响应的研究鲜见报道。因此本研究在青藏高原海拔3 500 m半湿润地区,在自然越冬的4个不同时间点,分别比较播种当年10个不同苜蓿品种根颈和根部抗氧化酶和渗透调节物质指标,并分析比较这些苜蓿品种的根系特征指标,研究这些指标与苜蓿越冬率的关系,以期为青藏高原高寒地区建植优质人工苜蓿草地和苜蓿新品种选育提供参考资料。
1 材料与方法
1.1 试验地概况
于四川若尔盖高寒湿地生态系统国家野外科学观测研究站草种质资源圃内(32.83° N,102.58° E)开展试验,试验地海拨3 492 m,年均降水量为753 mm,80%降水集中于5-10月份;干雨季分明,雨热同期;年平均气温约1.1℃,1月平均气温-10.3℃,7月平均气温10.9℃。该地气候类型属大陆性高原寒温带季风气候;日照长,太阳辐射强烈。试验地土壤为栗钙土,pH值为5.85;土壤容重为1.02 g·cm-3;土壤有机质含量24.62 g·kg-1;全氮含量为 2.76 g·kg-1;全磷含量为0.94 g·kg-1。离地表10 cm,20 cm,30 cm处土壤温度和土壤含水量利用预先置于试验小区中的EM50土壤温、湿度监测系统采集,每10 min采集1次温湿度数据,土壤温、湿度变化情况如图1所示。
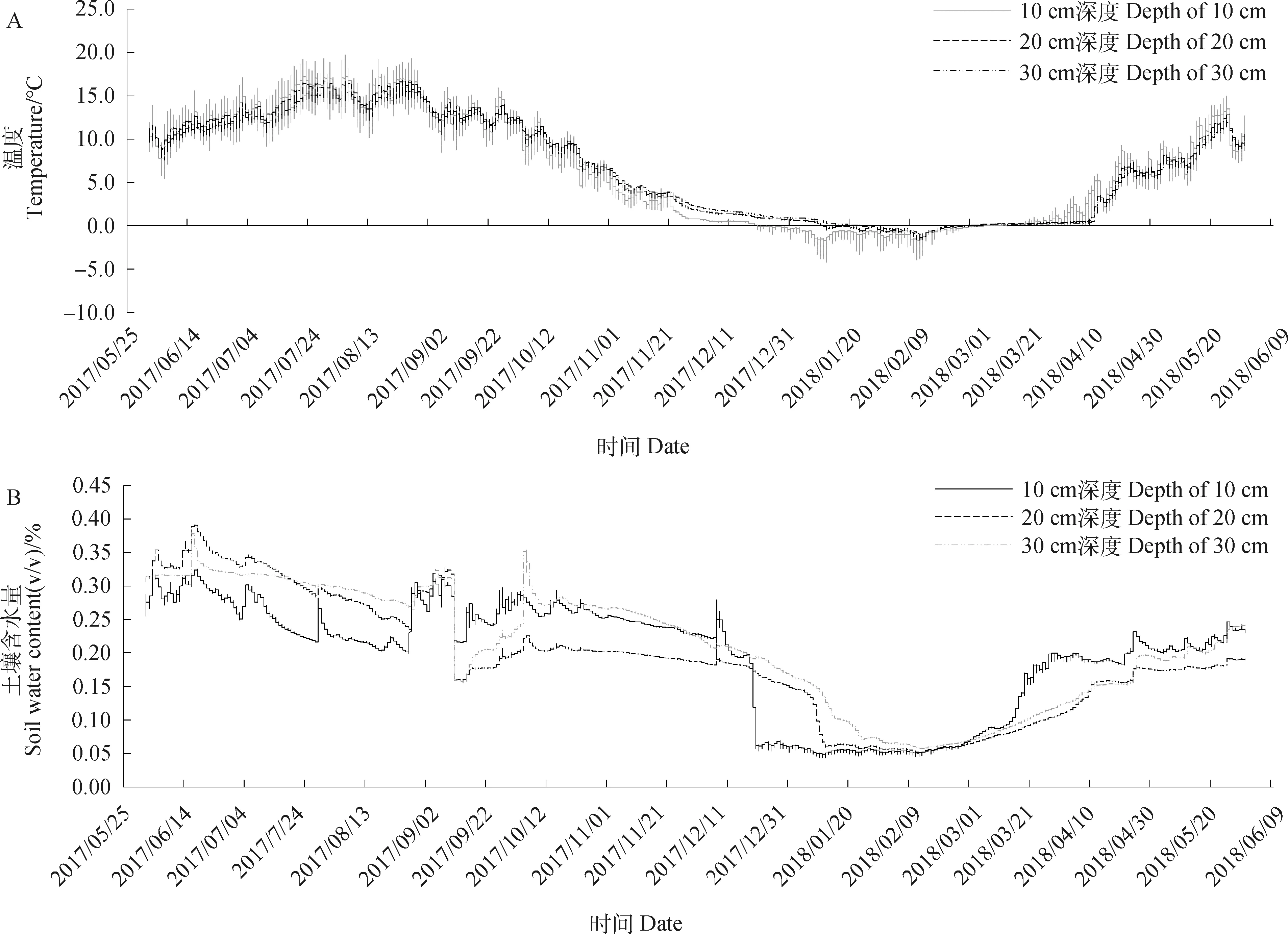
图1 试验地距离地表10 cm,20 cm,30 cm处土壤温度和土壤含水量变化
1.2 试验设计
将10个苜蓿品种(表1)于2017年6月2日种植于西南民族大学青藏高原基地牧草资源圃内,设3个重复,共30个小区,小区面积15 m2(3 m×5 m),采用随机区组排列。播前翻耙平整后开沟,开沟深约2~3 cm;条播,行间距约30 cm,播种量为3 g·m-2。试验期间各小区统一管理,人工除草3次。分别在2017年9月26日、11月16日和2018年1月15日、3月24日(分别记T1为抗寒锻炼初期;T2抗寒锻炼末期;T3土壤开始冻结;T4土壤解冻)取根及根颈组织鲜样迅速投入液氮中并储存至—80℃冰箱中保存,用于测定与抗寒性相关的生理生化指标。并于返青后2018年5月11日统计越冬率。且于越冬前,在上述每个小区内随机选取30株苜蓿,挖取根系用于根系特征的测定。
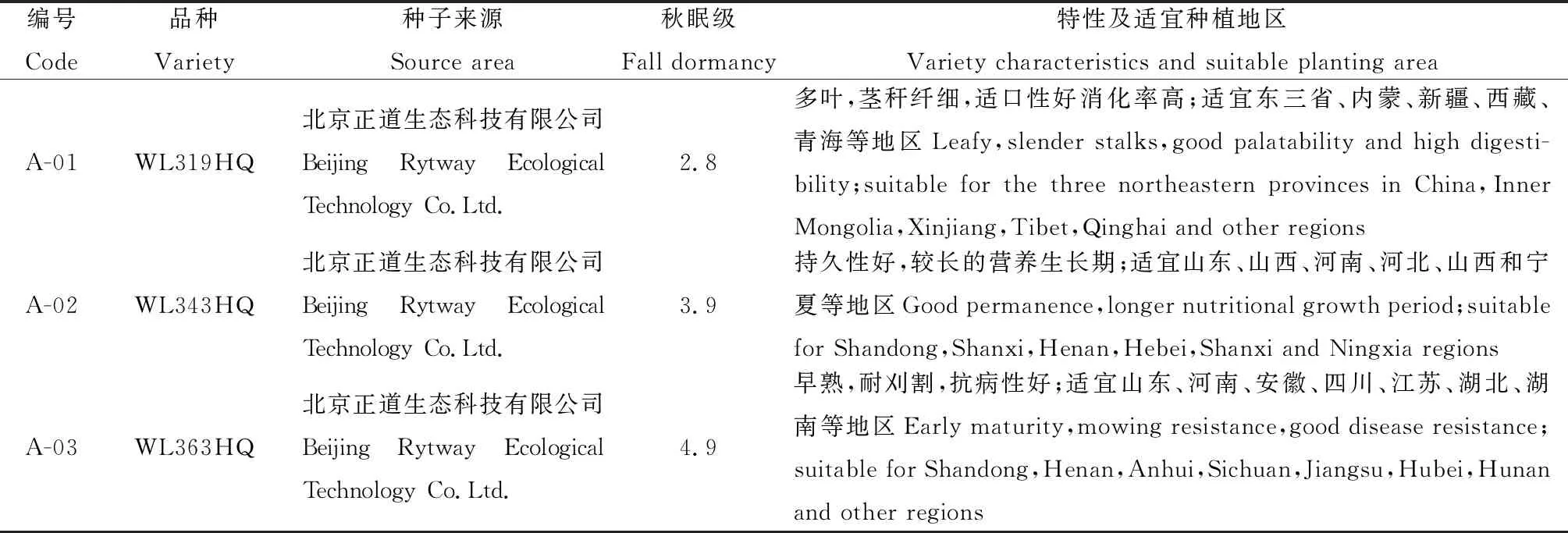
表1 供试品种

续表1
1.3 测定指标与方法
1.3.1越冬率(Overwintering rate)的测定 越冬率(%)=返青存活株数/越冬前存活株数×100[15]。
1.3.2生理生化指标测定 超氧化物歧化酶(Superoxide dismutase,SOD)、过氧化氢酶(Catalase,CAT)、过氧化物酶(Peroxidase,POD)活性和丙二醛(Malondialdehyde,MDA)、游离脯氨酸(Proline,Pro)、可溶性糖(Soluble sugar,SS)含量采用邹琦[16]所述方法进行测定。
1.3.3根系形态指标的测定 用流水彻底清洗根系,然后将根系置于透明聚甲基丙烯酸根盘中,加蒸馏水使水位达1 cm高,用塑料镊子拨动根系,使根系尽量避免交叉和重叠,然后利用Epson expression 12 000 xl扫描仪在600 DPI下获取图像,最后利用Win-RHIZO 2017a(Regent Instruments,Inc.,Quebec,Canada)软件分析扫描的图像,并得到所需根系数据。
1.3.4根系拓扑指数的测定 Fitter[17]和Bouma[18]等人提出了鱼骨形分支(图2B)和叉状分支(图2A)两种极端根系拓扑类型,并使用根系拓扑指数(Topological index,TI)反映植物根系的不同分支模式。其中TI=lgA/lgM(M表示外部连接的数量,等于根中分生组织的数量;A表示根系从外部连接到最基础连接的最长路径上的连接数)。相关研究表明[19-20],大多数植物根系拓扑结构是在叉状分支和鱼骨形分支模式之间。当TI接近1时,根系呈现鱼骨形分枝,当TI接近0.5时,根系呈现叉状分枝。
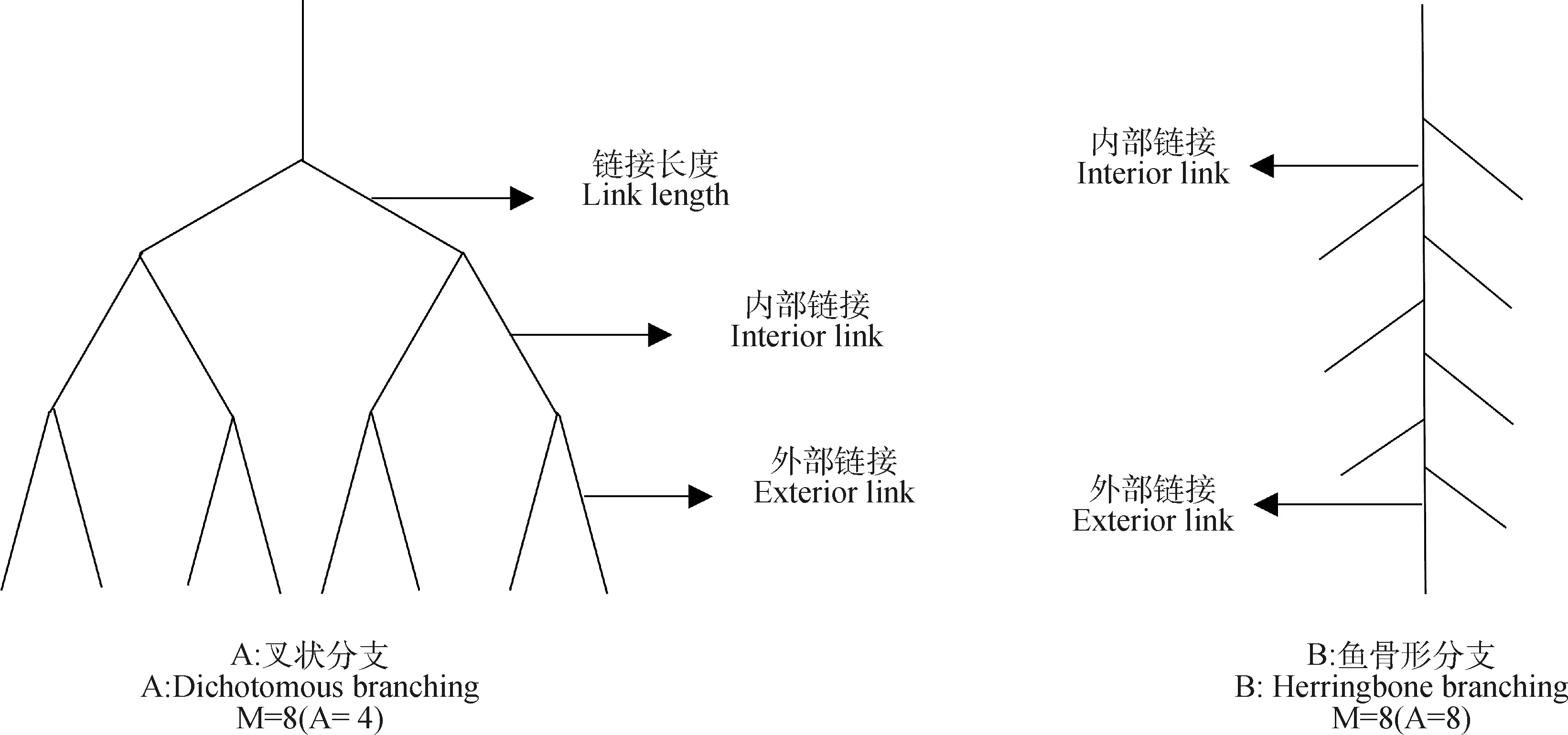
图2 根系拓扑结构
1.4 数据统计分析方法
数据利用IBM SPSS Statistics 22.0软件进行单因素方差分析(One-Way ANOVA)新复极差法(Duncan)多重比较和各指标的相关性分析(Pearson),用Microsoft Excel 2019进行数据初步整理和作图。
2 结果与分析
2.1 不同品种苜蓿第一年越冬率的比较
如图3所示,参试不同苜蓿品种越冬率差异显著(P<0.05),其中A-07品种越冬率最高,越冬率为94.01%,A-04越冬率最低,为86.05%,该地区参试苜蓿当年越冬率均在85%以上。
2.2 越冬期不同品种苜蓿根部和根颈抗寒生理响应
2.2.1越冬期不同品种苜蓿根和根颈中3种抗氧化酶活性的比较 由表2可知,参试不同苜蓿品种根部和根颈的SOD活性在不同取样时期差异显著(P<0.05),T1时期,A-07根部SOD活性显著高于其他品种(P<0.05),其活性为400.81 U·min-1·g-1FW;同样在T1时期,根颈中A-09活性最高,SOD活性为484.68 U·min-1·g-1FW。SOD活性在根部呈先升高后降低再升高的趋势,而在根颈中呈先降低后升高再降低的趋势,该酶活性在根部与根颈中的变化特征刚好相反。

表2 参试苜蓿品种越冬不同时期根和根颈超氧化物歧化酶活性
由表3可知,参试不同苜蓿品种根部和根颈的POD活性在不同取样时期差异显著(P<0.05),T1时期,A-10根部POD活性显著高于其他品种(P<0.05),其活性为53 176.59 U·min-1·g-1FW;同样在T1时期,A-08根颈POD活性显著高于其他品种(P<0.05),其活性为93 230.83 U·min-1·g-1FW。POD活性在根部和根颈中呈先略有升高然后持续降低的趋势。
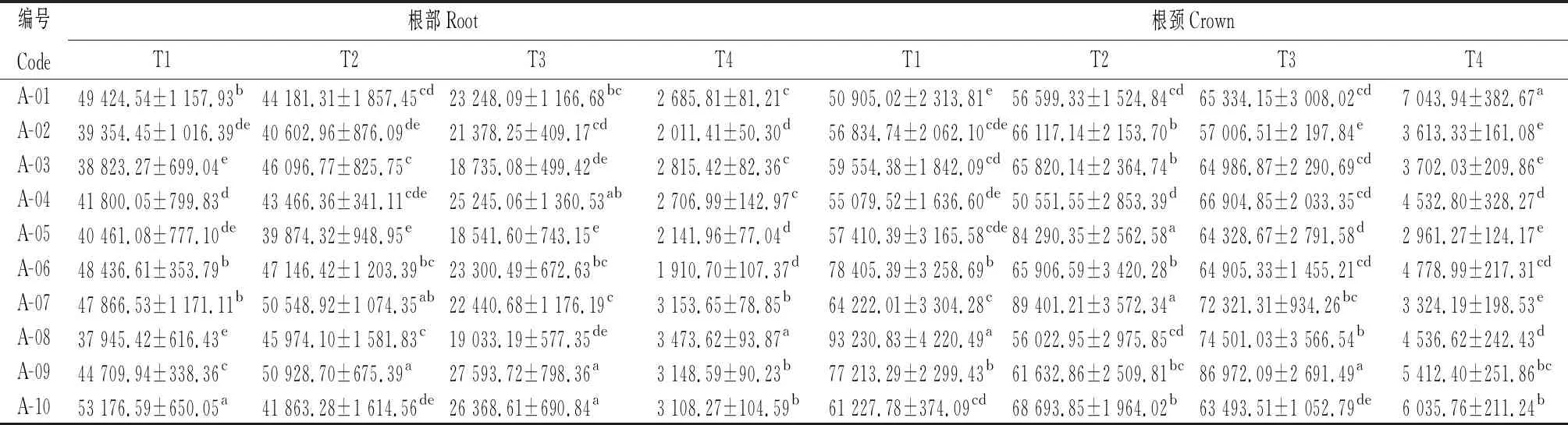
表3 参试苜蓿品种越冬不同时期根和根颈过氧化物酶活性
由表4可知,参试不同苜蓿品种根部和根颈的CAT活性在不同取样时期差异显著(P<0.05),T2时期,A-01根部CAT活性最高,其活性为531.43 U·min-1·g-1FW;同样在T2时期,A-04根颈CAT活性显著高于其他品种(P<0.05),其活性为1 125.74 U·min-1·g-1FW。根颈和根部的CAT活性变化特征相似,呈先升高后持续降低的趋势。
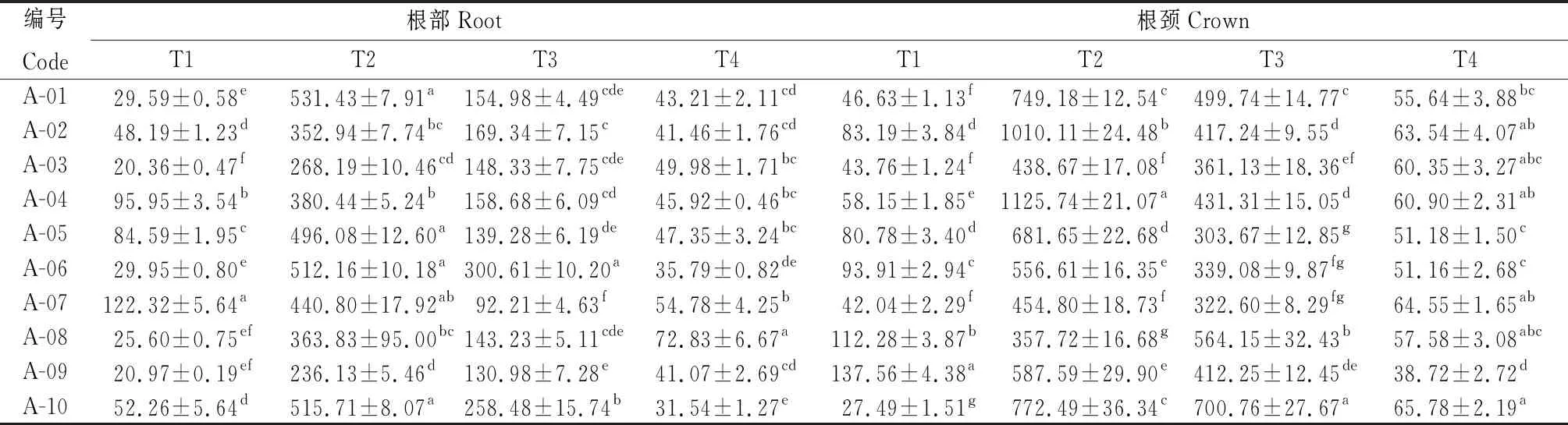
表4 参试苜蓿品种越冬不同时期根和根颈过氧化氢酶活性
2.2.2越冬期不同品种苜蓿根和根颈中主要渗透调节物质含量的变化 由表5可知,参试不同苜蓿品种根部和根颈的SS含量在不同取样时期差异显著(P<0.05),在T3时期,A-09根部SS含量最高,其含量为131.19 mg·g-1FW;在T2时期,A-10根颈SS含量显著高于其他品种(P<0.05),其含量为111.78 mg·g-1FW。所有参试品种根部SS含量先持续升高,T3时达到最高,然后下降;在根颈中A-02,A-03,A-04品种SS含量T3时达到最高,而其余参试品种根颈中SS含量在T2时已经达到最高。
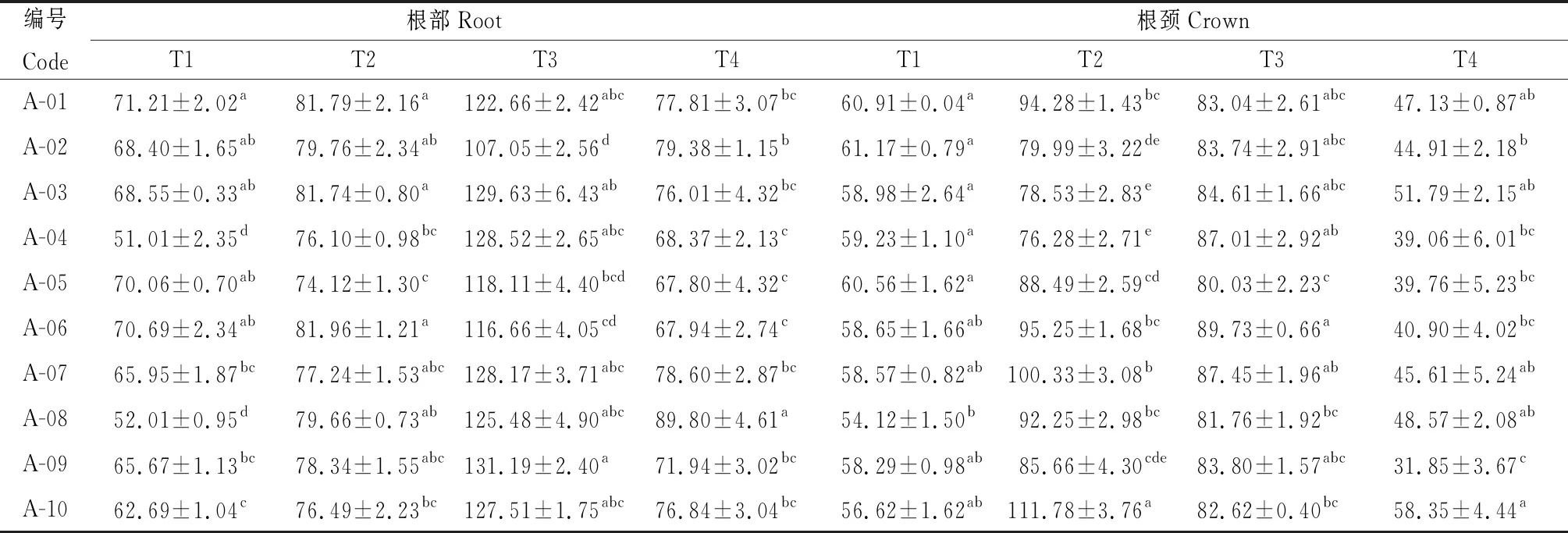
表5 参试苜蓿品种越冬不同时期根和根颈可溶性糖含量
由表6可知,参试不同苜蓿品种根部和根颈的Pro含量在不同取样时期差异显著(P<0.05),在T4时期,A-07根部的Pro含量显著高于其他品种(P<0.05),其值为873.64 μg·g-1FW;在T3时期,A-01根颈中的Pro含量最高,其值为1 044.43 μg·g-1FW。根部和根颈中的Pro含量变化特征较为一致,从T1开始持续上升,到T3达到最高,然后开始下降,在整个越冬期4个取样时间点,不同苜蓿品种根颈中Pro含量高于对应的根部。
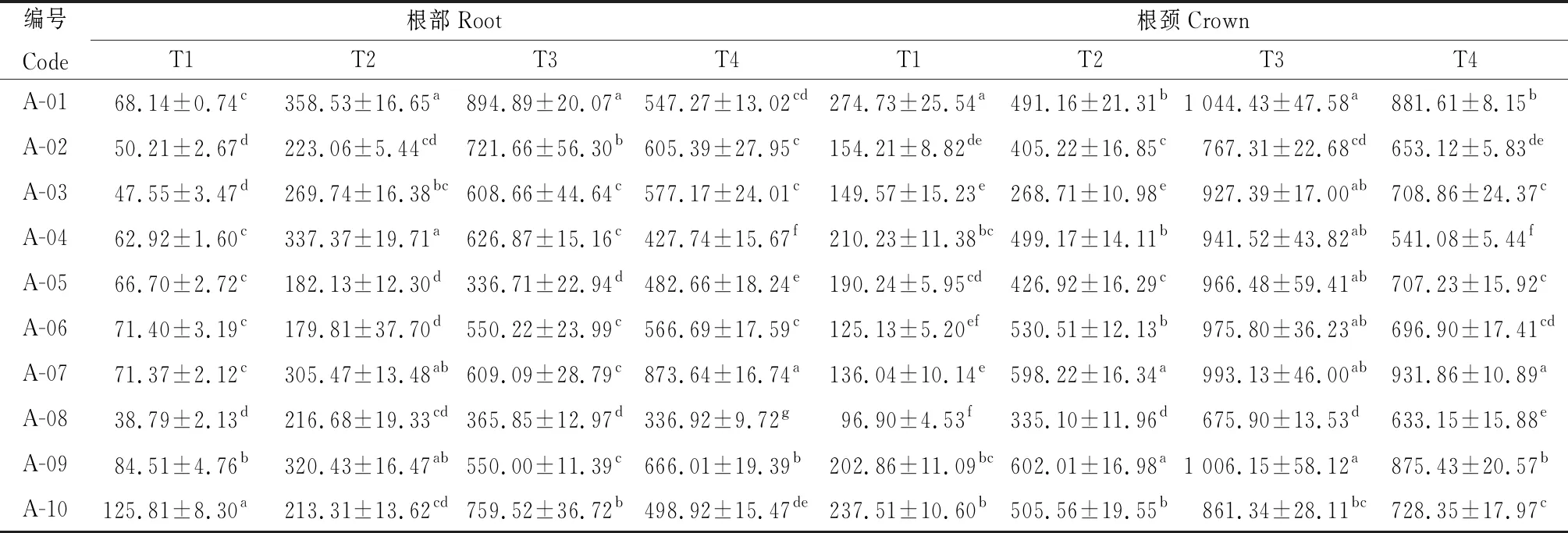
表6 参试苜蓿品种越冬不同时期根和根颈脯氨酸含量
2.2.3越冬期不同品种苜蓿根和根颈丙二醛含量的变化 由表7可知,参试不同苜蓿品种根部和根颈的MDA含量在不同取样时期差异显著(P<0.05)。T2时期,A-08根部的MDA含量显著低于其他品种(P<0.05),其值为10.49 μmol·g-1FW;同样在T2时期,A-09根颈中的MDA含量最低,其值为17.01 μmol·g-1FW。越冬期间参试品种苜蓿的根部和根颈丙二醛含量在T1时最高,T1到T2间,根部和根颈丙二醛含量降低幅度较大。

表7 参试苜蓿越冬不同时期根和根颈丙二醛含量
2.3 不同苜蓿品种根系特征分析
2.3.1不同苜蓿品种根系形态指标比较 由图4可知,不同品种苜蓿根序、总根长、主根平均直径、根体积4个指标差异显著(P<0.05)。品种A-09根序值与总根长等2个指标最大,其根序值为6.36(图4A),总根长为383.45 cm(图4B);品种A-01主根平均直径最大,其主根平均直径为1.47 mm(图4C);品种A-10根体积最大,其根体积为0.36 cm3(图4D)。

图4 不同品种苜蓿根序、总根长、主根平均直径、根体积比较
由图5可知,各参试不同苜蓿品种间总根表面积、平均根系直径、根尖数、分叉数4个指标差异显著(P<0.05)。品种A-09总根表面积、根尖数与分叉数等3个指标最大,其总根表面积为40.18 cm2(图5A),根尖数为557.13个(图5C),分叉数为734.14个(图5D);品种A-08平均根系直径最大,其平均根系直径为0.41 mm(图5B)。

图5 不同品种苜蓿总根表面积、平均根系直径、根尖数、分叉数比较
2.3.2不同品种苜蓿根系拓扑指数比较 由图6可知参试各苜蓿品种拓扑指数差异显著(P<0.05),品种A-08拓扑指数最大,其拓扑指数为0.82;品种A-09根系拓扑指数最低,其拓扑指数为0.72。

图6 不同品种苜蓿根系构型比较
2.4 苜蓿生理及根系特征指标与越冬率的相关性分析
如表8所示,参试苜蓿的总根长、总根表面积、主根平均直径、T4时期根部脯氨酸含量及T1时期根颈可溶性糖含量与其越冬率呈极显著正相关关系(P<0.01);总根体积、根尖数、分叉数及T4时期根颈脯氨酸含量与越冬率呈显著正相关关系(P<0.05);而T2时期根颈过氧化氢酶活性与越冬率呈显著负相关关系(P<0.05)。

表8 与越冬率有关指标的相关关系
选取10个与越冬率有显著相关性的指标,利用主成分分析,如表9所示,前三个成分的特征值大于1,累计贡献率为78.59%,提取的3个公因子可以代表绝大部分信息。

表9 与越冬率相关指标公因子和方差贡献率
进一步的利用与越冬率有关的因子主成分载荷矩阵,如表10所示,可得到3个公因子F1,F2,F3(其中,X1表示总根长;X2表示总根表面积;X3表示主根平均直径;X4表示总根体积;X5表示根尖数;X6表示分叉数;X7表示T4根部Pro;X8表示T2根颈CAT;X9表示T4根颈Pro;X10表示T1根颈SS,下同)。F1=0.964X1+0.978X2+0.752X3+0.941X4+0.921X5+0.953X6+0.502X7+0.003X8+0.379X9+0.204X10;F2=—0.106X1—0.141X2—0.089X3—0.175X4—0.074X5—0.110X6+0.531X7—0.096X8+0.588X9+0.759X10;F3=0.008X1—0.014X2—0.100X3—0.044X4+0.036X5+0.096X6+0.038X7+0.957X8—0.187X9+0.234X10。
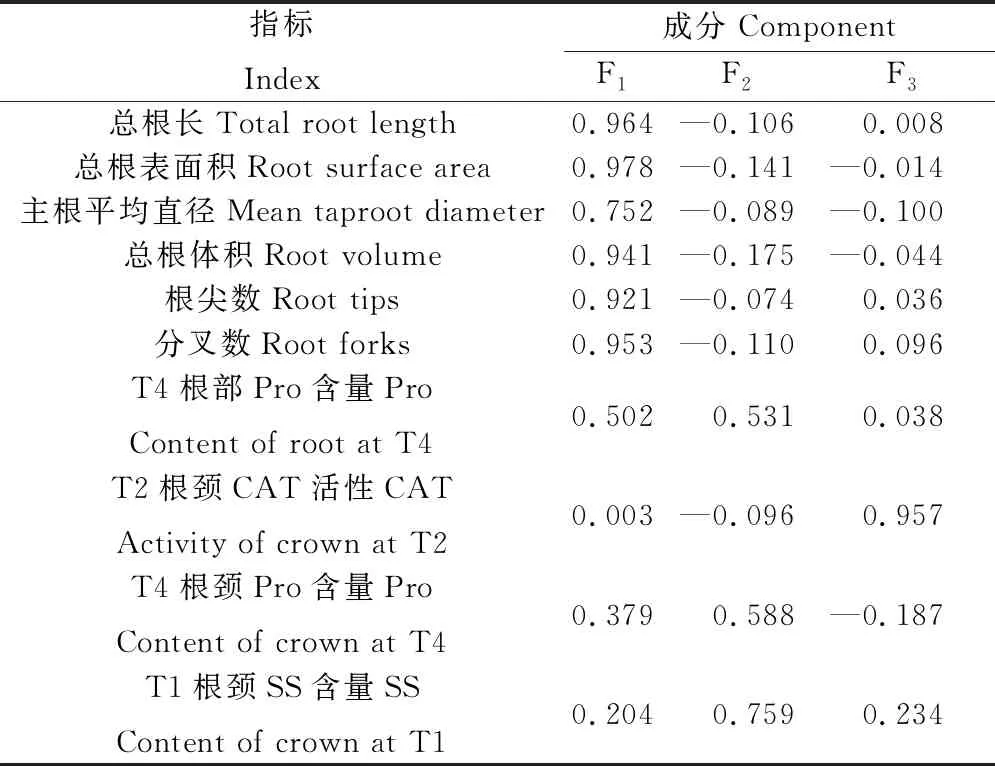
表10 与越冬率有关的因子主成分载荷矩阵
利用公因子的方差百分比和上述分析中各参数所对应的系数,计算综合因子,最终得到综合模型:
F=0.520 13X1+0.521 059X2+0.393 988X3+0.493 091X4+0.503 393X5+0.522 586X6+0.350 521X7+0.087 696X8+0.266 75X9+0.235 538X10
X6,X2,X1的相关系数分别为0.522 6,0.521 1,0.520 1,对分叉数、总根表面积、总根长进行回归后得到回归方程:
Y=0.842—1.135X6+0.501X2+1.075X1(R2=0.325,P=0.015)
由上述分析可知,苜蓿根系的分叉数、总根表面积、总根长对苜蓿越冬率影响较大。
3 讨论
3.1 越冬期苜蓿根和根颈中生理指标对低温的响应
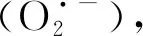

在植物抗寒过程中SS和Pro均具有渗透调节的功能,SS和Pro等渗透调节物质在低温驯化阶段的积累改变了细胞的渗透势,从而减少了细胞间形成的冰与细胞内溶液之间的水势差,使得水从细胞中渗出的速率降低。相关研究表明,低温诱导的糖代谢调节与耐冷性之间存在因果关系[29]。本试验中,苜蓿根部和根颈中可溶性糖含量随着温度的降低而升高,到了T4(返青前)可溶性糖含量明显降低,与魏双霞等人[30]的研究结果一致,在拟南芥中,糖积累的另一个作用是避免冰成核,抗寒锻炼期间SS积累与较低的冰成核温度(冰晶开始形成的温度)相关[31],到苜蓿返青前,SS作为贮藏性物质被消耗利用。
Pro被认为是相容性溶质,据报道它在保护酶免受变性、稳定蛋白质合成机制、增加水结合能力以及充当碳氮源的储藏中起着重要作用[32]。本试验中,苜蓿根颈与根部Pro随着温度的降低持续升高,起到渗透调节等保护作用,到T4(返青前)根部和根颈中的Pro含量均维持在较高的水平,为返青提供碳和氮的来源来促进生长[33];根颈中的Pro含量均高于根部,Pro含量的变化与环境胁迫紧密相关;T4(返青前)根颈中的Pro含量与越冬率显著正相关(P<0.05),但根颈中T1(抗寒锻炼初期)的SS含量与越冬率呈极显著正相关(P<0.01),关于这一结果,文献中未见报道,需进一步深入研究。
MDA是脂质过氧化的最终产物,其含量反映了膜脂过氧化程度[34]。本试验中根部与根颈的MDA含量在抗寒锻炼初期就达到较高的水平,到抗寒锻炼末期MDA含量达到最低水平,与此同时根部和根颈中的CAT活性达到最高,抗寒锻炼阶段MDA的累积量可能与CAT的活性有关。
3.2 苜蓿根系特征与抗寒性的关系
苜蓿为直根系多年生牧草,根系是苜蓿养分吸收、运输、贮存的主要功能器官,其生长发育状况直接影响其产量以及饲用品质,并且在自然越冬过程中根系与苜蓿的抗寒性能密切相关[35]。本试验中,根序级与苜蓿越冬率相关性不显著,根序级在一定程度上反映了不同苜蓿品种细根系统内部结构上的异质性;越冬率与总根长与总根表面积极显著正相关,总根长和总根表面积反映了根系空间扩张、吸收养分和吸收土壤水分的能力,所以总根长和总根表面积较大的苜蓿品种获得水分和营养元素的能力越强,适应环境的能力越强[36]。本试验中主根平均直径与越冬率呈极显著相关关系,周洋洋[37]的研究也表明主根直径与越冬率呈极显著正相关关系,说明主根的营养物质积累和发育状况与苜蓿的抗寒性密切相关;总根体积、根尖数和分叉数也与苜蓿越冬率显著正相关,而有研究表明,总根体积越大、根尖数越多分叉数越多则说明根部在土壤中的分布越广、根系代谢越旺盛、各级根向四周的扩展范围能力越强[38]。根系的拓扑指数反映了不同植物根系的分支模式,其直接影响到植物根系吸收效率和根系构建过程中所需的碳量[39],本研究中越冬率最高的A-07,A-09两个品种拓扑指数更接近于0.5,也有在藜科植物中的研究表明,叉状分支模式的根系,在高海拔可以迅速获得营养物质,这有助于它们在营养有限的生境中具有潜在的竞争力[19]。
4 结论
10个不同品种苜蓿在青藏高原东缘半湿润地区的越冬过程中越冬率均在85%以上;返青前根颈和根部脯氨酸含量和越冬初根颈可溶性糖含量与越冬率有相关性;根颈生理活动较根部敏感;苜蓿根系特征指标如分叉数、总根表面积、总根长是影响苜蓿越冬率的主要指标;根系发达、扩展性较强的‘WL319HQ’、‘皇后’、‘太阳神’、‘驯鹿’等苜蓿品种在该地区具有较好的越冬能力。
