铁代谢调节分子Erythroferrone研究进展*
2022-04-24万双双郭玥彤杨文静郭佳帅高国粉常彦忠
关 鹏 万双双 郭玥彤 杨文静 郭佳帅 高国粉 常彦忠* 于 鹏*
(河北师范大学生命科学学院,石家庄050024)
铁是人体必需的微量元素,在众多生理生化过程中发挥着重要的生物学功能。铁在DNA 的合成与修复、蛋白质的合成与折叠、电子传递、能量代谢、细胞增殖与分化等细胞代谢过程中发挥着至关重要的作用。铁缺乏可以引起缺铁性贫血和儿童神经系统疾病,而当机体内的铁超过了正常的铁存储机制负荷时,过多的铁可以催化自由基产生并对细胞产生氧化应激损伤,从而引起血色素沉着症、神经退行性疾病及衰老相关的疾病[1]。因此,机体存在着严格的铁代谢调节机制,以确保体内铁含量始终处于正常生理水平。铁调素(hepcidin)是调控机体铁代谢的关键分子,主要促进目前唯一已知的铁排出蛋白——膜铁转运蛋白(ferroportin1,FPN1) 的内化降解,从而减少肠道的铁吸收和巨噬细胞储存铁的释放进入血液循环[2]。由此可见,hepcidin 表达调控是治疗铁代谢紊乱疾病的潜在靶点。
铁是红细胞成熟过程中合成血红蛋白必不可少的原料,红细胞生成的速度是决定铁吸收量的重要因素。早在1994年,Finch[3]就提出可能存在响应红细胞生成需求而调控铁的激素。到2014 年,Kautz 等[4]首次确认erythroferrone(ERFE)可以调控hepcidin的表达,是连接红细胞生成和铁代谢调控的重要分子。本文对ERFE 的发现、分子结构、功能,以及分子靶向治疗等方面的研究进展综述如下。
1 ERFE的发现
失血和低氧均能刺激肾上腺髓质合成与分泌促红细胞生成素(EPO),使骨髓生成红细胞的数量增加。红细胞的大量生成导致对铁的需求增多,机体通过抑制肝脏合成与分泌hepcidin,动员循环铁用于骨髓中红细胞发育所用。虽然EPO 抑制hepcidin 的作用已经明确,但是体外研究显示,EPO并不直接抑制肝细胞中hepcidin的表达[5],表明EPO 在调控hepcidin 时可能还有一个分子桥接。2014 年,Kautz 等[4]发现机体失血引起Fam132bmRNA 增多,这一变化与血清中EPO 的含量变化相一致;直接给予EPO 可以引起Fam132bmRNA更加快速地增多,表明Fam132b 可能受EPO 的直接 调 控, 后 来 将 Fam132b 命 名 为 ERFE(erythroferrone)。近年来对ERFE 作用的机制研究发现,ERFE 主要通过与肝脏骨形态形成蛋白(bone morphogenetic protein,BMP)I型受体结合,阻断BMP/SMAD 信号通路从而抑制hepcidin转录[6]。
2 ERFE的结构特征
ERFE 是由Fam132b基因编码的糖蛋白,由于其C端含有球状的C1q结构域,故属于C1q/TNF相关蛋白(C1q/TNF-related protein,CTRPs)家族,与早前报道的CTRP15和肌联素(myonectin)蛋白是同一个分子[7-8],肌联素最初是在骨骼肌细胞中发现的与脂代谢相关的调控因子。小鼠和人类ERFE 基因同源性很高,其编码区序列全长均为10 kb左右,包含8个外显子,分别位于小鼠1号染色体和人类2号染色体上[9]。
人ERFE 蛋白含354 个氨基酸,小鼠ERFE 蛋白含340 个氨基酸,两者相似度达到71%。ERFE蛋白有5 个结构域[10],有4 个Cys 残基和4 个潜在N-连接的糖基化位点:从N 端开始1~24 氨基酸是信号肽;第25~96 位氨基酸是N 端结构域1;第97~114 位氨基酸为含有6 个甘氨酸-X-Y(X、Y 代表任意一种氨基酸)重复序列的胶原结构域;第115~190位氨基酸为N端结构域2;第191~340位氨基酸构成一个与C1q/TNF 同源的C 端球形结构域(图1)。C 端的TNF 区域在不同物种间高度保守,是调节hepcidin 的一个重要区域。ERFE 蛋白常以三聚体、六聚体或高分子量低聚物的形式分泌,分泌过程与蛋白质N端的糖基化修饰有关。4个保守的半胱氨酸与ERFE 的多聚化相关,Cys273 和Cys278对于ERFE蛋白的正确折叠很重要,任一位点被丙氨酸取代均可抑制蛋白质分泌;而Cys142或Cys194 被丙氨酸取代可增强蛋白质分泌,表明在内质网的滞留促进了ERFE 寡聚物的组装[11]。ERFE 还含有2 个PCSK3/furin 识别位点[8],所以ERFE 蛋白加工后可能以多种剪接异构体形式存在,但是关于不同剪接形式的ERFE蛋白的多聚化调控及其功能目前还不清楚。
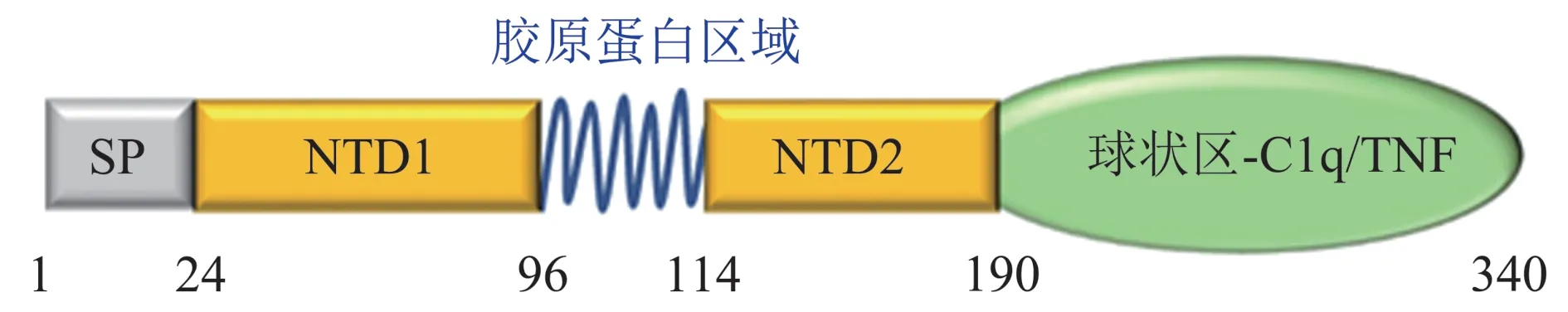
Fig.1 Schematic representation of the ERFE protein domain structure(modified from reference[7-8])图1 ERFE的蛋白质结构预测图(修改自文献[7-8])
3 ERFE的分布和功能
机体在受EPO刺激时,ERFE是由网织红细胞分泌并表达的。给予小鼠外源性的EPO,或放血引起内源性的EPO 增加均可以促进ERFE 表达。Kautz 等[4]发现,EPO 以JAK2/STAT5 依赖的方式促进ERFE蛋白的表达增加。此外,骨骼肌、平滑肌、心脏、脑、肠等组织器官也可产生ERFE。ERFE在机体中发挥着重要的作用。一方面,ERFE可以调节糖代谢和脂代谢,是机体感知营养状态的一种感应因子;另一方面,ERFE 可以抑制hepcidin 的分泌,通过增加铁摄取和动员储存铁进入血液从而满足红细胞生成中铁的需求。研究发现,ERFE在地中海贫血小鼠体内显著增加,并表现出EPO水平升高,肝脏hepcidin表达下降,网织红细胞数量增加等特征[12],推测EPO 刺激了网织红细胞分泌ERFE,进而抑制肝脏hepcidin的分泌,从而增加铁的供应。
3.1 ERFE对糖脂代谢的调节
Li 等[13]研究发现,2 型糖尿病患者和糖耐量异常患者ERFE 水平显著升高,并且ERFE 水平与体脂含量、甘油三酯、空腹血糖、糖负荷后2 h 血糖、空腹胰岛素、糖化血红蛋白等指标呈正相关,表明ERFE参与糖脂代谢。葡萄糖或游离脂肪酸均能够促进体外培养的肌细胞分泌ERFE,灌胃葡萄糖和脂质能够增加小鼠血清中ERFE的水平,提示ERFE是机体感知糖脂状态的一种感应因子[7]。同时,ERFE 也和胰岛素敏感性相关,Yang 等[14]认为,高脂或高糖引起的胰岛素抵抗可能通过PI3K/p38-MAPK 信号通路在转录水平抑制ERFE;而Lim 等[15]推测,ERFE 可能通过影响线粒体DNA参与胰岛素抵抗的调节。除了参与糖代谢,ERFE还可以通过抑制脂肪分解或促进游离脂肪酸的吸收来降低循环系统内游离脂肪酸水平。并且,高脂饮食上调ERFE 蛋白的表达仅与高脂食物本身有关,而与小鼠的肥胖状态无关。Gamas 等[16]发现,ERFE可以在体外培养的脂肪细胞和肝细胞中通过上调与游离脂肪酸吸收相关的蛋白CD36、脂肪酸转移蛋白(FATP1)、Cav1 和脂肪酸结合蛋白(FABP)的表达来促进游离脂肪酸的吸收。综合来看,ERFE将骨骼肌与肝脏和脂肪组织中的体内脂稳态联系起来,揭示了能量平衡的改变可能与ERFE介导的糖脂代谢紊乱有关。
3.2 ERFE在EPO调控hepcidin通路中的作用
ERFE 作为应激激素,在急性红细胞生成刺激下迅速降低肝脏hepcidin的表达。当然,也有观点认为长期的EPO刺激才是肝脏hepcidin表达下降的原因。比如,在急性大出血或者溶血性疾病中,EPO可以刺激网织红细胞分泌ERFE进入血液,并通过抑制肝脏hepcidin 的分泌,从而增加铁摄入,供应血红蛋白生成中铁的需求,使得红细胞的水平恢复正常。Subramaniam 等[17]发现,EPO 与受体的结合可以降低C/EBPα 与Hamp的启动子结合进而降低hepcidin 的表达。有研究指出,ERFE 可以捕获BMP,通过阻挡BMP 配体与其相关受体的结合减弱hepcidin的表达[6]。表面等离子体共振研究证实了ERFE 能与BMPs 蛋白家族成员结合,发现ERFE 与BMP2、BMP6 及BMP2/6 异二聚体的结合力 最 强[6,18]。此 外,EPO 也 可 以 通 过 降 低SMAD1/5/8 的磷酸化水平来下调hepcidin 的表达[19]。BMP/SMAD 信号途径位于调控hepcidin 表达的上游,是铁代谢调节的关键通路。作为转化生长因子β(transforming growth factor-β,TGF-β)家族成员,BMPs参与了细胞增殖、分化和凋亡等生命活动[20]。BMP与受体结合后激活SMAD1/5/8并使它们磷酸化,而后与SMAD4形成复合物进入细胞核内,激活hepcidin 的转录和表达[20]。当BMP/SMAD途径异常激活时,EPO不再促进ERFE的产生,但是由于BMP/SMAD 途径对hepcidin 的激活作用大于ERFE 对hepcidin 的抑制作用,所以总体上hepcidin 仍然表达升高。只有抑制BMP/SMAD信号途径时,ERFE 对hepcidin 的抑制作用才得以显现[21]。当完全阻断BMP/SMAD 信号通路时,ERFE 对hepcidin 的抑制作用也会消失[22]。Wang等[19]培育了肝脏特异性敲除SMAD1/5 的小鼠模型,发现ERFE 对该小鼠肝脏hepcidin 的表达没有抑制作用。这些结果表明,ERFE 对hepcidin 的抑制作用至少在一定程度上依赖于BMP/SMAD 信号通路。Arezes 等[22-23]进一步证实,ERFE 与BMP6结合并抑制BMP/SMAD 信号通路引起的hepcidin表达。综合以上观点,EPO、ERFE 和hepcidin 三者的关系可以看成,ERFE作为EPO的应答蛋白会参与EPO对hepcidin的调控。
3.3 ERFE在转铁蛋白受体(transferrin receptor,TfR)调控hepcidin通路中的作用
ERFE是一种EPO应答蛋白,而EPO的变化受到TfR2 的影响。细胞铁摄取蛋白TfR2 与TfR1 有很高的相似度,均可以与携带铁的转铁蛋白(holo-transferrin,holo-Tf)结合[24]。但是,含铁Tf与TfR1的结合力远高于与TfR2的结合力,而含铁Tf 与TfR2 的结合在低铁水平时也能达到饱和,而结合了TfR2 的Tf 就会通过ERK 通路稳定hepcidin的转录,从而上调hepcidin的表达。因此,TfR2可以监控机体铁的含量[25]。除此以外,TfR2与EPO 受体形成复合物参与调节红细胞的生成,是红细胞与铁代谢关联的关键位点之一。正常的情况下,当铁充足时,携带了铁的Tf 与TfR2 的结合会使网织红细胞中的EPO 受体稳定表达[26],促使红细胞大量的生成。同时,肝细胞中的TfR2 又促进hepcidin大量的生成,减少铁的摄入。而当铁缺乏时,Tf 不足以与TfR2 结合,使得EPO 作用于幼红细胞时不能促进红细胞的大量生成;为了达到正常供氧量,机体产生了红细胞生成的欲望,使得幼红细胞生成的ERFE 作用于肝细胞来抑制hepcidin的生成[24]。
由于TfR2 可以稳定成红细胞表面的EPO 受体从而促进红细胞生成[27],所以TfR2 对于ERFE 有间接性的调节作用。那么与之相似的TfR1 又会有什么作用呢?Tf 是铁代谢中运输铁的主要转运分子,在生理状态下,机体循环中铁会结合30%的Tf 来发挥作用[28]。在病理状态下,如地中海贫血等,机体会产生大量的铁,而过多的铁超出了Tf的运转能力导致血浆内不稳定的铁(labile plasma iron,LPI)大量增多,从而导致机体出现一系列的病理现象[29-30]。那么,如果增加机体中Tf 的含量是否就可以解决这一问题呢?人为地增加空载的Tf 可以减少TfR1 的表达从而促进红细胞的成熟。有文献报道,增加Tf 的量使得机体中的LPI 减少,可以改变病理情况中机体在产生大量红细胞时铁供应不足的现状,减少体内LPI所引起的毒性,进而改善铁引起的氧化应激损伤[30]。同样,如果减少机体中与含铁Tf 相结合的TfR1 量,可以引起hepcidin升高,病理现象也会得到改善。
4 ERFE与临床疾病
由于ERFE 对于hepcidin 有抑制作用,所以ERFE可能作为治疗缺铁性疾病的潜在靶点。
4.1 ERFE与地中海贫血
在β-地中海贫血的患者中,ERFE 含量的升高可能是导致机体hepcidin降低的主要原因。地中海贫血是由于β-珠蛋白的突变而引起的有效红细胞生成过程受阻所致[31]。该病患者体内铁超负荷,因铁累积在多个组织中造成细胞毒性而引发组织损伤[32]。患者的主要症状是红细胞前体呈凋亡状态,体内生命周期短的无效红细胞大量生成[33],因而造成血液携带氧气的能力下降。为了保证正常的供氧量,机体EPO 含量升高,促进红细胞生成,进而维持红细胞携带和运输氧气的作用,使机体供氧充足。红细胞生成中需要大量的血红素,因而机体需要更多的铁来参与血红素的合成;此时,巨噬细胞可以吞噬生存周期短的红细胞将其中的铁再次排出进入血液循环[34];与此同时,机体生成红细胞过程中,有核幼红细胞ERFE 分泌增多,抑制hepcidin 表达从而导致FPN1 表达量升高,肠道上皮细胞铁摄取和吸收逐渐增加,造成铁在组织内的聚集。ERFE 可以抑制hepcidin 的分泌,然而在地中海贫血小鼠敲除Fam132b基因后的研究发现,与单纯地中海贫血小鼠相比,此双敲除小鼠hepcidin 受抑制的情况得到改善,恢复到了正常水平,肝脏铁水平下降,但是贫血症状并未改善,血清铁水平更加下降,红细胞体积更小,呈更严重铁限制性红细胞生成的特征[4,35]。但也有研究从ERFE 抗体着手,发现靶向N 端结构域的抗ERFE抗体可以阻断ERFE 与BMP6 的结合,从而阻止EPO诱导的hepcidin抑制作用,并改善β-地中海贫血模型小鼠的铁积聚和贫血[18,36]。在减少铁的同时,抗体治疗还使红细胞、血红蛋白和血细胞比容增加,网织红细胞数量、平均红细胞体积和细胞分布宽度减少,从而改善无效的红细胞生成。但ERFE 抗体处理的β-地中海贫血模型小鼠的肝脏铁未降低至野生型小鼠的水平,这可能是由于在给予ERFE 抗体之前肝脏的铁积累和/或由于增加的hepcidin 不足以完全抑制饮食铁的吸收。有趣的是,尽管新生小鼠已经存在完整的EPO/ERFE/hepcidin调控轴[37],但是成年大鼠较幼年地中海贫血大鼠的脾脏ERFE 水平更高,对肝脏hepcidin 的抑制也更有效,表明EPO/ERFE/hepcidin 调控轴的作用具有年龄差异[38]。
4.2 ERFE与慢性肾脏疾病(CKD)
野生型小鼠注射热灭活的布鲁氏杆菌会产生炎性贫血,血红蛋白降低,肝脏和骨髓中ERFE表达显著增加;而Fam132b基因敲除会加剧小鼠炎症、hepcidin 水平升高和更严重的贫血,这表明ERFE可能会通过抑制hepcidin和增加铁的利用,有助于小鼠从炎症性贫血中恢复[18,39]。贫血是慢性肾脏疾病患者重要的并发症之一,在血液透析患者中更为常见[40]。慢性肾脏疾病的进展过程中,细胞因子及炎症介质增多、EPO 产生减少、骨髓对EPO反应减弱、血液丢失过多、红细胞寿命缩短等因素均会加重肾性贫血的进展[41]。慢性肾脏疾病患者的铁摄入不足和低水平的EPO 是贫血发生、发展的主要原因。由于血液中的hepcidin水平受肾脏功能、铁状态和炎症的影响,因此慢性肾脏疾病患者铁代谢的调节非常复杂[42]。Spoto 等[43]在一项针对1 123 名血液透析患者和745 名慢性肾脏疾病的研究中,对血清ERFE的水平和死亡率以及非致死性心血管疾病的关系进行了分析。研究发现,血液透析患者的血液ERFE水平与血清铁和铁蛋白呈负相关。在745 名慢性肾脏疾病患者中有126 名死亡或经历了非致命性心血管事件;在单变量Cox回归分析中,血清ERFE升高2µg/L意味着死亡和非致死性心血管事件的风险增加3%;在多因素Cox 回归分析中校正了年龄、烟尘、白蛋白、磷酸盐、血红蛋白和本身的心血管疾病,证实血清ERFE与死亡率和非致死性心血管事件的关联仍然显著相关;在59 名血液透析患者中确实观察到ERFE 和hepcidin水平之间呈负相关[44]。另有研究发现,慢性肾脏疾病透析患者的血清ERFE水平高于非透析慢性肾脏疾病患者和健康人[42]。当给予慢性肾脏疾病透析患者外源性的EPO 治疗后,患者产生的ERFE 增多。因此,ERFE 可能在抑制慢性肾脏疾病患者的hepcidin异常增加方面具有重要作用。
4.3 ERFE是一种心脏保护激素
在命名ERFE之前,myonectin在心脏功能中的研究就已经有报道[8]。myonectin 基因敲除和超表达小鼠进行心肌缺血-再灌注损伤研究发现[45],myonectin 敲除小鼠心肌细胞凋亡更严重,而myonectin 超表达小鼠心脏损伤减弱,表明myonectin在心肌细胞在缺血-再灌注损伤中具有保护作用。Myonectin基因敲除小鼠心肌缺血-再灌注损伤后,促炎基因表达水平和心肌梗死面积的大小均显著增加。小鼠骨骼肌内myonectin 基因超表达会通过减少心肌细胞凋亡而降低心肌缺血-再灌注损伤,但是心肌保护的机制还并不十分清楚。尽管BMP 信号通路对ERFE抑制hepcidin非常重要,但是BMP 与myonectin 的相关性还不是十分清楚,myonectin的作用机制研究也很缓慢。
4.4 ERFE检测在基础研究和临床检测中的应用
4.4.1 竞技性运动中ERFE可作为生物标志物
在国际和国内竞技性体育运动中,为了维护比赛的公正性、保护运动员的身心健康,检测参赛人员是否使用过兴奋剂以求提高运动成绩一直以来是各级体育组织的关注焦点。历史上,促蛋白合成代谢类固醇常用于提高成绩,但是其代谢物易于在尿液中检测到。而红细胞输血尤其是比赛前输入运动员自己的血液,及注射促红细胞生成试剂(比如EPO)等[8]改变的是血液学指标比如红细胞比例、血红蛋白浓度等的变化,这加大了检测的难度。曾经有研究建议检测血液内铁水平、铁蛋白和hepcidin 水平的变化,尤其是hepcidin 的表达变化早于血液学指标的变化,受血浆铁水平的负调控和受炎症的正调控,可以作为一个很有用的生物标志物[46]。但是,hepcidin的表达受到多种不同的信号转导通路调控。自ERFE 发现以来,由于具有和hepcidin 一样的检测灵敏度,而且EPO 刺激下ERFE变化早于hepcidin并位于其表达调控的上游,因此ERFE可能被视为一个新的可用于检测血液兴奋剂的生物标记物[8]。
4.4.2 人血液中ERFE的免疫检测
2017 年,兔单克隆抗体的三明治型免疫印迹检测了临床上人血清中的ERFE[47],来自健康成年人志愿者血液样本、EPO处理后的老年贫血病人、β-地中海贫血病人(输血或不输血)、健康成年人放血后的样本,血清hepcidin水平下降。利用免疫印迹方法检测ERFE水平,结果发现,未输血及输血前的β-地中海贫血病人ERFE水平增加,输血后的ERFE 水平下降,进一步证实了ERFE 与血清hepcidin 水平间的负相关性。利用单克隆抗体检测人ERFE 的免疫检测试剂盒可在Intrinsic LifeSciences公司购买。
4.4.3 小鼠ERFE免疫检测
美国Silarus Therapeutics 公司开发了用小鼠单克隆抗体检测鼠类EREF 的酶联免疫检测试剂,Ganz教授实验室[8]改良了此检测试剂,用DELFIA 报告系统代替了HRP 的显色系统。Intrinsic LifeScience 试剂公司也可以用多克隆抗体检测小鼠ERFE,在检测中,健康雄性C57BL/6 小鼠的ERFE水平太低不容易检测到,但是Hbbth3/+的β-地中海贫血小鼠模型中ERFE含量多,因而能检测到。现在也有许多其他试剂,但需要更多的研究验证方能证明数据的可行性。
5 总结与展望
近年的研究已经证实,ERFE 可以通过调节hepcidin 的表达维持机体铁稳态和红细胞的生成。在机体大量失血或EPO 刺激下,骨髓中有核幼红细胞中ERFE 蛋白表达增加,继而通过BMP/SMAD 等信号转导通路降低肝脏内hepcidin 的合成,进而减弱hepcidin-FPN1 轴对铁释放的抑制作用,从而肠道的铁吸收增加和巨噬细胞铁释放增多,导致血液内铁水平增加,有更多的铁可用于血红素和血红蛋白的合成,加速红细胞生成,缓解失血或贫血的病理状态,最终使机体恢复到正常水平(图2)。因此,EPO/ERFE/hepcidin-FPN1轴在铁代谢和红细胞生成中发挥着举足轻重的作用。

Fig.2 The diagram of the relationship among erythroferrone,hepcidin and erythropoiesis图2 ERFE、hepcidin和红细胞生成关系模式图
对于hepcidin 与ERFE 之间关系的深入研究能进一步了解红细胞的生成与铁代谢之间的关系,从而为贫血等多种疾病提供更为有效的诊断和治疗手段[48]。所有的脊椎动物基因组内均存在ERFE,不同物种间ERFE序列存在保守性[8],鉴于前期研究Fam132bmRNA 在多组织器官的不同程度的表达[4],ERFE 在心脏保护和爪蟾发育中功能的研究,说明ERFE在生命维持正常的生理功能中发挥着重要的作用。但是,至今关于ERFE在哺乳动物胚胎发育、心血管功能、十二指肠吸收、骨骼肌生物功能以及在神经系统发育和功能中的作用及机制等还存在着很多的未知之处。ERFE在小肠和神经系统铁代谢通路调控的深入研究还有望为铁代谢紊乱疾病的防治提供理论基础。