人参皂苷Rg1 对发育期癫痫模型大鼠认知功能的影响
2022-04-23李慧陈李兰李蕊戴园园
李慧 陈李兰 李蕊 戴园园
癫痫是常见的神经系统疾病,小儿发病率尤高。长期反复癫痫发作可导致不同程度的认知功能障碍,约1/3 癫痫患者合并认知功能障碍[1]。研究发现,癫痫患者的起病年龄与其认知功能损害程度呈负相关,即起病年龄越小对其认知功能的损害就越大,尤其反映在精神运动方面。已有研究证实,神经限制性沉默因子(NRSF)与人类的认知功能有相关性,且NRSF 与受其调控的基因在对人类认知功能的影响上有联合作用[2-3]。miR-124 为神经元特异性miRNA,与NRSF 相互作用共同调控神经系统的发育[3]。人参皂苷Rg1(ginsenoside Rg1)是人参的主要活性成分之一,具有营养神经及神经保护作用[4-6]。谷氨酸类似物红藻氨酸(kainic acid,KA),为制作癫痫模型常用药[7]。本研究应用KA 制作慢性癫痫模型幼鼠,通过行为学、海马内NRSF 及miR-124 的表达及海马结构的改变,研究人参皂苷Rg1 对慢性癫痫模型幼鼠的影响及机制。
1 实验材料
1.1 动物 50 只健康14d 龄清洁级SD 大鼠,雌雄不限,由徐州医科大学实验动物中心提供,体质量(20.0±3.0)g。在室温(22±2)℃,湿度50%,12h 光/暗循环(早上8:00 亮)下,自由获得食物和水。所有动物实验均经徐州医科大学动物伦理和使用委员会审核批准(编号:2015-46,2015-47),动物合格证号:20200910,动物许可证号:SYXK(苏)2020-0048。
1.2 主要试剂 KA(K0250,美国Sigma 公司);兔抗鼠NRSF 抗体(PAB9358,北京博奥森生物技术有限公司);碱磷酶标记山羊抗兔IgG(ZF0308,北京中杉金桥);Morris 水迷宫(ACT-200A,Coulbourn 公司);人参皂苷Rg1(GR-133-140620,上海源叶生物科技有限公司);SYBR Green 染料试剂盒(qPCR001,天根生化科技有限公司),NRSF 引物、miR-124 引物及β-actin 引物(上海生工生物工程有限公司)。
2 实验方法
2.1 分组 50 只大鼠按随机数字表法分为对照组(NS)、模型组(KA)、人参皂苷Rg1 低剂量组(人参皂苷Rg1 10mg/kg 组)、中剂量组(人参皂苷Rg1 30mg/kg)和高剂量组(人参皂苷Rg1 60mg/kg),每组10 只。
2.2 造模及给药 模型组和人参皂苷Rg1 组大鼠称体质量后,给予KA 10mg/kg 腹腔注射。注射KA后1~3mim 开始出现癫痫发作,按照Lado 幼鼠癫痫发作分级标准[8]:0 级为无发作;1 级为机械性咀嚼;2级为连续性点头;3 级为单侧前肢阵挛;3.5 级为前肢交替阵挛;4 级为双侧前肢阵挛、后退;5 级为双侧前肢阵挛、后退、摔倒;6 级为狂奔嘶叫;7 级为强直发作(癫痫发作达5 级以上并出现癫痫持续状态(status epilepticus,SE)且21d后出现自发性反复惊厥(spontaneous recurrent seizure,SRS)的癫痫模型大鼠视为造模成功,对照组大鼠腹腔注射相同体积的生理盐水。治疗组于造模成功后行Morris 水迷宫实验检测大鼠学习、记忆能力有无损害,后分别给予人参皂苷Rg1 10、30、60mg/kg,每天1 次,灌胃治疗30d。再行Morris 水迷宫实验检测大鼠学习、记忆能力有无改善,最后将所有大鼠断头取脑并分离双侧海马,采用RT-qPCR 法检测NRSF mRNA 及miR-124 的表达。用Western blot 法检测蛋白的表达,尼氏染色(Nissl 染色)检测海马结构的病理改变。
2.3 Morris 水迷宫测定SD 幼鼠学习记忆功能(1)定位航行实验(place navigation task):历时6d,每天4 次,将大鼠分别从4 个象限放入水中,记录90s内寻找平台所需要的时间,找到平台后休息10s,如果90s 内找不到平台,则逃避潜伏期计为90s,并帮助其找到平台并在上面休息10s。(2)空间探索实验(spatial probe test):用于测量大鼠学会寻找平台后,对平台空间位置记忆的能力。即在训练第7d 撤除平台,将大鼠从距离平台最远的象限作为入水点面向池壁放入水中,记录90s 内大鼠的游泳轨迹和目的象限游泳的时间。实验期间迷宫内外参照物保持不变,迷宫上方安装摄像机,计算机自动记录游泳轨迹和时间。
2.4 Western blot 法检测海马NRSF 蛋白表达 提取海马组织总蛋白,BCA 试剂盒进行蛋白定量,SDS-PAGE 电泳,半干法转膜,封闭,一抗孵育,洗膜,加入碱磷酶标记山羊抗兔IgG 标记的二抗孵育,BCIP/NBT 碱性磷酸酯酶显色试剂盒显色反应,拍照,保存图像。用Image-J 图像分析软件测条带的灰度值,并做统计学分析。
2.5 实时荧光定量PCR 检测海马NRSF mRNA 及miR-124 表达 参照Trizol 试剂使用说明的实验步骤提纯大鼠海马RNA,紫外分光光度计和电泳检测RNA 浓度、纯度和完整性。通过随机引物体外反转录获取cDNA,RT-qPCR 引物序列如下:NRSF 上游引物5'-AGGTTGGCTTAGTC-3',下游引物:5'-TGGTCCTTGGGTGTCTCTTC-3';miR-124 上游引物:5'-TTAAGGCACGCGGTGAATGCCA-3',下游引物:5'-GCTGTCAACGATACGGCTACGCTAACG-3';5Sr-RNA 上游引物5'-GTCTACGGCCATACCACCCTGAAC,下游引物:5'-GCTGTCAACGATACGCTACGCTAACG-3';β-actin 上游引物:5'-TCATCACCATTGGCAATGAG-3';下游引物:5'-CACTGTGTTGGCGTACAGGT-3’。用SYBR'Green 染料法获得不同样本中目的基因的相对表达量。PCR 反应循环参数:95℃预变性15min;95℃变性10s,58℃退火20s,72℃延伸30s,共40 个循环。通过2-ΔΔCt算法,计算目的基因mRNA 相对表达量。
2.6 Nissl 染色 10μm 石蜡包埋切片常规二甲苯脱蜡,梯度酒精浸水,先用0.3%H2O2室温作用6~8min,接着浸入配制好的柠檬酸/柠檬酸钠中,95℃水浴15min。PBS 洗后用血清封闭,上一抗置于4℃48~72h。PBS 洗3 遍,以后的操作按VectABC 试剂盒进行,即生物素标记的二抗4℃过夜,PBS 洗3 遍,辣根过氧化物酶(HRP)标记的生物素卵白素复合物,37℃1h。然后梯度酒精脱水、二甲苯透明,中性树脂封片,光镜下观察。
2.7 统计学方法 应用SPSS 16.0 统计软件完成。符合正态分布的实验数据以均数±标准差()表示,多组间比较采用单因素方差分析(One-Way ANOVA),方差齐时采用LSD 法,方差不齐采用Dunnett T3 法,P<0.05 认为差异有统计学意义。
3 实验结果
3.1 各组大鼠定位巡航逃避潜伏期比较 随着训练天数的增加,各组大鼠逃避潜伏期都出现逐渐缩短,与对照组比较,模型组大鼠逃避潜伏期显著延长(P<0.05);与模型组比较,不同剂量的人参皂苷Rg1 组大鼠逃避潜伏期均有缩短,高剂量组在第3 天以后缩短显著(P<0.05),其余各组差异无统计学意义(P>0.05),见表1。
表1 各组大鼠定位巡航逃避潜伏期比较(s,)
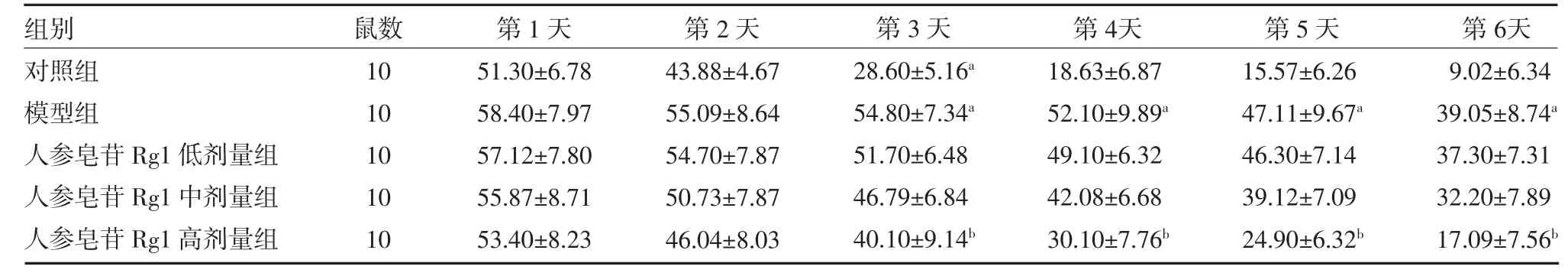
表1 各组大鼠定位巡航逃避潜伏期比较(s,)
注:对照组为健康大鼠,给予生理盐水;模型组大鼠给予10mg/kg 红藻氨酸建立癫痫模型;人参皂苷Rg1 低剂量组大鼠给予人参皂苷Rg1 10mg/kg 组;人参皂苷Rg1 中剂量组大鼠给予人参皂苷Rg1 30mg/kg;人参皂苷Rg1 高剂量组大鼠给予人参皂苷Rg1 60mg/kg;与对照组比较,aP<0.01;与模型组比较,bP<0.01
3.2 各组大鼠空间探索实验结果和大鼠海马组织NRSF 蛋白表达量比较 探索实验结果显示,与对照组比较,模型组大鼠在目的象限(原平台象限)游泳时间百分比明显减少(P<0.01);与模型组比较,人参皂苷Rg1 高剂量组游泳时间百分比明显增加(P<0.01)。与对照组比较,模型组大鼠海马组织NRSF 蛋白表达明显增多(P<0.05);不同剂量人参皂苷Rg1干预组较模型组均有减少,以高剂量组最显著(P<0.05)。见表2,图1。
表2 各组大鼠目的象限游泳时间百分比和海马NRSF 与β-actin 灰度比值比较()
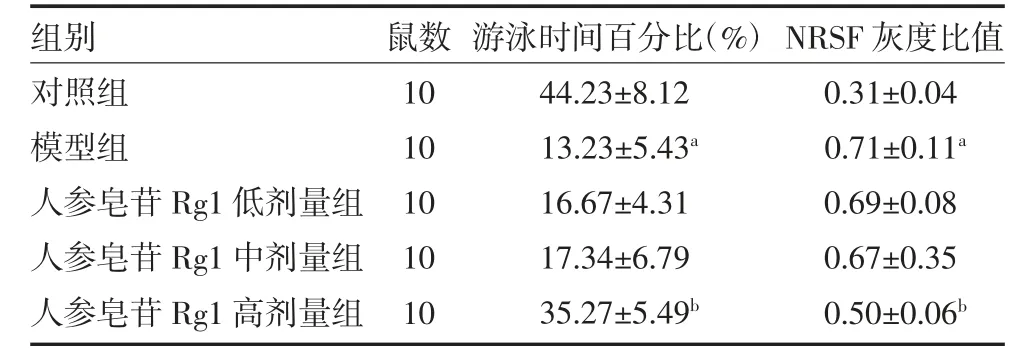
表2 各组大鼠目的象限游泳时间百分比和海马NRSF 与β-actin 灰度比值比较()
注:对照组为健康大鼠,给予生理盐水;模型大鼠给予10mg/kg 红藻氨酸(KA)建立癫痫模型;人参皂苷Rg1 低剂量组大鼠给予人参皂苷Rg1 10mg/kg 组;人参皂苷Rg1 中剂量组大鼠给予人参皂苷Rg1 30mg/kg;人参皂苷Rg1 高剂量组大鼠给予人参皂苷Rg1 60mg/kg;与对照组比较,aP<0.01;与模型组比较,bP<0.01

图1 各组大鼠海马NRSF 蛋白表达比较
3.3 各组大鼠海马组织miR-124、NRSFmRNA 表达量比较 与对照组比较,模型组大鼠海马组织miR-124 表达明显增多(P<0.05);人参皂苷Rg1 高剂量组较模型组明显增多(P<0.05)。与对照组比较,模型组大鼠海马组织NRSF 表达明显增多(P<0.05);人参皂苷Rg1 高剂量组较模型组明显减少(P<0.05)。见表3。
表3 大鼠海马组织miR-124 和NRSF mRNA 表达量比较()
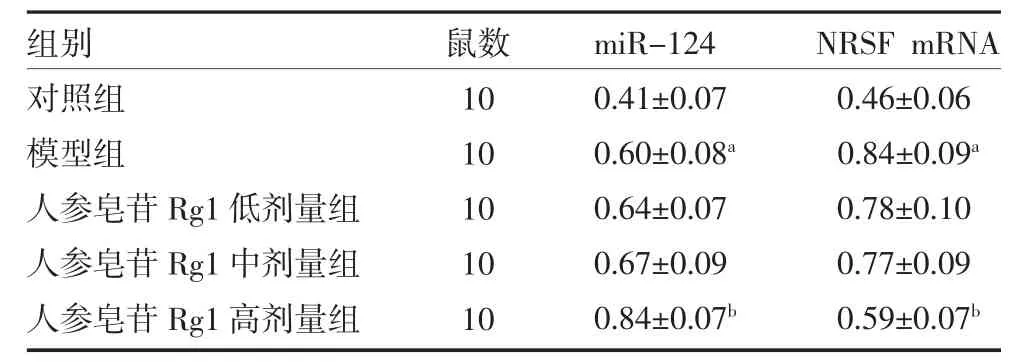
表3 大鼠海马组织miR-124 和NRSF mRNA 表达量比较()
注:对照组为健康大鼠,给予生理盐水;模型大鼠给予10mg/kg 红藻氨酸(KA)建立癫痫模型;人参皂苷Rg1 低剂量组大鼠给予人参皂苷Rg1 10mg/kg 组;人参皂苷Rg1 中剂量组大鼠给予人参皂苷Rg1 30mg/kg;人参皂苷Rg1 高剂量组大鼠给予人参皂苷Rg1 60mg/kg;与对照组比较,aP<0.05;与模型组比较,bP<0.05
3.4 大鼠海马CA3 区组织Nissl 染色结果 Nissl 染色结果显示,对照组大鼠海马CA3 区锥体细胞排列整齐、紧密,细胞结构完整,神经元内布满深蓝色颗粒状的尼氏小体;模型组大鼠海马CA3 区锥体细胞排列疏松,部分神经元胞体皱缩、碎裂,核固缩,胞质内尼氏小体大量脱失;不同剂量人参皂苷Rg1 组大鼠海马CA3 区神经元皱缩、碎裂、尼氏小体减少、脱失较模型组减轻,以高剂量组减轻明显,见图2。
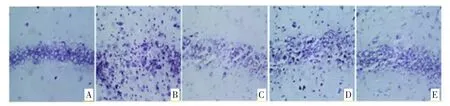
图2 大鼠海马组织CA3 区Nissl 染色结果(×400)
4 讨论
癫痫是儿童常见的神经系统疾病,且癫痫患儿更容易合并认知功能障碍[9]。研究发现,有多种药物能够改善成年人的认知记忆能力,包括脑循环改善药物、胆碱酯酶抑制剂等,但这些药物对于儿童癫痫患者来说缺少临床应用的证据[10-11]。本研究结果显示,人参皂苷Rg1 可以改善SD 大鼠幼鼠癫痫所致的认知功能障碍,而且可能与减少NRSF 的表达量及增加miR-124 的表达量有关,且高剂量组改善更明显。
NRSF 参与神经系统的发育,维持神经系统发育的平衡,与多种神经系统发育异常及相关疾病的发生密切相关[12]。癫痫发作后,海马内NRSF 表达上调,可以抑制神经细胞过度增殖、分化[3]。近年研究发现,NRSF 可通过调控miR-124 表达,在神经系统的协调发展中起到关键的作用,其相互作用为负反馈调控[12-13]。miR-124 已被证明参与脑神经发育与认知功能的调节,在癫痫发作时,多种神经元特异性miRNA与靶基因间相互调控,在神经和非神经系统中起重要作用,被认为可作为癫痫临床生物标志物[9,12]。有研究证实,在癫痫发作后海马内miR-124 表达上调,从而促进内源性神经干细胞的增殖与分化[14-15]。
Morris 水迷宫是研究学习记忆最常用的实验方法[16]。本研究通过KA 构建发育期慢性癫痫模型模型,利用Morris 水迷宫观察人参皂苷Rg1 对慢性癫痫模型大鼠的学习记忆功能的影响。检测各组实验大鼠海马内NRSF 蛋白和miR-124 的表达情况。我们发现,模型组大鼠逃避潜伏期较对照组延长,空间探索缩短,间接说明其伴有认知功能障碍;人参皂苷Rg1 高剂量组较模型组的逃避潜伏期明显缩短,空间探索延长,表明人参皂苷Rg1 可以改善癫痫所致的学习记忆损害,且呈剂量依赖性。模型组海马内NRSF、miR-124 较对照组明显增加,这也证实癫痫发作后NRSF、miR-124 表达量是增加的,人参皂苷Rg1 高剂量组海马内NRSF 表达量较癫痫模型组减少,而miR-124 的表达量增加,提示人参皂苷Rg1可以通过减少NRSF 的表达量及增加miR-124 表达量,改善癫痫所致的认知功能障碍。Nissl 染色结果也显示,人参皂苷Rg1 可以减轻发育期癫痫大鼠海马结构的病理改变。
综上所述,本研究结果显示,人参皂苷Rg1 可以改善发育期大鼠癫痫所致的认知功能障碍,这可能与减少NRSF 的表达量及增加miR-124 的表达量有关,且呈剂量依赖性。
