硫化氢对植物根系生长及组蛋白去乙酰化酶的影响
2022-04-23裴锌锌陈虹宇刘华杰
裴锌锌,陈虹宇,李 晓,刘华杰,李 华
(河南农业大学 生命科学学院,河南 郑州450002)
硫化氢(H2S)是继一氧化氮(NO)和一氧化碳(CO)之后被发现的第3 种气体信号分子,高浓度的H2S 可抑制线粒体细胞色素C 氧化酶的活性,是细胞代谢的毒性物质,低浓度H2S 对细胞生理功能具有重要的调节作用[1‑2]。YANG 等[1]研究发现,H2S 在动物体内可以内源产生,并且可通过血管平滑肌细胞上的三磷酸腺苷敏感性钾通道(Adenosine triphosphate‑sensitive potassium,KATP)调节血压。在植物中,H2S 可调节气孔运动、种子萌发、根系发育、衰老、果实后熟等[3]诸多种生理过程,还能响应各种生物和非生物(干旱、盐、重金属、高温等)胁迫[4‑5]。在植物根系中,H2S 对植物根系的调节一般具有浓度依赖性,随着NaHS(H2S 供体)浓度的不断增加,黄瓜根系长度和数目均呈现先上升后下降的趋势[6],番茄的侧根长度和密度也具有相同趋势[7],并且H2S对番茄侧根生长的调节作用与过氧化氢和甲烷信号途径有关[8‑9]。
组蛋白乙酰化修饰被认为是基因表达调节中重要且普遍存在的表观遗传标记[10]。组蛋白乙酰化可以削弱组蛋白与DNA 之间的相互作用,改变核小体的表面结构,使染色质伸展,有助于转录因子结合位点的形成。因此,一般来说,组蛋白乙酰化可诱导基因激活,相反,组蛋白去乙酰化通常会导致染色质浓缩并抑制基因转录[11]。组蛋白去乙酰化酶(Histone deacetylases,HDACs)是一个家族,其功能是将组蛋白去乙酰化,与组蛋白乙酰化转移酶(Histone acetyltransferases,HATs)共同维持组蛋白乙酰化修饰的稳态。近年来研究显示,HDACs基因也介导根系生长发育过程。通过丁酸钠和曲古抑菌素处理抑制HDACs活性,可抑制拟南芥的主根生长[12],在拟南芥中过表达白杨组蛋白去乙酰化酶基因PtHDT902可促进主根伸长[13]。
H2S 和HDACs 基因对植物根系均有调节作用,二者在调节根系生长过程中的作用关系尚不明确,因此,采用不同浓度NaHS 处理后,测定小麦和拟南芥根系中HDACs 活性及其基因表达情况,以探讨H2S 对植物根系生长的调节与组蛋白去乙酰化酶的相互作用关系,丰富对植物根系生长调节机制的认识。
1 材料和方法
1.1 材料培养及处理
拟南芥种子表面消毒灭菌后,播种到1/2MS 培养基上,4 ℃放置3 d 后,在22 ℃/20 ℃(光照16 h/黑暗8 h)条件下生长,4 d后将其转移到含0(CK)、50、100、150、200 μmol/L NaHS 的1/2MS 培养基上继续生长,6 d后测其根长,-80 ℃保存,用于测定HDACs活性及基因表达。
将小麦(郑麦366,ZM366)种子用5%H2O2消毒3 min,清水冲洗5 次,蒸馏水浸泡4~6 h 后,把种子放在湿润的滤纸上催芽,3 d 后将其移至含0(CK)、50、100、200、400 μmol/L NaHS 的1/4Hoagland 营养液中培养,培养条件为25 ℃/20 ℃(光照14 h/黑暗10 h),相对湿度70%。3 d更换1次营养液,6 d后测量根系长度,并取根系样品于-80 ℃保存,用于测定HDACs活性及基因表达。
1.2 测定项目及方法
1.2.1 根长 在根系旁放置标尺并拍照,将图片置入Photoshop 7.0,使用标尺工具进行根长测定,每个处理测量5~10株。
1.2.2 HDACs 活性 分别取0.1 g 拟南芥和小麦样品,用液氮研磨后,加1 mL 提取液[50 mmol/L Tris-HCl,pH 值为7.5,150 mmol/L NaCl、2%十二烷基钠硫酸(Sodium dodecyl sulfate,SDS)和蛋白酶抑制剂],4 ℃、12 000×g离心10 min,取上清待用。按照植物组蛋白去乙酰化酶ELISA 试剂盒(Mlbio,中国上海)操作说明测定HDACs活性。
1.2.3 HDACs 基因表达 拟南芥和小麦根系总RNA 用Trizol 试剂提取,使用PrimeScriptTMRT reagent Kit with gDNA Eraser(Takara)试剂盒进行反转录。参照LI 等[14]的方法采用qRT-PCR 分析拟南芥和小麦根系的HDACs基因表达情况,使用引物具体见表1,拟南芥和小麦分别以AtACT-2和TaACT-1作为内参基因。

表1 qRT-PCR分析使用引物Tab.1 The primers used for qRT-PCR analysis
1.3 数据处理与分析
所有定量结果均为至少3 次重复的平均值±标准误差(SD)。使用SPSS 17.0 进行数据统计与分析。
2 结果与分析
2.1 H2S对拟南芥和小麦根系生长的影响
用不同浓度NaHS 处理拟南芥和小麦发现,H2S可显著调节拟南芥和小麦根系生长(图1—2)。与CK(0 μmol/L NaHS)相比,50~200 μmol/L NaHS 可使拟南芥主根伸长减少16.0%~51.1%(图1),50~400 μmol/L NaHS 可使小麦主根伸长减少10.0%~20.1%(图2A)。除对主根产生影响外,H2S 还可调节小麦侧根的生长,50~200 μmol/L NaHS 可促进小麦侧根生长,侧根长度比CK 增加7.2%~13.5%,但高浓度NaHS(400 μmol/L)抑制了侧根生长(图2B)。
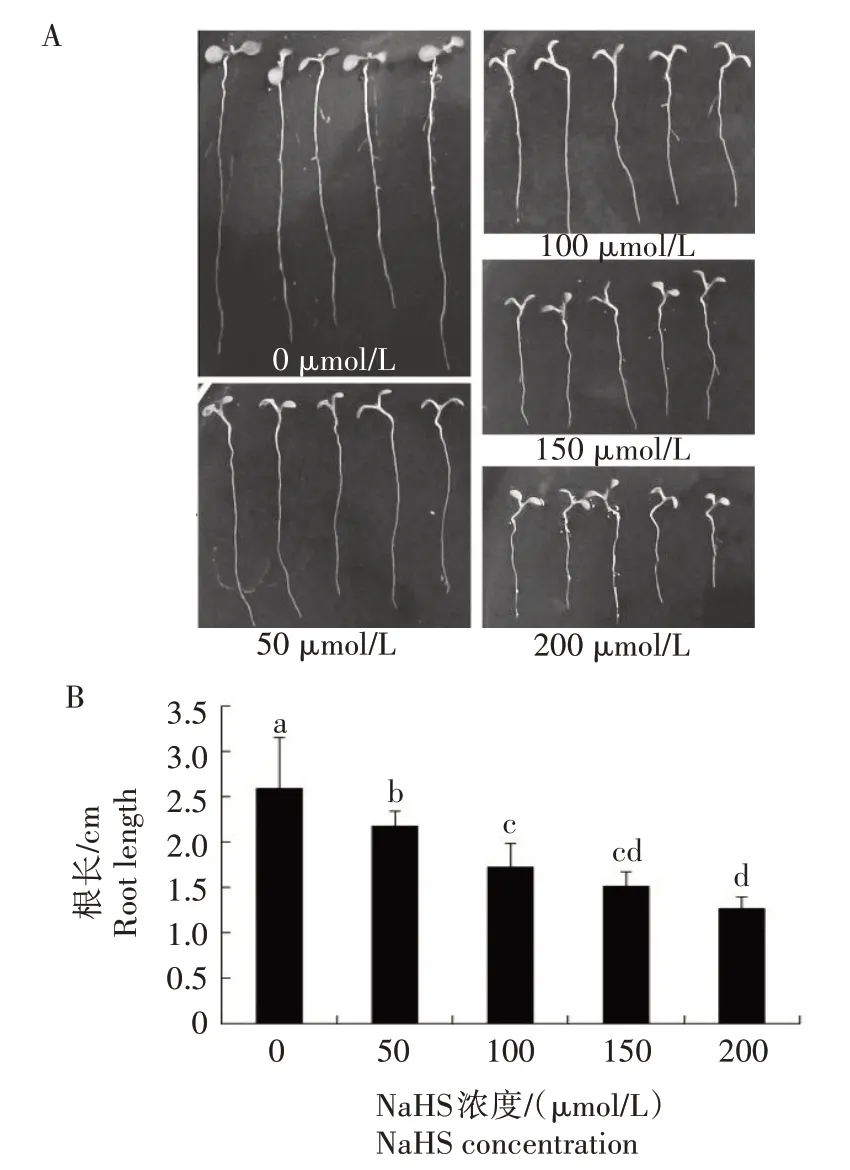
图1 H2S对拟南芥主根生长的影响Fig.1 Effect of H2S on the primary root growth of Arabidopsis
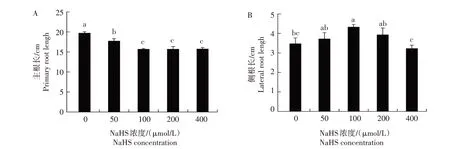
图2 H2S对小麦主根(A)和侧根(B)生长的影响Fig.2 Effects of H2S on the primary and lateral root growth of wheat
2.2 H2S对拟南芥和小麦根系HDACs活性的影响
不同浓度NaHS 处理后,对拟南芥和小麦根系HDACs 活性进行分析,结果发现,不管拟南芥还是小麦中,NaHS处理均诱导了HDACs活性,但具有浓度依赖性(图3)。拟南芥中较低浓度NaHS(50~100 μmol/L)对HDACs 活性无显著影响,但较高浓度NaHS(150~200 μmol/L)可 使HDACs 活 性 提 高48.0%~50.0%(图3A);50~400 μmol/L NaHS 处理均能显著诱导小麦HDACs 活性,100 μmol/L 浓度下达到最大,HDACs活性较CK提高76.6%(图3B)。
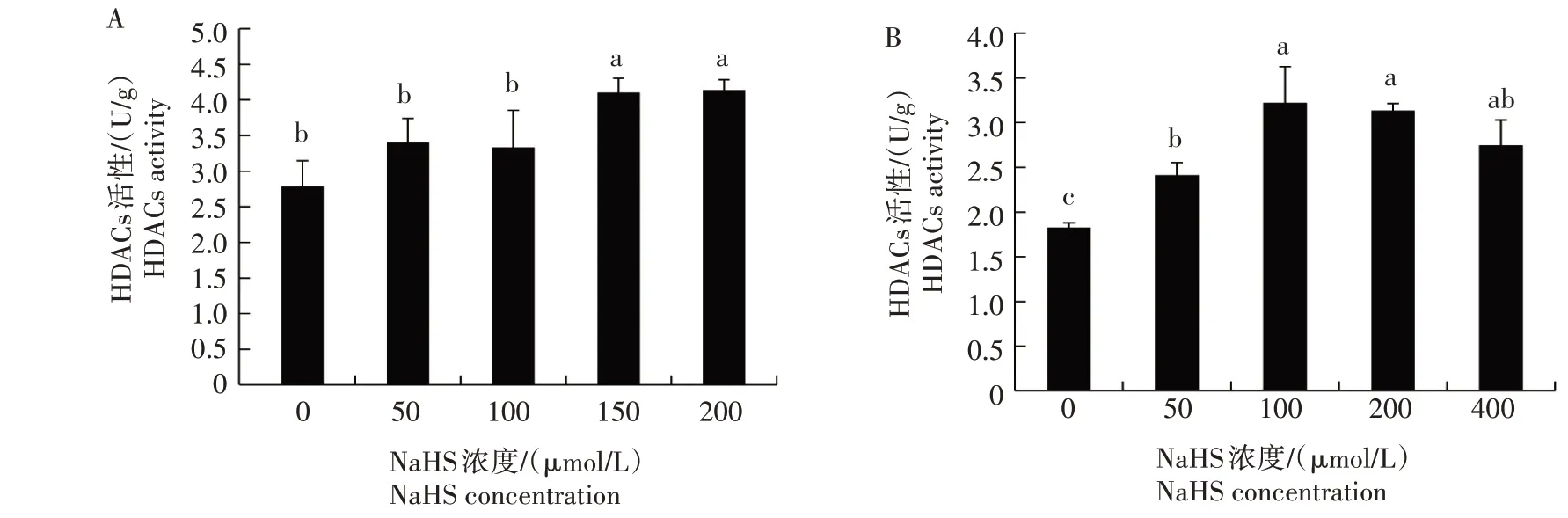
图3 H2S对拟南芥(A)和小麦(B)根系HDACs活性的影响Fig.3 Effect of H2S on the HDACs activity in Arabidopsis(A)and wheat(B)
2.3 H2S对拟南芥和小麦HDACs基因表达的影响
HDACs 是由多个基因组成的基因家族,在拟南芥中发现有18 个HDACs 基因[15],前期通过全基因组分析已从小麦中鉴定出53 个HDACs 基因[16],现进一步分析不同浓度NaHS 处理下拟南芥和小麦HDACs基因的表达模式。
由于AtHDA10、AtHDA17基因与AtHDA9的N 端相似度可达97%[15],通过RT-PCR 不能从转录水平区分AtHDA10和AtHDA17各自的表达情况,因此,只探讨其他16个AtHDACs基因在NaHS处理下的表达变化。结果(图4)显示,有4个AtHDACs基因不受NaHS 影响,这4 个基因(AtHDT1、AtHDT2、AtHDT3、AtHDT4)均属于HD2 亚家族,其余12 个AtHDACs均响应NaHS 处理,但表达模式不同,且具有浓度依赖性。如AtHDA2、AtHDA7、AtHDA8和AtHDA14表达水平在50 μmol/L NaHS 处理下均显著下调,AtHDA5、AtHDA6、AtHDA19和AtSRT1表达水平仅在150 μmol/L NaHS 处 理 下 显 著 上 调,AtHDA15、AtHDA18和AtSRT2在较高浓度NaHS 处理下可被持续诱导表达,而AtHDA8和AtHDA14的表达在低浓度NaHS处理下被抑制,而较高浓度下被诱导。

图4 H2S对拟南芥HDACs基因表达的影响Fig.4 Effect of H2S on HDACs gene expression in Arabidopsis
由于六倍体小麦的A、B 和D 基因组在mRNA水平上极为相似,因此将TaHDACs-A、TaHDACs-B和TaHDACs-D 视为一个组合基因,分析了19 个TaHDACs在不同浓度NaHS 处理下的表达水平(图5)。19 个TaHDACs基因中有2 个基因(TaHDA5和TaSRT1)不受NaHS 影响,其余17 个TaHDACs对NaHS 的响应模式各有不同。与CK 相比,TaHDA9和TaHDA19在100 μmol/L NaHS 处理下被显著诱导表达,TaHDA20在200 μmol/L NaHS 处理下上调表达,TaHDA21和TaHDA22的表达量在50、100、400 μmol/L NaHS 处 理 下 均 显 著 上 升,TaHDA2、TaHDA6、TaHDA8、TaHDA18、TaSRT2、TaHDT1和TaHDT2均在100、200 μmol/L NaHS 处理下显著下调表达,TaHDA14和TaHDT3的表达量在50~400 μmol/L NaHS处理下均显著下降。
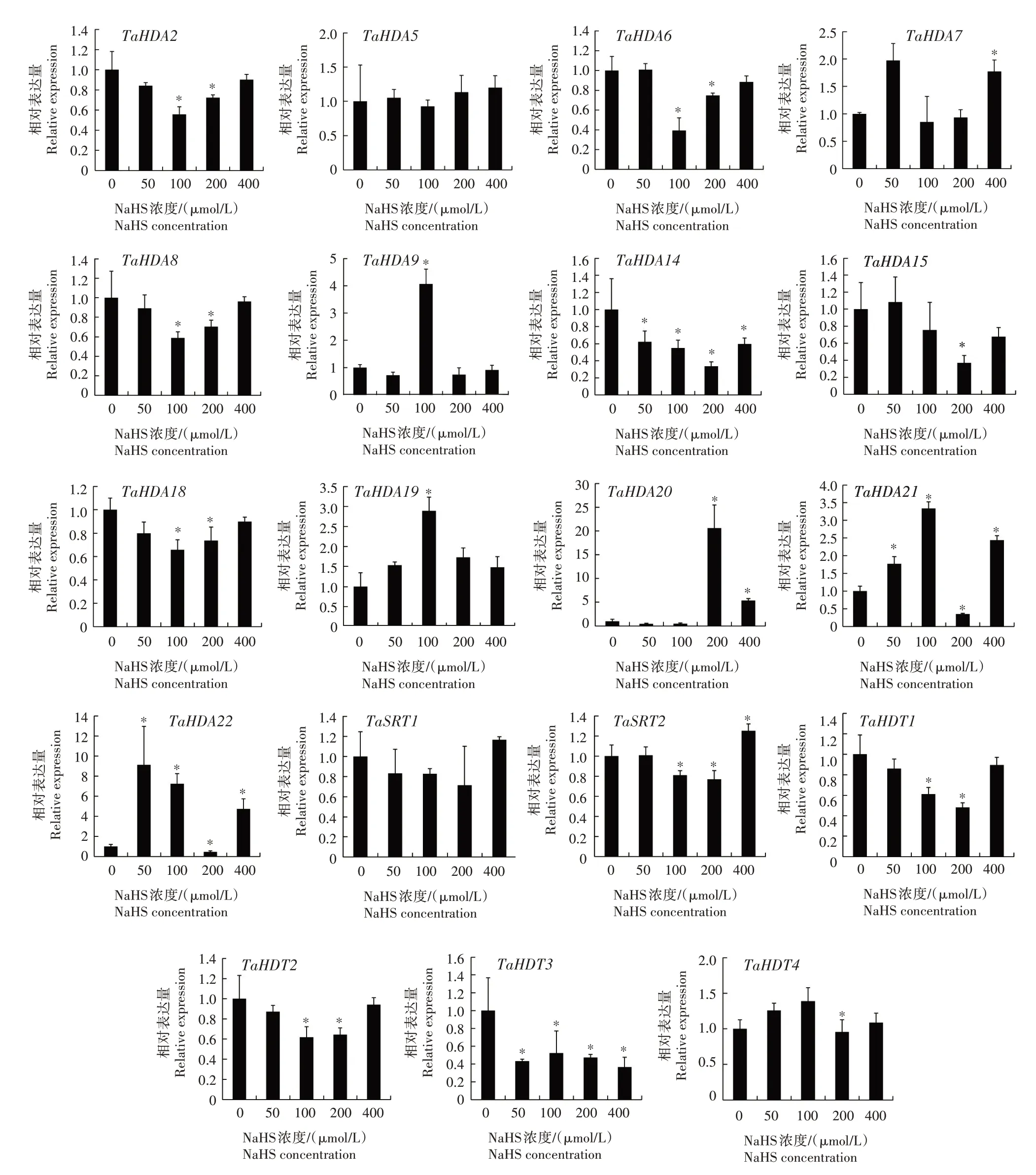
图5 H2S对小麦HDACs基因表达的影响Fig.5 Effect of H2S on HDACs gene expression in wheat
3 结论与讨论
在拟南芥[17]、黄瓜[18]、番茄[19]等双子叶植物中的研究均显示,H2S 可调节植物根系生长,但在单子叶植物中H2S对根系的调控作用及机制是否与双子叶植物一致尚不清楚。本研究比较了H2S对拟南芥和小麦根系生长的调节作用。与拟南芥中的结果一致,NaHS 可显著抑制小麦主根生长,但随NaHS 浓度增加,小麦侧根长度表现为先上升后下降的趋势,说明H2S 对单子叶植物和双子叶植物根系生长的调节作用相似,H2S 对其主根和侧根均有调节作用,且具有浓度依赖性。
在拟南芥中已有研究显示,H2S 抑制主根生长的作用依赖于ROS-MPK6-NO 信号途径[20],即外源H2S 诱导了ROS 的产生,而后ROS 激活丝裂原活化蛋白激酶MPK6,MPK6 通过MAPK 途径促使NO 产生,NO 再抑制生长素的分布及降低根尖分生细胞的分裂潜能,最终表现出H2S 对主根生长的抑制作用。在番茄中,H2S 对侧根生长的调节由H2O2信号介导,H2S 可通过诱导H2O2的产生促使细胞周期调节相关基因(如SlCYCA2;1、SlCYCA3;;1、SlCDKA1)及侧根形成相关microRNAs(miR390a和miR160)的表达,最终促进侧根生长[21]。近来,组蛋白去乙酰化酶对根系的调节也有研究报道,如水稻组蛋白去乙酰化酶基因OsHDAC1过表达可促进根系生长[22];组蛋白去乙酰化酶抑制剂(HDIs)通过促进PIN1 蛋白降解抑制拟南芥主根伸长[23];HDA19突变降低了低磷对根毛数量及长度的诱导[24];拟南芥HDT1/2双突变体的主根长度显著短于野生型[25]。H2S 调节植物根系生长,组蛋白去乙酰化酶也介导根系生长,那么H2S与组蛋白去乙酰化酶在调节根系生长作用中是否有相关性,这个问题在植物中尚未有探讨。但在动物体中已发现H2S 可调节组蛋白去乙酰化酶,如H2S 可诱导大鼠细胞中组蛋白去乙酰化酶基因SIRT1表达来缓解甲醛诱导的内质网应激[26];H2S 以组蛋白去乙酰化酶SIRT3依赖的方式改善小鼠心肌肥大细胞线粒体功能[27];H2S 也可通过诱导HDACs活性,抑制炎性细胞因子IL-6和TNF-α的表达,最终保持骨骼稳态[28]。本研究发现,不管在拟南芥还是小麦中,H2S 均可诱导组蛋白去乙酰化酶活性表达,并且对HDACs家族基因表达也有不同的调控模式,由此说明,H2S 对植物根系的调控与组蛋白去乙酰化酶息息相关。
与CK 相比,H2S 处理下,拟南芥和小麦根系HDACs 基因都有不同程度的表达差异。部分HDACs基因在拟南芥和小麦中的表达趋势不一致,如HDA6、HDA15和HDA18在拟南芥中被H2S 上调表达,而在小麦中则被H2S下调表达,HDT1—4在拟南芥中不响应H2S,而在小麦中则被H2S 抑制表达,这可能是因为这些基因在双子叶植物和单子叶植物根系存在不同的响应机制。值得关注的是,同源基因AtHDA2和TaHDA2的表达分别在50 μmol/L NaHS 和100 μmol/L NaHS 下被显著抑制,而同源基因AtHDA19和TaHDA19分别在150 μmol/L NaHS 和100 μmol/L NaHS 下被显著诱导表达,整体而言,随H2S浓度增加,拟南芥和小麦根系HDA2的相对表达量呈先降低后升高的趋势,HDA19的相对表达量呈现先升高后降低的趋势。根据前人研究[22‑25]报道,增加组蛋白的去乙酰化可促进根系生长,相反,降低组蛋白的去乙酰化可抑制根系生长。在小麦和拟南芥中均发现H2S 可抑制HDA2的表达,说明H2S对植物根系的调节可能与HDA2基因有关。而H2S对HDA9和HDA19基因的诱导作用可能与逆境胁迫调节有关,因为在动物应激反应中,H2S 诱导组蛋白去乙酰化酶表达[26‑28]。
总的来说,H2S 对HDACs 具有显著的调节作用,但H2S 可能通过不同HDACs 基因介导不同的生长过程或逆境胁迫。通过本研究发现,HDA2可能参与H2S 信号调节根系生长,HDA9和HDA19可能参与H2S 信号介导植物逆境胁迫,但H2S 对这些HDACs 的调节机制及介导HDACs 调节根系生长的下游基因都需进一步研究和鉴定。
