青海某盐湖光卤石浮选尾盐综合回收钾钠资源试验研究
2022-04-22卢志斌杨三妹
胡 勇,卢志斌,杨三妹
(中蓝长化工程科技有限公司,湖南 长沙 410116)
我国是钾肥生产大国,也是钾肥消费大国,钾肥自给率不足[1]。我国钾肥消费量逐年上升,但可供开采的优质钾肥资源逐步减少[2],因此,钾资源利用最大化、减小钾资源损失是我国钾肥产业的重要课题。
青海和新疆地区的钾肥生产企业,通过浮选法生产氯化钾过程中,会产生大量的浮选尾盐。李守江[3]等通过机械溶浸法对尾盐中的钾资源进行回收,对氯化钾浮选尾盐中K+和 SO42-的回收率分别达到为96.20%和96.78%;徐盛[4]等研究将兑卤法引入浮选尾盐的处理,在回收氯化钾的同时,提高尾盐中氯化钠含量。将兑卤完成液回用,溶浸浮选尾盐,可节约用水,经两次兑卤,一次分解,得到质量较高的氯化钾。
1 试验部分
1.1 试验原料
本试验的原矿来自青海某盐湖光卤石矿反浮选脱钠尾盐池,试样多元素化学分析结果见表1,化学组成见表2。

表1 尾盐多元素化学分析结果

表2 尾盐化学组成
如表2所示,尾盐中含有部分光卤石,若能将光卤石充分溶解,不仅可以回收其中的钾资源,还可得到较为纯净的氯化钠产品。
1.2 工艺计算
如图1所示,浮选尾盐的溶K过程分为两个阶段:
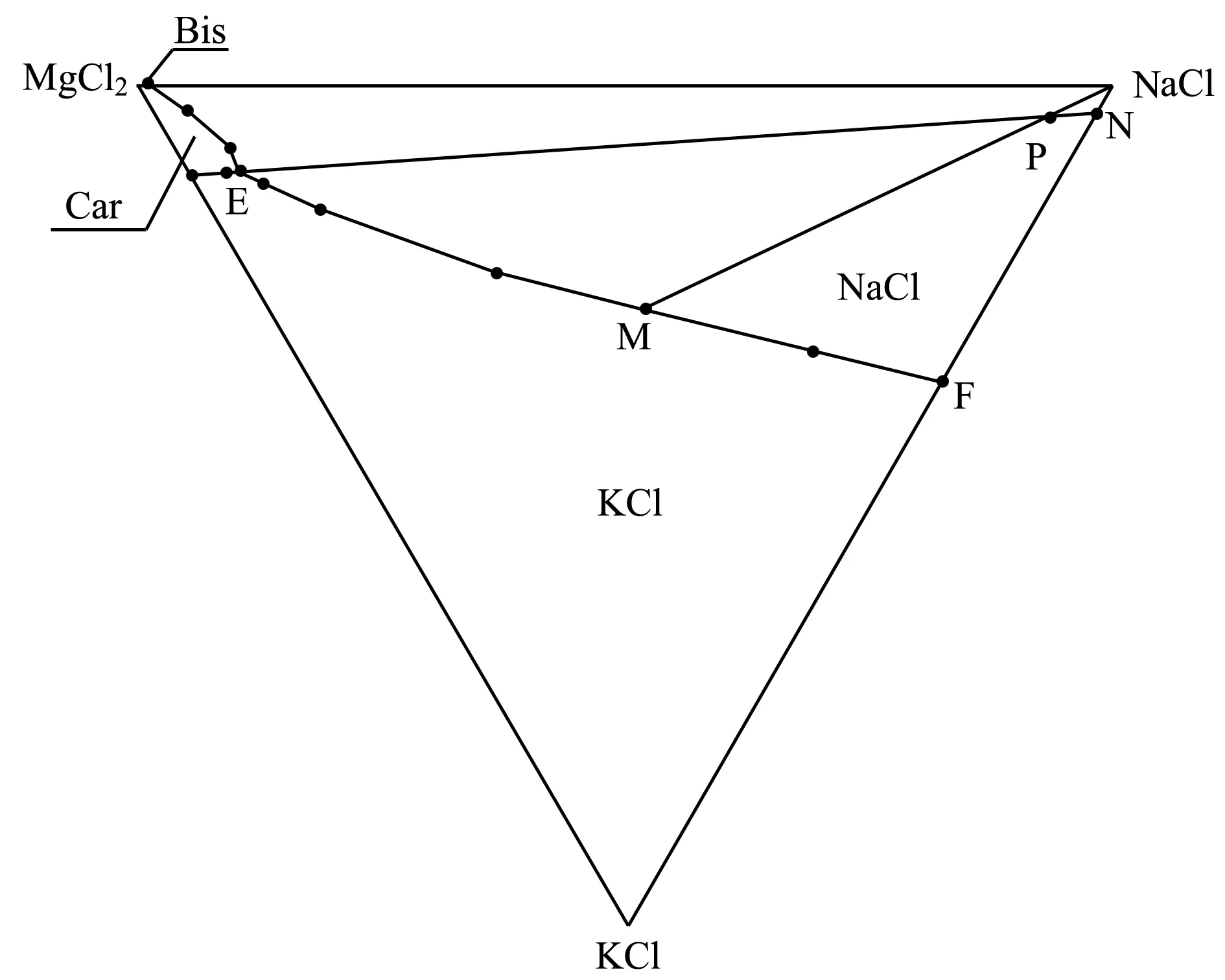
图1 25 ℃ Na+、K+、Mg2+/Cl-—H2O四元体系相图
第一阶段:尾盐(P点)中光卤石分解,得到固相(N点,其中包含NaCl和KCl)和液相(E点,三相饱和点),即P+淡水→N+E;
第二阶段:继续添加淡水,N点固相中KCl和NaCl溶解,当KCl固体溶解完全后,得到固相NaCl和M母液,即N+E+淡水→NaCl+M。
两个阶段合并得到:P+淡水→NaCl+M。
通过相图计算可以得到M点组成,从而计算得出理论KCl刚好完全溶解时需要的加水量。
溶解反应过程:
P + H2O → NaCl + M母液
1 000 g 231.88 g 731.54 g 500.34 g
1.3 试验方法
试验采用自然无搅拌浸出法回收尾盐中的钾元素和NaCl。称取一定量的尾盐置于水桶内,然后按照比例称取定量的淡水加入桶内,盖上薄膜和桶盖,记录时间,按照拟定的浸出时间称量取样。取样方法:将固液混合物过滤称重,取少量液体分析化验,剩余液体倒入桶内继续浸出。到达试验拟定的最大浸出天数后,浸出试验结束。
浸出试验加水量如表3所示。

表3 尾盐浸出试验条件
2 试验结果及讨论
对照表3中的原矿和淡水比例,分别称取尾盐和淡水开展浸出试验。在一定浸出时间后,分别对浸出液体和浸出固体称重,并取样分析,浸出试验结果如表4所示。
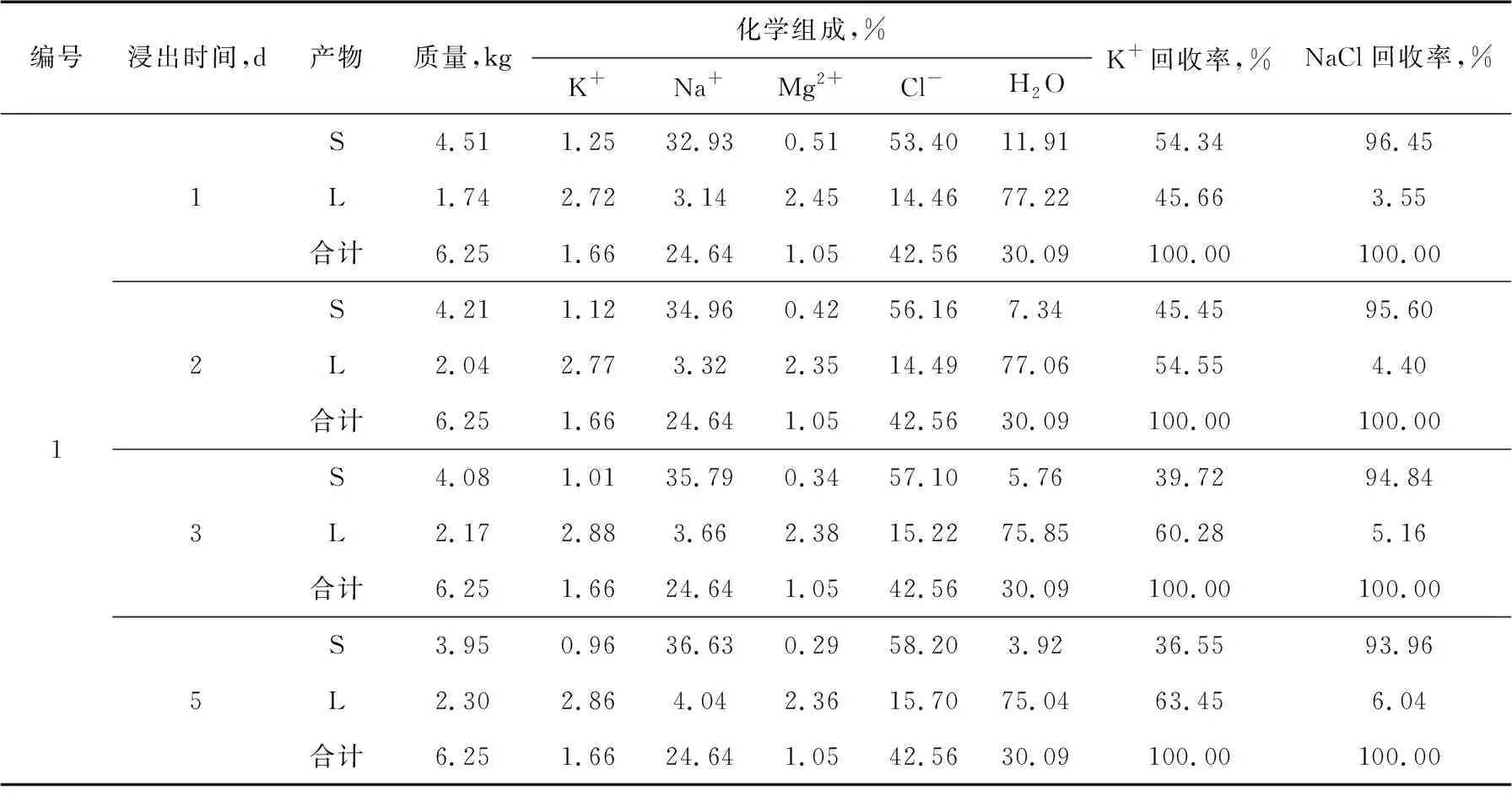
表4 尾盐浸出试验结果
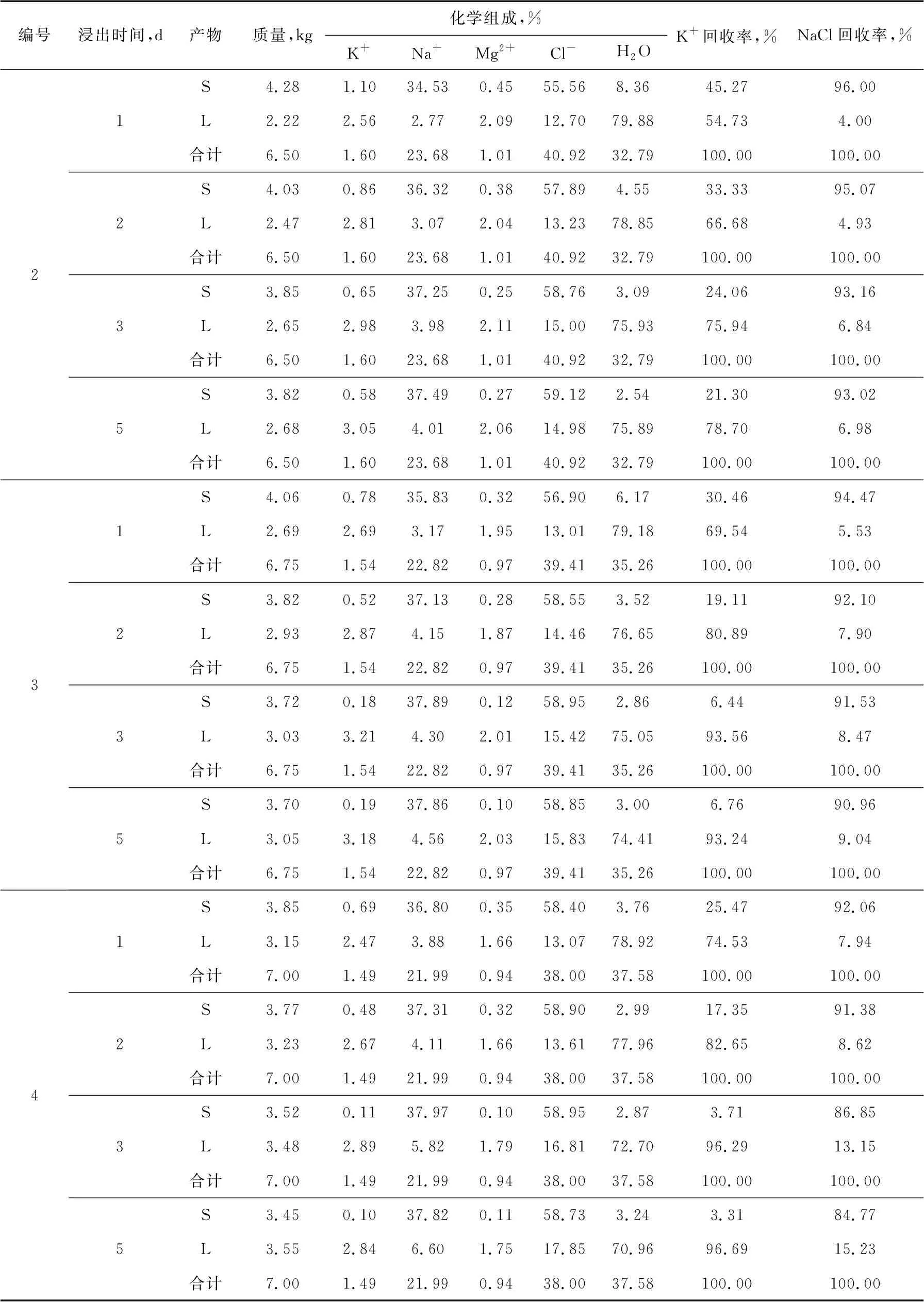
(续表)
如表4所示,3号试验条件下,浸出三天,尾盐中K基本溶解进入母液中,可得到较高的钾回收率和较为纯净的NaCl固体。延长浸出时间,各项指标变化不是很大;加大浸出水量,如4号试验所示,母液中钾含量降低,且NaCl回收率降低,不利于K、Na元素的回收利用。
因此,浸出淡水量为尾盐质量的35%,浸出时间为三天时,可以得到K+含量3.21%、回收率93.56%的浸出液指标和NaCl含量97.15%、回收率91.53%的浸出固体指标。
浸出固体经过简单淋洗、烘干等工序,容易得到NaCl含量高于99%的NaCl产品,可做为制碱工业的原料。浸出液体重新返回盐田摊晒,可以析出含钾的钾石盐矿和光卤石矿。
3 结 论
本文依据Na+、K+、Mg2+/Cl-—H2O四元体系相图理论,为充分利用钾、钠资源,实现尾盐综合回收利用,采用自然无搅拌浸出的生产工艺路线,可得到NaCl含量高于99%的NaCl产品(制碱工业原料)以及含钾母液。该工艺充分利用了尾盐中的有用成分,回收了KCl、NaCl资源,显著提高了盐湖钾、钠资源利用率,经济环保效益显著。
