西达本胺通过线粒体凋亡途径诱导结肠癌HCT-15细胞凋亡
2022-04-22赵琳珊李玉苗李楠贾友超王晓芳韩强臧爱民
赵琳珊,李玉苗,李楠,贾友超,王晓芳,韩强,臧爱民
(1.河北大学附属医院 肿瘤内科,河北省肿瘤放化疗机制与规程研究 重点实验室,河北 保定 071000;2.河北大学 临床医学院,河北 保定 071000)
结肠癌是临床常见的消化系统恶性肿瘤,早期结肠癌患者采取手术为主的综合治疗,部分患者可以治愈[1]. 随着靶向治疗和免疫治疗的进展,晚期结肠癌患者生存期逐渐延长,但治愈希望仍然渺茫,难以控制的复发和转移是目前临床治疗所面临的难题,因此需要从不同角度进一步探索结肠癌生物学治疗的手段.表观遗传修饰的改变在多种恶性肿瘤的发生发展以及耐药过程中发挥重要作用,其中组蛋白乙酰化与肿瘤的发生发展紧密相关.组蛋白乙酰化修饰由组蛋白乙酰转移酶和组蛋白去乙酰化酶(histone deacetylases,HDAC)协调进行.在肿瘤细胞中,HDAC的过度表达增强了组蛋白去乙酰化作用,DNA与组蛋白结合紧密,不利于抑癌基因的转录,导致基因“沉默”.由组蛋白乙酰化修饰的改变引起的异常基因表达水平可以使用表观遗传药物HDAC抑制剂调节或逆转[2].
西达本胺(Chidamide)化学名是N-(2-氨基-4-氟苯基)-4-{N-[(E)-3-(3-吡啶)丙烯酰基]氨甲基}苯甲酰胺,是一种口服的组蛋白去乙酰化酶抑制剂,通过选择性抑制HDAC1、HDAC2、HDAC3和HDAC10[3],调节染色体上的组蛋白和非组蛋白乙酰化水平,进一步调控基因的表达,从而诱导肿瘤细胞凋亡,阻滞细胞周期.西达本胺在外周T细胞淋巴瘤、多发性骨髓瘤临床试验中显示出较好的治疗效果[4-7],但在实体瘤治疗方面的价值仍不确定.本文旨在研究西达本胺对结肠癌细胞HCT-15的细胞凋亡和细胞周期的影响,并初步探讨其作用机制,为结肠癌治疗提供新的思路.
1 材料与方法
1.1 细胞株及培养条件
人结肠癌细胞系HCT-15细胞株由南方科技大学馈赠.将含有10%(体积分数)胎牛血清的RPMI-1640培养基置于温度为37 ℃,在体积分数5% CO2且相对湿度为90%的培养箱内培养,传2-3代后取对数生长期细胞用于实验.
1.2 药物和主要试剂
西达本胺由深圳微芯科技公司馈赠,使用二甲基亚砜(DMSO)进行溶解,配制储备液浓度为40 mmol/L,-20 ℃冰箱保存备用;Histone H3、Histone H4、Acetyl-Histone H3、Acetyl-Histone H4、Bcl-2、Bax、Caspase 3、Cleaved Caspase 3、Caspase 9、Cleaved Caspase 9、PARP、Cleaved PARP、Cytc、γH2AX、p21、p27、CDK2、CyclinA2抗体均购自cell signaling公司;CCK-8试剂盒购自MedChemExpress公司;FITC Annexin V凋亡检测试剂盒购自BD生物公司;EdU细胞增殖检测试剂盒购自锐博生物公司.
1.3 CCK-8实验检测细胞活力
将对数生长期HCT-15细胞每孔100 μL(4×103/孔)接种于96孔板,24 h后按不同浓度梯度(64、32、16、8、4、2、1 μmol/L)加入西达本胺含药培养基,每组均设置了RPMI-1640培养基空白对照组和DMSO阴性对照组,并同时设置6个复孔.待培养24、48、72、96、120 h后,避光加入CCK-8溶液10 μL,孵育4 h后,酶标仪检测波长450 nm光密度值(OD值),进行3次独立重复实验.计算抑制率,抑制率=(OD加药组-OD空白组)/(OD对照组-OD空白组).
1.4 细胞形态学观察
消化对数生长期HCT-15细胞每孔2.5 mL(5×105/孔)接种于6孔板,24 h后分别加入终浓度1.272、2.815、10.943 μmol/L的西达本胺含药培养基,并设置DMSO阴性对照组,继续培养48、72 h后于显微镜下观察细胞形态变化并拍照.
1.5 克隆形成实验
取经不同浓度西达本胺处理48 h后的HCT-15细胞,消化后按500/孔接种于6孔板,十字形晃动使细胞分散均匀,置于培养箱培养,10 d后出现大于50个细胞肉眼可见的克隆集落且克隆之间不发生融合终止培养.弃去培养基,PBS清洗2~3次,经质量分数4%多聚甲醛固定20 min后,使用质量分量1%的结晶紫染液染色15 min,洗去多余染色剂放置室温干燥,待水渍消失后扫描拍照.
1.6 流式细胞术检测细胞凋亡
消化对数生长期HCT-15细胞,5×105/孔,每孔2.5 mL接种于6孔板,24 h后分别加入终浓度2.815、10.943 μmol/L的含药培养基,并设置DMSO阴性对照组.继续培养48 h后使用Annexin V-FITC/PI双染法对细胞进行处理染色;避光、室温(25 ℃)孵育15 min后,上机检测.
1.7 EdU细胞增殖实验
消化对数生长期HCT-15细胞,5×105/孔,每孔2.5 mL接种于6孔板,24 h后分别加入终浓度0.612、1.272、2.815、10.943 μmol/L的含药培养基.每组均设置DMSO对照组,继续培养48 h后进行EdU标记.制备25 μmol/L的EdU工作液,加入6孔板孵育2 h,PBS清洗后加入质量分数4%多聚甲醛使细胞固定,室温孵育30 min,弃固定液后加入甘氨酸溶液,摇床孵育5 min以去除多余的固定液.清洗后加入渗透剂室温孵育10 min.再次清洗后加入Apollo染色液,避光摇床孵育30 min.渗透剂清洗之后加入Hoechst染色液进行细胞核染色,避光摇床孵育30 min.PBS清洗2次洗去多余染色液,使用荧光倒置显微镜在镜下观察并拍照.
1.8 蛋白免疫印迹实验检测细胞凋亡途径
收集经不同浓度(1.272、2.815、10.943 μmol/L)西达本胺处理48 h后的HCT-15细胞蛋白.每个样品取30 μg蛋白进行SDS-聚丙烯酰胺凝胶电泳,上层浓缩胶用60 V电压,分离胶电压调至100 V.将蛋白转移至PVDF膜上,恒压90 V转膜1.5 h.质量分量5%脱脂奶粉室温封闭2 h,洗膜3次,每次10 min.一抗采用1∶1 000体积比稀释, 4 ℃孵育过夜,二抗采用1∶2 000体积比稀释,室温下孵育1 h.加入1∶1(体积比)配制的ECL化学发光A液、B液显色3 min,使用化学发光仪显影拍照.
1.9 统计学分析
采用SPSS 23.0软件、GraphPad Prism 8.0软件进行数据分析及作图,所有实验均进行3次独立重复实验.(SPSS软件计算72 h的 IC10、IC20、IC50值分别为1.272、2.815、10.943 μmol/L).采用单因素方差分析或独立样本t检验方法分析组间差异,P<0.05视为差异有统计学意义.
2 结果
2.1 西达本胺抑制HCT-15细胞的增殖
CCK-8法检测西达本胺对HCT-15细胞增殖的抑制作用,结果显示,HCT-15细胞经不同浓度药物处理24、48、72、96、120 h后,能够明显抑制细胞增殖,相同浓度不同时段对比,随着时间延长抑制率明显增高,有明显的时间依赖性,P<0.000 1(图1a);相同时间不同浓度对比,随着加药浓度的增加抑制率明显增高,当药物浓度为4 μmol/L时,抑制率出现明显的浓度依赖性,P<0.000 1(图1b).上述结果表明随着药物浓度的增加和时间的延长,西达本胺抑制HCT-15细胞的增殖且呈一定的时间和浓度依赖性.
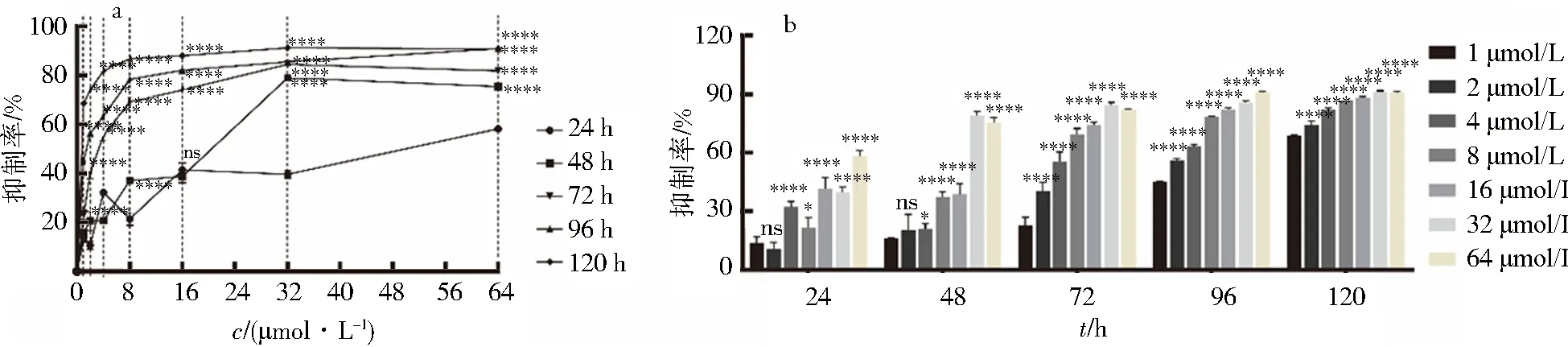
a.相同浓度不同时段的抑制率;b.同时段不同浓度的抑制率.(与对照组比较:*P<0.05,**P<0.01,***P<0.001,****P<0.000 1).图1 西达本胺对HCT-15细胞的增殖抑制呈浓度-时间依赖性Fig.1 Concentration-dependent effect of Chidamide on HCT-15 cell proliferation
2.2 西达本胺影响HCT-15细胞形态及克隆形成能力
细胞经不同浓度药物处理后形态发生变化(图2a),随着药物浓度及作用时间的增加,细胞形态变为长梭形,触角增多,细胞内颗粒物增多,并且可见空泡;同时相邻细胞之间连接疏松,细胞膜折光度下降,细胞数量也随之减少.平板克隆的结果显示,随着加药浓度的增加克隆集落数减少,且单个集落体积逐渐减小(图2b).平板克隆结晶紫染色结果同样印证了上述结果,集落数明显减少(图2c).由此可见,西达本胺显著影响了结肠癌HCT-15细胞的生物学形态和克隆形成能力.
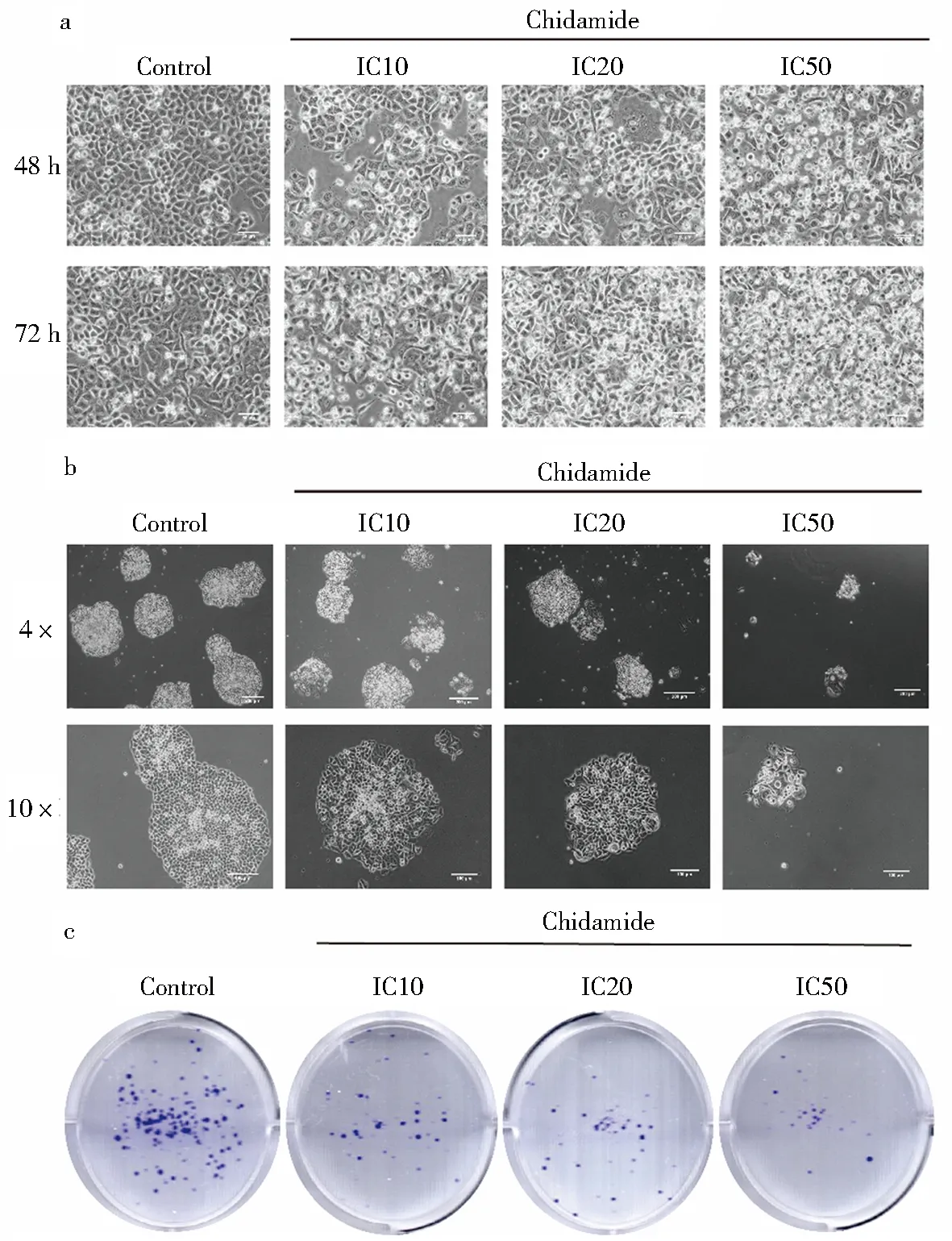
a.不同浓度西达本胺作用于HCT-15细胞48 h和72 h后的细胞形态变化; b.平板克隆形成实验第10的集落形成情况; c.平板克隆形成实验结晶紫染色.图2 西达本胺抑制细胞增殖的形态学变化Fig.2 Chidamide inhibits morphological changes of cell proliferation
2.3 西达本胺诱导HCT-15细胞凋亡并阻滞细胞周期
流式细胞术检测到明显的细胞凋亡,随着加药浓度的升高,细胞凋亡数量增多,早期凋亡细胞、晚期凋亡细胞和坏死细胞的数量都随之上升(图3a).测得实验组凋亡率分别为12.32%±0.84%(P<0.05)、15.63%±0.91%(P<0.001),与对照组相比,有统计学意义(图3b).与此同时通过EdU实验检测其细胞周期的变化(图3c),随着加药浓度的增高,Hoechst蓝色荧光染色细胞数目减少,即活细胞数减少,药物对细胞杀伤作用显著;EdU绿色荧光染色细胞数减少,即进入DNA复制期的细胞数量减少.表明西达本胺可以明显促进HCT-15细胞凋亡、抑制其增殖且阻滞细胞周期.
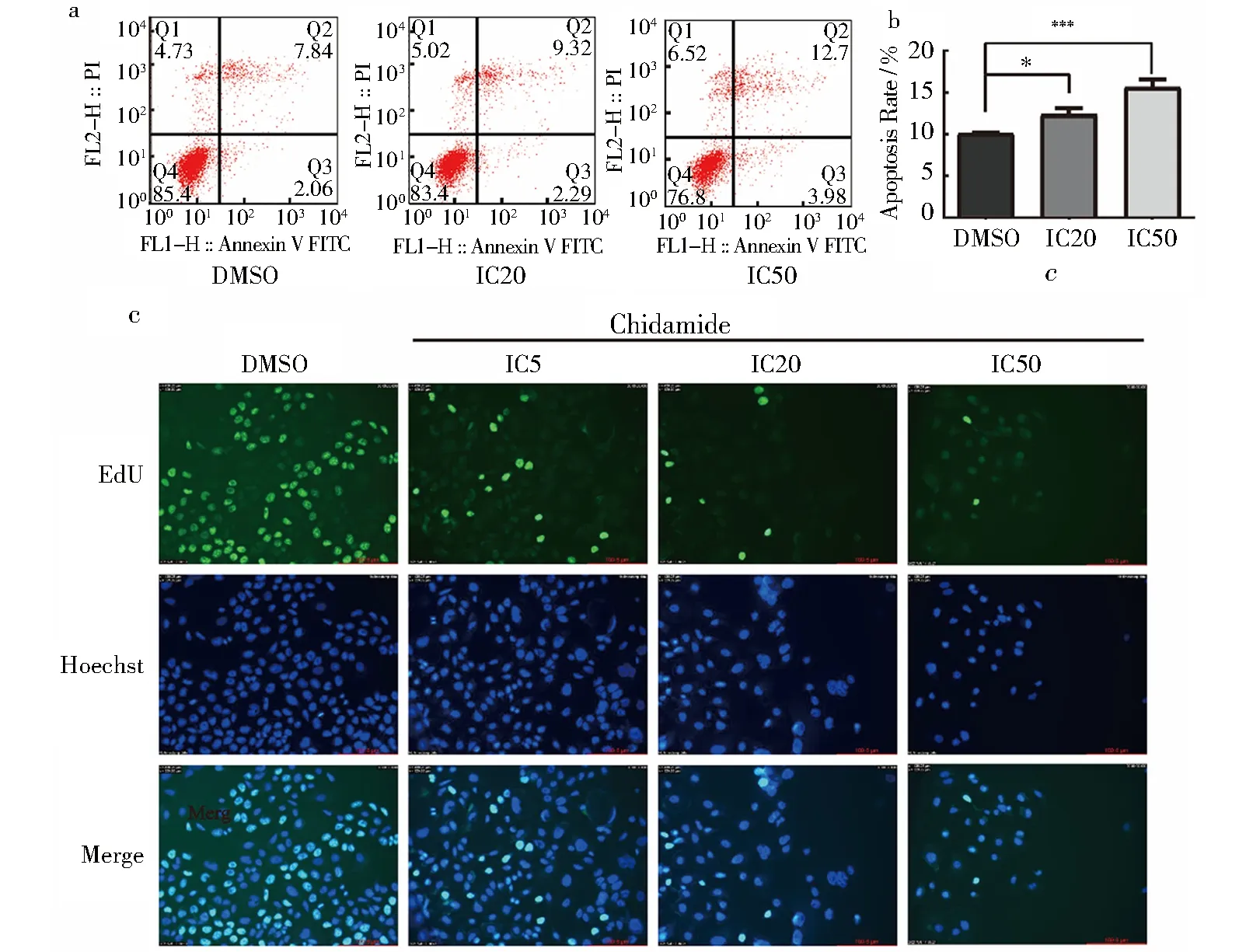
a.流式细胞术检测HCT-15细胞凋亡;b.凋亡率与对照组相比具有显著性差异(*P<0.05,**P<0.01,***P<0.001);c.EdU检测HCT-15细胞周期阻滞.图3 西达本胺对细胞凋亡和周期的影响Fig.3 Effects of chidamide on apoptosis and cell cycle
2.4 西达本胺通过线粒体凋亡机制介导细胞凋亡
Western blot 结果显示,随着加药浓度增大,乙酰化组蛋白Acetyl-Histone H3、Acetyl-Histone H4表达上调(图4a).由线粒体介导的Caspase信号通路相关蛋白Bcl-2表达下调,Bax、Cytc、Cleaved Caspase 9、Cleaved Caspase 3、Cleaved PARP表达上调.DNA双链断裂标志物γH2AX表达上调(图4b).细胞周期相关蛋白p21、p27表达上调,CDK2、CyclinA2蛋白的表达水平下调(图4c).
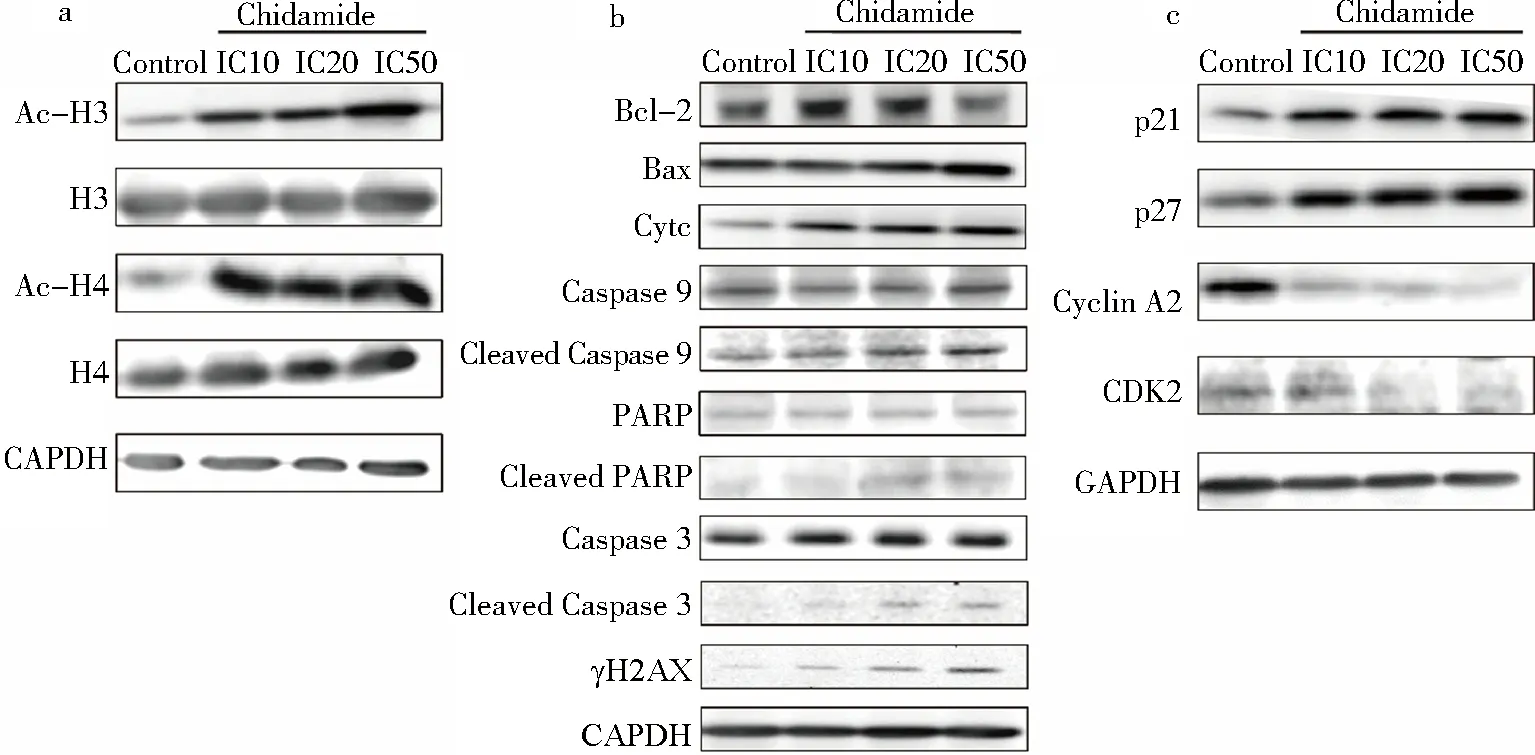
图4 西达本胺对乙酰化组蛋白、线粒体凋亡途径相关蛋白、周期蛋白表达的影响Fig.4 Effects of Chidamide on expression of acetylated histones,mitochondrial apoptosis pathway related proteins and cyclins
3 讨论
结肠癌的发生发展与原癌基因的活化和抑癌基因的失活紧密相关.组蛋白的乙酰化有利于DNA和组蛋白八聚体的解离,核小体结构变得松弛,使得原本无法和启动子接触的区域成为新的转录靶点,各种转录因子与DNA结合,激活转录过程[8].西达本胺是一种新型的组蛋白去乙酰化酶抑制剂,通过抑制组蛋白去乙酰化酶的活性,提高组蛋白的乙酰化水平,促进抑癌基因的表达,诱导肿瘤细胞凋亡.本研究发现,随着药物浓度的升高,HCT-15结肠癌细胞凋亡增多,细胞体外克隆形成能力减弱,初步证实了西达本胺对结肠癌HCT-15细胞系的抑制作用.而后笔者检测了经不同浓度西达本胺处理后的组蛋白的乙酰化水平,结果显示随着加药浓度增加Acetyl Histone 3、Acetyl Histone 4表达水平逐渐增高,证实了西达本胺可以诱导结肠癌细胞系组蛋白乙酰化水平增高.
进一步探讨了西达本胺处理后结肠癌HCT-15细胞系的具体凋亡途径.细胞发生凋亡的主要途径有两种,即内源性凋亡途径和外源性凋亡途径.内源性凋亡途径主要由线粒体介导.以往研究表明,西达本胺可以通过激活线粒体凋亡途径来诱导肿瘤细胞凋亡[9-10].西达本胺通过Caspase依赖的凋亡途径抑制AML细胞增殖,阻断G1/S期转变,诱导细胞凋亡[11].西达本胺下调抗凋亡蛋白Bcl-xL和Bcl-2,激活促凋亡蛋白Bax,在p53信号的调控下,Cytc从细胞质转移到线粒体,与线粒体膜结合释放Cytc,在dATP的作用下,Cytc释放到细胞质内,与凋亡蛋白酶激活因子1(APAF-1)结合形成聚合物,与Caspase 9前体结合形成凋亡体,Caspase 9被激活.Caspase 9激活了该通路下游的一系列Caspase成员,包括Caspase 7和Caspase 3,进一步诱导特定的凋亡底物和细胞凋亡[12-13].此外,西达本胺还具有诱导DNA损伤的作用[14].为了验证以上结论,本研究检测了由线粒体介导的Caspase信号通路相关蛋白的表达量变化,结果显示抗凋亡蛋白Bcl-2表达下调,Bax、Cytc、Cleaved Caspase 9、Cleaved Caspase 3、Cleaved PARP表达上调,随着药物浓度的增加,γH2AX表达量上升.这说明西达本胺可能通过上调组蛋白乙酰化水平,使染色质结构变得疏松,从而引起细胞的DNA双链损伤并激活内源性凋亡途径促进肿瘤细胞凋亡,发挥抗肿瘤作用.细胞周期的调控主要与Cyclin、CDK以及CDKI有关.Cyclin与CDK形成复合物促进细胞周期进展,而CDKI的作用则相反.p21是CDKI的成员,可抑制CDK活性,阻滞细胞周期.在结肠癌中,西达本胺调控p21、CDK4、p53表达水平,阻滞细胞于G0/G1期[15].在淋巴瘤中,西达本胺调控p21、CyclinE表达水平,阻滞细胞周期于G0/G1期[16].本研究发现经西达本胺处理结肠癌细胞HCT-15后,p21表达上调,而CDK2、CyclinA2蛋白的表达下调,EdU实验检测细胞总周期变慢.结果提示西达本胺可能通过上调p21的表达并抑制周期蛋白依赖性激酶复合物Cyclin-CDK-CDKI的活性达到阻滞细胞周期的效果.
乙酰化调控异常是多种肿瘤的共同生物学特征之一,西达本胺在淋巴瘤、乳腺癌均获批适应证,应用前景广阔,需要我们在其他类型肿瘤对其进行更深入的探索.本研究验证了西达本胺在结肠癌细胞系HCT-15发挥作用的主要机制,探讨了造成该细胞系凋亡的具体途径,但是药物造成DNA损伤的具体机制尚未明确,需要在后续的工作中继续研究.
