FaGST基因改良菊苣新种质创制
2022-04-22刘晓霞刘重阳姚文琴赵德刚王小利
陈 锡, 陈 莹, 刘晓霞, 刘重阳, 吴 溪, 姚文琴, 赵德刚,, 王小利
(1.贵州省农业科学院/贵州省草业研究所, 贵阳 550006;2.贵州大学生命科学学院/山地植物资源保护与种质创新教育部重点实验室/喀斯特山区植物资源利用与育种国家地方联合工程研究中心, 贵阳 550025)
菊苣(Cichoriumintybus)是菊科(Asteraceae)菊苣属(Cichorium)多年生草本植物,主要分布于欧洲和地中海地区,北非、中亚和北美也有分布[1]。菊苣是一种具有很大开发潜力的高产优质青鲜饲用牧草,含有丰富的矿物质,饲口性好,营养价值高,易消化,还有产量高和刈割后再生能力强等优势,许多国家已广泛栽培利用[2-3]。因此,培育适应性和抗性强的菊苣新品种对生产高产优质牧草具有重要实践意义。
谷胱甘肽转移酶是一类超家族蛋白,具有多种功能,通过选择性ABC转运蛋白将谷胱甘肽的代谢物质转运入液泡,在细胞解毒过程中发挥重要的作用[4]。谷胱甘肽转移酶广泛分布于植物、动物、酵母和细菌中,植物中谷胱甘肽转移酶被90多个基因编码,经胁迫诱导大多数基因的表达水平具有显著差异性,它们均在酶促活性氧清除机制方面发挥着重要作用[5]。Wang等[6]在香蕉(Musaacuminata)根中分离获得2个组成型表达的MaGSTU2和MaGSTU3基因。采用15%PEG-6000处理香蕉根部,2个基因表达量呈显著性上调,表明MaGSTU2和MaGSTU3基因均响应干旱胁迫。Yang等[7]在拟南芥中将刚毛怪柳(Tamarixhispida)ThGSTZ1基因过量表达,获得转ThGSTZ1基因拟南芥GST活性显著增强。Chronopoulou等[8]将农药喷洒在菜豆(Phaseolusvulgaris)幼苗叶片上,从叶片中分离得到3个基因,分别是PvGSTU1、PvGSTU2和PvGSTF1,转基因株系中GST活性为野生型的2.7~2.9倍,表明PvGSTs在植物解毒机制中具有积极作用。何学高等[9]研究表明,漆树TvGST7基因表达增加了大肠杆菌对非生物胁迫的抗性,推测TvGST7基因对清除非生物胁迫产生的氧化损伤发挥着重要作用。因此,研究GST抵御植物非生物胁迫的作用,对培育植物抗性新品种具有重要意义。
本研究利用前期从高羊茅叶片中克隆获得的FaGST基因,通过BamHI和PstI双酶切将FaGST基因片段连接在真核表达载体pCAMBIA 1300-35 S上,成功构建pCAMBIA 1300-35 S-FaGST过表达载体,遗传转化牧草菊苣,定向改良菊苣获得新种质。为下一步深入了解FaGST基因功能和分子调控机制奠定基础,为培育植物抗逆新种质的育种研究提供理论依据。
1 材料与方法
1.1 材 料
试验材料为黔引普那菊苣,由贵州省草业研究所2006年育成及保存。
菌株和质粒:大肠杆菌(Escherichiacoli)DH 5 α、根癌农杆菌GV 3101(Agrobacterium tumefaciens)、pCAMBIA 1300-35 S载体由武汉转导生物实验室提供。
试剂和酶:植物DNA提取试剂盒、胶回收试剂盒、质粒提取试剂盒均购自天根生化科技(北京)有限公司;卡那霉素(Kan)、潮霉素(Hyp)、氨苄青霉素(Amp)、DNA Marker 2000、BamHI限制性内切酶、SalI限制性内切酶购自宝生物工程(上海)有限公司;RNA反转录试剂盒、2 X SYBR Green qPCR Master Mix均购自安诺伦(北京)生物科技有限公司。
1.2 试验方法
1.2.1植物pCAMBIA 1300-35 S-FaGST过表达载体构建
利用前期从高羊茅叶片中克隆获得FaGST基因,分别用BamHI和PstI进行双酶切,将酶切的目的基因与重组质粒pCAMBIA 1300-35 S进行体外连接,通过热激法将连接产物转化到感受态(DH 5 α)细胞中,置于含卡那霉素(Kan)+氨苄(Amp)的LB固体培养皿中培养16 h,挑取单菌落鉴定,经测序分析获得正确的pCAMBIA 1300-35 S-FaGST超表达载体,再用电激转化农杆菌EHA 105,置于-80 ℃冰箱保存备用。
1.2.2菊苣遗传转化
将大小均一的菊苣子叶置于人工培养箱内暗培养,利用活化的农杆菌悬浮液浸染10 min,平铺在1/2 MS添加[0.01 mg/L噻苯隆(TDZ)+1 mg/L生长素(IAA)+10 g/L蔗糖]的培养基中,置于光照培养箱[光照强度0.54~0.67 mmol/(m2·s),光培养16 h/d,暗培养8 h/d,相对湿度为60%,温度为(24±2)℃]共培养2 d,再用含有100 mg/mL头孢霉素的无菌水清洗2~3次,然后转移到MS含有2 mg/mL 6-苄氨基嘌呤(6-BA)+3 mg/L潮霉素(Hyp)+1 mg/mL IAA+10 g/L蔗糖的培养基上,等待长出愈伤。将愈伤移至添加1 mg/L 6-BA+1 mg/L IAA+3 mg/L Hyp+10 g/L蔗糖的MS培养基中,间隔7 d继代一次,待绿芽长至3~6 cm,从愈伤组织上切下再生植株,移入添加含有1 mg/L萘乙酸(NAA)+3 mg/L Hyp+10 g/L蔗糖的MS培养基中15~20 d,待根系生长完整,炼苗4~5 d,移栽至营养土中常规培养。
1.2.3转基因菊苣鉴定
利用试剂盒分别提取野生型和转基因菊苣植株DNA,设计引物为Hyt-F,Hyt-R进行PCR扩增反应,反应总体系为20 μL,其中模板DNA 1 μL,Green Master Mix 10 μL,Hyt-F 1 μL,Hyt-R 1 μL,ddH2O 7 μL。反应程序:94 ℃ 3 min;94 ℃ 30 s,55 ℃ 30 s,72 ℃ 40 s,35个循环;72 ℃ 5 min,25 ℃ 5 min。利用0.9%琼脂糖凝胶电泳拍照检测。

表1 实验所用引物序列Table 1 Primer sequences used in the study
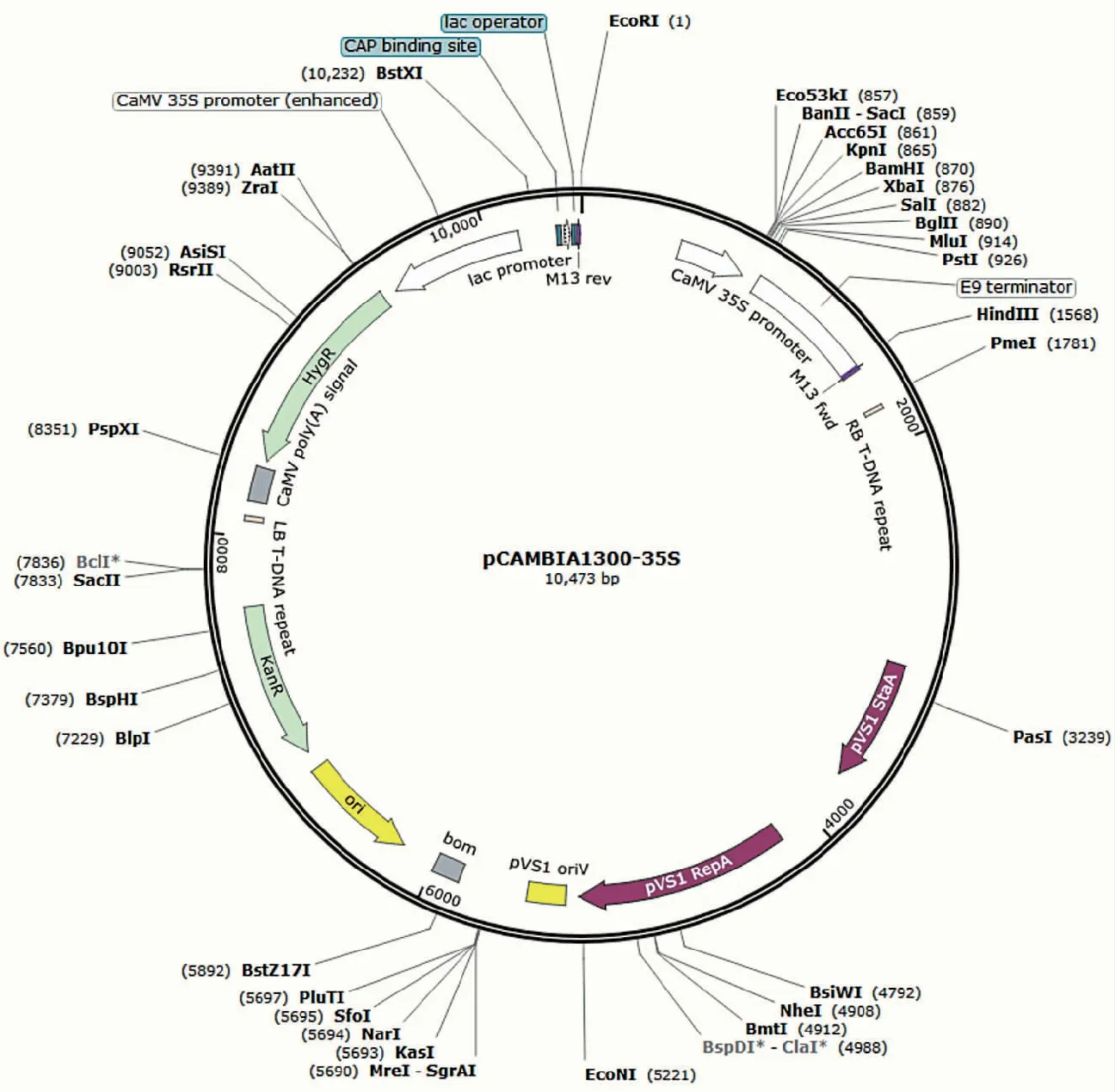
图1 pCAMBIA 1300-35 S载体结构图Fig.1 Vector structure of pCAMBIA 1300-35 S

图2 pCAMBIA 1300-35 S-FaGST载体结构图Fig.2 Vector structure of pCAMBIA 1300-35 S-FaGST
1.2.4转基因菊苣总RNA提取及cDNA合成
根据RNA试剂盒操作说明提取普那菊苣叶片总RNA,利用1%琼脂糖凝胶电泳和核酸分析仪检测质量;按照反转录试剂盒的操作说明合成cDNA第一链。
1.2.5转基因菊苣荧光定量分析
根据FaGST基因的序列,设计荧光定量特异引物:FaGST-F 2和FaGST-R 2。利用实时荧光定量PCR技术分析菊苣转基因植株中FaGST基因的表达分析,操作步骤参照SYBR Premix ExTaqTM试剂盒说明书。以菊苣EF为内参基因,引物序列EF-F,EF-R。总体系20 μL,其中SYBR Premix ExTaq(2×)10 μL、FaGST-F 3(10 μmol/L)0.5 μL、FaGST-R 3(10 μmol/L)0.5 μL、cDNA模板1 μL、双蒸水8 μL。反应液全程冰上配制,置于实时荧光定量PCR仪Applied BiosystemsTMQuantStudioTM3 & 5上进行反应。反应程序为:95 ℃ 2 min;95 ℃ 15 s,60 ℃ 15 s,40个循环。相对表达量的数据结果利用2-ΔΔct方法计算分析,利用Excel 2007软件整理分析数据及作图。
2 结果与分析
2.1 FaGST表达载体构建
利用实验室前期从高羊茅中克隆获得FaGST基因,通过BamHI和PstI双酶切pCAMBIA 1300-35 S空载体,并回收目的片段,利用T 4连接酶连接,完成载体构建,该载体含有植物体内没有的潮霉素特异基因。

注:A为无菌苗培养;B为共培养;C为继代培养;D为生根培养。图3 遗传转化过程Fig.3 Genetic transformation process
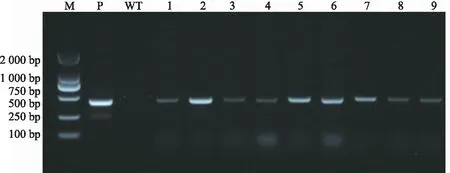
图4 转基因菊苣PCR验证Fig.4 PCR verification of transgenic chicory
2.2 FaGST遗传转化菊苣的获得
将菊苣无菌苗叶片切成0.5 cm大小,利用农杆菌侵染,将外植体转移到培养基上进行诱导,叶片膨大形成绿色愈伤,经3 mg/L潮霉素进行筛选后进行分化和生根,最后炼苗移栽。
2.3 菊苣转基因植株鉴定
以获得的菊苣叶片总DNA为模板,利用潮霉素hpt基因对获得9株转基因菊苣进行PCR检测,结果显示,有9株转基因植株出现明亮条带,而野生型植株无条带,表明已经成功将转基因植株整合到菊苣基因组中。
2.4 转基因菊苣表达量分析
以获得的总RNA为模板,反转录合成cDNA第一链。利用实时荧光定量PCR技术检测转FaGST基因菊苣的表达量情况,发现转基因菊苣表达量均明显上调,最大达2.89倍,说明该基因在菊苣中已过量表达,为后期菊苣的抗性研究奠定基础。
3 讨 论
植物谷胱甘肽转移酶GST可催化谷胱甘肽与疏水、亲电化合物质的亲核取代反应。当外界胁迫诱导GST时,它会作出精细调控响应措施,提高植物适应环境和忍耐胁迫的能力,继而行使其解毒、抗逆及信号转导等功能[10]。Takesawa等[11]利用农杆菌介导法使GST基因在水稻(Oryzasativa)中过量表达,发现低温条件下可增加水稻种子的萌发率及生长量。George等[12]从大枣(Prosopisjuliflora)叶片中克隆出PjGSTU1基因,利用农杆菌介导法将过表达载体遗传转化烟草(Nicotianatabacum),增强了烟草抵抗干旱胁迫的能力。LoCicero等[13]从甜橙(Citrussinensis)中克隆获得2个谷胱甘肽转移酶基因,命名为CsGSTU1和CsGSTU2,将这2个基因在烟草中异源过表达,增加了烟草抵御盐胁迫和干旱胁迫的能力。Chan等[14]将从大豆(Glycinemax)中克隆到的GmGSTL1基因在烟草及拟南芥(Arabidopsisthaliana)中异源过表达,增强了它们抵抗盐胁迫的能力。Bjarnholt等[15]研究发现,GSTL能促进代谢流之间正常进行切换。
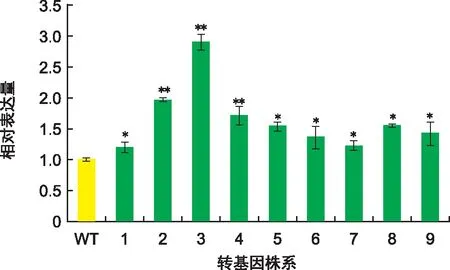
图5 转基因菊苣表达量分析Fig.5 Expression levels analysis of transgenic chicory
逆境导致植物体内活性氧含量大幅度提高,致使细胞结构和代谢物质产生氧化,植物生长发育和代谢受到严重影响[16-17]。超氧化物歧化酶(SOD)、过氧化氢酶(CAT)、GST和过氧化物酶(POD)等会形成保护酶系统,将植物体内多余的活性氧及其他有害的自由基进行有效清除,分解对细胞有害的代谢物质,达到减缓或免受伤害的目的,从而起到保护作用[18]。植物谷胱甘肽转移酶在胁迫下可增强植株抵御环境压力的能力,因此通过GST改良植物从而获得抗逆新品种,对逆境条件下增强植物的品质和抗性具有非常重要的意义。本研究构建FaGST基因过表达载体,利用农杆菌介导遗传转化菊苣,使用潮霉素进行筛选,成功获得转基因植株,通过实时荧光定量PCR技术检测,转基因菊苣中FaGST基因表达量明显上调,表明该基因已经成功整合到菊苣植株中,为下一步抗性功能研究奠定基础。
4 结 论
初步建立了农杆菌转化菊苣的转基因体系,通过继代后可以稳定出苗。成功构建过表达载体pCAMBIA 1300-35 S-FaGST,利用农杆菌介导遗传转化菊苣,获得转基因菊苣植株,为下一步研究菊苣的抗性奠定基础。
