高地芽胞杆菌ST15的筛选、鉴定及生防特性研究
2022-04-22苗成琪赵延存刘嘉钰李朝辉刘凤权
苗成琪,赵延存,包 艳,凌 军,刘嘉钰,李朝辉,刘凤权*
(1. 江苏省农业科学院植物保护研究所/省部共建国家重点实验室培育基地-江苏省食品安全重点实验室,南京 210014;2. 南京农业大学植物保护学院,南京 210095)
水稻黄单胞菌Xanthomonas oryzae包含两个亚种:水稻细菌性条斑病菌X.oryzaepv.oryzicola(Xoc)和水稻白叶枯病菌X.oryzaepv.oryzae(Xoo),分别引起水稻细菌性条斑病(bacterial leaf streak,BLS)和水稻白叶枯病(bacterial leaf blight,BLB),是我国水稻生产上的两种主要细菌病害,通常造成产量损失5%~10%,严重时达40%以上,甚至绝产[1,2]。目前,水稻细菌病害的防控主要依靠化学农药,包括三氯异氰尿酸、噻霉酮、噻唑锌等[3]。然而,化学农药的长期不合理使用导致病原菌抗药性逐渐增强,同时残留农药对食品安全和生态环境构成严重威胁。近年来,具有相对安全、无残留、环境友好等优点的生物农药产业不断增长,基于微生物的生物防控技术被认为是未来控制作物细菌病害的主要发展方向之一[4]。芽胞杆菌Bacillusspp. 属于革兰氏阳性细菌,广泛分布于土壤、植物表面、水体、农业废弃物等各种生境中,具有广谱的抗菌活性、较高的芽胞产率和较强的逆境适应性,被认为是最具有应用开发潜力的有益微生物之一[5]。高地芽胞杆菌B. altitudinis是芽胞杆菌属的一个新种,对多种病原真菌具有拮抗活性,能够有效抑制白绢病菌Sclerotium rolfsii、瓜亡革菌Thanatephorus cucumeris、立枯丝核菌Rhizoctonia solani、胶孢炭疽菌Colletotrichum gloeosporioides等多种病原真菌的生长,同时,对植物表现一定的促生作用[6,7]。目前,关于高地芽胞杆菌对水稻黄单胞病菌具有拮抗作用的报道较少。
本研究从梨树根际土壤分离筛选到 1株对水稻黄单胞菌具有较强拮抗活性的细菌 ST15,根据生物学特征、生理生化指标及保守核苷酸序列,确定了该菌株的分类地位;评估了其次生代谢抗菌物质的抑菌活性及稳定性,测定了ST15对水稻细菌性条斑病的田间防治效果、对水稻的促生作用以及与化学杀菌剂的兼容性,以期为开发防治水稻细菌性病害的微生物农药提供新的菌株资源和试验依据。
1 材料与方法
1.1 材料
1.1.1 菌株 本研究所用病原菌菌株包括黄瓜细菌性角斑病菌Pseudomonas syringaepv.lachrymansPSL、梨锈水病菌Dickeya fangzhongdaiLXS、大白菜软腐病菌Pectobacterium carotovorumsubsp.carotovorumPCC、瓜类果斑病菌Acidovora xavenaesubsp.citrulliGXGB、金黄色葡萄球菌Staphylococcus aureusVISA、茄科雷尔氏菌Ralstonia solanacearumsQQK、梨火疫病菌Erwinia amylovoraLHY、野油菜黄单胞菌野油菜致病变种Xanthomonas campestrispv.campestris Xcc、水稻细菌性条斑病菌6个菌株(Rs105、Xoc-192、Xoc-197、Xoc-S、Xoc-M、Xoc-W)、水稻白叶枯病菌7个菌株(PXO99、YN1、YN7、YN24、FUJ、SCYC-6、GD414),这些菌株均为本实验室保存菌株。
1.1.2 培养基 NB 培养基:蔗糖10 g/L、蛋白胨5 g/L、酵母粉1 g/L、牛肉浸膏3 g/L,pH 6.8~7.0。1/2 NB培养基:蔗糖5 g/L、蛋白胨2.5 g/L、酵母粉0.5 g/L、牛肉浸膏1.5 g/L,pH 6.8~7.0。固体培养基在液体培养基配方基础上添加15 g/L琼脂粉。PDA培养基:去皮马铃薯200 g/L(煮沸直至马铃薯变软,三层纱布过滤)、葡萄糖20 g/L、琼脂粉15 g/L。上述培养基在121 ℃条件下灭菌20 min。
1.2 细菌种子液、发酵液、无菌滤液及菌悬液的制备
1.2.1 细菌种子液制备 利用灭菌牙签挑取单菌落于含有5 mL NB液体培养基的试管中,180 r/min、28 ℃条件下培养至OD600=1,备用。
1.2.2 细菌发酵液制备 将1.2.1所得的种子液以1%(v/v)的比例接种到1/2 NB培养基中,180 r/min、28 ℃摇培48~52 h。
1.2.3 无菌滤液的制备 将1.2.2制备的ST15发酵液8000 r/min离心10 min,取上清,用0.22 μm细菌过滤器过滤除菌,得到无菌发酵滤液。
1.2.4 细菌菌悬液的制备 将1.2.2制备的ST15发酵液8000 r/min离心10 min,弃上清,用无菌水悬浮菌体,并将菌体密度调整到1.0×108CFU/mL。
1.3 生防细菌的分离、筛选及初步鉴定
1.3.1 生防细菌的分离 从安徽砀山、河南宁陵、河北石家庄、江西南昌、新疆库尔勒、甘肃张掖、江苏句容和溧水的16个梨园采集27份土样,从辽宁大连的2个苹果园采集3份土样,从江苏句容和溧水的5块水稻田采集6份土样,每份土样充分混匀后称取10 g,放入500 mL锥形瓶中,加入90 mL无菌水,28 ℃、180 r/min振荡培养1 h,使其充分混匀后,用无菌水梯度稀释至10-1、10-2、10-3、10-4、10-5,每梯度吸取100 μL均匀涂布在NA平板上,每个浓度重复3次,28 ℃条件下培养2~3 d,挑取形态不同的菌落划线纯化培养,甘油菌种保存于-80 ℃[8]。
1.3.2 生防细菌的筛选 以水稻细菌性条斑病菌Rs105菌株为靶标,筛选具有显著拮抗活性的生防细菌。吸取100 μL Rs105种子液(OD600=1)稀释100倍,取3 mL在NA平板上均匀涂布,吸掉多余的菌液,晾干后,分别取3 μL候选生防菌种子液(OD600=1)滴加在距离平板中心2.5 cm处相对称的6点,以滴加无菌水为对照,每个处理重复3次,28 ℃条件下培养2~3 d,观察并测量抑菌圈的直径。
1.3.3 生防细菌的16S rDNA测定 选取拮抗圈直径大于2.0 cm的菌株,制备所选细菌的菌液,使用TIANGEN细菌基因组DNA提取试剂盒提取细菌的总基因组DNA。利用细菌16S rDNA基因的通用引物27F(5′-A GAGTTTGATCCTGGCTCAG-3′)和 1492R(5′-GGTTACCTTGTTACGACTT-3′)PCR 扩增 DNA 片段[9]。PCR反应条件:94 ℃预变性3 min;94 ℃变性30 s,55 ℃退火30 s,72 ℃延伸1 min,30 个循环;72 ℃延伸5 min。所得PCR产物送六合华大生物公司进行序列测定,将测得序列在NCBI数据库进行BLAST比对分析。
1.4 菌株ST15的鉴定
1.4.1 形态观察 利用灭菌牙签从4 ℃保存的ST15平板上挑取单菌落,在NA固体平板上划线培养,28 ℃培养48 h,观察该菌株的菌落形态。从NA固体平板上挑取菌株ST15的单菌落,28 ℃、180 r/min条件下摇培,于24和48 h分别取样2 mL,12000 r/min离心10 min收集菌体,利用PBS缓冲液轻缓悬浮菌体,离心洗涤2次,最后利用2.5%戊二醛固定,送扬州大学电镜室观察该菌株的菌体形态和芽胞形态。
1.4.2 Biolog测定 委托中国科学院微生物研究所菌种保藏管理中心,使用 BIOLOG GENIII 试剂盒(按照试剂盒说明书操作)对菌株 ST15 进行基本特性试验、生长试验以及化学敏感试验的测定。
1.4.3gyrB基因的测定及进化树分析 利用细菌gyrB基因的通用引物UP-1(5′-GAAGTCATCATGACCG TTCTGCAYGCNGGNGGNAARTTYGA-3′)和 UP-2r(5′-AGCAGGGTACGGATGTGCGAGCCRTCNACR TCNGCRTCNGTCAT-3′)PCR扩增DNA片段;利用测序引物UP-1S(5′-GAAGTCATCATGACCGTTCT GCA-3′)和 UP-2Sr(5′-AGCAGGGTACGGATGTGCGAGCC-3′)对 PCR 产物进行测序[10]。所得 PCR 产物送六合华大生物公司进行序列测定,并将测定序列提交NCBI数据库。基于gyrB及GenBank下载的参考序列,利用MEGA 7.0软件进行多序列比对及遗传进化树构建,选择绿脓杆菌Pseudomonas aeruginosaPAO1作为遗传进化树的外围参照菌株[11]。
1.5 菌株ST15对病原细菌的抗菌谱测定
采用平板对峙法[12]测定ST15对10种病原细菌的21个菌株的拮抗活性。首先,将各病原菌接种到NB液体培养基中,28 ℃条件下培养至OD600=1.0,作为种子菌液。参照1.3.2方法,分别将各供试病原细菌的种子菌液涂布在NA平板上,然后吸取3 μL ST15 的种子菌液滴在平板中心,28 ℃条件下培养2 d,测量抑菌圈的直径。每个处理重复3次。
1.6 菌株ST15无菌滤液的抑菌活性及稳定性分析
1.6.1 无菌滤液的抑菌活性分析 以水稻细菌性条斑病菌Rs105和水稻白叶枯病菌PXO99为靶标,采用平板对峙法对ST15无菌滤液、噻唑锌以及噻霉酮的抑菌活性进行比较。以DMSO分别溶解噻唑锌和噻霉酮,并分别配置浓度为1 mg/mL和10 μg/mL的药液。参照1.3.2的方法将病原菌涂布在NA平板上,晾干后用孔径为5 mm的无菌打孔器在平板中心以及距离平板中心2.5 cm处相对称的4点打孔。分别吸取30 μL的ST15无菌滤液、1 mg/mL噻唑锌溶液以及10 μg/mL噻霉酮溶液滴加在小孔处,以滴加DMSO的处理作为对照,每处理重复3次,28 ℃培养2 d,测量抑菌圈直径。
1.6.2 次生代谢抗菌活性物质的热处理稳定性分析 将ST15无菌滤液分装于2 mL离心管中,每管1 mL,分别在30 ℃、50 ℃、65 ℃、85 ℃和100 ℃条件下水浴处理30 min,以未做处理的ST15无菌滤液作为对照,以水稻细菌性条斑病菌 Rs105菌株为靶标,检测抑菌活性。每个处理重复3次。
1.6.3 次生代谢抗菌活性物质的蛋白酶处理稳定性分析 将ST15无菌滤液分装于2 mL离心管中,每管1 mL,分别加入胰蛋白酶、胃蛋白酶和蛋白酶K,使酶的终浓度为100 μg/mL,以添加无菌水作为对照,37 ℃放置6 h,以水稻细菌性条斑病菌Rs105为靶标,检测抑菌活性。每个处理重复3次。
1.6.4 次生代谢抗菌活性物质的酸碱处理稳定性分析 分别吸取5 mL ST15无菌滤液于6孔培养板中,利用HCl和NaOH溶液分别将pH调整为3.0、5.0、7.0、9.0和11.0,室温放置1 h后,将各处理无菌滤液的pH 再调整为 7.0,以未经处理的 ST15 无菌滤液作为对照,以水稻细菌性条斑病菌Rs105为靶标,检测抑菌活性。每个处理重复3次。
1.6.5 次生代谢抗菌活性物质的紫外处理稳定性分析 取15 mL ST15无菌滤液于培养皿中,打开皿盖,置于超净工作台25 W紫外灯下60 cm处,垂直向下照射处理1 h,以未经处理的ST15 无菌滤液作为对照,以水稻细菌性条斑病菌Rs105菌株为靶标,检测抑菌活性。每个处理重复3次。
1.7 菌株ST15对水稻的促生效果测定
选取健康水稻种子(Y两优911),75%酒精消毒5 min,无菌水冲洗5次,以彻底消除酒精。将120粒水稻种子放入含有100 mL ST15菌悬液(1×108CFU/mL)的500 mL广口瓶中,浸种36 h,以无菌水处理作为对照。倒掉菌悬液,将水稻种子倒入铺有一层无菌滤纸的灭菌培养皿中,用同种浸种液将滤纸浸湿,盖上皿盖,26 ℃放置72 h催芽,测定种子发芽率,随机选择100粒种子测定其根长和芽长。
1.8 菌株ST15对3种化学杀菌剂的耐受性测定
分别将噻唑锌和噻霉酮溶于DMSO,配置20 mg/mL噻唑锌和6.4 mg/mL噻霉酮母液;将三氯异氰尿酸溶于无菌水,配置7.1 mg/mL母液;然后,分别制备噻唑锌终浓度为0、8、16和32 μg/mL的NA固体平板,噻霉酮终浓度为0、0.125、0.25和0.5 μg/mL的NA固体平板,三氯异氰尿酸终浓度为0、64、128和256 μg/mL的NA固体平板。将菌株ST15培养液(OD600=1.0)和水稻细菌性条斑病菌Rs105菌株培养液(OD600=1.0)分别稀释5、25、125倍,分别吸取2 μL ST15和Rs105原液及各浓度稀释液滴加在含上述杀菌剂的NA固体平板上,28 ℃条件下培养2 d,观察菌落的生长情况。每个处理重复3次。
1.9 菌株ST15生防菌剂对水稻细菌性条斑病的田间防效测定
1.9.1 菌株ST15生防菌剂的配置 将菌株ST15的种子液以1%(v/v)的比例接种到NB培养基中,180 r/min、28 ℃摇培48 h,菌体浓度约3.5×109cfu/mL,向发酵液中添加5%(v/v)98B助剂、0.05%吐温80以及0.1%苯甲酸钠,充分混匀,然后无菌分装,室温保存。
1.9.2 试验设计 田间试验于2020年在江苏省泗阳县张家圩镇进行,本试验共设4个处理:ST15生防菌剂10 L/hm2、ST15生防菌剂15 L/hm2、3%噻霉酮悬浮剂1.5 L/hm2和清水对照,兑水600 kg/hm2稀释喷雾,每处理重复3次,随机区组排列,每个小区面积为20 m2。在水稻细菌性条斑病发生初期(水稻孕穗期)第1次施药,12 d后进行第2次施药,连续施药2次,采用3WBD-16型背负式电动喷雾器(台州市路桥喷农喷雾器有限公司生产,工作压力0.2~0.4 MPa)进行喷雾。
1.9.3 调查及统计方法 于第1次施药前(8月7日)调查病情基数,在第2次用药后第11 d(8月30日)调查防效。采用五点(对角线)取样法进行取样,每点取5丛,每丛调查20株,每株调查水稻上部2张叶片。病害的分级标准和防效统计方法参照《农药 田间药效试验准则(二)第 105部分:杀菌剂防治水稻细菌性条斑病》[13],病情指数=Σ(病级数×该病级病叶数)/(调查总叶数×9)×100,防治效果(%)=[1-(空白对照区药前病情指数×处理区药后病情指数)/(空白对照区药后病情指数×处理区药前病情指数)]×100。
1.10 数据统计与分析
试验数据统计分析采用GraphPad Prism 和Excel软件,采用Duncan新复极差法检验处理间差异显著性。
2 结果与分析
2.1 生防细菌的筛选和初步鉴定
从采集的36份土样中共计分离到549株细菌。以水稻细菌性条斑病菌Rs105菌株为靶标菌,通过平板对峙试验发现有20株细菌对Rs105具有显著的拮抗效果(拮抗圈直径≥2 cm),16S rDNA鉴定结果显示有10株属于芽胞杆菌,其中菌株ST15的拮抗活性最高,拮抗圈直径为(2.88±0.06)cm(表1)。
2.2 菌株ST15的鉴定
在NA平板上,菌株ST15单菌落为乳白色,扁平,圆形或近圆形,直径1.0~3.0 mm,菌落表面皱缩,边缘整齐(图1A);挑取24 h的培养物,利用透射电镜进行观察,菌体为杆状,直径约0.5~0.6 µm,长度约1.5~2.0 µm(图1B);挑取48 h的培养物,利用透射电镜进行观察,菌体大部分转化为芽胞,芽胞呈梭状,直径约0.5~0.6 µm,长度约1.0~1.5 µm(图1C)。利用Biolog系统测定的生理生化结果表明,革兰氏染色阳性,接触酶和氧化酶均为阴性,能够利用明胶、果胶、蔗糖、D-甘露醇等,不能利用α-D-乳糖、L-乳酸、D-苹果酸等,耐受8% NaCl(表2)。对照《伯杰氏细菌鉴定手册》[14],ST15具有高地芽胞杆菌的生理生化特性。

表2 菌株ST15的理化试验分析结果Table 2 Physiological and biochemical characters of strain ST15
以菌株 ST15的基因组 DNA为模板,扩增的gyrB基因片段为 930 bp,并提交到了 NCBI数据库(Genebank:OM575083)。基于获得的gyrB基因序列和GenBank数据库中的序列,利用MEGA 7.0软件对菌株ST15进行进化树分析,结果表明该菌株与高地芽胞杆菌Bacillus altitudinisSCU11聚合在一起(图2)。综合上述试验结果,生防菌株ST15应为高地芽胞杆菌。

图2 基于gyrB基因序列的菌株ST15系统发育分析Fig. 2 Phylogenetic tree of strain ST15 based on the partial sequence ofgyrBgene
2.3 菌株ST15的抑菌谱测定结果分析
通过平板对峙试验发现,菌株ST15对水稻黄单胞菌表现较强拮抗活性,其中ST15对7株水稻白叶枯病菌菌株(YN24、FUJ、SCYC-6、YN7、GD414、YN1、PXO99)的拮抗圈直径为 2.65~3.97 cm,对 6株水稻细菌性条斑病菌菌株(Rs105、Xoc-192、Xoc-197、Xoc-S、Xoc-M、Xoc-W)的拮抗圈直径为1.50~2.93 cm。同时,发现ST15对梨火疫病菌LHY和野油菜黄单胞菌野油菜致病变种Xcc表现一定的拮抗活性,但对其他病原细菌的拮抗活性很弱(图3)。

图3 菌株ST15对21株病原细菌的拮抗活性测定Fig. 3 Determination of antibacterial activity of strain ST15 against 21 pathogens
2.4 菌株ST15无菌滤液的抑菌活性
拮抗试验表明,菌株ST15的无菌发酵滤液、1 mg/mL噻唑锌和10 μg/mL噻霉酮溶液对水稻白叶枯病菌POX99和水稻细菌性条斑病菌Rs105均具有拮抗活性,其中ST15无菌发酵滤液对POX99的拮抗圈直径为(2.35±0.05)cm,分别是1 mg/mL噻唑锌溶液和10 μg/mL噻霉酮溶液的1.64和1.52倍;ST15无菌发酵滤液对Rs105产生的拮抗圈直径为(2.08±0.13)cm,分别是1 mg/mL噻唑锌溶液和10 μg/mL噻霉酮溶液的1.54和1.32倍(图4)。

图4 菌株ST15无菌滤液、噻唑锌与噻霉酮对水稻黄单胞菌的拮抗活性测定Fig. 4 The antagonistic activity of ST15 sterile filtrate, zinc thiazole and benziothiazolinone againstX.oryzae
2.5 菌株ST15次生代谢抗菌活性物质的稳定性
与未处理的对照相比, ST15产生的次生代谢拮抗活性物质对热处理(30 ℃~100 ℃)、酸碱(pH 3.0~11.0)和紫外光照射均表现较好的稳定性(图5A、B、D)。另外,胰蛋白酶、胃蛋白酶和蛋白酶K处理也不影响ST15无菌发酵滤液的抑菌活性(图5C)。
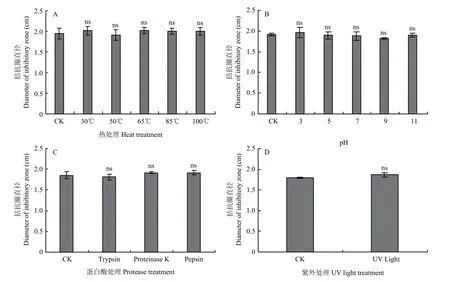
图5 温度、蛋白酶、pH和紫外光对菌株ST15 无菌滤液抗菌活性的影响Fig. 5 Effects of temperature, protease, pH and UV on antibacterial activity of ST15 sterile filtrate
2.6 菌株ST15对水稻幼苗的促生作用
与清水对照相比,ST15菌悬液处理不影响水稻种子的发芽率,但对水稻根和幼苗具有显著的促生作用。ST15菌悬液处理种子72 h后,水稻根长为(3.34±0.69)cm,较对照增长了30.47%,对根具有极显著促生作用(P<0.01);ST15 菌悬液处理的水稻芽长为(1.61±0.39 cm),较对照增长了6.62%。ST15菌悬液处理种子7 d后,幼苗根系较对照浓密,并且开始有叶片展开,多处于1叶或1叶1心期,而对照处理的水稻还未有叶片展开(图6)。

图6 菌株ST15对水稻的促生效果Fig. 6 Growth-promoting effect of strain ST15 on rice
2.7 菌株ST15对3种化学杀菌剂的耐受性
试验结果表明,相较于水稻细菌性条斑病菌菌株Rs105,生防菌株ST15对3种化学杀菌剂表现较强的耐受性;除三氯异氰尿酸外,各个浓度的 ST15在噻霉酮和噻唑锌平板上均能生长,这表明菌株 ST15可与化学杀菌剂联合使用(图7)。

图7 菌株ST15对三种化学农药的耐受性Fig. 7 Tolerance of strain ST15 to three chemical pesticides
2.8 菌株ST15生防菌剂对水稻细菌性条斑病的防控效果
田间试验结果表明(表3),连续施药两次,ST15生防菌剂10和15 L/hm2剂量处理的防效分别为(55.05±4.67)%和(63.51±3.28)%,高剂量处理与化学药剂3%噻霉酮悬浮剂的防效相近,3个处理之间差异不显著(P>0.05)。

表3 生防菌剂ST15对水稻细菌性条斑病的田间防效Table 3 Control effect of ST15 biocontrol agent on rice bacterial leaf streak in field
3 讨论
本研究从梨树根际土壤分离筛选到1株高地芽胞杆菌ST15,其对水稻黄单胞菌具有较强的拮抗活性,对野油菜黄单胞菌野油菜致病变种和梨火疫病菌也表现一定的拮抗活性,但是对测试的其他6种病原细菌拮抗活性很弱,对前期试验测定的多种病原真菌也不具有拮抗活性。近期,黄梦桑等[15]从辣椒根际筛选的高地芽胞杆菌181-7对水稻黄单胞菌具有较强的特异性拮抗活性,对测定的其他病原细菌和病原真菌的拮抗活性很弱,与ST15的细菌拮抗谱存在差异,两者对真菌拮抗活性均很弱。但Sunar等[6]从雪莲根际分离到的高地芽胞杆菌BRHS/S-73对白绢病菌、瓜亡革菌、菜豆根腐病菌和立枯丝核菌等病原真菌均具有较好的拮抗活性。这说明来源不同的高地芽胞杆菌株系间的抗菌谱和抑菌机制存在差异。另外,本研究发现,尽管ST15对不同来源和致病力的水稻细菌性条斑病菌和水稻白叶枯病菌菌株均表现较强的拮抗活性,但病原菌菌株间对ST15的敏感性存在差异,菌株ST15对强致病力株系Xoc-S和中等致病力株系Xoc-M的拮抗活性显著强于弱致病力株系Xoc-W(P<0.05),并且ST15对水稻白叶枯病菌菌株的整体抑制活性强于水稻细菌性条斑病菌。
相比化学农药,芽胞杆菌生物农药的持效期长,但速效性差。将芽胞杆菌与化学杀菌剂交替或混合使用可以提高对作物病害的综合防治效果,减少化学农药用量。吉沐祥等[16]将枯草芽胞杆菌B.subtilisDJ-6与吡唑醚菌酯混合使用,用于防治草莓枯萎病,防效良好且稳定。本研究测定了菌株ST15对3种主要的化学杀细菌剂的耐受性,发现相较于水稻细菌性条斑病菌,菌株ST15对3种化学农药均表现较强的耐受性,这使得该菌可以与化学杀菌剂联合使用[17]。菌株ST15与化学农药的交替及混合使用技术还需要进一步的研究,以便为该菌株的田间应用提供理论指导。
生防菌通过产生各种抗菌活性物质来达到抑菌目的,而抗菌活性物质的稳定性是影响生防菌株成功开发应用的关键因素。众所周知,芽胞杆菌能够合成并分泌特有的抗菌物质,在芽胞杆菌防控植物病害方面发挥重要作用,主要包括脂肽类化合物、聚酮类化合物和多肽类化合物[18]。已有大量研究显示,脂肽类化合物的理化性质较为稳定,对氯仿等有机溶剂有一定的耐受力,抗紫外线,对蛋白酶类的处理不敏感[19-21]。本研究生防菌株ST15的无菌发酵滤液对水稻黄单胞菌的拮抗活性显著强于两种浓度的化学药剂,并且对高温、蛋白酶、酸碱(pH 3.0~11.0)及紫外光处理均表现较好稳定性。由此推测,菌株ST15产生的拮抗活性物质可能是脂肽类化合物,其抗菌活性物质有待进一步分离鉴定。
芽胞杆菌除了具有抑制病原菌的能力,还具有促进植物生长的特性。早先的研究报道,芽胞杆菌通过产生细胞分裂素(CTK)、赤霉素(GA)、1-氨基环丙烷-1-羧酸(ACC)脱氨酶、铁载体、吲哚-3-乙酸(IAA)、磷增溶和固氮来促进植物生长[22-24]。Goswami和Deka[7]发现高地芽胞杆菌MS16对芥菜幼苗的生长有促生作用,包括种子发芽率、幼苗活力、根长和地上部干鲜重。Wang等[24]观察到,接种产ACC脱氨酶的芽胞杆菌能显著促进辣椒幼苗的生长。本研究发现菌株ST15对水稻有一定的促生作用,经菌株ST15处理过的水稻的根长显著增长,根系更加茂密。这表明菌株ST15还具有作为生物肥料开发的巨大潜力,不过其促生机制尚不明确,有待进一步研究。
张荣胜等[25]分离得到的解淀粉芽胞杆菌B. amyloliquefaciensLX-11在大面积示范试验中对水稻细菌性条斑病的防效达60.2%,基于LX-11研制的水剂“叶斑宁”获得正式农药产品登记,目前已经大面积应用于生产。黄梦桑等[15]的盆栽试验表明,高地芽胞杆菌181-7对水稻细菌性条斑病的预防效果为59.52%。本研究筛选的高地芽胞杆菌ST15对水稻细菌性条斑病菌的田间试验防治效果为(63.51±3.28)%,与LX-11和181-7的防效相近,并且与化学杀菌剂3%噻霉酮悬浮剂的防效相当。这些结果表明,ST15在生产上具备防治水稻细菌性病害的能力,具有良好的应用开发潜力。目前,关于ST15生防菌剂研究工作仍在进行中,后期还需对ST15的发酵体系进行优化,从而提高菌体密度、芽胞产率和拮抗活性物质的产量;建立ST15生防菌剂的田间应用技术,进一步提高其对水稻细菌性条斑病等细菌病害的防治效果。
