机械力学刺激诱导韧带肌腱异位骨化形成机制的研究进展
2022-04-22朱正亚刘少喻
朱正亚,刘少喻
中山大学附属第七医院骨科,广东 深圳 518107
韧带和肌腱异位骨化(heterotopic ossification of the tendon and ligament,HOTL)是指韧带或肌腱中形成异位骨,大多被认为是纤维结缔组织损伤再修复失败的结果。HOTL 的病因尚不明确,遗传、损伤刺激、异常机械应激、年龄、基础代谢疾病等是其危险因素[1,2]。异常机械刺激如何加速HOTL 进程不十分明确。一定负荷和频率的反复运动能够改变韧带成纤维细胞生存微环境并诱导干/祖细胞向成软骨/成骨方向分化,可能是韧带异位骨化形成的重要因素之一[3,4]。HOTL 是一个动态的病理过程,包括损伤、炎症反应、干/祖细胞募集、干/祖细胞向软骨、骨细胞分化,最后导致异位骨化形成。本文从人体解剖结构、动物模型及细胞反应3 个层面综述异常力学刺激引发HOTL 的病理机制,以期为更好地理解HOTL 的形成和进一步研究厘清思路。
1 HOTL 形成的人体解剖基础与病理机制
1.1 脊柱韧带骨化及病理机制
脊柱韧带骨化(ossification of the spinal ligament,OSL)多发生于后纵韧带和黄韧带。研究认为,脊柱韧带骨化分布特点与脊柱不同节段应力变化有关[5]。OSL 多发生于应力集中部位,后纵韧带骨化(ossification of posterior longitudinal ligament,OPLL)主要发生于颈椎(C5节段),其次是中、上胸椎;而黄韧带骨化(ossification of the ligament flavum,OLF)则以下胸椎为主,颈椎或腰椎OLF 相对较少。解剖学上的不同导致韧带活动范围、使用频率有较大差异[6]。
一项OPLL 术后长期临床随访研究表明,颈椎稳定性不佳致使椎间活动异常,后纵韧带局部应力增加,从而促使混合型OPLL 向连续型发展[7]。影像学检查显示,OPLL 患者接受颈椎单开门手术后,由于后柱不稳导致骨化韧带肥厚,而椎板成形术联合内固定融合术对于脊柱稳定性影响相对较小,能够延缓OPLL 的进展[8,9]。因此行脊柱手术治疗时,生物力学因素应当被纳入考虑范围。一项针对颈椎OPLL 患者椎间盘应力分布的生物力学研究发现,OPLL 进展速率与对应节段椎间盘异常应力强度呈正相关,提示椎体节段间应力分布不均可加速OPLL 的自然病程[10,11]。尽管颈椎后纵韧带和前纵韧带相互协调、共同维持颈椎稳定性,但颈部OPLL 的病例报道明显多于前纵韧带骨化(ossification of anterior longitudinal ligament,OALL)。日常生活中,颈椎PLL处于拉伸应力状态(颈部过曲)的时间明显多于ALL。且二者解剖学存在一定差异,后纵韧带沿椎体一直延续至骶骨,在头颈交界处最粗、最宽,腰椎变细变窄。而前纵韧带在颈椎较细,后续延伸逐渐变粗、变宽,这些解剖学差异导致颈椎OALL和OPLL发生率的不同[12]。
胸椎、腰椎部位OPLL 发生率明显低于颈椎,出现这一现象的原因是颈椎活动度相对较大,而胸椎有胸廓保护限制了其在屈伸、侧屈及旋转等方向的活动。胸椎OLF 导致胸椎椎管狭窄具有明显的节段分布特点,绝大多数发生于下胸椎[13]。研究表明,OLF 的发生部位与下胸椎黄韧带的应力分布密切相关。下胸椎由于缺乏胸廓的有效支撑且位于胸椎生理性后弯及腰椎前弯的移行区域,此阶段韧带活动度相对较大,容易在后柱形成应力集中区,导致OLF 的发生[5,14,15]。有学者认为OLF 的进展速率和发生部位与胸椎关节突关节的方向以及旋转应力有关。由于胸椎关节突关节呈近似矢状位排列,且在下胸椎无肋骨限制其活动,在T11、T12区域黄韧带承受更大的旋转应力刺激,因而更容易发生骨化[16]。
1.2 牙周韧带骨化及病理机制
施加在牙上的正畸力会产生复杂的机械加载模式,包括压缩、拉伸和剪切应力,进而在牙周组织中引起复杂的生物反应[17]。牙齿-牙周韧带-牙槽骨复合体共同作用,用于对抗消除咀嚼或正畸牙移动过程中产生的机械载荷。牙周韧带(periodontal ligament,PDL)是一种纤维关节,可通过调节骨组织形成与重塑来响应机械应变。PDL 应力侧与张力侧不均时,局部韧带组织出现血管化表现,细胞和细胞外基质对机械应力表现出适应性重组反应。当PDL 持续性受压时,局部血流紊乱,细胞凋亡,随后玻璃化组织被移除,临床表现为牙槽骨骨质破坏。而当PDL 持续拉伸时,细胞有丝分裂速率加快、局部纤维出现软骨化生,随后出现异位骨化[18]。总之,在牙周组织的局部微环境中,PDL 的机械应力导致细胞骨架发生变化,细胞外基质蛋白的构型改变及促炎细胞因子的产生,通过成骨与破骨之间的协同作用,最终导致异位骨化形成[17,19]。
1.3 肌腱异位骨化及病理机制
肌腱与韧带在解剖学与生理功能稍有区别,韧带多是骨与骨之间的连接,主要维持身体的静态稳定性,而肌腱连接骨与肌组织,是骨骼肌带动骨运动的桥梁,需传导更强的机械力。
部分学者认为,高频率、超负荷的力学机械刺激是引起肌腱发生局部损伤的始动因素,组织损伤后,损伤部位募集大量炎性因子,引发后续损伤、修复、成骨一系列级联反应[20,21]。因此肌腱异位骨化部位往往发生于反复摩擦、活动范围较大的部位,如肩袖肌腱群、跟腱、屈肌腱等[1,20,22]。组织学上,反复机械刺激的肌腱呈现出损伤后难以自愈的状态,其特征为成纤维细胞受损、细胞增生、大量蛋白多糖沉积和胶原基质降解,修复部位出现纤维软骨化生[23]。
2 力学诱导韧带异位骨化的动物模型
动物模型是研究疾病在体内发生发展的合理化替代物,由于机械力学刺激对于细胞成骨分化诱导需要较长时间培养才可以观察到病理表型变化,因此目前建立的单纯力学加载诱导HOTL 的动物模型较少。
Tsukamoto 等[24]设计一种循环拉伸大鼠尾部脊椎韧带的装置,选取14~16 周龄Wistar 大鼠,将大鼠骨盆绑在移动床边缘,用钢钉插入第8 尾椎将其固定在远端固定器上。大鼠体部在移动床的牵引下以1 Hz 频率前后运动,每次牵引运动可以将两倍于大鼠体重的拉伸力集中于鼠尾前部节段(2~5 尾椎)。影像学结果显示,应力集中区的脊柱韧带发生HO,组织学染色表明拉伸部位有大量成熟软骨细胞样细胞增殖,拉伸时间越长,这些病理改变越明显。
Petri 等[25]构建一种体内肌腱拉伸动物模型用于评估成骨分化倾向,将绵羊股四头肌肌腱取出后两端固定于小型固定舱内,机械刺激组的肌腱两端分别与股四头肌和髌骨上端缝合,非机械刺激组仅与股四头肌端缝合。股四头肌端固定舱内有预先留置的髂骨松质骨与股四头肌腱连接,当股四头肌发生收缩时,机械刺激组肌腱会受到纵向牵引力。术后6 周肌腱Safranin O/von Kossa 染色结果表明,机械刺激组成骨范围更广并且矿化基质沉积更多。
以上动物研究能够较真实地反映外界刺激对于生物体的整体影响,但直接将力学刺激加载于动物肢体来建立HOTL模型具有耗时长、操作复杂和失败率高等缺点。因此,更加合理的动物模型有待设计。
3 机械刺激对细胞成骨分化的调控
3.1 拉伸应力诱导成纤维细胞成骨分化
韧带组织主要由成纤维细胞构成,目前已有多项关于韧带成纤维细胞的成骨特性的研究,包括拉伸、压缩、流体剪切力、机械振动等多种应力方式对细胞成骨分化的作用,但具体机制仍不完全清楚。内质网应激反应(endoplasmic reticulum stress,ERS)和连接蛋白43(Cx43)是力学刺激引起成纤维细胞成骨分化的研究热点。ERS 在骨骼发育和成骨细胞增殖分化过程中起着重要作用[26,27]。多项报道表明,力学刺激诱导成纤维细胞向成骨方向分化可能与ERS 有关[28,29],当拉伸应力或流体剪切力作用于成纤维细胞时,ERS 的主要转导分子蛋白激酶R 样内质网激酶(PERK)得到活化,MAPK/PERK 通路被异常激活,导致成纤维细胞向成骨方向分化[27,30]。Yang 等[31]研究发现牙周韧带细胞的反复压缩应力可以上调PERKeIF2α-ATF4 途径介导的内质网应激反应,在牙周膜骨化过程中发挥重要调节作用。此外,当OPLL 患者后纵韧带成纤维细胞接受拉伸刺激时,Cx43 相关的NF-κβ炎症信号通路被激活[32],引发局部炎症反应,用Cx43 siRNA 或NF-κβ抑制剂可显著对抗拉伸应力刺激诱发的成骨分化作用[33,34]。
基于上述结果,Cx43 与ERS 共同响应拉伸应力引起HOTL 的交互作用机制被进一步研究,Cx43 部分地通过激活MAPK/PERK 信号通路来促进韧带成纤维细胞的成骨分化,对Cx43 表达的操控可相应改变ERS[30]。因此,通过敲除Cx43影响MAPK/PERK 通路,可能是逆转机械应力诱导韧带成纤维细胞成骨分化的有效方法之一。
3.2 拉伸、压缩应力刺激诱导MSCs 成骨分化
软骨内异位骨化过程中,间充质干细胞(MSCs)错误分化是十分关键一步,多条信号通路参与了干细胞的成骨分化[1,4]。当韧带发生损伤或过度拉伸应力刺激时,驻留的或招募的MSCs 向损伤部位趋附,发生一系列复杂细胞信号级联反应引起软骨内成骨。目前已检测到HOTL 有多种干细胞来源,包括间充质干细胞、血管内皮细胞、神经内皮细胞等[35~37]。
有文献报道,在没有任何成骨诱导因子作用下,单独对MSCs 施加拉伸或压缩刺激足以诱导其向软骨/骨方向分 化[38~40]。Huang 等[41]将MSCs 种植于3D 水凝胶支架中,对支架施加正弦性拉伸-压缩循环刺激,MSCs 接受间接力学刺激,RNA 测序表明TGF-β1 基因过表达。纤维蛋白水凝胶支架能够诱导负载的干细胞向成纤维细胞方向分化,在该支架上加入适量的外源性TGF-β3,MSCs 会沿着肌源性途径分化[42,43]。而当拉伸力-压缩力正弦性循环作用于纤维蛋白水凝胶后,MSCs 接收间接传导的力学刺激并表现出对外源性TGF-β3 的高响应,MSCs 呈现出强烈的成骨方向分化[44]。因此循环拉伸-压缩刺激诱导干细胞成骨分化可能与TGF-β通路有关[41]。
3.3 力学机械刺激加速基因缺陷突变细胞成骨分化
TTW(tiptoe walking)小鼠异位骨化模型是一种自然发生的突变体,其病理表型与人类OPLL 非常相似[45]。据报道,TTW 小鼠异位骨化表型是由编码核苷酸焦磷酸酶(ENPP1)基因无义突变引起(甘氨酸568 终止)。ENPP1 作为一种胞外酶,在调节磷酸盐(Pi)和焦磷酸盐(PPi)平衡具有重要作用。PPi 是一种强骨化抑制剂,能够有效抑制异位骨形成,当Pi 与PPi 代谢异常时,小鼠会表现出全身多处软骨内骨化,包括OPLL 形成。Nakajima 团队[45]以TTW 小鼠为研究对象,将其后纵韧带细胞种植于Flexcell 细胞拉伸仪,以特定参数对细胞施加拉伸应力和静息休息交替作用,结果表明OPLL 细胞接受循环拉伸应变后RSPO2、HAO1 和CCDC91 等OPLL 易感基因上调,而同样的力学刺激作用于正常后纵韧带细胞并未引起上述基因改变。
进行性骨化性纤维发育不良(fibrodysplasia ossificans progressiva,FOP)是一种罕见的韧带软骨内异位骨化性疾病,该疾病由骨形态发生蛋白(bone morphogenetic protein,BMP)1型受体Acvr1 基因突变引起,导致BMP 传导通路过度激活,最终引起全身多处纤维结缔组织异位骨形成,FOP 患者或动物模型即便遭受轻微的皮肤、韧带损伤即会呈现出较为强烈的成骨分化倾向[46]。流行病学显示,几乎所有典型的FOP 病例发生了Acvr1 功能获得性突变(R206H;c.617G>A)。Stanley团队[47,48]将Acvr1R206H/+细胞种植于水凝胶材料,对细胞间接施加压缩应变。机械信号传导至Acvr1R206H/+细胞后,细胞内机械转导效应因子RhoA/ROCK 和YAP1 活性增加,Acvr1R206H/+细胞表现出对BMP 成骨信号高响应,与静息Acvr1R206H/+细胞相比,接受间接力学刺激的细胞表现出更强的成骨分化能力。
随着基因编辑技术的发展,越来越多基因编辑动物模型被应用。既往研究表明,适当的外界力学刺激可以增加Mkx(+/+)大鼠腱细胞中胶原的产生,促进MSC 向腱细胞分化。而Suzuki 等[49]应用CRISPR/Cas9 技术将大鼠Mkx 基因敲除,获取Mkx(−/−)基因缺陷大鼠腱细胞,实验结果表明,在接受同样力学刺激的Mkx(−/−)大鼠腱细胞中软骨形成标记物高表达,Micro-CT 证实机械刺激的Mkx(−/−)大鼠早期即出现跟腱HO,这一机械信号促骨化作用可能与Hedgehog 信号异常响应有关[50]。
4 总结
HOTL 作为一种常见致残性疾病备受临床医师的关注,目前普遍认为,局部力学刺激引起HOTL 是软骨内成骨过程。该病理过程包括局部炎性因子募集、干/祖细胞向软骨/骨分化等(图1)。力学刺激在HOTL 形成过程中的机制被广泛研究,但许多问题鲜有报道,如:不同类型机械应力引起HOTL 的病理机制是否相同?机械应力是通过何种途径传递至韧带细胞和腱细胞内引起基因改变?总之,HOTL 是一个多因素调控、多种细胞参与的复杂的病理过程,很难通过单一理论去解释,需探寻出各病因之间的内在联系,进而设计合理的治疗策略。
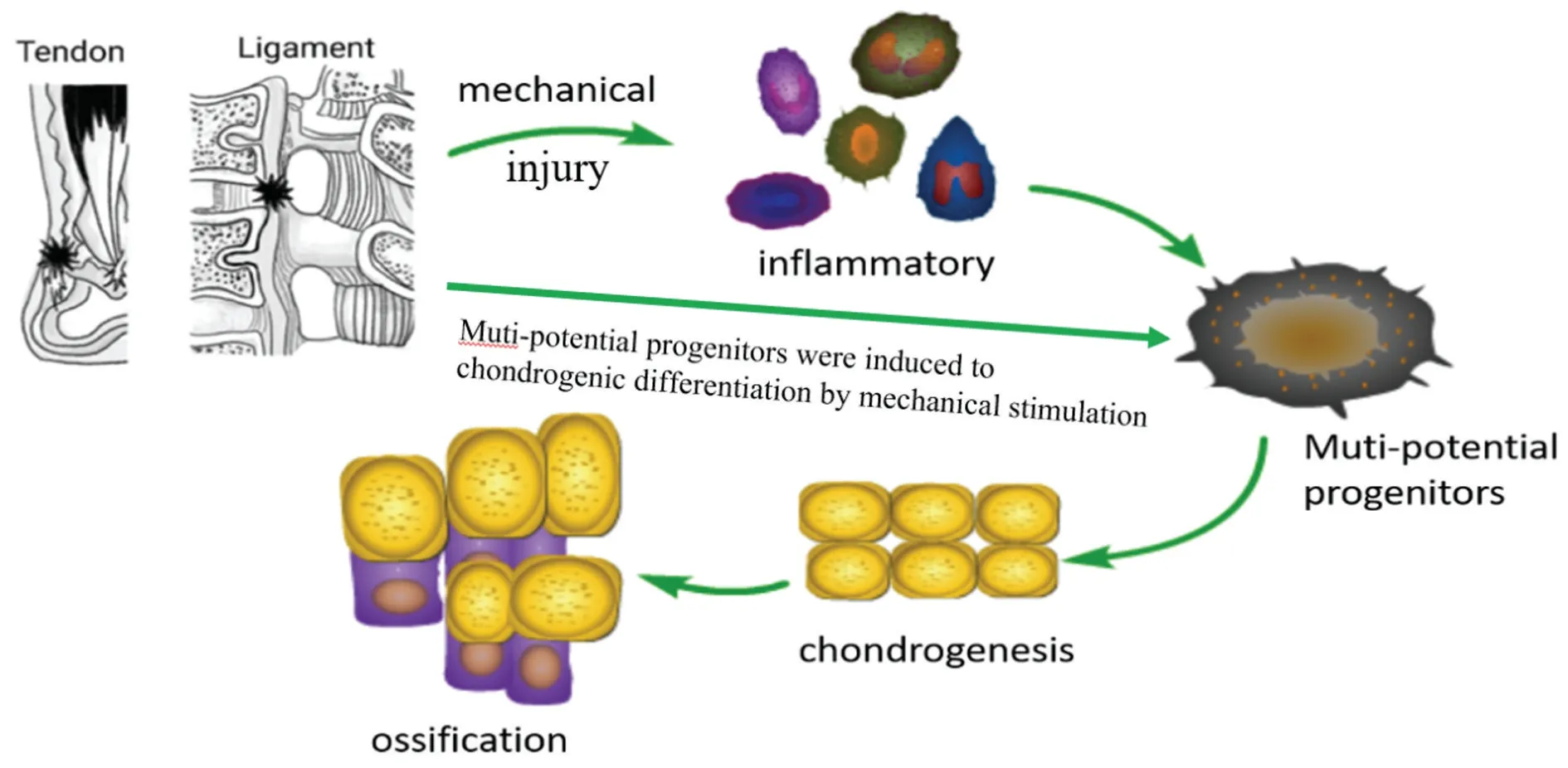
图1 机械刺激诱导肌腱、韧带异位骨化形成示意图(软骨内成骨模式图)当力学刺激/损伤因素加载至肌腱、韧带组织时,局部引起炎症反应,同时大量驻留多能干细胞(祖细胞)和募集的多能干细胞(祖细胞)集中到应力集中区。在力学刺激下多能干细胞(祖细胞)表现出向软骨的错误分化,最终形成软骨内异位骨化
