不同产地卤虫幼体对云龙石斑鱼幼苗生长和抗胁迫能力的影响
2022-04-21刘晓翠邓洪刚于学权朱亚光王鹏飞隋丽英
刘晓翠,邓洪刚,于学权,朱亚光,王鹏飞,隋丽英
(1. 天津科技大学海洋与环境学院,天津300457;2. 天津食品集团立达海水资源开发有限公司,天津300450;3. 西藏双湖县普若岗日生物科技有限公司,那曲853317)
石斑鱼是具有重要经济价值的海洋鱼类,近年来我国石斑鱼养殖产量逐年上升[1],但由于石斑鱼苗种畸形率高、对环境的应激反应强烈、自相残杀严重、病害多,因此工厂化培育难度大[2-3].云龙石斑鱼是云纹石斑鱼(♀ Epinehelus moara)与鞍带石斑鱼(♂Epinehelus lanceolatus)杂交而成的新品种,具有耐低温、肉质鲜美的特点,其生长快、抗病能力强,是市场认可度较高的优质杂交新品种.n-3高不饱和脂肪酸(n-3HUFA,C>20)主要包括EPA和DHA,是细胞膜磷脂的重要成分,在细胞膜流动性、脂质性能、生殖发育、脂质代谢和免疫功能等方面发挥重要作用.但是,海洋鱼虾蟹类自身不能合成HUFA或合成能力有限,需要在饲料或饵料中补充[4-5].研究[6]表明,饵料中一定水平的n-3HUFA(1.47%~1.70%)可显著提高杂交石斑鱼(♀Epinephelus fuscoguttatus×♂Epinephelus lanceolatu)幼鱼的生长速度、非特异性免疫力和抗病力,抑制炎症反应.饲料中一定水平的n-3HUFA(1.27%~1.42%)对斜带石斑鱼(Epinephelus coioides)的增重率、饵料系数和蛋白质利用率都有显著促进作用,且石斑鱼肌肉中的n-3HUFA含量随饲料n-3HUFA水平的增加而增加[7].
卤虫(Artemia)具有使用方便、适口性好和营养较为丰富等特点,是水产经济动物苗种重要的开口饵料[8].全球商业化卤虫卵生产原料主要来源于中国、美国、俄罗斯和哈萨克斯坦等国的盐湖或日晒盐场.我国是卤虫卵资源采收、加工流通和使用的主要国家,卤虫卵资源主要分布在环渤海盐田以及青海、新疆、西藏等地的盐湖中.由于生物学和环境因子(如盐度、温度和饵料等)的差异,不同产地的卤虫卵径和卤虫幼体的大小、营养组成和含量有较大差别,甚至同一产地、不同时间采收的卤虫卵,其营养水平也有所不同[9-11].西藏其香错盐湖卤虫个体大、颜色深红、富含EPA、孵化率高,孵化后幼体与卵、空壳分离好,近年来产量较大且稳定.中亚地区咸海卤虫卵市场价位具有竞争力,在国内苗种培育中广泛使用.咸海卤虫幼体EPA含量虽然较高,但与其香错卤虫幼体相比仍有一定的差距.
卤虫是非选择性滤食动物,可通过生物包裹的方式将水产苗种所需要的特殊成分(如HUFA、色素、免疫增强剂等)快速包裹于卤虫肠道,并通过摄食有效送达水产动物体内,因此缺乏水产动物必需脂肪酸的卤虫可以通过强化富含n-3HUFA的产品(如鱼油、裂殖壶藻等)实现其在海水育苗中的有效应用[12].
本研究以西藏其香错卤虫幼体、裂殖壶藻强化的咸海卤虫幼体和不强化的咸海卤虫幼体投喂云龙石斑鱼幼苗,分析比较不同产地卤虫幼体和营养强化对石斑鱼幼苗生长、肌肉脂肪酸含量、抗氨氮胁迫和对弧菌攻毒的耐受力,旨在为不同产地卤虫幼体和营养强化在石斑鱼育苗中的有效应用提供参考.
1 材料与方法
1.1 卤虫幼体孵化与营养强化
本研究所用西藏其香错卤虫卵、中亚地区咸海卤虫卵分别由西藏双湖县普若岗日生物科技有限公司、天津食品集团立达海水资源开发有限公司提供.卤虫卵孵化条件:温度28℃,盐度20~30g/L,光照强度2000lx,连续充气.孵化24h后收集卤虫幼体,用相同盐度稀释卤水冲洗,备用.
咸海卤虫幼体收集后暂养6h,用裂殖壶藻(青岛越洋有限公司)进行营养强化.卤虫幼体强化条件:温度25℃,卤虫幼体密度150~200个/mL,裂殖壶藻剂量0.2g/L,强化时间6~12h.
1.2 石斑鱼养殖条件
石斑鱼苗种培育在天津食品集团立达海水资源开发有限公司进行.将石斑鱼幼苗分为3组,每组2个平行池,分别投喂其香错卤虫幼体、裂殖壶藻强化咸海卤虫幼体和未强化的咸海卤虫幼体,连续投喂30d.单位养殖水体40m3,每个养殖池中布卵300g.养殖水体盐度25g/L,温度25℃,溶解氧(DO)含量6~7mg/L.每天分别于09:00和15:00投喂卤虫幼体,每池每天的平均投喂量为32×106个卤虫幼体.
1.3 指标分析
1.3.1 卤虫幼体和石斑鱼肌肉脂肪酸组成及含量测定
将卤虫幼体在冷冻干燥机(德国Marin Christ公司)中干燥.精确称取冻干样品0.03g,加入1mg脂肪酸内标C20:2n-6(美国NU-CHEK PREP公司).分别以V(甲醇)﹕V(甲苯)=3﹕2、V(氯乙酰)﹕V(甲醇)=1﹕20的比例配制混合试剂,各加入5mL,充分匀浆后煮沸1h进行脂肪酸甲酯化,用正己烷萃取脂肪酸甲酯并浓缩.用气相色谱仪(日本Shimadzu公司)进行脂肪酸组成和含量的测定[9].
养殖结束后,每组随机取10尾鱼,用无菌海水冲洗去除体表附着物,获取石斑鱼肌肉并进行冷冻干燥.样品处理及脂肪酸组成和含量测定方法同上.
1.3.2 石斑鱼幼苗生长测定
育苗结束后,每组随机取10尾鱼,测定并计算平均体长、平均体质量和出苗率.
1.3.3 胁迫实验
分别从每组中随机取石斑鱼若干,暂养2d.暂养条件同养殖条件,投喂颗粒饲料(三通生物工程有限公司).暂养结束后,分别从各箱中随机取20尾鱼,进行弧菌攻毒和氨氮胁迫实验.
哈维氏弧菌(Vibrio harveyi MCCC1A03218)购于自然资源部第三海洋研究所,有效感染量总计5×107mL-1.根据预实验结果,氨氮胁迫NH4Cl-N质量浓度总计12mg/L,计算得到非离子氨NH3-N质量浓度总计0.95mg/L[13].胁迫期间水体盐度20g/L,温度(25±1)℃,DO 6~7mg/L,单位水体10L.弧菌攻毒和氨氮胁迫时长均为72h,在此期间不投喂饲料,记录每组石斑鱼的最终死亡数.
1.4 数据统计学分析
利用SPSS 25.0统计分析软件对数据进行ANOVA单因素分析和Duncan’s多重比较分析.所有数据以“平均值±标准差”表示,不同字母表示组间具有显著差异(P<0.05).
2 结果与分析
2.1 卤虫幼体脂肪酸组成和含量
卤虫幼体脂肪酸组成及含量(以干质量计)见表1.其香错卤虫幼体不饱和脂肪酸(PUFA,C>18)和n-3HUFA含量最高,分别为125.73、31.78mg/g,EPA含量为30.53mg/g,远高于其他2种卤虫幼体.咸海卤虫幼体PUFA含量最低,为40.40mg/g.强化后咸海卤虫幼体DHA含量有所提高,为2.31mg/g.
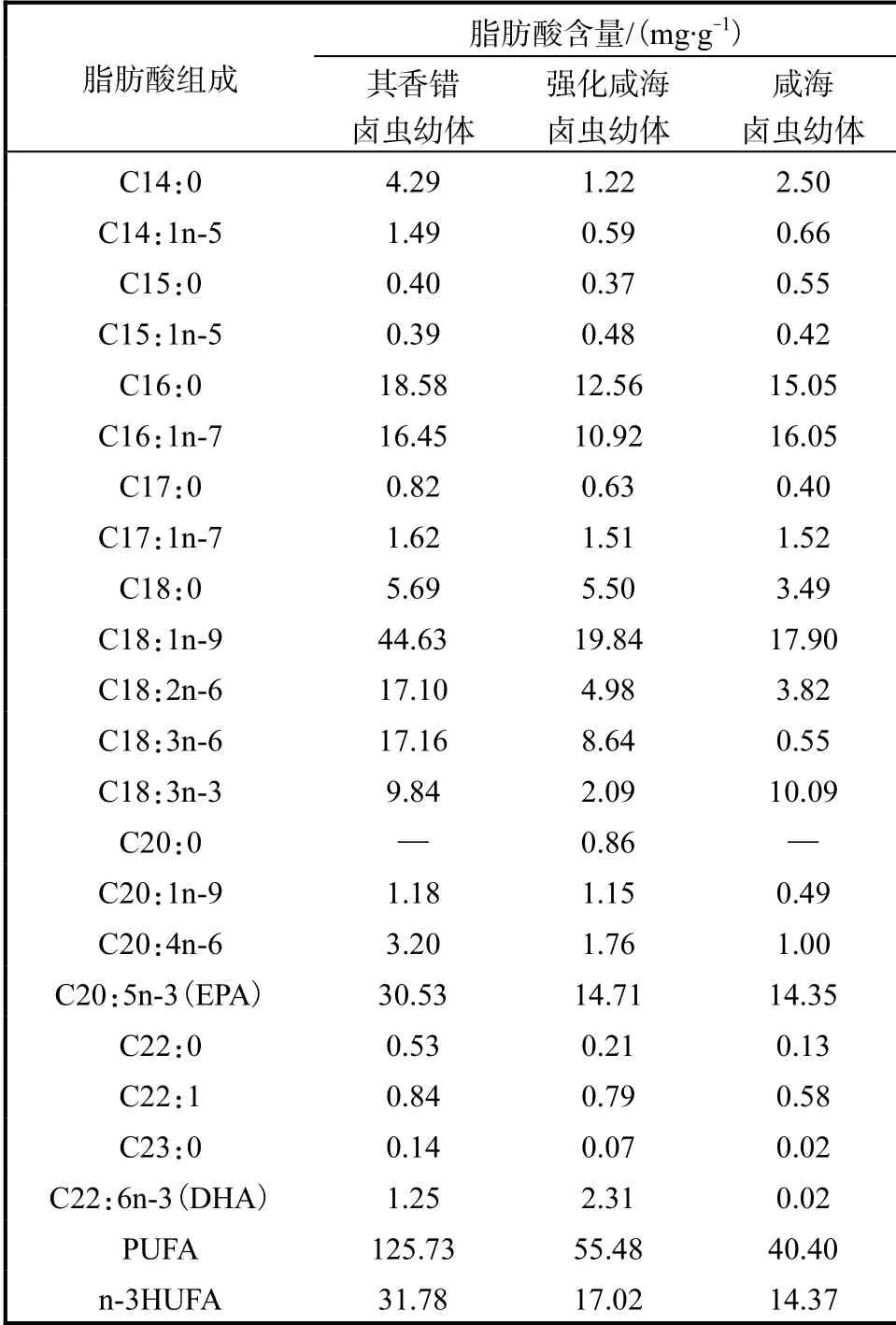
表1 卤虫幼体脂肪酸组成及含量Tab. 1 Fatty acid composition and contents of Artemia nauplii
2.2 石斑鱼幼苗的生长
石斑鱼平均体长、平均体质量和出苗率见表2.石斑鱼出苗率为2.53%~7.60%,整体水平较低,这与鱼卵质量和养殖水体质量等有关.投喂其香错卤虫幼体和强化咸海卤虫幼体的石斑鱼平均体长显著高于投喂未强化咸海卤虫幼体组(P<0.05).投喂其香错卤虫幼体石斑鱼平均体质量显著大于强化咸海卤虫幼体组和未强化咸海卤虫幼体组(P<0.05).

表2 石斑鱼平均体长、平均体质量和出苗率Tab. 2 Average body length,average body weight and survival percentage of grouper juveniles
2.3 石斑鱼肌肉脂肪酸组成和含量
石斑鱼肌肉脂肪酸组成和含量(以干质量计)见表3.投喂其香错卤虫幼体石斑鱼肌肉PUFA和n-3HUFA含量最高,强化咸海卤虫幼体组居中,未强化咸海卤虫幼体组最低(P<0.05).
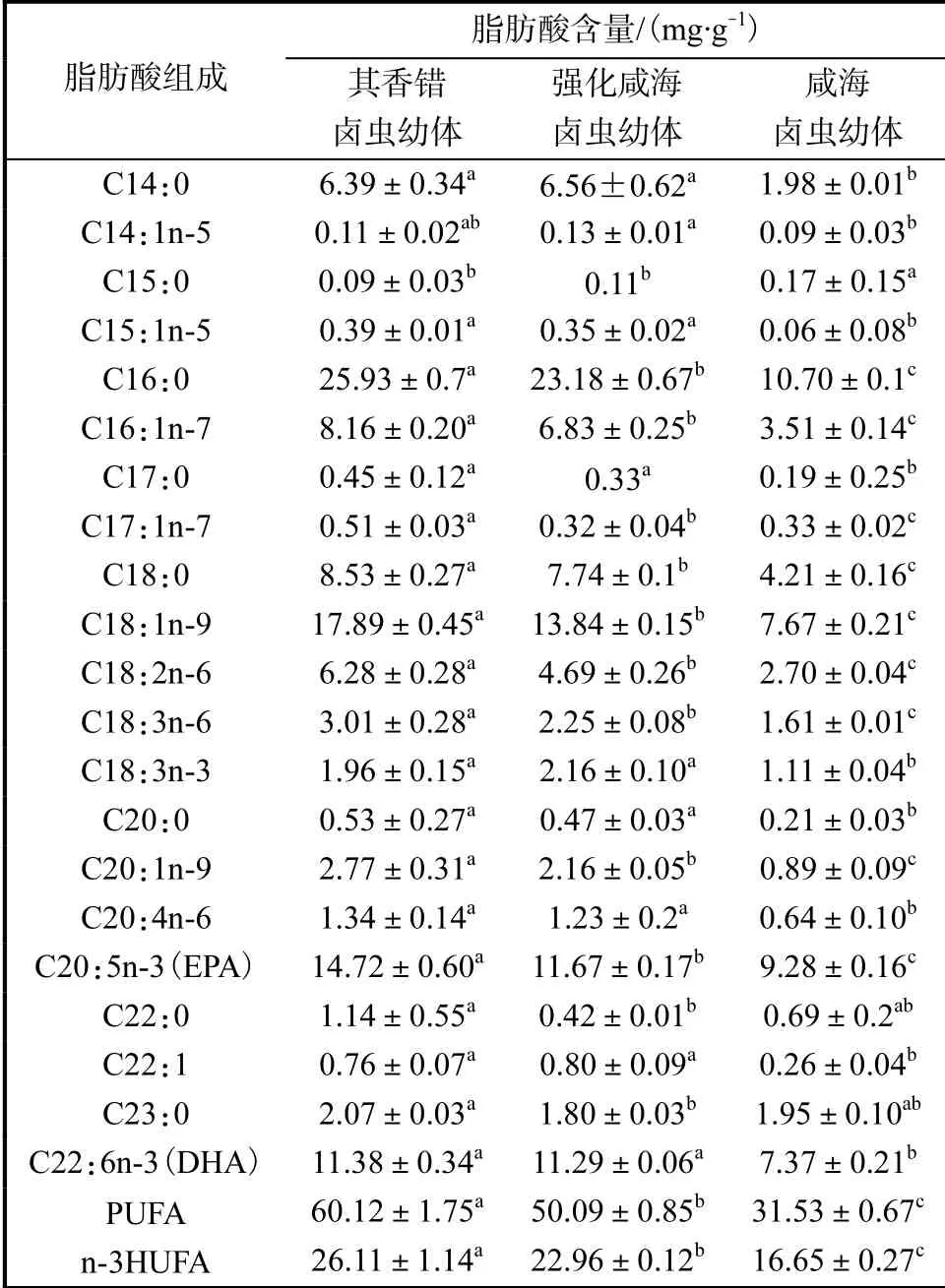
表3 石斑鱼肌肉脂肪酸组成和含量Tab. 3 Fatty acid composition and contents of grouper juvenile muscles
2.4 石斑鱼对弧菌攻毒和氨氮胁迫的耐受力
弧菌攻毒和氨氮胁迫72h的石斑鱼存活率见图1.弧菌攻毒72h后,投喂其香错卤虫幼体石斑鱼存活率(100%)显著高于其他两组(P<0.05),强化咸海卤虫幼体组和未强化组石斑鱼存活率没有显著差异.
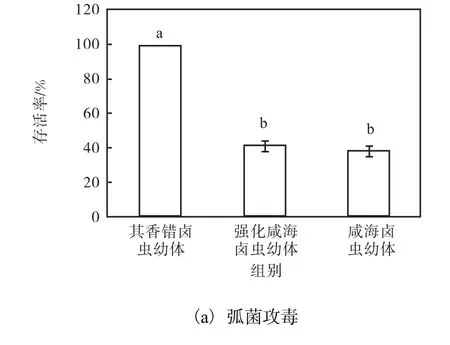

图1 弧菌攻毒和氨氮胁迫72h的石斑鱼存活率Fig. 1 Survival percentage of grouper juvenileswhen exposed to Vibrio harveyi and ammonia nitrogen stress for 72h
氨氮胁迫72h后,投喂其香错卤虫幼体石斑鱼存活率(96.67%)显著高于其他两组,强化咸海卤虫幼体组最低(P<0.05).
3 讨 论
3.1 不同产地卤虫对云龙石斑鱼生长和肌肉脂肪酸含量的影响
本研究表明,投喂其香错卤虫幼体和裂殖壶藻强化咸海卤虫幼体可显著促进石斑鱼苗种的生长.EPA和DHA是维持海水鱼虾蟹生长、发育和繁殖的必需脂肪酸[14-15].作为海水鱼虾蟹育苗的重要生物饵料,虽然不同产地卤虫幼体PUFA和n-3HUFA含量差异较大[9-10],但通过鱼油和裂殖壶藻等强化剂进行短期营养强化,可显著提高其HUFA含量[16-18].研究表明,通过鱼油强化提高卤虫幼体中n-3HUFA含量和DHA与EPA的比例,显著提升了中华绒螯蟹(Eriocheir sinensis)蚤状幼体的变态生长、存活和抗盐度胁迫能力[17];与投喂油酸(C18:1n-9)强化的卤虫幼体相比,投喂n-3HUFA强化的卤虫幼体能够显著提高日本牙鲆(Paralichthys olivaceus)幼苗的生长、存活和耐盐能力[18].
由于病害和自相残杀等原因,石斑鱼育苗出苗率普遍较低[3].研究[19]发现,鞍带石斑鱼(♂)与褐点石斑鱼(♀)杂交获得的石斑鱼苗,用未强化的卤虫和桡足类等生物饵料培育至30日龄,成活率为0.5%,平均体长为2.25cm;黄进光等[20]对云纹石斑鱼工厂化育苗60d,成活率为2%,平均体长为3.85cm;余庆等[14]应用在不同时期投喂小球藻和鱼油强化的轮虫、卤虫和桡足类的策略进行珍珠龙胆石斑鱼育苗35d,成活率为10.5%,平均体长为2.55cm.本研究中云龙石斑鱼幼苗培育30d后,各组石斑鱼成活率为2.53%~7.60%,平均体长为2.62~3.17cm,其中其香错卤虫幼体组和裂殖壶藻强化咸海卤虫幼体组石斑鱼体长显著大于未强化卤虫幼体组,应该与其香错卤虫幼体较高的EPA含量以及强化后咸海卤虫幼体DHA含量的提升有关.
水产动物肌肉的脂肪酸积累主要来源于饵料或饲料[6-7,21].银黑鲷和金头鲷肌肉n-3HUFA含量随着饵料n-3HUFA水平的升高呈上升趋势[22-23],中华绒螯蟹肝胰腺脂肪酸含量随饵料n-3HUFA水平的增加而增加[17].本研究中其香错卤虫幼体组石斑鱼肌肉PUFA和n-3HUFA含量显著高于强化咸海卤虫幼体组和未强化卤虫幼体组,表明饵料HUFA影响石斑鱼肌肉PUFA和n-3HUFA组成.
3.2 投喂不同产地卤虫对云龙石斑鱼弧菌攻毒和氨氮胁迫耐受力的影响
致病性弧菌给海水养殖业造成严重的经济损失[24]. n-3HUFA能够有效提高水产动物的免疫能力,n-3HUFA可调节虹鳟鱼(Oncorhynchus mykiss)免疫力,提高巨噬细胞的杀菌能力[25].饵料中一定水平的n-3HUFA可提高石斑鱼抵抗哈维氏弧菌的能力[6],促进大黄鱼非特异性免疫和抵抗寄生虫的能力[5],有效提高金鲳鱼(Trachinotus ovatus)血清和肝脏中n-3HUFA含量,促进免疫反应[26].本研究中哈维氏弧菌攻毒72h后,其香错卤虫幼体组石斑鱼存活率为100%,其余两组分别为41.67%和38.33%,这可能与其香错卤虫幼体中较高的n-3HUFA,特别是较高的EPA含量有关.裂殖壶藻强化咸海卤虫幼体组石斑鱼存活率高于未强化组,可能与强化卤虫幼体中较高的DHA含量有关.
养殖环境中的氨氮是主要的污染因子,其来源于蛋白质的分解代谢[27].氨氮胁迫使虾蟹鱼类机体非特异性免疫系统遭到破坏,抗氧化能力降低,影响机体健康[28-31].研究发现,投喂n-3HUFA强化的卤虫幼体可以显著提高粉红虾(Farfantepenaeus paulensis)对氨氮的耐受能力[31],提高金鲳鱼抗氧化的能力[26],投喂n-3HUFA和维生素C共同强化的卤虫幼体显著提高波斯鲟(Acipenser persicus)和欧洲鳇鱼(Huso huso)对温度、盐度和氨氮的耐受力[32].本研究投喂其香错卤虫幼体组石斑鱼氨氮胁迫72h后存活率最高,表明投喂西藏卤虫幼体可以显著提高云龙石斑鱼抵抗氨氮胁迫的能力.
4 结 论
西藏其香错卤虫幼体中PUFA和EPA的含量明显高于咸海卤虫幼体,裂殖壶藻强化后咸海卤虫幼体PUFA和DHA含量有所提升.投喂其香错卤虫幼体和强化卤虫幼体可显著促进云龙石斑鱼苗种的生长,提高石斑鱼肌肉中PUFA和n-3HUFA的含量;投喂其香错卤虫幼体显著提升石斑鱼对弧菌攻毒和氨氮胁迫的耐受力,说明生物饵料卤虫幼体中较高的n-3HUFA水平对石斑鱼苗种培育具有积极作用.应该指出的是,使用其香错卤虫幼体无需营养强化操作,且石斑鱼的总体状况优于投喂裂殖壶藻强化的咸海卤虫,所以西藏其香错卤虫幼体更适合作为石斑鱼苗种培育的生物饵料.
