双功能噻吨酮类光敏有机染料的合成与表征
2022-04-21蒋春辉朱学杰陆鸿飞
蒋春辉,倪 成,秦 伟,朱学杰,陈 葳,陆鸿飞
(江苏科技大学 环境与化学工程学院,镇江 212100)
噻吨酮及其衍生物既可以作为光敏有机染料,同样也是一种应用价值极高的医药中间体[1-2].在1945年研发的抗血吸虫病药物Miracil D(图1)具有噻吨酮这一核心骨架[3].噻吨酮作为光敏有机染料,除了光敏反应催化剂的光谱催化特性外,也可以作为有着显色作用的光敏剂来使用[4-7].在催化合成领域,早有研究表明当噻吨酮与胺增效剂结合使用时,会引发丙烯酸月桂酯的聚合[8].近年来文献[9]通过将咪唑引入噻吨酮,合成了一种新颖的光引发剂2-(2-羟基-3-咪唑)丙氧基噻吨酮(简称IPTX,如图2).文献[10]研发了一种基于噻吨酮生色团的聚合物引发剂,该引发剂对甲基丙烯酸甲酯有着光致聚合作用.噻吨酮的显色作用最早报导于1991年,并被用于患风湿性关节炎的治疗[11].
图1 Miracil D
图2 IPTX
文献[12]巧妙地将噻吨酮连接到手性噁唑啉,合成双功能光敏手性thioxanthone-BOX配体,实现了一种催化剂兼具光催化和手性控制的能力,已应用于不对称有氧氧化反应.文献[13]的咪唑烷酮-噻吨酮手性仲胺催化剂,应用于不对称烷基化反应.文献[14]合成了噻吨酮-氢键手性催化剂,应用于去消旋化以及不对称环丙烷化反应(图3).

图3 噻吨酮双功能催化剂
基于之前的研究结果,文中提出了在噻吨酮的基础构架上再引入手性环己二胺,使它既具有光催化的作用,又能起到手性胺的催化功能.同时作为有机染料和生物活性试剂,手性环己二胺-噻吨酮有着极为广阔的应用前景.以1,2-环己二胺和噻吨酮酸为原料,用邻苯二甲酸酐保护胺基,脱水缩合,再用水合肼进行胺基的脱保护来制备手性环己二胺-噻吨酮(图4).并且最后的产物使用质谱(MS), 核磁共振光谱(1H-NMR,13C-NMR)进行表征,并测试其光化学性质[15].

图4 手性环己二胺-噻吨酮
1 实验
1.1 合成路线
图5是以2-硝基对苯二甲酸二甲酯为原料合成噻吨酮酸的实验路线,图6是以1,2-环己二胺和噻吨酮酸为原料合成手性环己二胺-噻吨酮的实验路线.

图5 噻吨酮酸的合成

图6 手性环己二胺-噻吨酮的合成
1.2 仪器与试剂
试剂:实验中所用化学品和溶剂均通过商业渠道购买,使用前未进一步纯化.
仪器:DF-2 油浴锅(金坛区白塔安瑞实验仪器厂);RE53-3 旋转蒸发仪(上海沪西分析仪器厂有限公司);DF-102B 磁力搅拌加热器(金坛市医疗仪器厂);Ion Spec FT-ICR 高分辨质谱仪(美国安捷伦公司);ZF-I 紫外分析仪(上海顾村电光仪器厂).
1.3 实验步骤
1.3.1 噻吨酮酸的合成
先在100 mL的圆底烧瓶内加入2-硝基对苯二甲酸二甲酯1a(14.3 mmol,3.4 g),然后再加入二甲基甲酰胺(6.4 mL),并在-30℃的温度下搅拌,不断加入苯硫酸钠(16.8 mmol,2.2 g),让其在该反应温度下反应1 h.移至室温反应2 h,用乙酸乙酯将产物萃取出来,并进行纯化处理.得到中间产物2-(苯硫基)对苯二甲酸二甲酯1b(1.7 g, 39.0%产物).
将中间产物2-(苯硫基)对苯二甲酸二甲酯1b加入到100 mL的烧杯中,加入配取好的10% KOH溶液使其水解反应,再加入1.2 mol/L 的HCl溶液调节反应液的pH值至2.3左右,用乙酸乙酯萃取产物2-(苯硫基)对苯二甲酸1c(1.1 g,68.6%产物),并干燥.
然后将2-(苯硫基)对苯二甲酸加入到100 mL的圆底烧瓶中,再加入50 mL的多聚磷酸,在100℃的温度下反应3 h,待反应结束,使其冷却至室温.将反应液倒入装有150 mL水的250 mL烧杯中,有灰色固体产生.过滤,取灰色固体并将其水洗、干燥,得到最终的噻吨酮酸1d(0.6 g,58.6%产物).
1.3.2 手性环己二胺-噻吨酮的合成
在200 mL的圆底烧瓶内依次加入1,2-环己二胺2a(14.9 mmol,1.7 g)、1,3-异苯并呋喃二酮2b(14.9 mmol,2.2 g),对甲苯磺酸(14.9 mmol,2.8 g)、二甲苯(70 mL)搅拌反应4 h.待反应结束后抽滤,并用二甲苯和石油醚洗涤滤饼得白色固体.用饱和碳酸氢钠溶解固体,加入二氯甲烷溶液(60 mL),搅拌过夜.用二氯甲烷萃取反应液,取有机相,干燥,得白色固体(偏黄褐色).用二氯甲烷溶解固体,并加入稀盐酸(1.2 mol/L)调节pH至酸性,生成大量白色固体.过滤,用二氯甲烷洗涤滤饼后,抽干后再用饱和碳酸氢钠溶液碱化,用二氯甲烷萃取,并干燥得到中间产物2c(1.3 g,35.5%产物).
将噻吨酮酸1d(2.0 mmol,500 mg),1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐(2.2 mmol,391.5 mg),1-羟基苯并三唑(2.0 mmol,276.8 mg)加入到50 mL的三颈烧瓶中,插上温度计.用二氯甲烷(5 mL)使它们溶解,并且冰浴降温至-5℃左右.然后用恒压滴液漏斗缓慢滴加N,N-二异丙基二胺10 mL.期间再取邻苯二甲酸酐(1.9 mmol,500 mg),用二氯甲烷(5 mL)溶解.待N,N-二异丙基二胺滴加完毕后,将刚刚溶解的中间产物2c在冰水浴下缓慢滴加至反应液中(缓慢滴加约30 min).待滴加完毕后,再取二氯甲烷(5 mL)于恒压滴液漏斗中再次滴加.滴加完毕后室温反应约6 h.反应完全后浓缩反应液,再用乙酸乙酯(EA)∶石油醚(PE)=1∶10的洗脱剂进行柱分离、干燥.取N-(2-(1,3-二氧代异吲哚-2-基)环己基)-9-氧代-9H-硫杂蒽-3-甲酰胺2d(0.4 mmol,200 mg)于50 mL圆底烧瓶中,加入乙醇溶液(5 mL)溶解.然后搅拌下滴加水合肼(0.8 mmol,38.85 g).接着进行冷凝回流,在95℃的油浴锅中进行反应.反应3 h左右,停止反应并冷却至室温.将反应液抽滤并取滤液,用甲醇(MeOH)∶二氯甲烷(DCM)=1∶10的洗脱剂进行柱分离.最后干燥得到最终产物N-(2-氨基环己基)-9-氧代-9H-噻吨并-3-羧酰胺2e(107 mg,73.5%产物).
噻吨酮酸1d:MS(ESI)m/z calcd for C14H8O3S(M-H)-= 255.0, found = 255.0;1H NMR(400 MHz, DMSO)δ13.59(s, 1H), 8.51(dd,J=8.3, 2.7 Hz, 1H), 8.44(d,J=6.8 Hz, 1H), 8.29(d,J=0.9 Hz, 1H), 8.00(dd,J=8.3, 1.4 Hz, 1H), 7.88-7.73(m, 2H), 7.63-7.53(m, 1H).
4 N-(2-(1,3-二氧代异吲哚-2-基)环己基)-9-氧代-9H-硫杂蒽-3-甲酰胺2d:MS(ESI)m/z calcd for C28H22N2O4S(M-H)-= 481.1, found = 481.0;1H NMR(400 MHz, CDCl3)δ8.49(dd,J=8.1, 1.1 Hz, 1H), 8.43(d,J=8.4 Hz, 1H), 7.77(d ,J=2.5 Hz, 2H), 7.70(d,J=1.4 Hz, 1H), 7.67-7.61(m, 2H), 7.60-7.54(m, 1H), 7.48-7.40(m, 3H), 6.39(d,J=9.1 Hz, 1H), 4.80-4.68(m, 1H), 4.16(td,J=12.3, 3.9 Hz, 1H), 2.76-2.60(m, 1H), 2.26(dd, J =18.3, 8.5 Hz, 1H), 1.98-1.79(m, 3H), 1.60-1.36(m, 3H).
N-(2-氨基环己基)-9-氧代-9H-噻吨并-3-羧酰胺 2e:MS(ESI)m/z calcd for C20H20N2O2S(M-H)-= 353.45, found = 353.13;1H NMR(400 MHz, DMSO)δ 8.63(d,J=8.3 Hz, 1H), 8.49(m, 2H), 8.31(d,J=1.4 Hz, 1H), 8.00(dd,J=8.4, 1.6 Hz, 1H), 7.89(d,J=8.0 Hz, 1H), 7.80(m, 1H), 7.61(m, 1H), 3.64(d,J=8.5 Hz, 1H), 2.75(m, 1H), 1.90(m, 2H), 1.68(d,J=3.0 Hz, 2H), 1.26(m, 6H).13C NMR(101 MHz, DMSO)δ=179.57, 179.46, 165.94, 139.25, 137.69, 134.21, 130.68, 130.14, 130.10, 129.42, 128.05, 127.66, 126.72, 126.58, 55.55, 54.22, 33.72, 32.55, 25.64, 25.37.
2 结果与讨论
2.1 氨基保护试剂的选择
因为在底物1,2-环己二胺中存在两个胺基,在产物的设计中只需要一个胺基与羧酸进行缩合反应,因此需要对另一个胺基添加保护.常见的保护试剂有Cbz、Boc、Fmoc、Pht等.最终使用邻苯二甲酸酐即Pht来对1,2-环己二胺中其中的一个伯胺基进行保护,选用邻苯二甲酸酐有3个优势方面.第一,它保护基团单一,副产物生成较少;第二,它的位阻效应大,很难与1,2-环己二胺上的两个伯氨基同时反应,有效地保护了其中一个胺基;第三,最终的产物只需要用水合肼就能脱去邻苯二甲酸酐的保护.
2.2 噻吨酮酸的位阻效应
虽然噻吨酮酸本身也存在着位阻效应,但它与1,2-环己二胺的2个伯胺基都能反应.如果不能进行有效地保护,必然会引起副产物的增多,产率的下降.因此,实验中必须用邻苯二甲酸酐的保护来对1,2-环己二胺上其中的一个伯胺基进行保护.
2.3 紫外图谱分析
图7为手性环己二胺-噻吨酮的紫外光谱,在390 nm和262 nm处有吸收峰,峰值是0.189 3和1.129 9.其紫外光谱的图谱与Alemán研究团队所测得紫外吸收光谱的吸收峰位置及吸收峰数目都极其相似[13].进一步验证了所合成的双功能手性环己二胺-噻吨酮催化剂的结构及其性能的正确性.

图7 手性环己二胺-噻吨酮的紫外光谱
2.4 荧光图谱分析
图8为手性环己二胺-噻吨酮的荧光光谱,在430 nm处荧光增强,最大吸收峰值为2.92×105.
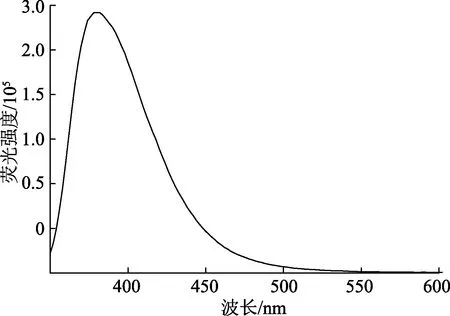
图8 手性环己二胺-噻吨酮的荧光光谱
3 结论
文中基于国内外对噻吨酮类有机光敏染料的研究,提出了以噻吨酮为基础构型,在此基础上修饰手性环己二胺结构,使它具有噻吨酮光敏催化光剂和手性胺有机小分子催化剂的双重性能,很大地拓展了噻吨酮类有机染料的应用前景.
