快速净化柱在植物油黄曲霉毒素B1测定中的应用
2022-04-21蒋林惠袁琛凯周易枚
周 楠,蒋林惠,石 敏,杨 俊,袁琛凯,周易枚
南通市食品药品监督检验中心 (南通 226000)
黄曲霉毒素是生长在植物种子及食物、饲料中的黄曲霉和寄生曲霉代谢的产物,在天然污染中以黄曲霉毒素B1最为多见[1-3]。黄曲霉毒素B1(AFT B1)毒性及致癌性极强,且耐热,分解温度为268 ℃左右,一般烹调加工破坏很少,摄入AFT B1后出现中毒现象,表现为免疫力降低,肝、脾和肾等器官损伤,有强致突变性和强致癌性[4-6]。我国根据不同的食品类别也制定了相应的 AFT B1食品卫生标准,其中花生油和玉米油AFT B1限量为20 μg/kg,其它植物油脂中限量为10 μg/kg[7-8]。快速简单的AFT B1的检测方法对于保障粮油安全显得尤为重要。
AFT B1的检测方法主要包括:同位素稀释液相色谱串联质谱法[9-13]、高效液相色谱-柱前衍生法、高效液相色谱-柱后衍生法[14-16]、酶联免疫吸附筛查法[17-19]等等。其中同位素稀释液相色谱串联质谱法由于其回收率高,且避免基质背景干扰,是目前最常见的检测方法[20-21]。但液相色谱联用质谱法对上机样液要求较高,因此需要净化提取样品中的AFT B1,目前最常见的净化提取方法为免疫亲和柱净化提取法。随着复合型快速净化柱的问世,净化柱法也逐渐得到重视和应用。
本文采用免疫亲和柱-同位素稀释液相色谱串联质谱法以及快速净化柱-同位素稀释液相色谱串联质谱法对植物中黄曲霉毒素B1进行了检出限、加标回收率等实验比对,分析了两种方法特点和适用条件。
1 材料与方法
1.1 主要标准物质及试剂
黄曲霉毒素B1内标,0.511 μg/mL,ANPLE公司);黄曲霉毒素B1,100.2 μg/mL,阿尔塔公司;乙腈,色谱纯, Merck公司;甲醇,色谱纯,Merck公司;乙酸,分析纯,中国国药集团;TritionX-100,化学纯,中国国药集团。
1.2 主要仪器与设备
免疫亲和柱(上海安普实验室科技有限公司)、复合快速净化柱(ROMER LAB),液质联用仪(Therme Fisher,TSQ-ALTIS)、离心机(Hettich,MIKRO 220R)、涡旋混合仪(ESSENSCIEN,VM-2500)、电子天平(Sartorius、 CPA225D)、氮吹仪(Horizon,Xcelvap)。
1.3 方法
1.3.1样品前处理
1.3.1.1 快速净化柱净化法
在50 mL离心管中称取5 g样品,加入同位素内标(100 ng/mL)100 μL后, 静置30 min。加入20 mL乙腈-水(85∶15,v/v)混合溶液,涡旋20 min,6 000 r/min离心5 min。在10 mL玻璃管中加入70 μL乙酸,取7 mL上清液加入玻璃管中,涡旋混匀,将填充净化柱的衬管推入装有样品上清液的玻璃外管,使得玻璃外管中样品上清液缓慢通过净化柱压入衬管,在衬管中取4 mL净化液于氮吹管中,50 ℃氮吹近干,用1 mL初始流动相复溶,经0.22 μm滤膜过滤后经液相色谱串联质谱仪测定。
1.3.1.2 免疫亲和柱净化法
称取5 g试样(精确至0.01 g)于50 mL离心管中,加入100 μL同位素内标工作液(100 ng/mL)振荡混合后静置30 min。加入20.0 mL乙腈-水溶液(85:15,v/v),涡旋混匀15 min,在6 000 r/min下离心10 min,取上清液备用。准确移取4 mL上清液,加入46 mL 1% TritionX-100的PBS(磷酸盐缓冲溶液)混匀。
将免疫亲和柱恢复至室温,待免疫亲和柱内原有液体流尽后, 将上述样液移至50 mL注射器筒中,调节下滴速度稳定下滴。待样液滴完后加入2×10 mL水淋洗。用真空泵抽干亲和柱。加入2×1 mL甲醇洗脱亲和柱,收集全部洗脱液至试管中。在50 ℃下用氮吹至近干,加入1.0 mL初始流动相,涡旋30 s溶解残留物,0.22 μm滤膜过滤,收集滤液于进样瓶中以备进样。
1.3.2标准溶液的制备
标准系列工作溶液:准确移取AFT B1标准工作液(100 ng/mL) 5 μL、10 μL、50 μL、100 μL、500 μL、1 000 μL、2 000 μL、5 000 μL至10 mL容量瓶中,加入200 μL 100 ng/mL的同位素内标工作液,用初始流动相定容至刻度,配制浓度点为0.05 ng/mL、0.1 ng/mL、0.5 ng/mL、1.0 ng/mL、5.0 ng/mL、10.0 ng/mL、20.0 ng/mL、50.0 ng/mL的系列标准溶液。AFT B1内标浓度为2 ng/mL。
1.3.3空白样品加标
称取阴性空白样品24份,每份称样质量5.0 g,分四浓度水平加标(编号1~24)。加标浓度分别为0.1 μg/kg 、1 μg/kg、 10 μg/kg、20 μg/kg。每个浓度水平加标6份空白样品,其中3份前处理过程参照快速净化柱净化法,另外3份前处理过程参照免疫亲和柱净化法。
1.4 仪器条件
1.4.1液相色谱条件
色谱柱,Accucore RPMS C18柱,150 mm×2.1mm,2.6 μm;流速0.3 mL/min;进样体积2 μL;柱温35 ℃。流动相A相:5 mmol/L乙酸铵溶液;流动相B相:乙腈-甲醇(50∶50,v/v);梯度:35% B(0 ~0.5 min),45% B(3~4 min), 100% B(4.2~4.8 min),32% B(5.0~7.0 min)。
1.4.2质谱条件
离子源,电喷雾;喷雾电压3 500 V;离子源温度400 ℃;离子管传输温度320 ℃;检测方式,选择反应监测(SRM);鞘气35 Arb、辅助气8 Arb、吹扫气0 Arb;均为高纯氮气。
黄曲霉毒素B1(AFT B1):定量离子对(m/z)为313/285;透镜电压(V)为73;碰撞能量(eV)为23.57;定性离子对(m/z)为313/241,透镜电压(V)为73,碰撞能量(eV)为37.71。黄曲霉内标B113C17-AFT B1:定量离子对(m/z)为330/255;透镜电压(V)为91;碰撞能量(eV)为39.53;定性离子对(m/z)为330/301,透镜电压(V)为91,碰撞能量(eV)为24.29。
2 结果与讨论
2.1 快速净化柱净化法提取剂优化
本文采用乙腈-水(85∶15,v/v)、乙腈-水(70∶30,v/v)、乙腈-水(50∶50,v/v)、甲醇-水(85∶15,v/v)、甲醇-水(70∶30,v/v)、甲醇-水(50∶50,v/v)作为提取剂,用快速柱净化法处理1 μg/kg的加标样品中,涡旋震摇15 min,其余前处理操作按照1.3.1.1进行,回收率结果如图1。
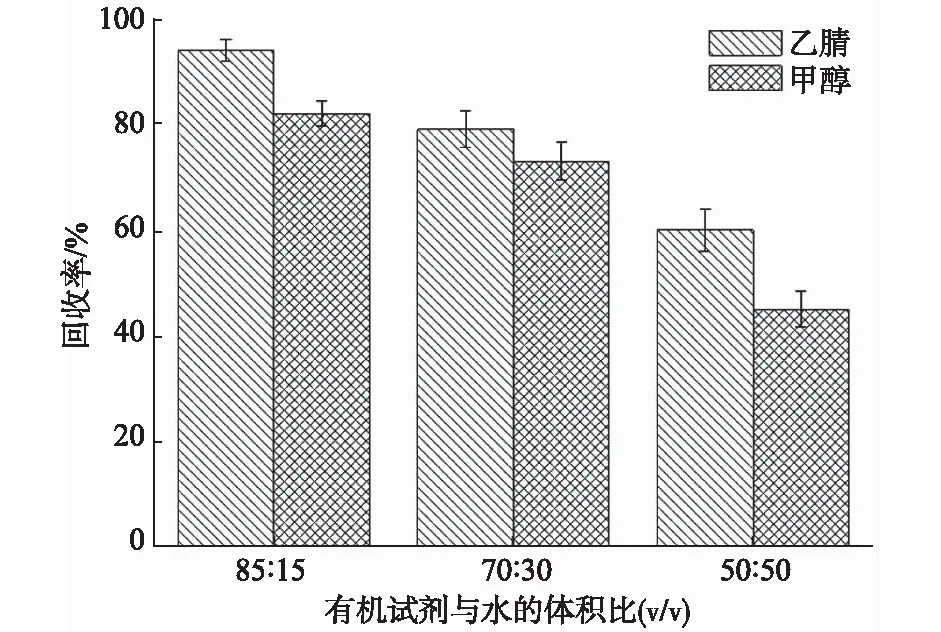
图1 提取剂类型与配比对回收率的影响
由图1可见,同样浓度配比的乙腈-水溶液提取效果优于甲醇-水,且有机相比例高,有利于黄曲霉毒素B1的提取。本文选择了乙腈-水混合液(85∶15,v/v)作为提取剂。
2.2 检出限及线性范围测定结果对比
由于两种前处理方法标准曲线都是内标物质参与的试剂曲线,其配制过程一致,检测仪器一致,因此其线性范围、线性方程及其相关系数都是一致的。检出限通过向空白样品中加标,经前处理步骤后上机测定,根据其响应信噪比(S/N)≥3确定。由表1可以看出,净化柱处理法检出限略低于免疫亲和柱处理法,该法检测灵敏度更好。

表1 两种检测方法的工作曲线及检出限
2.3 加标实验结果对比
通过对空白样品四水平加标(n=3)进行回收率比对(结果见表2)。由表2可见,净化柱法平均回收率范围在86.0%~105.0%, 相对标准偏差为6.6%~15.1%。免疫亲和柱处理法平均回收率范围为 88.0%~96.9%, 相对标准偏差为 4.3%~9.1%。
2.4 质控样品的定值测定t值检验
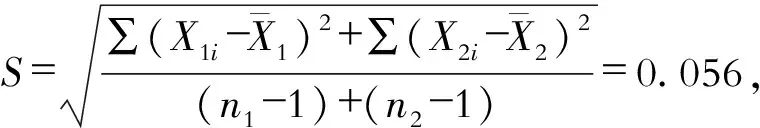
3 结论
本文对免疫亲和柱-同位素稀释液相色谱-串联质谱法、快速净化柱净化-同位素稀释液相色谱-串联质谱法测定植物油中AFT B1方法比对分析。实验表明两种方法均能够较好的进行定量分析。快速净化柱处理法检出限较低,适合于低含量样品检测,且处理方法简单快捷,使用试剂少、避免繁琐的试剂配制过程,适合大批样品批量化处理。免疫亲和柱前处理法步骤复杂,其加标实验结果回收率较快速净化柱净化法略高,且相对标准偏差略小,可见该前处理方法准确定性和稳定性较好,适合于较低含量样品的检测,但不适合大批量样品检测。用t值检验法对两种前处理测定质控样品植物油黄曲霉毒素B1结果进行比较,结果显示两种处理方法对于测定植物油中的黄曲霉毒素B1具有良好的一致性,说明两种前处理方法准确度较高。综上所述,快速柱净化法可以应用于大批量植物油样品中黄曲霉毒素B1的检测。
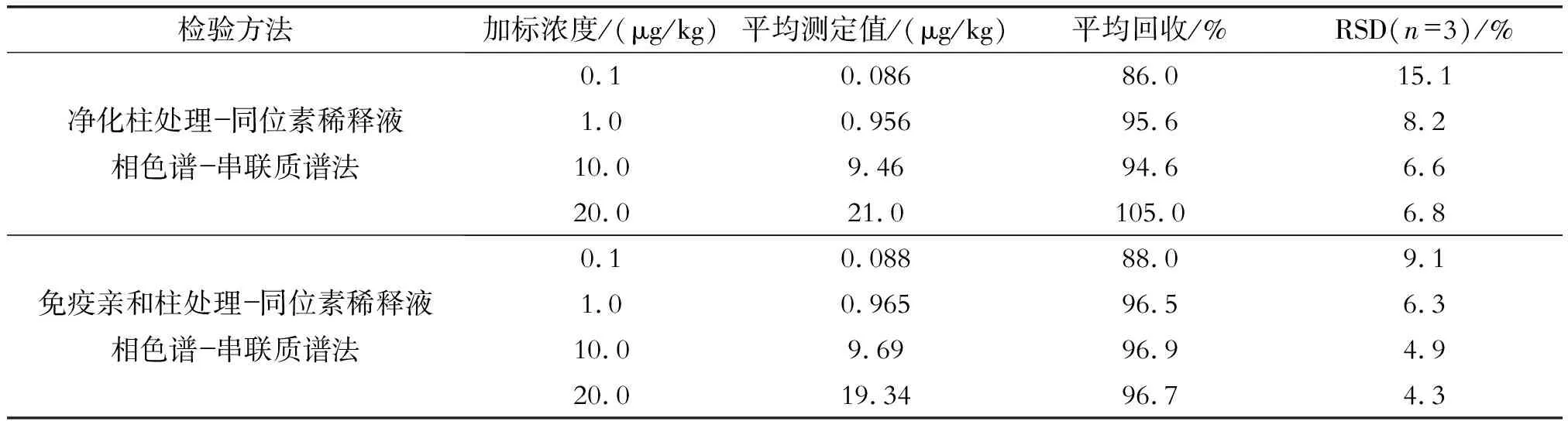
表2 净化柱处理-同位素稀释液相色谱-串联质谱法和免疫亲和柱处理-同位素稀释液相色谱-串联质谱法测定黄曲霉B1 的回收率和精密度(n=3)

表3 两种前处理方法测定AFT B1质控样品结果
