从网络药理学角度比较草珊瑚指标成分迷迭香酸和氟西汀抗抑郁作用机制
2022-04-21祁克明林可欣张家源魏艺聪
祁克明,李 叶,林可欣,张家源,卢 伟,魏艺聪
(福建中医药大学药学院,福建 福州 ,350122)
根据报道,抑郁症是导致残疾的三大原因之一,目前全球有超过2.4亿人患有抑郁症[1]。抑郁症的症状包括情绪和认知障碍,如情绪低落易怒、缺乏快感、疲倦、失眠或嗜睡、反应迟钝、食欲不振等[2]。抑郁症的发病机制比较复杂,主要与神经营养因子、下丘脑-垂体-肾上腺(hypothalamic-pituitaryadrenal,HPA)轴、单胺类神经递质、神经可塑性、炎症反应等有关[3-4]。虽然已有多种抗抑郁药如氟西汀(fluoxetine,FLU)、氯胺酮等应用于抑郁症患者的治疗中,但仅对30%~40%的患者有效[5],因此抗抑郁新药的研发十分必要。迷迭香酸(rosmarinic acid,RA)是一种天然多酚化合物,主要存在于草珊瑚(又名肿节风)、薄荷、迷迭香、丹参、鼠尾草、麻黄、紫苏等药用植物中[6],并且与异嗪皮啶共同作为中药肿节风的质量控制成分被收录入《中华人民共和国药典》2020版[7]。研究表明,RA具有抗氧化、抗炎、抗菌、抗抑郁、抗焦虑、抗肿瘤、抗菌、保肝等药理作用[8]。大量研究表明,RA能够通过调节单胺能神经递质的传递、脑源性神经营养因子(brain-derived neurotrophic factor,BDNF)、齿状回新生细胞数量和炎症反应等机制发挥抗抑郁作用[9]。氟西汀(fluoxetine,FLU)是一种广泛应用于临床的抗抑郁药物,主要通过提高大脑内5-羟色胺(serotonin,5-HT)、BDNF,增强神经可塑性、促进神经发生来发挥抗抑郁作用[10]。氟西汀还具有抗炎、抗氧化、抗凋亡等药理作用,可以提高脑内胰岛素样生长因子-1(insulin-like growth factor 1,IGF1)、抑制肿瘤坏死因子-α(tumor necrosis factor Alpha,TNFα)、白介素-6(interleukin-6,IL-6)等促炎因子发挥抗抑郁作用[11]。但目前尚无关于RA与FLU联合用药治疗抑郁症的相关研究。网络药理学是一种包括系统生物学、网络分析、连通性、冗余和多效性的药物设计方法,为新药的发现和阐明化合物对疾病的作用机制研究提供依据,同时为提高药物临床疗效和了解毒副作用提供重要依据[12]。本研究运用网络药理学研究方法预测RA治疗抑郁症的潜在途径和可能的机制,并且以经典抗抑郁药FLU作为对照,对比分析二者存在的异同点,从而为RA与FLU治疗抑郁症联合用药的研究提供理论依据。
1 方法
1.1 化合物信息的获取 将rosmarinic acid和fluoxetine输入化合物数据库Pubchem中进行检索,获得RA和FLU的SMILES式、二维结构。
1.2 RA、FLU相关靶点的获取 将化合物名称输入中药系统药理学数据库与分析平台(TCMSP),检索得到潜在靶点。将化合物三维结构文件上传至Pharmmapper数据库,选择“靶点(targets)”,类型为“仅针对人类蛋白质(human protein targets only)”,从结果中筛选出适配度(fit score)>3分的靶点。将化合物三维结构文件上传至SwissTargetPrediction和Stitch数据库,选择“物种(species)”为“人类(HOMOsapiens)”,获得潜在靶点,并从SwissTarget-Prediction结果中筛选出可能性(probability)>0的靶点。将以上4个数据库的靶点合并去重,使用Uniprot数据库将获得的靶点转换为人类基因标准名。
1.3 抑郁症靶点的获取 将“depression”“depressive disorder”“major depressive disorder”作 为 抑 郁症关键词,分别从治疗靶点数据库(therapeutic target database,TTD)、人类孟德尔遗传数据库(online mendelian inheritance in man,OMIM)、GeneCards数据库和基因疾病关联数据库(a database of genedisease associations,DisGeNet)获得疾病靶点。筛选GeneCards数据库中相关性得分(relevance score)>10的靶点,TTD数据库结果中Disease为Depression或Major depressive disorder的靶点,以及DisGeNet数据库评分(score gda)>0.2的靶点。将以上4个数据库得到的靶点合并去重,转换为人类基因标准名。
1.4 迷迭香酸和氟西汀治疗抑郁症靶点整合 筛选出RA与抑郁症的交集靶点作为RA治疗抑郁症的候选靶点,FLU与抑郁症的交集靶点作为FLU治疗抑郁症的候选靶点,并筛选出二者共同的候选靶点。
1.5 蛋白-蛋白互作网络(protein-protein interactio,PPI)的构建及分析 将“1.4”得到的RA与抑郁症和FLU与抑郁症的交集靶点导入在线分析工具STRING数据库中,选择物种为“HOMO sapiens”构建“化合物-靶点”PPI网络。将获得的PPI网络导入Cytoscape 3.8.2软件中进行可视化处理,利用Network Analyzer功能计算节点度值(degeree),度值越大,则颜色越深,说明与该靶点相连的靶点越多,其相关度越大。此外,使用Cytoscape 3.8.2软件的MCODE算法对PPI网络进行聚类分析,提取核心基因模块。
1.6 分子对接验证 选择RA的关键靶点蛋白进行分子对接验证。将RA的二维结构导入Chem3D 19.0.0.22优化力学结构,导出为pdb格式。从PDB数据库下载关键靶点蛋白分子的3D结构,采用Py-MOL 2.5.2对蛋白质去水,去配体,导出为pdb格式。利用AutoDockTools对蛋白质和RA加氢,转换为pdbqt格式,进行分子对接。结合能≤-5.0 kcal/mol时具有良好的对接活性,结合能≤-7 kcal/mol时具有较强的对接活性。
1.7 生物学过程及通路分析 运用注释、可视化和集成发现数据库(database for annotation,visualization and integrated discovery,DAVID)对PPI网络中靶点进行基因功能(gene ontology,GO)注释和KEGG(kyoto encyclopedia of genes and genomes,KEGG)通路富集分析,了解RA和FLU对治疗抑郁症可能的生物功能和信号途径。
2 结果
2.1 RA和FLU治疗抑郁症靶点筛选 从TCMSP数据库得到RA的潜在靶点18个,FLU潜在靶点0个;从Pharmmapper数据库筛选得到RA潜在靶点114个,FLU潜在靶点42个;从Stitch数据库得到RA靶点2个,FLU靶点10个;从SwissTargetPrediction数据库得到RA靶点62个,FLU靶点42个。将获得的疾病靶点整合去重,共得到RA潜在靶点179个,FLU潜在靶点87个。从TTD数据库获得抑郁症潜在靶点32个,OMIM数据库获得靶点271个,GeneCards数据库中得到靶点1 506个,DisGeNet数据库得到靶点577个,整合后共得到抑郁症潜在靶点1 753个。分别对RA和FLU治疗抑郁症的靶点进行筛选后,共得到63个RA作用于抑郁症的候选靶点,45个FLU作用于抑郁症的候选靶点,其中包含7个RA和FLU共同作用于抑郁症的候选靶点。
2.2 基于PPI互作网络的分析和预测 使用Cytoscape 3.8.2软件分别建立RA与抑郁症63个交集靶点、FLU与抑郁症45个交集靶点的PPI网络,并依据度值对蛋白互作进行可视化处理。结果表明,RA与抑郁症的PPI网络图共包含了60个靶点和479条边,见图1A,度值排名前15的靶点为AKT1、MAPK1、CASP3、MMP9、IGF1、MAPK8、SRC、PTGS2、EGFR、CCL2、ESR1、MMP2、AR、JAK2、ERBB2。FLU与抑郁症的PPI网络图共包含了45个靶点和220条边,见图1B,度值排名前15的靶点为BDNF、SLC6A4、OPRM1、MAOA、DRD2、CYP2D6、HTR1A、DRD4、SLC6A3、DRD3、SLC6A2、OPRK1、ADRA2A、IGF1、ACHE、CASR、HTR2A。将排名前15的靶点基因作为核心(HUB)靶点基因,二者度值排名前15的靶点均包含IGF1。使用Cytoscape 3.8.2软件的MCODE算法对RA和FLU的PPI网络进行聚类分析,RA共得到2个核心基因模块,模块1由24个节点和220条边组成,得分为19.13分,模块2由4个节点和5条边组成,得分为3.333分。FLU共得到4个核心基因模块,模块1由15个节点和91条边组成,得分为13.143分,模块2~4均由3个节点和3条边组成,得分均为3分,见图2。

图1 迷迭香酸(A)和氟西汀(B)与抑郁症交集靶点蛋白-蛋白互作网络图

图2 迷迭香酸(A)与氟西汀(B)PPI网络的MCODE分析图
2.3 化合物与关键靶点蛋白分子对接 利用AutoDockTools计算RA与关键靶点蛋白之间的最低结合能。结果显示RA与15个关键靶点蛋白的结合能均<-5.0 kcal/mol,说明RA与其治疗的靶点具有良好的结合能力,并且与MMP2、MMP9、MAPK8、JAK2、EGFR、CASP3、AR、AKT1之间具有较强的结合活性,见表1。
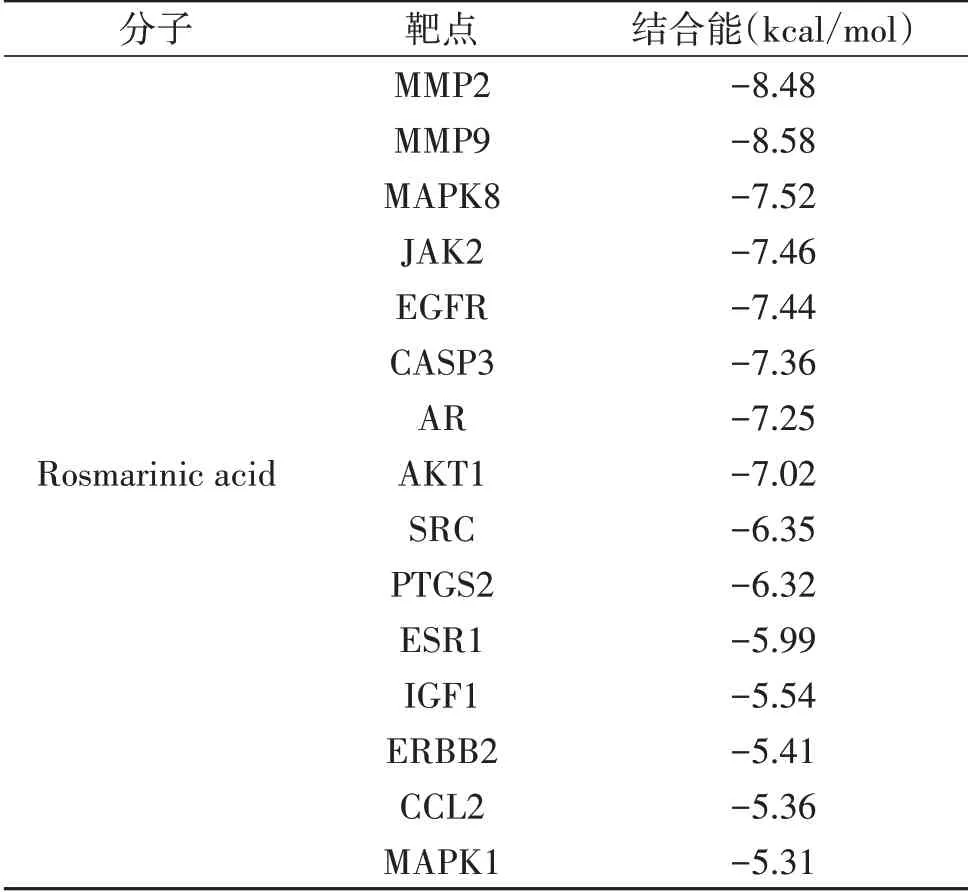
表1 关键靶点蛋白与RA分子对接结果
2.4 基于GO功能注释的分析和预测 通过DAVID在线平台对两种化合物治疗抑郁症的潜在靶点基因进行GO功能注释(P<0.05)。得到了RA相关条目一共1 342个,其中生物过程(biological process,BP)1 188个,细胞成分(cellular components,CC)46个,分子功能(molecular function,MF)108个;FLU相关条目共961个,BP、CC、MF分别为853、27、81个。根据P值对所得条目由小到大进行排序,筛选出每一类中前15位,并对前10位进行可视化处理,见图3。结果表明,RA可能主要通过调节代谢过程的调控、对刺激的反应、信号传导的调控、生化活性的调节等生物过程发挥作用。此外,在排位前15的条目中,RA和FLU都与代谢过程的正调控、信号转导的调节、对有机物的反应、大分子代谢过程的正调控、细胞通讯调节、信号调节、细胞代谢过程的正调控、细胞对化学刺激的反应、神经元投射、受体结合、酶结合、相同的蛋白质结合、离子结合等有关。

图3 迷迭香酸(A)和氟西汀(B)抗抑郁的GO富集分析
2.5 基于KEGG富集分析的分析和预测 为了探究RA用于治疗抑郁症潜在的信号通路,我们使用DAVID在线工具对两种化合物治疗抑郁症的潜在靶点基因进行KEGGPathway富集分析(P<0.05),得到RA潜在作用通路72条,FLU潜在作用通路22条。两个化合物交集通路共11条,主要包括5-羟色胺能突触(serotonergic synapse)、Ras信号通路(Ras signaling pathway)、Rap1信号通路(Rap1 signaling pathway)、ErbB信号通路(ErbB signaling pathway)、PI3K-Akt信号通路(PI3K-Akt signaling pathway)、神经营养因子信号通路(neurotrophin signaling pathway)、HIF-1信号通路(HIF-1 signaling pathway)、间隙连接(gap junction)等通路。
此外,筛选RA和FLU富集得到的信号通路中包含靶点基因数最多的20条通路,并进行可视化处理(图4)。结果表明,肿瘤坏死因子信号通路(TNF signaling pathway)、MAPK信号通路(MAPK signaling pathway)、雌激素信号通路(estrogen signaling pathway)、趋化因子信号通路(chemokine signaling pathway)等是RA独有的治疗抑郁症的潜在信号通路。神经活性配体受体相互作用(neuroactive ligand-receptor interaction)、钙信号通路(calcium signaling pathway)、多巴胺能突触(dopaminergic synapse)、cAMP信号通路(cAMPsignaling pathway)、花生四烯酸代谢(arachidonic acid metabolism)、炎症介质对TRP通道的调节(inflammatory mediator regulation of TRPchannels)等通路是FLU独有的治疗抑郁症的潜在信号通路。

图4 迷迭香酸(A)和氟西汀(B)抗抑郁的KEGG富集分析
3 讨论
中医认为抑郁症属于“郁证”范畴,多由情志不畅、气机郁滞所致[13],对于郁证的治疗大多以疏肝理气、调节脾胃、养血安神等为主[14]。RA是金粟兰科植物草珊瑚[Sarcandra glabra(Thunb.)Nakai]的指标性成分,而草珊瑚归心经、肝经,具有祛风通络、活血凉血的功效[7],说明草珊瑚有可能通过疏肝理气作用发挥抗抑郁作用。现代药理研究也表明其具有抗炎、抗压的作用[15]。而RA作为草珊瑚的有效成分,已被证明具有抗抑郁作用[16-17],但其抗抑郁作用的许多关键机制还尚未明确。本研究通过网络药理学方法来探究RA和FLU抗抑郁作用的可能机制,为后续新药研发以及联合用药治疗抑郁症提供依据。
通过在线网络数据库分别检索了RA和FLU的潜在作用靶点和抑郁症的作用靶点,结果表明,RA与抑郁症的交集靶点比FLU多18个。对二者与抑郁症的交集靶点进行PPI网络分析,发现二者度值排名前15的交集靶点仅有IGF1一个靶点,说明RA与FLU可能共同作用于IGF1而发挥抗抑郁作用,且通过作用于不同的基因靶点而发挥抗抑郁作用,提示二者的抗抑郁作用机制可能存在较大差异。MCODE聚类分析进一步证明RA和FLU的抗抑郁作用于IGF1密切相关。通过GO功能注释分析,我们发现RA和FLU治疗抑郁症过程都是多个生物过程、分子功能和细胞成分共同参与的结果,涉及到酶结合、蛋白受体结合、离子结合、多种代谢过程调节、信号传导调节等分子功能,是一个多途径协同调节的过程。KEGG分析结果也表明RA和FLU均可以通过5-羟色胺能突触、ErbB信号通路、PI3K-Akt信号通路、神经营养因子信号通路、HIF-1信号通路等信号途径发挥抗抑郁作用,说明RA与FLU可能作用于同一信号通路的不同靶点发挥作用。此外,在GO富集分析和KEGG富集分析预测的GO terms和信号通路中,RA得到的GO terms和潜在信号通路数量远大于FLU,均说明RA的抗抑郁机制比FLU更加广泛。
在RA的HUB基因中,RA已经被证明可以调节脑缺血大鼠AKT、CASP3的水平发挥抗炎、神经保护等作用[18],以RA为主要成分的薄荷可以通过作用于MAPK1、MAPK8、PTGS2在束缚大鼠模型中发挥抗应激作用,并且与RA含量成正比[19],说明RA可能作用于这些靶点发挥抗抑郁作用。虽然目前没有关于RA在神经退行性疾病中与MMP9、MMP2、EGFR、CCL2、JAK2,但研究表明,这些靶点都参与了炎症的发病机制,RA可以作用于MMP9、MMP2、EGFR而抑制肿瘤细胞的增殖、迁移、侵袭能力[20-21]。此外,目前没有关于RA与SRC、IGF1、ESR1、AR、ERBB2的相关报道,而SRC与抑郁症大鼠纹状体神经元有着密切关系[22],ERBB2也与啮齿类动物纹状体神经元兴奋有关[23]。抑郁症患者的IGF1水平高于健康人群,而IGF1又可以作用于大脑的IGF1受体发挥抗抑郁作用[24-25]。分子对接结果也验证了RA与其关键靶点蛋白具有良好的结合能力,并且与MMP2、MMP9、MAPK8、JAK2、EGFR、CASP3、AR、AKT1之间具有较强的结合活性。与此一致,KEGG富集分析结果也表明RA可以通过肿瘤坏死因子信号通路、MAPK信号通路、雌激素信号通路、趋化因子信号通路等发挥抗抑郁作用。
FLU的HUB基因中,BDNF、CYP2D6、SLC6A4、MAOA与FLU的抗抑郁治疗反应相关,可以参与到突触可塑性调节、药物分布、中枢5-HT和去甲肾上腺素的代谢和调节、神经递质的传递等生物学过程[26]。AChE、HTR1A、HTR2A、ADRA2A、SLC6A2、SLC6A3单胺能神经传递相关,HTR1A、AChE、ADRA2A在抑郁动物模型FLU药物反应有关,SLC6A2、SLC6A3是FLU治疗抑郁的作用靶点[27-31],HTR2A与FLU的治疗反应无关。HTR1B启动子区域的甲基化水平与FLU的临床效果呈负相关[32]。FLU可以改善抑郁小鼠脊髓的IGF1表达水平[33],还可以调节抑郁大鼠CASR表达水平,改善突触可塑性[34]。FLU还可以作用于大鼠伏隔核的DRD2、DRD3发挥抗抑郁作用[35]。DRD4的多态性与抑郁症相关[36],OPRK1、OPRM1与啮齿类动物的社交行为相关[37],目前没有FLU作用于这两个靶点的报道。KEGG富集分析结果也表明FLU可以神经活性配体受体相互作用、钙信号通路、多巴胺能突触、cAMP信号通路等发挥抗抑郁作用。
综上所述,RA的HUB基因主要通过调节氧化应激、炎症、细胞凋亡等发挥抗抑郁作用,而FLU的HUB基因主要通过调节单胺能神经传递和突触可塑性发挥抗抑郁作用。此外,已有研究表明RA可以作用于BDNF调节抑郁大鼠神经可塑性[38],也可以调节大鼠多巴胺能神经传递发挥抗神经毒性作用[39],进一步说明RA的抗抑郁机制比FLU更加广泛。提示RA可能与FLU通过联合用药发挥更好的抗抑郁作用。
