Ce掺杂La0.7Sr0.3Cr0.5Fe0.5O3-δ材料的制备及其电化学性能
2022-04-20常香玉苏世阳陈绘丽
常 宏,常香玉,苏世阳,陈绘丽
(1.太原工业学院材料工程系,太原 030013;2.山西大学分子科学研究所,山西省能源转换与存储重点实验室,太原 237016)
0 引 言
近年来化石燃料的大量消耗导致温室效应日益严重,为了实现自然界的“碳中和循环”,CO2的利用和减排技术备受关注。CO2在水中的溶解度较低且化学性质较稳定不易被转化,因此找到有效的CO2转化技术具有重要意义[1-3]。固体氧化物电解池(sold oxide electrolysis cell, SOEC)电解CO2技术在转化利用CO2方面表现出较大的潜力,该技术可以利用太阳能、风能等可再生能源提供的电能,来电解CO2和H2O,制备H2和CO等高附加值化学品,将电能转换成化学能储存起来,在缓解温室效应的同时,为“碳中和循环”提供有效途径,具有重要的研究意义和商业化应用前景[4-6]。
缺乏稳定、高催化活性和成本低廉的燃料电极材料限制了SOEC电解CO2技术的发展[7]。Ni-YSZ燃料电极是SOEC最常用的燃料电极材料,然而Ni颗粒的氧化、积碳和烧结会导致电解池性能下降[8-9]。钙钛矿ABO3-δ材料因其良好的混合离子-电子导电性以及出色的催化性能成为人们关注的重点[10],其中SrFeO3-δ是研究的重中之重,在低氧分压环境下B位Fe4+阳离子会被还原为较低的价态,为保持材料的电中性结构中产生了相应的氧空位。此外铁酸锶盐在较强的还原气氛下会从立方晶系转变为斜方晶系,而在此过程中氧空位始终有序排列[11-12]。其中La0.7Sr0.3Cr0.5Fe0.5O3-δ表现出优异的氧化还原稳定性,可适应阴极的强还原气氛,但其对CO2的催化活性较低限制了其电解效率。材料中的氧空位可有效吸附/活化CO2,并显著提高CO2脱附温度使其适应SOEC的工作温度[13-14]。
在La0.7Sr0.3Cr0.5Fe0.5O3-δ的A位晶格引入氧化还原活性较好的Ce元素,原位构筑氧空位以捕捉CO2分子,实现CO2的高温化学吸附。通过二氧化碳程序升温脱附(CO2-TPD)和热重分析(TGA)来表征电极材料吸附/脱附CO2的能力以及可移动氧空穴含量,评价其高温电解CO2的电流密度-电压-功率(I-E-P)曲线、电化学阻抗(EIS)曲线和电池恒压放电短期、长期稳定性。
1 实 验
1.1 粉体的合成
试验用电解质粉体(Y2O3)0.08(ZrO2)0.92(YSZ)为购买的商业化成品,燃料电极粉体La0.7Sr0.3Cr0.5Fe0.5O3-δ(Sto-LSCrF)、Ce0.08La0.62Sr0.3Cr0.5Fe0.5O3-δ(Ce-LSCrF)、空气电极粉体La0.8Sr0.2Co0.8Fe0.2O3-δ(LSCoF)以及隔离层粉体Sm0.2Ce0.8O1.9(SDC)均通过溶胶-凝胶法合成。以Ce-LSCrF合成为例,合成步骤简述如下:首先按Ce-LSCrF化学计量比准确称取相应的硝酸盐,加入适量蒸馏水充分溶解;然后依次加入乙二胺四乙酸(EDTA)以及柠檬酸(CA),并加入氨水调节pH值为6~7,90 ℃ 缓慢加热除去溶液中的水,得到淡黄色的凝胶前驱体;将其置于烘箱中200 ℃加热10 h,然后在马弗炉中1 100 ℃煅烧2 h后研磨,即得到Ce-LSCrF粉体。
1.2 电池浆料以及电池的制备
燃料电极、空气电极以及隔离层浆料的制备:以Ce-LSCrF浆料为例,先准确称取1.6 g Ce-LSCrF和0.4 g SDC,再用移液管分别量取20 mL异丙醇、4 mL乙二醇、1.6 mL丙三醇,转移至高能球磨罐中,300 r/min球磨35 min制得Ce-LSCrF燃料电极浆料。
单电池的制备:首先称取0.1 g干燥的YSZ粉体放入模具(φ=15 mm),通过干压-煅烧后得到致密的YSZ电解质片。然后依次在YSZ电解质片上均匀喷涂隔离层SDC浆料、燃料电极和空气电极浆料,高温煅烧后即可得到单电池。其次将导电银胶均匀刷涂在电池两侧表面形成集流层,并在电池两侧用银浆粘长度适中的两根银线作为电极引线,最后用银浆将电池密封在石英管上就可以得到构型为Ce-LSCrF|SDC|YSZ|SDC|LSCoF的电解质支撑型电池。为进行对比试验,采用相同方法得到了Sto-LSCrF|SDC|YSZ|SDC|LSCoF单电池。
1.3 电池材料的表征与电化学性能测试
采用X射线衍射仪(BRUKER D8 Advance)对所得样品结构及成分进行分析。采用日本 JSM-7001F型扫描电子显微镜(SEM)对Sto-LSCrF和Ce-LSCrF粉体形貌进行了表征,操作电压为10 kV,需要注意的是样品测试前需对其进行喷金预处理。通过二氧化碳程序升温脱附(CO2-TPD)来测试电极材料吸附/脱附CO2的能力。首先将0.1 g造粒后的电极材料颗粒(300~450 μm)与0.2 g石英砂均匀混合后装入特制的内径为8 mm的固定床石英反应器中部,并在850 ℃用纯H2还原。然后在He保护下降温至450 ℃,并在该温度下通入CO2预处理2 h,随后在He气氛中降温至室温。最后以流速为20 mL·min-1的He 为载气,用Hiden HPR20质谱仪检测反应器从100 ℃加热到900 ℃时 (升温速率为10 mL·min-1) 尾气中的CO2。
通过TA Instruments SDT Q600热重分析(TGA)仪分析电极材料中可移动氧空穴含量,先将样品材料在纯H2气氛中850 ℃还原2 h。然后在惰性气体Ar保护下程序降温至室温,最后记录样品在空气气氛中从300 ℃升温至900 ℃时的质量变化。
燃料电池的电化学性能通过电化学工作站(Ivium Technologies B.V.)获得,主要包括电池的电流密度-电压-功率(I-E-P)曲线、电化学阻抗(EIS)曲线以及电池恒压放电曲线等。其中单电池的 EIS 是在开路电压下获得的, 其频率范围为0.1 Hz~1 MHz,外加交流信号幅值为10 mV。
2 结果与讨论
2.1 XRD分析
通过溶胶-凝胶法制备了Sto-LSCrF、Ce-LSCrF两种燃料电极材料,为确定该粉体在1 100 ℃ 煅烧2 h后的晶体结构,对其进行X射线衍射分析(见图1)。从图1(a)可以看出,Sto-LSCrF和Ce-LSCrF均为结晶性良好的立方钙钛矿,与LaCrO3的标准PDF卡片(PDF#24-1016)相吻合,且在精度范围内没有杂相存在。此外Sto-LSCrF、Ce-LSCrF两种材料的XRD精修结果如图1(b)和1(c)所示,Sto-LSCrF、Ce-LSCrF 的空间群均为Pbnm,Sto-LSCrF的晶格参数为a=5.488 87(7) Å,b=5.520 4(5) Å,c=7.773 6(3) Å,V=235.549 Å3(Rwp=5.55%,Rp=7.11%,判别因子CHI^2=1.78),而Ce-LSCrF的晶格参数为a=5.502 0(1) Å,b=5.5043(6) Å,c=7.778 3(5) Å,V=235.567 Å3(Rwp=5.66%,Rp=7.61%,判别因子CHI^2=2.07)。说明在相同的晶体结构下,A位掺杂Ce使Ce-LSCrF 的晶格发生了畸变,其晶格体积增大,此现象产生的原因可能为Ce离子半径(Ce3+的半径为148 pm,Ce4+的半径为128 pm)小于La的离子半径(La3+的半径为150 pm)[15]。
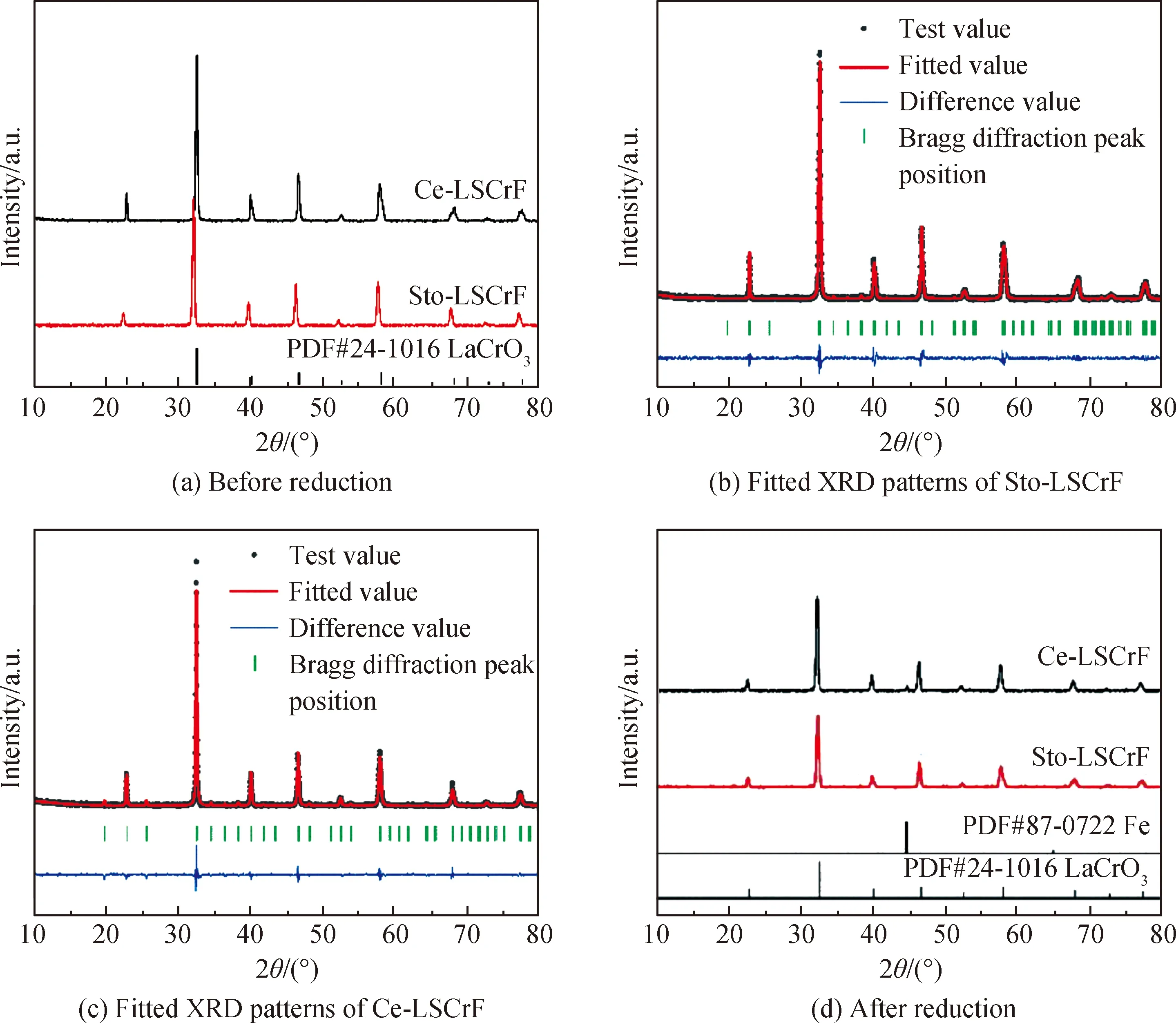
图1 Sto-LSCrF和Ce-LSCrF 850 ℃时在H2中还原前的XRD谱,相应的XRD精修结果以及还原后的XRD谱
为了测试Ce-LSCrF 做燃料电极时(在还原性气氛中)的结构稳定性,将Sto-LSCrF、Ce-LSCrF 在湿氢气气氛中850 ℃处理 2 h,并对其进行X射线衍射分析。如图1(d)所示,Sto-LSCrF仍旧保持着良好的钙钛矿结构,没有杂相生成,因此推测Sto-LSCrF 没有发生可见的分解和相分离现象。而A位掺杂Ce的 Ce-LSCrF的XRD谱显示高温还原后有少量杂相Fe产生,但是仍保持着钙钛矿结构,说明Ce-LSCrF在还原性气氛中具有一定的稳定性[16]。
2.2 粉体形貌分析
燃料电极粉体的形貌和比表面积对材料催化性能有较大影响。图2(a)为Sto-LSCrF粉体的SEM照片,可以看到样品由聚集纳米粒子组成,形貌较均一。而掺入Ce后,Ce-LSCrF样品也呈现类似于Sto-LSCrF粉体的均匀纳米粒子结构,如图2(b)所示。此外为了清晰地评价Sto-LSCrF粉体掺入Ce后对电极孔隙率的影响,通过氮气吸附/脱附法测量Sto-LSCrF和Ce-LSCrF粉体的BET比表面积,样品测试前需将其在真空环境中200 ℃预处理 5 h 以除去其表面吸附的物质。图2(c)和图2(d)分别为Sto-LSCrF和Ce-LSCrF的BET曲线,v为吸附体积,D为直径,Sto-LSCrF粉体的比表面积和孔体积分别为1.06 m2·g-1和0.24 cm3·g-1,Ce-LSCrF粉体的比表面积和孔体积分别为1.16 m2·g-1和0.27 cm3·g-1。另外由图2(c)和(d)插图可知Sto-LSCrF和Ce-LSCrF粉体均表现出介孔结构且其平均孔径分别为10.93 nm和12.51 nm。综上所述,Ce-LSCrF均匀纳米粒子表现出较大的比表面积和平均孔径,可为反应物提供有效的气体通道从而提高其催化活性。
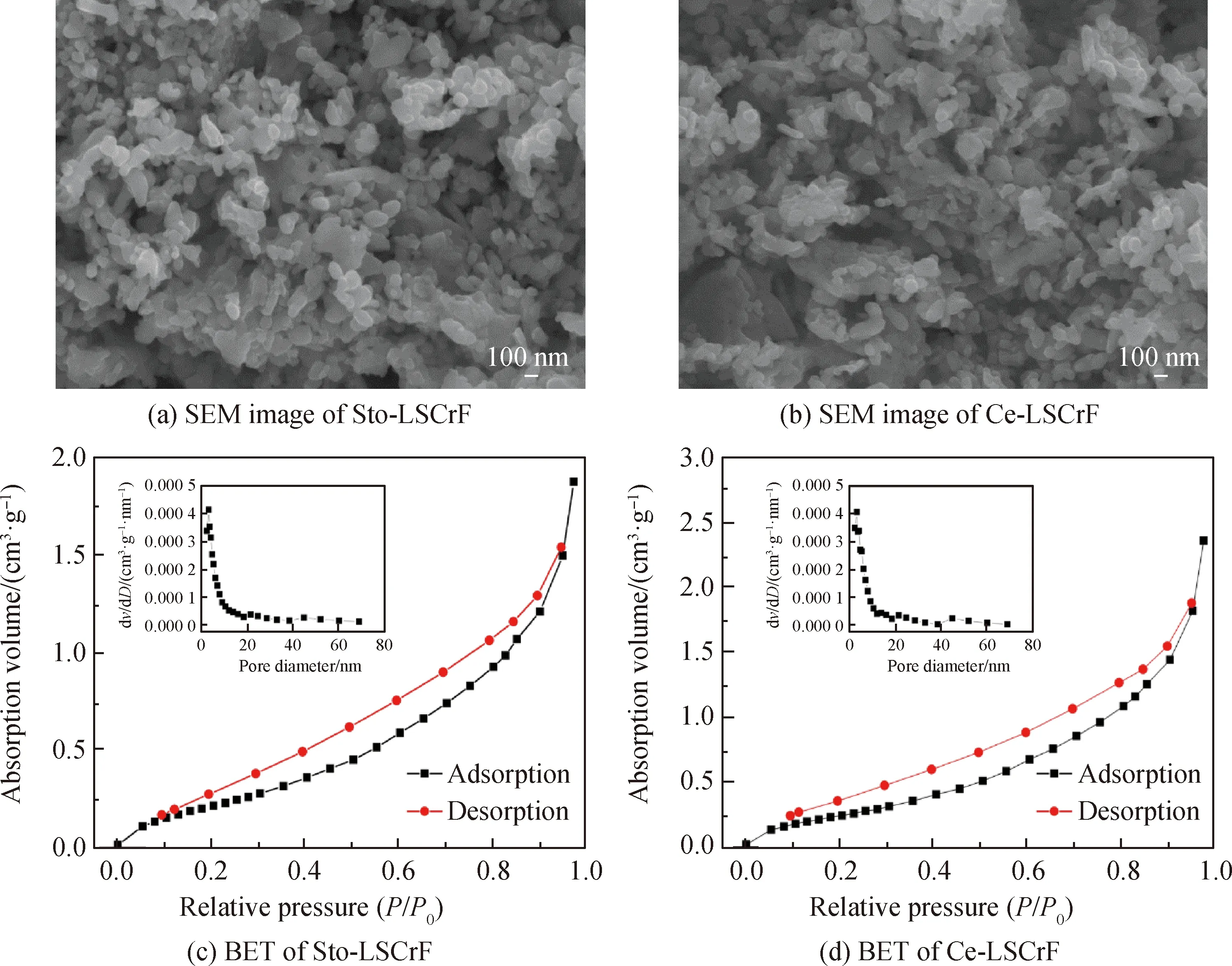
图2 Sto-LSCrF和Ce-LSCrF样品的SEM照片和BET曲线
2.3 TGA分析
因为Sto-LSCrF和Ce-LSCrF样品表现出优良的氧化还原稳定性,所以通过测试样品还原后在空气中的 TGA曲线可以判断材料中可移动的氧空穴含量[17-18]。图3为还原后的Sto-LSCrF和Ce-LSCrF样品在空气中的TGA曲线,可以看到Sto-LSCrF和Ce-LSCrF样品的质量随着温度的升高而增加,增幅分别为0.58%和0.82%。与Sto-LSCrF相比,Ce-LSCrF的质量增幅提高了约41%。由此推断,Ce-LSCrF 中掺杂的多氧化态的 Ce 可以增加钙钛矿结构中可变化的氧空位含量[14,18],进而提高其电化学吸附/活化CO2的能力。
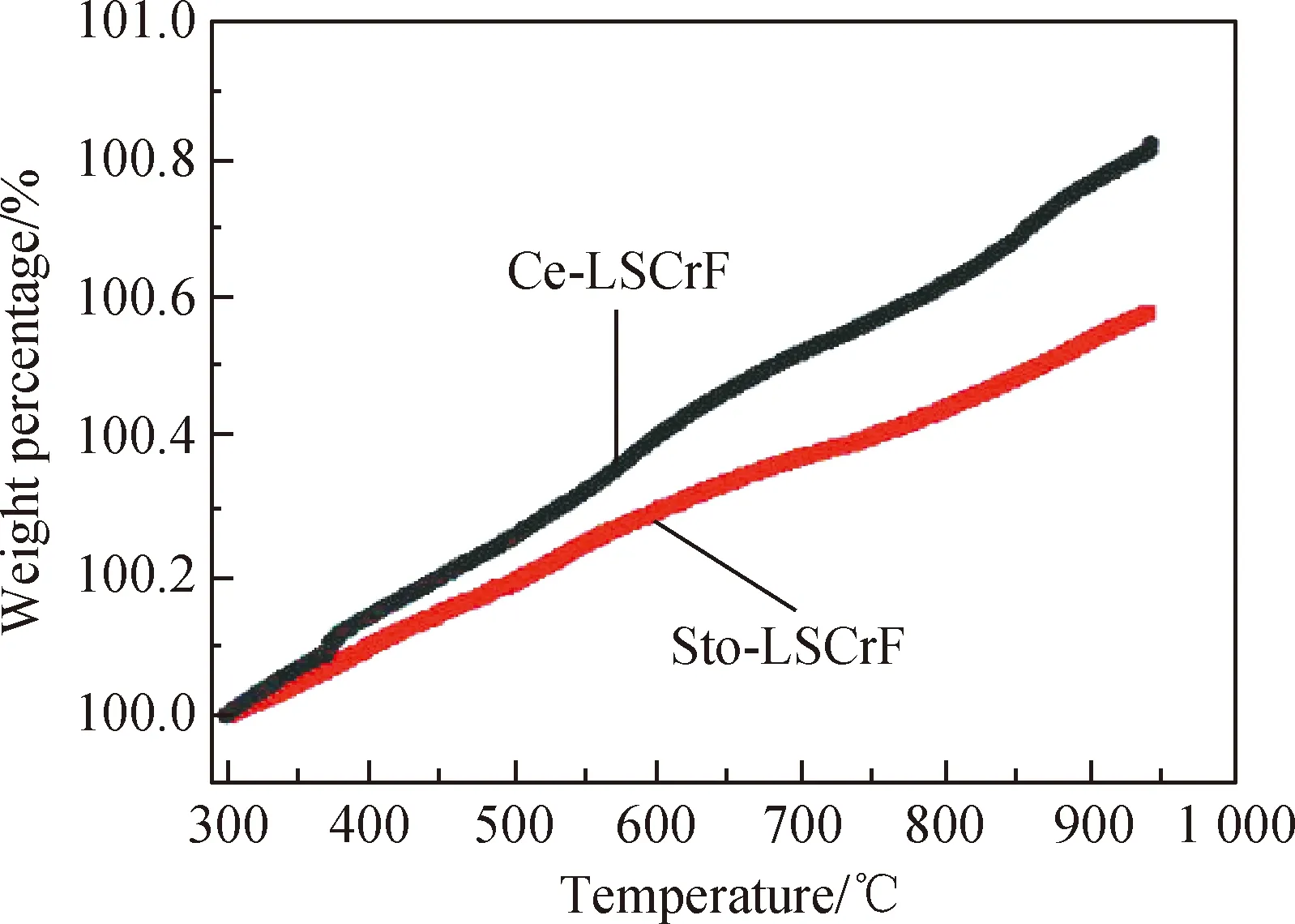
图3 还原后的Sto-LSCrF和Ce-LSCrF样品在空气中的TGA曲线
2.4 CO2-TPD分析
材料中的氧空位可以为高温下化学吸附CO2提供有效的活性位点[19-20]。图4为还原后的Sto-LSCrF和Ce-LSCrF样品的CO2-TPD曲线,可以看到 Sto-LSCrF 样品在215 ℃ 左右有一个较小的CO2物理脱附峰,而Ce-LSCrF 样品在 550~850 ℃ 间表现出较宽的化学脱附峰[19]。另外可以观察到Ce-LSCrF 样品脱附峰的积分大于Sto-LSCrF样品。以上结果表明 Ce-LSCrF样品可在高温下脱附出大量CO2来参与电化学反应从而使电池获得更高的电解性能。根据TGA和CO2-TPD结果可以推测Ce-LSCrF中掺杂的Ce可以产生更多氧空位进而提高其高温化学吸附/活化CO2的能力。
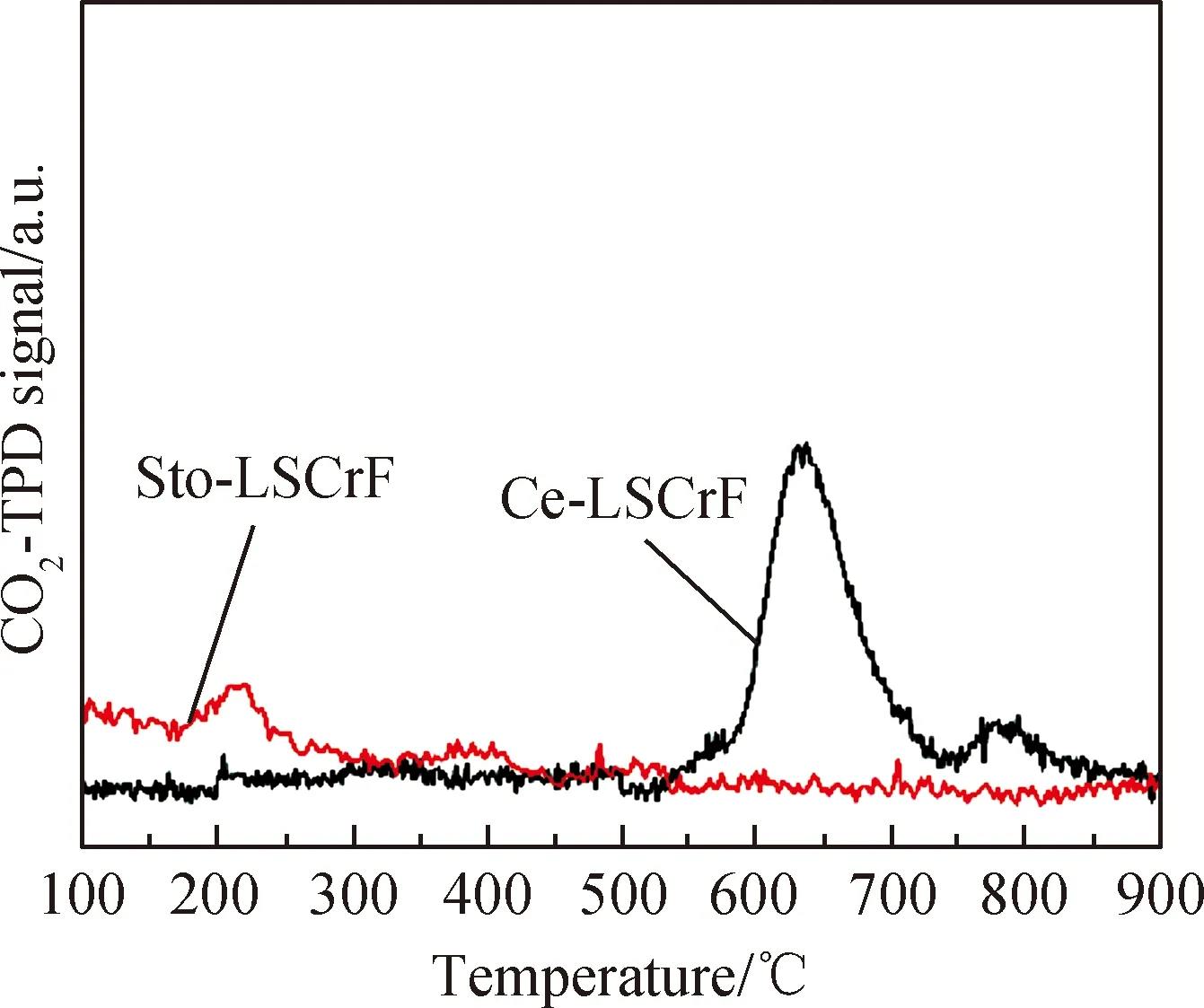
图4 还原后的Sto-LSCrF和Ce-LSCrF样品的CO2-TPD曲线
2.5 单电池电化学性能
2.5.1 单电池在H2气氛下的电化学性能
为了研究Ce-LSCrF电极材料的电化学性能,制备了构型为Ce-LSCrF|SDC|YSZ|SDC|LSCoF的电解质支撑型电池。向电池阴极通入流量为50 mL·min-1的湿H2,阳极置于空气中,在850 ℃测量其电化学性能。图5分别为Ce-LSCrF|SDC|YSZ|SDC|Ce-LSCrF和Sto-LSCrF|SDC|YSZ|SDC|Sto-LSCrF 电池在H2气氛下的电流密度-电压-功率曲线和电化学阻抗曲线。从图5(a)可以看到Ce-LSCrF和Sto-LSCrF基电池的开路电压(OCV)分别为 1.11 V、1.12 V,接近能斯特方程所计算的理论开路电压,说明电池的密封性良好。此外Sto-LSCrF基电池最高功率密度(PPD)为0.38 W·cm-2,而Ce-LSCrF基电池的PPD为0.50 W·cm-2,提高了约32%,这说明掺杂Ce后提高了Ce-LSCrF基电池对H2的催化活性。图5(b)为电池在H2气氛下的EIS曲线,其中:纵坐标为虚部阻抗(Z″),代表容抗;横坐标为实部阻抗(Z′),其与实轴在高频处与低频处的截距分别代表欧姆电阻(Ro)和总电阻(RT),而高频处与低频处的截距为极化阻抗(RP)。可以看出Sto-LSCrF电池和Ce-LSCrF电池的Ro分别为0.331 Ω·cm2和0.334 Ω·cm2,这是因为电池的Ro主要来源于电解质的离子电阻[21-22]。Sto-LSCrF电池的RP为0.499 Ω·cm2,而Ce-LSCrF电池的RP减小为0.436 Ω·cm2,极化阻抗减小通常归因于电极/电介质界面处的电化学过程以及与传质过程有关的气相扩散和解离过程[21-22]。说明掺杂Ce后可以提高Ce-LSCrF的电化学性能,降低极化阻抗值。
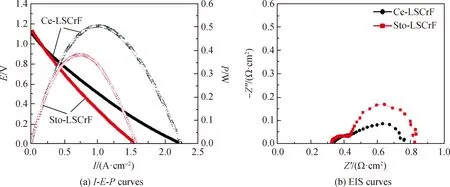
图5 Ce-LSCrF和Sto-LSCrF基电池在H2气氛下的电流密度-电压-功率曲线和阻抗曲线
2.5.2 单电池在CO2/CO气氛下的电化学性能
为了研究Ce-LSCrF 材料电解CO2的性能,向电池燃料电极通入流量为 30 mL·min-1的混合气体(VCO2∶VCO=8 ∶2),空气极置于空气中,在850 ℃测量其电化学性能。图6(a)为Sto-LSCrF和Ce-LSCrF基电池在850 ℃时电解CO2的电流密度-电压曲线,可以看到随着外加电压的增加其电流密度逐渐增加。如在1.5 V和1.9 V时Sto-LSCrF电池其电流密度分别为0.34 A·cm-2和0.62 A·cm-2。另外可以看到在相同电压下,Ce-LSCrF基电池的电解性能较高,例如在1.9 V时Ce-LSCrF电流密度可达到1.41 A·cm-2,比相同电压下的Sto-LSCrF提高了约32%。以上结果表明,Ce-LSCrF中较多的氧空位可提高其吸附/活化CO2的能力进而提高其电解CO2的性能[23]。图6(b)为Sto-LSCrF和Ce-LSCrF基电池在850 ℃ 时电解CO2的 EIS 曲线。极化电阻是评估电极材料催化性能的重要指标[24-25],如图所示,Sto-LSCrF和Ce-LSCrF基电池的Rp值分别为0.53 Ω·cm2和0.36 Ω·cm2。Ce-LSCrF基电池较低的Rp值表明较快的电极动力学有利于促进CO2的还原,这归因于Ce-LSCrF中Ce的掺杂提高了材料中的氧空穴含量[25]。
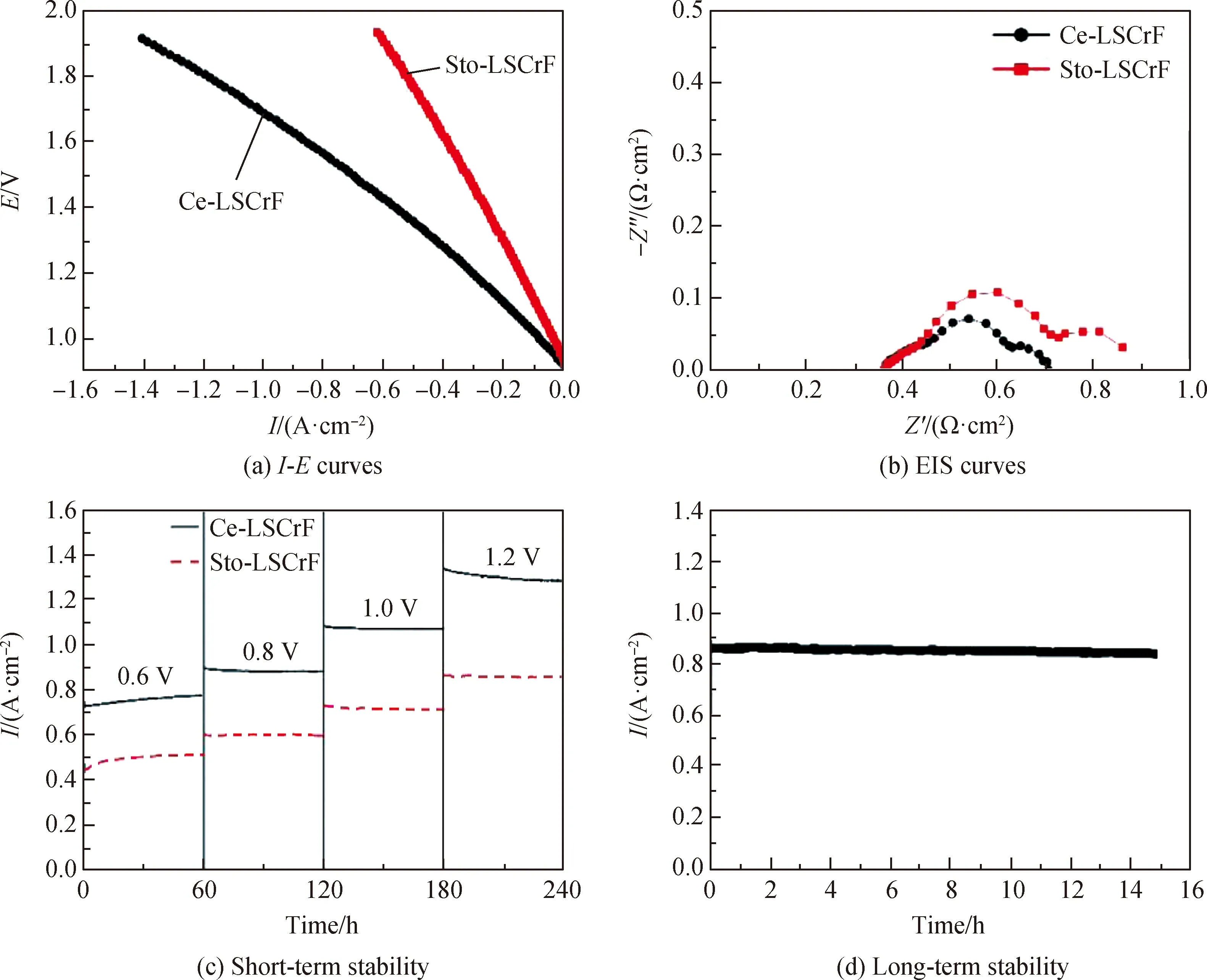
图6 Sto-LSCrF和Ce-LSCrF基电池在850 ℃时电解CO2的电流密度-电压曲线和阻抗曲线,Sto-LSCrF和Ce-LSCrF基电池在恒压负载条件下的短期和长期稳定性曲线
为了进一步研究Ce-LSCrF基电池电解CO2的性能,对Sto-LSCrF和Ce-LSCrF基电池施加一系列外加电压以研究其短期稳定性。从图6(c)可以看到在外加电压相同的条件下,Ce-LSCrF基电池的电流密度高于Sto-LSCrF电池,这与前面TGA结果相吻合。另外可以观察到随着电压增加,Sto-LSCrF和Ce-LSCrF基电池的电流密度逐渐增加。如随着外加电压从0.6 V增加到1.0 V,Ce-LSCrF的电流密度从0.75 A·cm-2增加到1.07 A·cm-2,这归因于外加电压的增加可产生更强的还原电位,从而使材料中产生更多的可吸附/活化CO2的氧空位,进而提高电极反应效率。电池的稳定性对商业化应用极为重要,图6(d)是850 ℃时Ce-LSCrF基电池在OCV基础上恒压负载为0.8 V时的长期稳定性曲线。可以观察到电池在VCO2∶VCO=8 ∶2中能够稳定运行16 h,电流密度稳定在 0.86 A·cm-2,这说明 Ce-LSCrF燃料极材料具有比较高的稳定性。
3 结 论
(1)采用溶胶-凝胶法可以成功将Ce掺杂到La0.7Sr0.3Cr0.5Fe0.5O3-δ中得到Ce-LSCrF、Sto-LSCrF和Ce-LSCrF,样品均表现出较好的氧化还原稳定性。TGA和CO2-TPD结果表明Ce-LSCrF中掺杂的Ce可以增加材料可移动的氧空位含量,进而提高其吸附/活化CO2能力,使更多的CO2可以参与电化学反应。
(2)在电压为1.9 V时,Sto-LSCrF电流密度仅为0.62 A·cm-2,Ce-LSCrF电流密度达到了1.41 A·cm-2,提高了约32%。此外Ce-LSCrF基电池在VCO2∶VCO=8 ∶2 燃料中能稳定运行16 h且电流密度稳定在0.86 A·cm-2,几乎没有出现明显衰减现象。因此,Ce掺杂是提高Ce-LSCrF电化学性能的一种有效方法,在燃料电池领域具有较好的应用前景。
