二烷基磷酸酯离子液体对NH3的高效吸收*
2022-04-20史云岚王思涵
史云岚, 于 游, 王思涵, 朱 霄
(曲阜师范大学化学与化工学院,273165,山东省曲阜市)
0 引 言
NH3是一种有毒气体,会对人类健康和环境造成严重的损害和污染[1-2]. 例如,NH3排放到空气中是形成小于2.5微米颗粒物(PM2.5)[3]的主要原因. 另一方面,NH3可作为化学工业中的一种重要原料,它可以转化为许多其他物质和化学产品,如化肥、尿素和炸药. 此外,工业制冷系统是NH3最重要的应用之一. 因此,尾气中NH3的去除和回收无疑对环境、气候和经济具有重要意义.
然而传统的NH3捕集技术,如水和酸性水溶液吸收法,由于吸附剂与NH3之间的强烈结合,往往会存在废水及副产品过多、再生能耗高等问题[4]. 因此,开发高效、稳定、选择性好以及经济、环保的NH3吸附剂是十分必要的. 经过几十年的发展,离子液体(ionic liquid)因其具有可忽略的蒸汽压、热稳定性高、液体范围广、性能可调等优异性能而被认为是绿色溶剂,使其在催化剂[5],有机合成[6],电化学[7],生物质转化[8],酸性气体吸收[9]等领域具有广泛的应用. 2007年Yokozeki A等[10-11]首次报道了NH3在咪唑离子液体中的溶解. 此后,越来越多的功能型离子液体被不断开发并用于NH3的吸收. 近年来,磷酸酯离子液体在溶解聚合物[12]、电极[13]、表面活性剂[14]等方面受到了广泛的关注. 本文制备了5种二烷基磷酸酯离子液体,在不同温度和NH3分压下测量了压力-温度-组分(pTx)数据. 为了揭示NH3在离子液体中的热力学性质,利用Peng-Robinson (P-R)状态方程计算了NH3的亨利定律常数,并计算了NH3在离子液体中的溶解焓ΔsolH,溶解熵ΔsolS和溶液吉布斯自由能ΔsolG等热力学性质.
1 实验部分
1.1 材料
高纯NH3(纯度99.999%)(由北京北文气材厂供应). 二烷基磷酸酯离子液体的分子结构和详细信息见图1和表1,所有离子液体均由上海成杰化工有限公司提供. 离子液体使用之前,在353.15 K的真空下干燥48 h. 离子液体的含水量采用Karl Fischer滴定仪(Mettler Toledo C20)测定,结果(见表2)表明离子液体的含水量均小于400 mg/L.

图1 二烷基磷酸酯离子液体的分子结构

表1 应用于本文的二烷基磷酸酯离子液体

表2 离子液体的含水量
1.2 NH3的吸收实验
吸收NH3的实验设备如图2所示[15]. 在316 L不锈钢制成的吸收罐(48.1 mL体积)中放入约10 g 离子液体,用磁力搅拌器搅拌. 待吸收容器保持在真空状态后,将NH3以所需压力从气体室注入吸收罐中. 在吸收过程中,吸收罐内压力逐渐减小,用压力传感器记录压力变化(精度为0.75,满量程为0~20 MPa). 当压力保持恒定2 h以上时,可视为达到吸收平衡,然后引入更多的气体进入吸收罐达到新的平衡. 吸收罐和储气罐浸泡在循环水浴中,以保持恒温.

(1.气瓶,2.储气罐,3.吸收罐,4.电磁搅拌器,5.压力计,6.阀,7.真空泵)图2 气体吸收装置原理图
通过吸收罐和储气罐内压力的变化,利用Peng-Robinson (P-R)状态方程[16]计算NH3的溶解度. Peng-Robinson方程如下
k=0.3746+1.54226ω-0.26992ω2.
p是NH3压强,T是吸收温度,Vm是NH3的摩尔体积,a,b和α是相关系数,Tc和Pc是NH3的临界温度和临界压力,Tr是相对温度,可以通过T/Tc获得,ω为偏心因子. 离子液体中NH3的溶解度可以通过如下公式计算
VA是吸收罐的体积,VIL是离子液体的体积,Yuan等[17]曾报道离子液体在吸收气体前后的体积变化可以忽略,VIL可以被认为是不变的.n(NH3)为NH3在离子液体中的物质的量,x(NH3)为NH3在离子液体中的摩尔分数.
1.3 热力学性质
离子液体中NH3的亨利定律常数H可以通过如下公式计算[18]
(1)
其中f1(T,p)为NH3的逸度,peq为平衡分压,φ1(T,p)为状态方程P-R计算的逸度系数
(2)
根据Krichevsky-Kasarnovsky (K-K)方程,逸度可以表示为
(3)
然后可以绘制出ln(f/xNH3)~p的关系图,根据直线斜率可得亨利定律常数H.由于气体溶解过程的热力学函数与亨利定律常数有关,利用公式(4)~公式(7)计算了溶解焓ΔsolH,溶解熵ΔsolS和吉布斯自由能ΔsolG.
(4)
考虑到本文所涉及的温度范围并不宽,ΔsolH的焓值可以认为是恒定的.因此,亨利定律常数H与溶解焓ΔsolH之间的关系可以表示为
(5)
然后,将lnH相对于1/T作图,利用简单的线性回归方法得到ΔsolH. 溶液吉布斯自由能ΔsolG和溶解熵ΔsolS可利用公式(6)~公式(7)计算:
ΔsolG=RTlnH,
(6)
(7)
2 结果和讨论
2.1 NH3在离子液体中的溶解度
表3和图3~图7给出了303.15~333.15 K,压力0.1~0.6 MPa下,NH3在二烷基磷酸酯离子液体中的溶解度. 显然,温度和压力对NH3的溶解产生重要影响. 如图3~图7所示,随着温度和压力的升高,离子液体中NH3的摩尔分数逐渐降低,这与其他离子液体对NH3的吸收行为一致[19-20].

表3 不同温度下NH3在离子液体中的溶解度(x为摩尔分数)
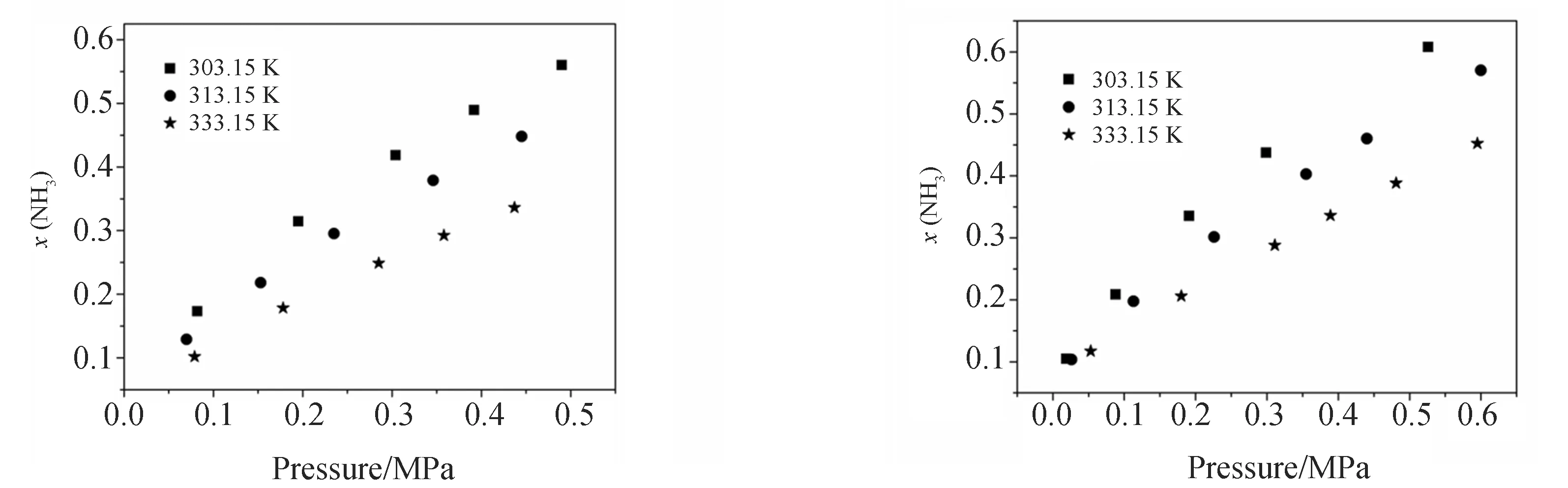
图3 NH3在[C4C1im][DBP]中的溶解度 图4 NH3在[C4C1im][DMP]中的溶解度

图5 NH3在[C2C1im][DEP]中的溶解度 图6 NH3在[C2C1im][DMP]中的溶解度
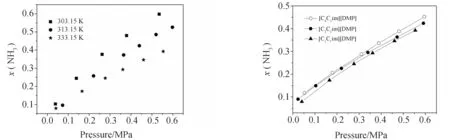
图7 NH3在[C1C1im][DMP]中的溶解度 图8 333.15 K时NH3在离子液体中的溶解度
2.2 阳离子和阴离子对NH3溶解度的影响
如图8所示,当阴离子均为DMP-时,NH3的溶解度大小顺序依次为[C4C1im]+>[C2C1im]+>[C1C1im]+,说明NH3的溶解度随着阳离子咪唑环侧链长度的增加而增大. 在其他离子液体[19]中也发现了类似的现象.
利用图9、图10可以对不同的阴离子进行比较. 在阳离子为[C4C1im]+或[C2C1im]+的情况下,NH3在离子液体中的溶解度大小顺序为:[C4C1im][DMP]>[C4C1im][DBP] 和[C2C1im][DMP] >[C2C1im][DEP],说明阴离子中烷基侧链长度越短,NH3的溶解度越高.
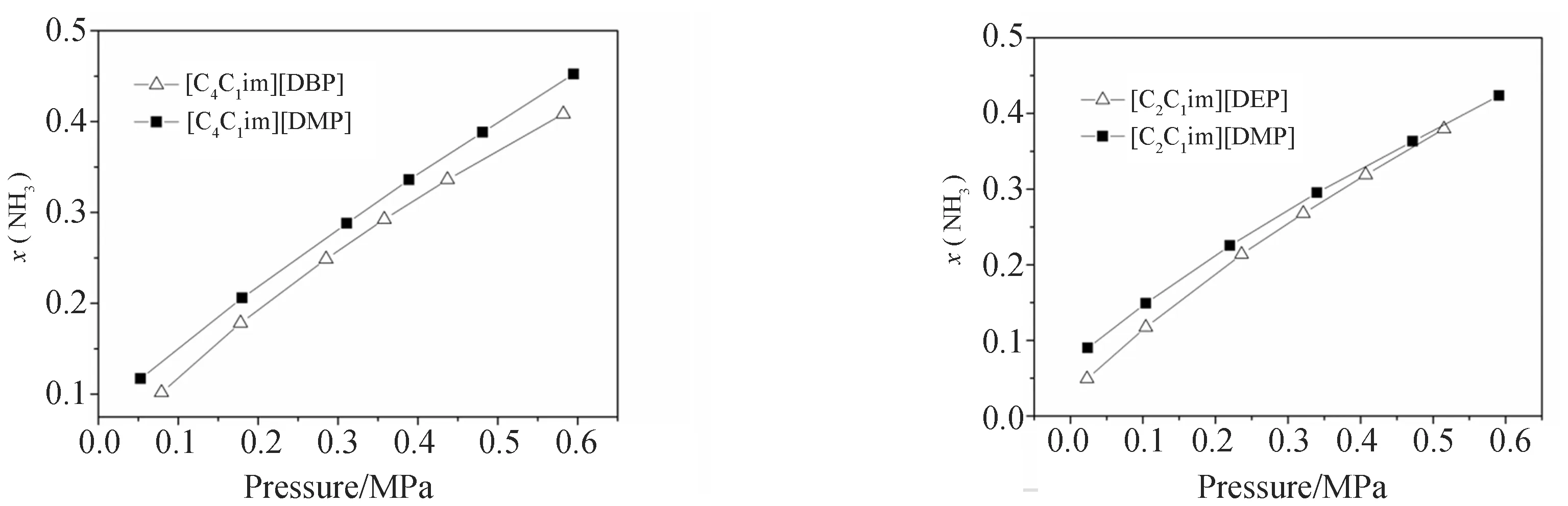
图9 333.15 K时NH3在离子液体中的溶解度 图10 333.15 K时NH3在离子液体中的溶解度
2.3 离子液体中NH3的亨利定律常数
亨利定律常数H常被用来评估气体在溶剂中的溶解度. 根据式(1)~式(3)和实验测得的溶解度数据,然后根据ln(f/xNH3)~p的关系图得到了不同温度下NH3在5种二烷基磷酸酯离子液体中的亨利定律常数,列于表4中. 结果表明,温度对亨利定律常数有着显著影响. 例如,[C4C1im][DBP]在303.15 K,313.15 K和333.15 K时的亨利定律常数分别为443.7 kPa,558.2 kPa和777.3 kPa,说明离子液体加热后,NH3在其中的溶解度逐渐减小. 此外,我们发现了不同离子液体之间的差异. 以[C4C1im][DMP]、[C2C1im][DMP]和[C1C1im][DMP]为例,在333.15 K时,这3种离子液体的亨利定律常数分别为527.2 kPa,598.5 kPa和842.0 kPa. 由于亨利定律常数越大,气体的溶解度越小,因此NH3的溶解度也按此顺序排列:[C4C1im][DMP]> [C2C1im][DMP]> [C1C1im][DMP],这与图8的溶解度数据一致. [C4C1im][DBP]和[C4C1im][DMP]具有相同的阳离子,333.15 K时,[C4C1im][DBP]和[C4C1im][DMP]的亨利定律常数分别为777.3 kPa和527.2 kPa,说明NH3在[C4C1im][DMP]中的溶解效果优于[C4C1im][DBP],如图9所示.
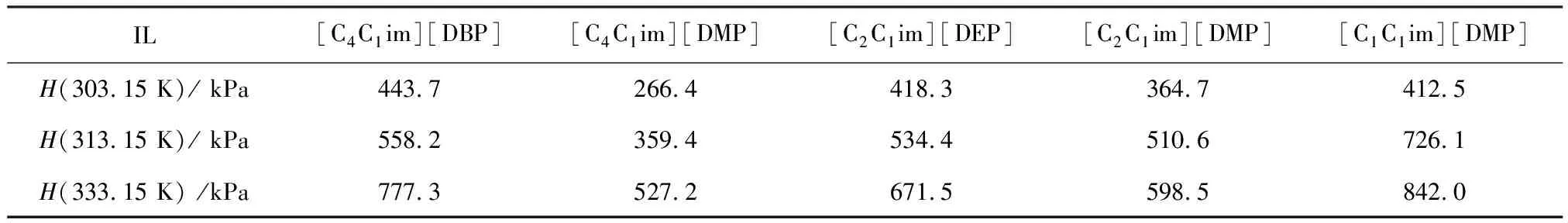
表4 在不同温度下的离子液体中NH3的亨利定律常数H
2.4 离子液体中溶解NH3的热力学性质
为了进一步研究NH3在二烷基磷酸酯离子液体中的溶解行为,根据亨利定律常数,利用式(5)~式(7)计算了NH3在离子液体中的溶解焓ΔsolH,溶解熵ΔsolS和溶液吉布斯自由能ΔsolG等热力学性质. 由表5可知,NH3吸附的溶解焓ΔsolH值均为负,说明NH3在离子液体中的溶解为放热过程. 吸收焓是表征气液相相互作用的一个重要参数. 与[C2C1im][DMP]和[C1C1im][DMP]相比,[C4C1im][DMP]的ΔsolH绝对值较高,表明NH3与[C4C1im][DMP]之间的相互作用更强,这其更小的亨利定律常数和较高的NH3溶解度相一致. 而且[C4C1im][DMP]ΔsolH的绝对值大于[C4C1im][DBP],与图9所示的溶解表现相一致.
[C2C1im][DMP]和[C1C1im][DMP]ΔsolH的绝对值分别为16.21 kJ·mol-1和18.32 kJ·mol-1,说明NH3与[C2C1im][DMP]的相互作用更弱一些,这与图10中[C2C1im][DMP]较高的NH3溶解度并不一致. Zeng[21]曾报道了[E3Py][NTf2]和[E1Py][NTf2]两种离子液体捕集CO2的性能,对于结构相似而侧链长度不同的离子液体,气体在其中的溶解度不仅仅与气体—离子相互作用有关,离子液体的自由体积也可能对气体的溶解度起主要作用.
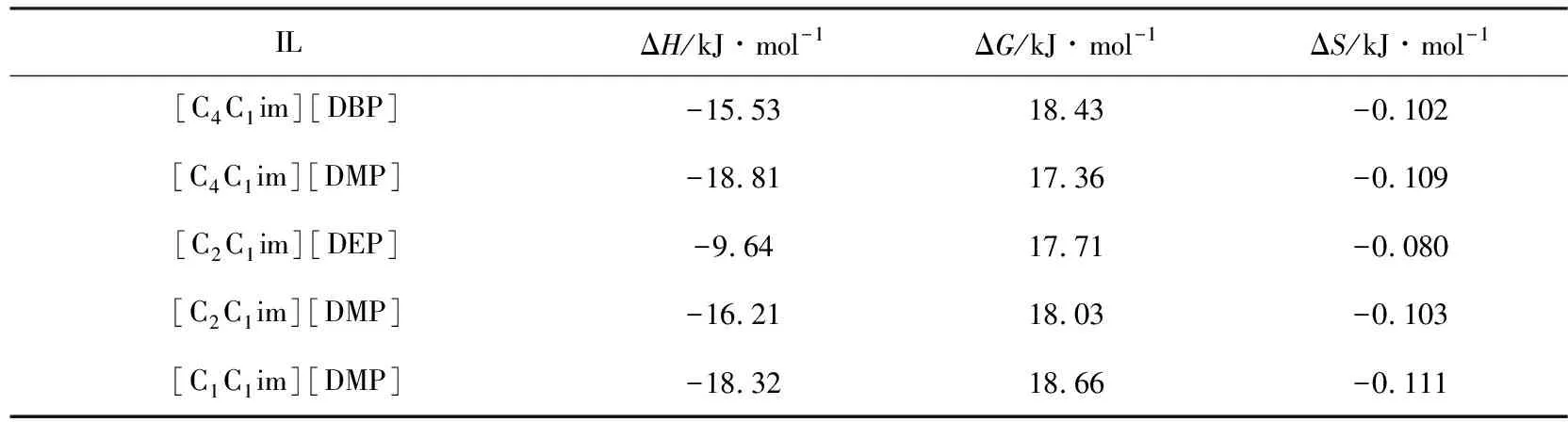
表5 在333.15 K时,离子液体中NH3的热力学性质
3 结 论
本文研究了NH3在5种二烷基磷酸酯离子液体中的溶解度. 在不同温度和压力下测量了NH3在其中的溶解度. 结果表明,温度、压力以及阴、阳离子的结构对离子液体的理化性质和溶解度有重要影响. NH3的溶解度随温度的降低和压力的增加而增大. 此外,咪唑阳离子的侧链增长,阴离子的侧链缩短更有利于提高NH3的溶解度. 利用Peng-Robinson (P-R)状态方程计算了NH3在离子液体中的亨利定律常数,进而计算得到了溶解过程的热力学函数. 结果显示,ΔsolH绝对值越高,对应的亨利定律常数越小,则表明NH3与离子液体的相互作用越强,NH3在离子液体中的溶解度越高.
