大蒜素对丙泊酚麻醉所致老年大鼠认知功能障碍的影响*
2022-04-20魏红芳王飞杨晓彬苑进革王瑞李斐陈永学
魏红芳,王飞,杨晓彬,苑进革,王瑞,李斐,陈永学
(邯郸市中心医院,邯郸 056000)
认知功能障碍是老年患者较为常见的术后并发症,主要表现为记忆力减退、学习能力下降、注意力不集中等,严重影响患者的生活质量,麻醉药抑制中枢胆碱能系统所致海马CA1区神经元损伤是其主要病理机制[1-2]。丙泊酚具有起效快、诱导期短、苏醒快的特点,是临床上常用的静脉麻醉药,但研究发现丙泊酚能够引发氧化应激、炎症反应及海马CA1区神经元凋亡而影响认知功能障碍[3-6]。
大蒜素(Allicin)是由大蒜鳞茎中提取的一种有机硫化合物,化学名为二烯丙基三硫化物,具有广泛的生物活性,有研究发现大蒜素能够通过抑制细胞凋亡、炎症和氧化应激损伤对感染性休克、脑缺血再灌注及铅中毒大鼠海马神经元起到保护作用[7-9];并且大蒜素能够通过抑制氧化应激和炎症反应改善阿尔茨海默病小鼠模型、血管性痴呆大鼠模型认知功能[10-11],但大蒜素是否对丙泊酚麻醉所致认知功能障碍具有改善作用尚未见文献报道。本实验旨在研究大蒜素对丙泊酚麻醉所致老年大鼠认知功能障碍的影响及其可能的作用机制。
1 材料与方法
1.1 实验动物与分组 120只无特定病源体级老年雄性SD大鼠,20月龄,体质量550~610 g,购自河北省实验动物中心[SYXK(冀)2018-004];清洁环境分笼饲养1周后开展实验[12 h光照黑暗交替、室温(25±1)℃、相对湿度(60±5)%],自由饮水进食。按照随机数字表法将大鼠分为正常对照组、模型组、吡拉西坦组(500 mg/kg)[12]和大蒜素低、中、高剂量组(5、10、20 mg/kg),每组 20 只。
1.2 实验药物与试剂 大蒜素注射液购自上海禾风制药有限公司(批号:4E38011);吡拉西坦注射液购自徐州莱恩药业有限公司(批号:2001014);丙泊酚购自西安力邦制药有限公司(批号:201908006)。原位末端标记法(TUNEL)试剂盒和超氧化物歧化酶(SOD)、过氧化氢酶(CAT)、丙二醛(MDA)试剂盒购自南京建成生物工程研究所(批号:200113、191207、191125、200108);酶联免疫吸附(ELISA)法肿瘤坏死因子-α(TNF-α)、白细胞介素-1β(IL-1β)、白细胞介素-6(IL-6)试剂盒购自北京索莱宝生物科技有限公司(批号:SEKR-0009、SEKR-0002、SEKR-0005);核因子 E2 相关因子 2(Nrf2)、抗血红素加氧酶-1(HO-1)、核因子-κB(NF-κB)、β-actin抗体购自北京博奥森生物技术有限公司(批号:bs-1074R、bs-23667R、bs-20355R、bs-0061R);ECL超敏化学发光液购自美国Thermo Fisher Scientific公司(批号:EB191104)。
1.3 主要仪器 DMS-2型Morris水迷宫及视频分析系统(中国医学科学院药物研究所);RM2125型石蜡切片机(德国Leica公司);SZ-1型组织匀浆器(江苏金坛市晶玻实验仪器厂);UV2100型紫外-可见分光光度计(北京瑞利分析仪器有限公司);CS-15R型低温离心机(美国Beckman公司);Model 680型酶标仪(美国Bio-Rad公司);CKX41型倒置光学显微镜(日本Olympus公司);SE300型电泳仪、TE22型转膜仪(美国Hoefer公司);Chem Doc XRS型凝胶成像仪(美国Bio-Rad公司)。
1.4 实验方法
1.4.1 模型制备与给药 正常对照组大鼠腹腔注射生理盐水,其余各组大鼠均100 mg/kg腹腔注射丙泊酚实施麻醉造模[13];待麻醉后各组大鼠分别腹腔注射给予相应药物(正常对照组和模型组给予生理盐水),每日1次,共7 d。
1.4.2 Morris水迷宫实验评测学习记忆能力 Morris水迷宫平台固定于第3象限,水温设置为(25±1)℃。给药治疗完成后,各组随机选取10只大鼠,充分适应游泳环境以减少应激反应,并诱导大鼠找到位于第3象限的平台。1)定位航行实验:于治疗完成后第2 d开始连续检测4 d。每日将每只大鼠分别从第1、2、4象限固定入水点头朝器壁方向放入水中,记录每只大鼠找到平台的时间(若120 s时间内未能找到平台则按120 s计算),各组大鼠取平均值,即逃避潜伏期;2)空间探索实验:待定位航行实验完成后,撤除第3象限平台,每只大鼠于第1象限固定点头朝器壁方向放入水中,记录120 s时间内穿越平台次数。逃避潜伏期和穿越平台次数能够分别代表认知能力中的学习能力和记忆能力。
1.4.3 苏木精-尹红(HE)染色法行海马CA1区神经元病理学检查 给药治疗完成后,各组随机选取10只大鼠,颈椎脱臼处死后取脑组织,去除小脑、脑干后置4%多聚甲醛溶液中固定72 h,浸石蜡包埋、切片(厚度约5 μm)和展片后,二甲苯脱蜡、梯度乙醇水洗后行HE染色(苏木精染色10 min、水洗后0.5%盐酸乙醇分化3 s、0.5%尹红乙醇染色1 min、80%乙醇分化3 s),梯度乙醇脱水、二甲苯透明后中性树胶封片,通过光学显微镜观察各组大鼠海马CA1区神经元病理学变化。
1.4.4 TUNEL染色法行神经元凋亡检查 取脑组织石蜡切片,经二甲苯脱蜡、梯度乙醇水洗后,按照TUNEL试剂盒操作说明行TUNEL染色,经脱水处理后50%甘油封片,然后通过倒置光学显微镜观察,细胞核黄褐色为阳性着色(凋亡细胞)。凋亡指数(AI)的计算:每只大鼠脑组织TUNEL染色切片均选取5张,每张切片随机取5个不重叠视野,计数视野内凋亡细胞数和细胞总数,AI(%)=(凋亡细胞数/细胞总数)×100%。
1.4.5 海马组织SOD、CAT活性和MDA含量检测 分别取各组剩余的10只大鼠,颈椎脱臼处死后取大脑、冰上剥离海马组织,剪碎、加入适量4℃冷裂解液后匀浆处理,4℃离心(离心半径10 cm、转速3 500 rpm、时间10 min)取上清液,采用黄嘌呤氧化酶法测定SOD活性、高锰酸钾滴定法测定CAT活性、硫代巴比妥酸法测定MDA含量。
1.4.6 海马组织TNF-α、IL-1β、IL-6含量检测 取“1.4.5”制备的组织匀浆液,4℃离心(离心半径10cm、转速3 500 rpm、时间10 min)取上清液,按照ELISA试剂盒操作方法处理,通过酶标仪检测TNF-α、IL-1β、IL-6含量。
1.4.7 海马组织Nrf2、HO-1、NF-κB蛋白表达检测取“1.4.5”制备的组织匀浆液,经4℃离心(离心半径10 cm、转速 12 000 rpm,时间 20 min)取沉淀,采用BCA法检测总蛋白浓度,10%十二烷基硫酸钠聚丙烯酰胺凝胶电泳分离蛋白、湿法转PVDF膜、5%脱脂奶粉室温封闭1 h,滴加一抗(Nrf2、HO-1、NF-κB、β-actin)后4℃孵育过夜,洗膜后滴加二抗37℃孵育1 h,洗膜后滴加ECL显色,然后以β-actin为内参半定量Nrf2、HO-1、NF-κB蛋白表达。
1.5 统计学处理 运用SPSS 20.0软件进行统计处理,实验数据以均数±标准差(±s)表示,多组间比较采用单因素方差分析,两两比较采用LSD-t检验,P<0.05为差异有统计学意义。
2 结果
2.1 各组大鼠学习记忆能力比较 与正常对照组比较,给药结束后第2~5天模型组大鼠逃逸潜伏期延长且穿越平台次数减少(P<0.01);与模型组比较,给药结束后第2~5天吡拉西坦组和大蒜素中、高剂量组逃逸潜伏期缩短、穿越平台次数增加(P<0.05或P<0.01);与吡拉西坦组比较,给药结束后第 3~5 天大蒜素高剂量组逃逸潜伏期缩短、穿越平台次数增加(P<0.05)。见图1和表1。

图1 各组大鼠定位巡航实验轨迹Fig.1 Locate cruise experimental track of rats in each group
表1 各组大鼠学习记忆能力评测结果(±s)Tab.1 Evaluation results of learning and memory ability of rats in each group(±s)
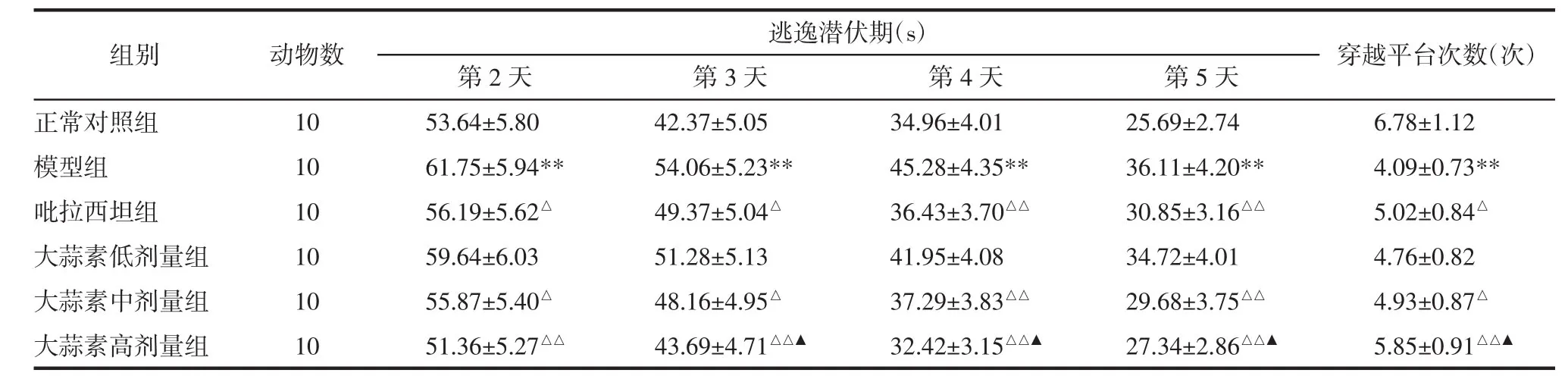
表1 各组大鼠学习记忆能力评测结果(±s)Tab.1 Evaluation results of learning and memory ability of rats in each group(±s)
注:与正常对照组比较,**P<0.01;与模型组比较,△P<0.05,△△P<0.01;与吡拉西坦组比较,▲P<0.05。
组别正常对照组模型组吡拉西坦组大蒜素低剂量组大蒜素中剂量组大蒜素高剂量组动物数10 10 10 10 10 10逃逸潜伏期(s) 穿越平台次数(次)第2天 第3天 第4天 第5天53.64±5.80 42.37±5.05 34.96±4.01 25.69±2.74 6.78±1.12 61.75±5.94** 54.06±5.23** 45.28±4.35** 36.11±4.20** 4.09±0.73**56.19±5.62△ 49.37±5.04△ 36.43±3.70△△ 30.85±3.16△△ 5.02±0.84△59.64±6.03 51.28±5.13 41.95±4.08 34.72±4.01 4.76±0.82 55.87±5.40△ 48.16±4.95△ 37.29±3.83△△ 29.68±3.75△△ 4.93±0.87△51.36±5.27△△ 43.69±4.71△△▲ 32.42±3.15△△▲ 27.34±2.86△△▲ 5.85±0.91△△▲
2.2 各组大鼠海马CA1区神经元病变比较 正常对照组大鼠海马CA1区神经元形态结构未见异常;模型组呈现海马CA1区神经元数量减少、排列疏松无序,胞膜、核膜边界不清,胞核固缩深染等病理学改变;与模型组比较,吡拉西坦组和大蒜素中、高剂量组海马CA1区神经元形态结构病理性改变明显改善,其中大蒜素高剂量组效果优于其他组。见图2。

图2 各组大鼠海马CA1区神经元病变(HE,×400)Fig.2 Neuronal pathological changes in hippocampal CA1 area of rats in each group(HE,×400)
2.3 各组大鼠海马CA1区神经元凋亡状况比较 正常对照组大鼠海马CA1区仅可见极少量凋亡神经元;与正常对照组比较,模型组海马CA1区凋亡神经元数量明显增多,AI显著升高(P<0.01);与模型组比较,吡拉西坦组和大蒜素低、中、高剂量组海马CA1区凋亡神经元数量不同程度减少,吡拉西坦组和大蒜素中、高剂量组AI显著降低(P<0.05或P<0.01);与吡拉西坦组比较,大蒜素高剂量组AI显著降低(P<0.01)。见图3和表2。
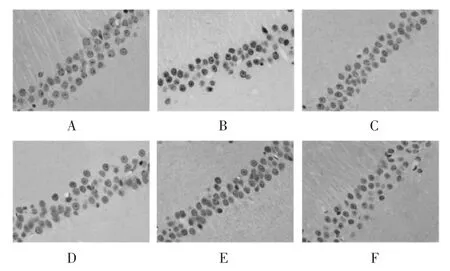
图3 各组大鼠海马CA1区神经元凋亡状况(TUNEL,×400)Fig.3 Neuronal apoptosis in CA1 area of hippocampus of rats in each group(TUNEL,×400)
表2 各组大鼠海马CA1区神经元AI(±s)Tab.2 The AI of neurons in hippocampal CA1 area of rats in each(±s)

表2 各组大鼠海马CA1区神经元AI(±s)Tab.2 The AI of neurons in hippocampal CA1 area of rats in each(±s)
注:与正常对照组比较,**P<0.01;与模型组比较,△P<0.05,△△P<0.01;与吡拉西坦组比较,▲▲P<0.01
组别动物数AI(%)正常对照组 10 1.97±0.36模型组 10 35.92±5.14**吡拉西坦组 10 17.58±3.26△△大蒜素低剂量组 10 31.42±4.58大蒜素中剂量组 10 29.76±4.55△大蒜素高剂量组 10 13.61±2.57△△▲▲
2.4 各组大鼠海马组织SOD、CAT活性和MDA含量比较 与正常对照组比较,模型组大鼠海马组织SOD、CAT 活性降低而 MDA 含量升高(P<0.01);与模型组比较,吡拉西坦组和大蒜素中、高剂量组SOD、CAT 活性升高且 MDA 含量降低(P<0.01);与吡拉西坦组比较,大蒜素高剂量组SOD活性升高、MDA 含量降低(P<0.05 或 P<0.01)。见表3。
表3 各组大鼠海马组织SOD、CAT活性和MDA含量(±s)Tab.3 The activity SOD,CAT and content of MDA in hippocampus of rats in each group(±s)
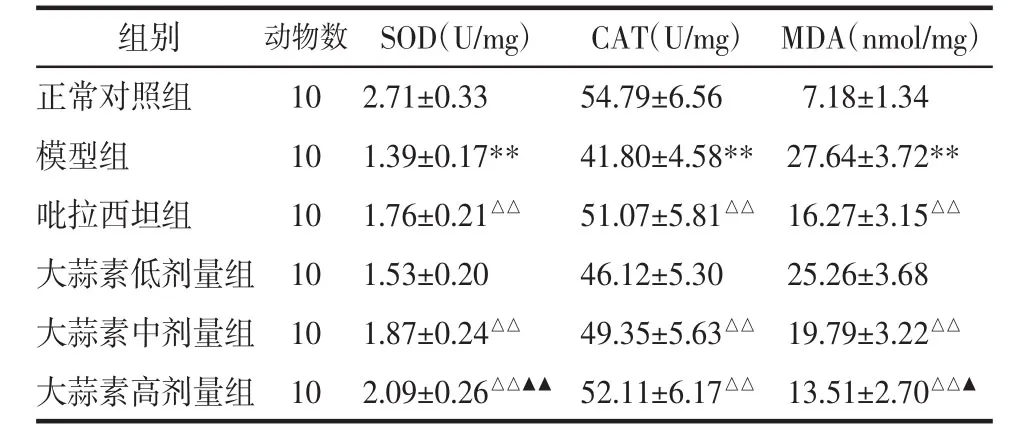
表3 各组大鼠海马组织SOD、CAT活性和MDA含量(±s)Tab.3 The activity SOD,CAT and content of MDA in hippocampus of rats in each group(±s)
注:与正常对照组比较,**P<0.01;与模型组比较,△△P<0.01;与吡拉西坦组比较,▲P<0.05,▲▲P<0.01。
组别正常对照组模型组吡拉西坦组大蒜素低剂量组大蒜素中剂量组大蒜素高剂量组动物数10 10 10 10 10 10 SOD(U/mg) CAT(U/mg) MDA(nmol/mg)2.71±0.33 54.79±6.56 7.18±1.34 1.39±0.17** 41.80±4.58** 27.64±3.72**1.76±0.21△△ 51.07±5.81△△ 16.27±3.15△△1.53±0.20 46.12±5.30 25.26±3.68 1.87±0.24△△ 49.35±5.63△△ 19.79±3.22△△2.09±0.26△△▲▲ 52.11±6.17△△ 13.51±2.70△△▲
2.5 各组大鼠海马组织TNF-α、IL-1β、IL-6含量比较 与正常对照组比较,模型组大鼠海马组织TNF-α、IL-1β、IL-6 含量升高(P<0.01);与模型组比较,吡拉西坦组和大蒜素中、高剂量组TNF-α、IL-1β、IL-6 含量降低(P<0.01);与吡拉西坦组比较,大蒜素高剂量组 TNF-α 含量降低(P<0.01)。见表4。
表4 各组大鼠海马组织 TNF-α、IL-1β、IL-6 含量(±s)Tab.4 The content of TNF-α,IL-1β,IL-6 in hippocampus of rats in each group(±s) (pg/mL)

表4 各组大鼠海马组织 TNF-α、IL-1β、IL-6 含量(±s)Tab.4 The content of TNF-α,IL-1β,IL-6 in hippocampus of rats in each group(±s) (pg/mL)
注:与正常对照组比较,**P<0.01;与模型组比较,△△P<0.01;与吡拉西坦组比较,▲▲P<0.01。
正常对照组模型组吡拉西坦组大蒜素低剂量组大蒜素中剂量组大蒜素高剂量组10 10 10 10 10 10 495.12± 54.17 29.10±3.74 42.87±5.32 1 116.03±132.16** 50.24±6.28** 97.65±9.91**672.71± 85.04△△ 36.70±4.31△△ 59.04±5.71△△1 019.75±130.24 45.62±5.53 89.51±9.20 766.41± 98.73△△ 39.74±4.79△△ 68.25±7.38△△493.82± 56.25△△▲▲ 34.83±4.12△△ 51.37±4.92△△▲▲
2.6 各组大鼠海马组织Nrf2、HO-1、NF-κB蛋白表达比较 与正常对照组比较,模型组大鼠海马组织Nrf2、HO-1 表达下调而 NF-κB 表达上调(P<0.01);与模型组比较,吡拉西坦组和大蒜素中、高剂量组Nrf2、HO-1 表达上调且 NF-κB 表达下调(P<0.01);与吡拉西坦组比较,大蒜素高剂量组Nrf2、HO-1表达上调且 NF-κB 表达下调(P<0.05 或 P<0.01)。见图4和表5。

图4 各组大鼠海马组织Nrf2、HO-1、NF-κB蛋白表达Fig.4 Expression of Nrf2,HO-1,NF-κB protein in hippocampus of rats in each group
表5 各组大鼠海马组织Nrf2、HO-1、NF-κB蛋白相对表达量(±s)Tab.5 The relative expression of Nrf2,HO-1,NF-κB protein in hippocampus of rats in each group(±s)

表5 各组大鼠海马组织Nrf2、HO-1、NF-κB蛋白相对表达量(±s)Tab.5 The relative expression of Nrf2,HO-1,NF-κB protein in hippocampus of rats in each group(±s)
注:与正常对照组比较,**P<0.01;与模型组比较,△△P<0.01;与吡拉西坦组比较,▲P<0.05,▲▲P<0.01。
组别正常对照组模型组吡拉西坦组大蒜素低剂量组大蒜素中剂量组大蒜素高剂量组动物数10 10 10 10 10 10 Nrf2/β-actin HO-1/β-actin NF-κB/β-actin 0.83±0.17 0.47±0.11 0.25±0.04 0.19±0.04** 0.11±0.03** 0.58±0.16**0.37±0.08△△ 0.35±0.07△△ 0.29±0.05△△0.21±0.05 0.14±0.04 0.56±0.16 0.46±0.10△△ 0.28±0.05△△ 0.40±0.11△△0.74±0.15△△▲▲ 0.43±0.08△△▲ 0.18±0.04△△▲▲
3 讨论
术后认知功能障碍是丙泊酚麻醉的重要并发症,其中以老年患者居多,发病率高达6%,给患者带来沉重的心理和经济负担。海马CA1区是与认知功能关系最为密切的脑区,病理生理学研究发现,术后认知功能障碍与麻醉药抑制中枢胆碱能系统所致海马CA1区氧化应激、炎症反应及海马神经元凋亡相关[14-16],这也为药物开发提供了靶点。
大蒜素是天然存在于百合科葱属植物大蒜鳞茎中的一种二烯丙基三硫化物,具有良好的抗炎、抗氧化、抗凋亡等生理活性。本研究通过制备丙泊酚麻醉所致老年大鼠认知功能障碍模型,Morris水迷宫实验结果显示,经大蒜素治疗能够有效提高认知功能障碍大鼠的学习记忆能力,改善海马CA1区神经元病变并降低CA1区神经元凋亡,提示大蒜素对丙泊酚麻醉所致老年大鼠认知功能障碍具有改善作用,其机制可能与降低海马CA1区神经元病变有关。
生理状态下,活性氧簇(ROS)能够被抗氧化酶催化还原而维持动态平衡,但麻醉药阻断胆碱能系统导致ROS大量生成与释放,过度消耗SOD和CAT,导致ROS过剩而引发氧化应激反应[17]。过剩的ROS能够破坏蛋白质、染色体以及生物膜等生成具有生物毒性的MDA。本研究发现,经大蒜素治疗能够有效提高海马组织SOD、CAT活性并降低MDA含量,提示大蒜素对丙泊酚麻醉所致老年大鼠认知功能障碍的改善作用可能与抑制氧化应激反应进而降低海马CA1区神经元有关。
麻醉药阻断胆碱能系统导致炎性细胞因子TNF-α、IL-1β、IL-6大量合成与释放而引发炎症反应[18]。此外,TNF-α、IL-1β 做为趋化因子能够进一步促进自身及其他炎症因子表达,进而形成炎症级联反应而加重炎症损伤[19];IL-6则能够刺激ROS合成与释放而加重氧化应激损伤[20]。本研究发现,经大蒜素治疗能够有效降低海马组织TNF-α、IL-1β、IL-6含量,提示大蒜素对丙泊酚麻醉所致老年大鼠认知功能障碍的改善作用可能与抑制炎症反应进而降低海马CA1区神经元有关。
Nrf2是真核细胞中普遍存在的一种核转录因子,生理状态下,Nrf2通过泛素连接酶与Kelch样环氧氯丙胺相关蛋白1(Keap1)结合而被降解,但ROS能够刺激Nrf2与Keap1解离,游离Nrf2转移至细胞核后与靶基因结合,诱导抗氧化酶(包括SOD、CAT)和HO-1转录表达;HO-1具有催化降解血红素、清除CO等生理学作用,在机体抗氧化应激和抗炎过程中发挥着重要作用[20-21]。NF-κB是细胞内调控炎症因子表达的重要信号通路,NF-κB被ROS激活后能够与p65结合并转移至细胞核,进而诱导TNF-α、IL-1β、IL-6大量表达而加重炎症反应[22]。本研究发现,经大蒜素治疗能够有效上调海马组织Nrf2、HO-1表达并下调NF-κB表达,这可能是大蒜素抑制丙泊酚麻醉所致老年大鼠海马神经元氧化应激和炎症反应的重要分子机制。
综上所述,大蒜素对丙泊酚麻醉所致老年大鼠认知功能障碍具有改善作用,其作用机制可能与激活Nrf2/HO-1通路、抑制NF-κB蛋白表达,抑制神经元凋亡、氧化应激和炎症反应进而降低海马CA1区神经元损伤有关。