基于氧化石墨烯构建新型荧光生物传感器用于 DNA 检测
2022-04-20肖雪,温暖,段辉
肖 雪,温 暖,段 辉
(西南民族大学化学与环境学院,化学基础国家民委重点实验室,四川 成都 610041)
脱氧核糖核酸(Deoxyribonucleic Acid,DNA)是生物体正常运作和发育必不可少的遗传物质,大多数生物都是以其作为遗传信息的载体[1].对生物样品中特定序列DNA 的检测可广泛地应用于基因序列分析、肿瘤的早期诊断以及遗传性疾病筛查等领域[2-3]. 因此,发展快速、简便、灵敏的DNA 检测方法有着十分重要的意义. 近年来,定量聚合酶联反应法、DNA 微阵列法、表面等离子体共振法、电化学法、荧光法等已经被广泛应用于检测DNA 特定序列[4-7]. 其中,荧光法因其具有选择性好、分析速度快、成本低等优点,受到广泛关注[8-9].
作为石墨烯的衍生物,氧化石墨烯(Graphene oxide,GO),具有良好的水分散性、生物相容性、电子和热性能[10-11].GO 对吸附在其表面的荧光基团的荧光具有强烈的猝灭作用,因此,可作为多种荧光体系的猝灭剂[12-13].此外,基于GO 对单链DNA(single stranded DNA,ssDNA)的结合力强于双链 DNA(double stranded DNA,dsDNA)的特点,能实现对核酸单双链特异性识别[14-15].基于此,GO 已经广泛地用于构建荧光生物传感器实现对DNA、RNA、蛋白质和金属离子的分析检测[16-19].Yang 等首次设计了基于GO 的荧光生物传感器用于ssDNA 的灵敏检测,该方法中羧基荧光素(carboxyfluorescein,FAM)修饰的 ssDNA 作为荧光探针吸附在GO 表面,荧光被猝灭,当加入靶物后,探针与靶物形成双链并从GO 表面释放,荧光恢复,通过加入靶物前后荧光信号差实现ssDNA 的灵敏检测[20].在该方法中荧光探针链与GO 直接相连,作用力较强,加入靶物后探针不易从GO 脱离,检测灵敏度受到限制.因此,Ihara 等设计了一种基于链置换的荧光检测法,该方法以GO 为荧光猝灭剂,荧光探针链通过一条捕获DNA 与GO 间接相连,加入靶物后通过竞争反应,探针链更易从GO 上释放,检测灵敏度提高[21].但该方法增加了捕获DNA,检测前需要和探针链进行杂交反应,增加了检测时间和成本. 本课题以荧光染料FAM 标记的ssDNA 为探针分子,以GO为荧光猝灭剂,构建了一种用于快速检测ssDNA 的新型荧光生物传感器. 传统的荧光法中,荧光染料修饰的DNA 探针通过π-π堆积和静电相互作用与GO 直接相连,当加入靶物后,由于探针和GO 之间强的相互作用使得探针不易从GO 上释放,从而限制了检测灵敏度[21-22].为了进一步提高检测灵敏度,本方法以发卡状的DNA 作为荧光探针,构建一种新型荧光检测平台实现对ssDNA 的灵敏检测.
1 实验部分
1.1 主要试剂与仪器
试剂:单层GO 购买于南京先丰纳米材料科技有限公司,DNA(表1)购买于生工生物工程(上海)股份有限公司,其他试剂购买于成都市科龙化工试剂厂.

表1 实验中所用 DNA 序列Table 1 The list of oligonucleotide sequences
仪器:Dual-FL 荧光光谱仪(HORIBA 公司),AR224CN 电子天平(奥豪斯仪器(上海)有限公司),TG-16 台式高速离心机(四川蜀科仪器有限公司),KQ5200E 型超声波清洗器(昆山市超声仪器有限公司),DF-101S 集热式恒温加热磁力搅拌器(巩义市予华仪器有限责任公司).
1.2 实验方法
反应过程:将probe DNA,磷酸缓冲液(pH 7.0,浓度 50 nM 的磷酸缓冲液,含1 M NaCl、20 mM MgCl2)和超纯水,漩涡混匀.将混合溶液在95 ℃孵育5 min 后,室温冷却30 min.随后加入一定浓度的GO 溶液,室温孵育30 min.最后,加入待检测靶物DNA(target DNA)并用超纯水定容至400 μL,37 ℃孵育30 min.
荧光测定:在荧光光谱仪上测定反应后溶液荧光强度.
激发波长:480 nm,发射波长:521 nm.
2 结果与讨论
2.1 实验原理及可行性分析
该方法的检测原理示意图见图1,FAM 标记的probe DNA 作为荧光探针,呈现发卡状,其修饰有荧光染料的单链部分通过π-π电子堆积作用吸附在GO表面,由于荧光共振能量转移作用,荧光被猝灭,相比于传统的方法,探针保留一部分未与GO 直接相连,因此整个探针在GO 上呈“半站立”状态,从而提高探针从GO 上释放的能力. 当加入 target DNA 后,由于probe DNA 和 target DNA 杂交形成双链从而使得probe DNA 从GO 上面脱落,荧光恢复.通过测定加入target DNA 前后传感系统的荧光强度变化可以实现定量检测target DNA.
为验证该设计方法的可行性,加入target DNA 前后传感系统荧光强度变化被测定. 如图2 所示,当probe DNA 单独存在时,系统发射出很强的荧光信号.加入GO 后由于探针吸附在GO 表面发生荧光共振能量转移,系统荧光信号随之下降. 在向混合液中加入 target DNA 后,probe DNA 和 target DNA 杂交形成双链,并从 GO 上面脱离,可检测到传感系统荧光信号增强.

图2 加入GO 和target DNA 前后荧光光谱图Fig.2 Fluorescence spectra in the absence and presence of target DNA with/without subsequent incubation with GO
2.2 反应条件优化
为了实现实验条件的最优化,在固定probe DNA浓度为50 nM、target DNA 浓度为5 nM 的条件下,GO浓度、GO 吸附 probe DNA 反应温度、target DNA 与probe DNA 杂交反应温度及时间对体系荧光强度变化的影响被考察.
2.2.1 GO 浓度的优化
首先探究了该方法中GO 浓度对检测信号的影响.在未加入target DNA 时,随着GO 浓度的增大,吸附在GO 上的probe DNA 随之增多,系统荧光强度不断下降,如图3(a)所示. 当加入 target DNA 后,probe DNA 与target DNA 杂交形成双链,从GO 上面脱落,系统荧光信号明显上升,如图3(b)所示. 从图3(c)中能看出系统的荧光差值先上升后下降,在GO 浓度为50 μg/mL 时系统荧光信号差达到最大值,因此,选择50 μg/mL 的GO 浓度作为最佳的GO 浓度用于后续实验.
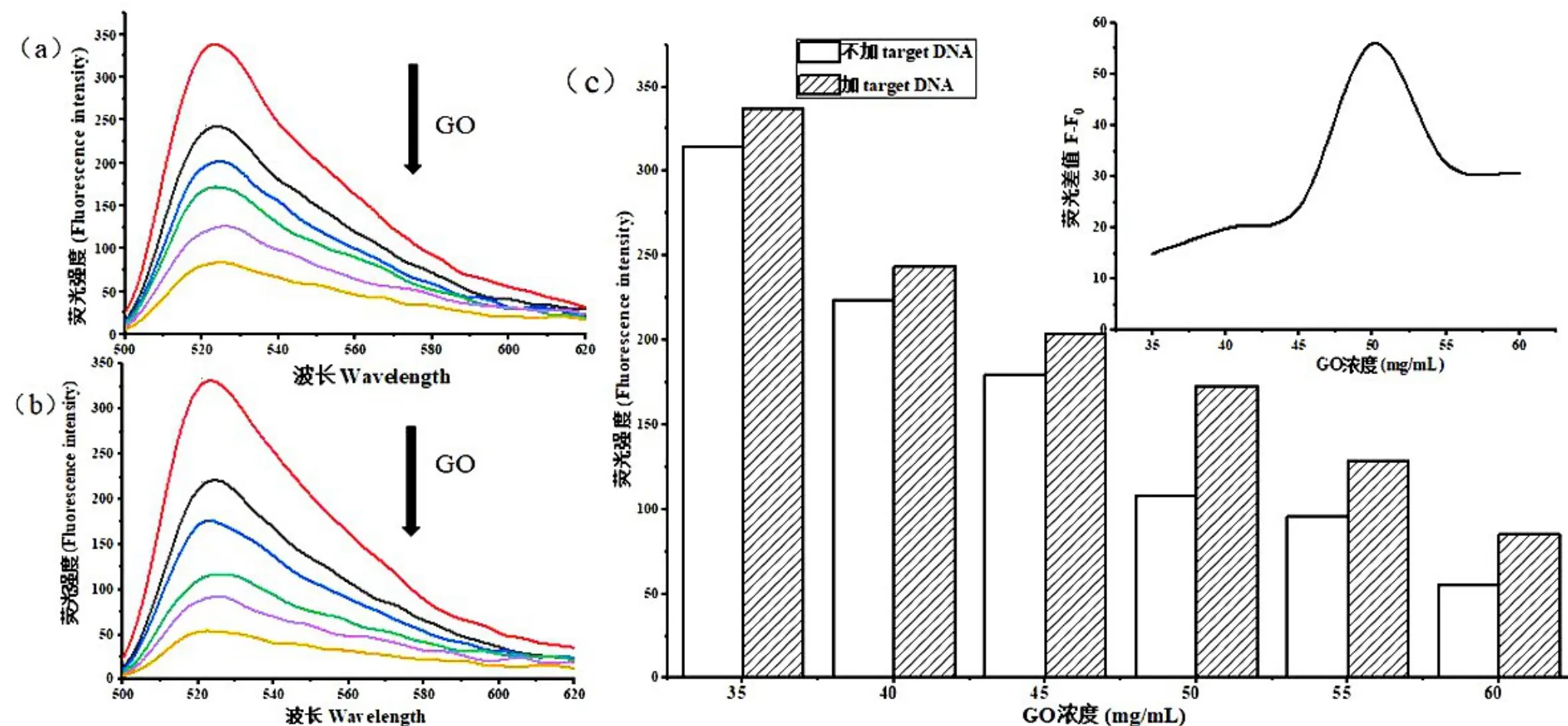
图3 不同GO 浓度下加入 target DNA 前后荧光强度变化对比图(a) GO 吸附probe DNA 的荧光强度随GO 浓度的变化.(b) target DNA 脱吸附probe DNA 的荧光强度随GO 浓度的变化(c) GO 吸附probe DNA 和target DNA 脱吸附probe DNA 的荧光强度及它们的荧光强度差随GO 浓度的变化Fig.3 Fluorescence intensity before and after the addition oftarget DNA with different concentrations of GO.(a) Fluorescence spectra of the probe with GO.(b) Fluorescence spectra of the probe-target DNA duplex with GO.(c) Fluorescence intensity changes of the probe and the probe-target DNA duplex as a function of GO concentration
2.2.2 反应温度的优化
在本荧光传感系统中,温度可能影响GO 吸附探针DNA 和双链杂交的能力,当升高反应温度时,可以促进target DNA 与probe DNA 杂交后的脱吸附反应,但温度若高于双链的解链温度,则会导致反应效率下降,因此,为了达到最佳检测性能,实验反应温度被优化.从图4 可以看出,GO 和 probe DNA 反应温度在37 ℃时,荧光信号强度差较大.因此,选择37 ℃作为GO 吸附probe DNA 的最佳温度用于后续实验. 图5为不同脱吸附温度下系统的荧光信号图,通过对比可以看出,系统在37 ℃时,荧光信号变化大.因此,选择37 ℃作为target DNA 脱吸附probe DNA 的最佳温度用于后续实验.

图4 probe DNA 和GO 不同吸附温度下加入target DNA 前后荧光强度变化对比图Fig.4 Fluorescence intensity response at different incubation temperature of the complex of probe DNA on GO
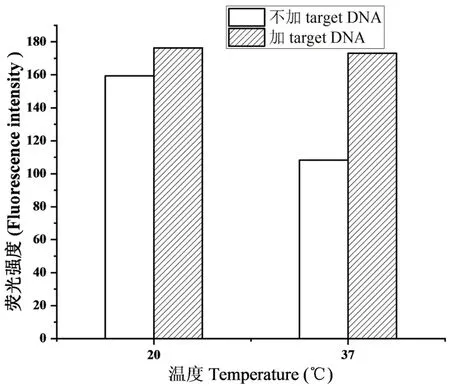
图5 不同吸附温度下加入target DNA前后荧光强度变化对比图Fig.5 Fluorescence intensity response of probe DNA-GO with target DNA at different temperature
2.2.3 反应时间的优化
此外,加入target DNA 后,荧光恢复过程所需的最佳反应时间被考察. 如图6 所示,系统荧光强度差值在30 min 时达到最大,而后趋于稳定. 因此,选择30 min 作为 target DNA 脱吸附 probe DNA 反应时间作为最佳反应时间用于后续实验.

图6 不同反应时间下加入target DNA 前后传感系统荧光信号变化对比图Fig.6 Fluorescence intensity response of probe DNA-GO with target DNA at different reaction time
2.3 ssDNA 的检测
在以上优化好的最佳实验条件下,加入不同浓度target DNA 后系统荧光强度的变化被测定,以评估该检测方法是否可用于定量检测ssDNA. 如图7 所示,荧光强度比 F/F0(F0和F 分别表示加入 target DNA前后传感系统的荧光强度)与target DNA 浓度的对数值在20 ~1 000 pM 的范围内,呈现出良好的线性关系.线性方程为y = 0.421 6 x+0.466 3(y 指荧光强度比值,x 指 target DNA 浓度的对数),即 F/F0=0.421 6 lgc+0.466 3,线性相关系数R2=0.997 6.此外,基于F/F0=a+b x(首先计算空白对照的荧光强度平均值,再计算出测得值与平均值的比值,然后再计算比值的标准偏差σ, 然后将3σ 代入方程中的F/F0,计算出 x 值)可估算出该方法的最低检测限为0.11 pM.与已发展的各类ssDNA 检测方法相比,具有较低的检测限和较宽的检测范围(表2).

表2 检测限比较Table 2 Comparison of detection limits

图7 F/F0与target DNA 浓度的对数的线性关系Fig.7 The linear relationship betweenF/F0 and the lg of the target DNA concentration
2.4 方法的选择性
为了考察本方法的选择性,在相同实验条件下,考察了加入相同浓度的target,mis-3、mis-5 后荧光信号变化.实验结果(图8)表明,只有当target 存在时,荧光强度差值较高,与mis-3、mis-5 产生的信号有较明显的差别,证明了本方法具有较好的选择性.
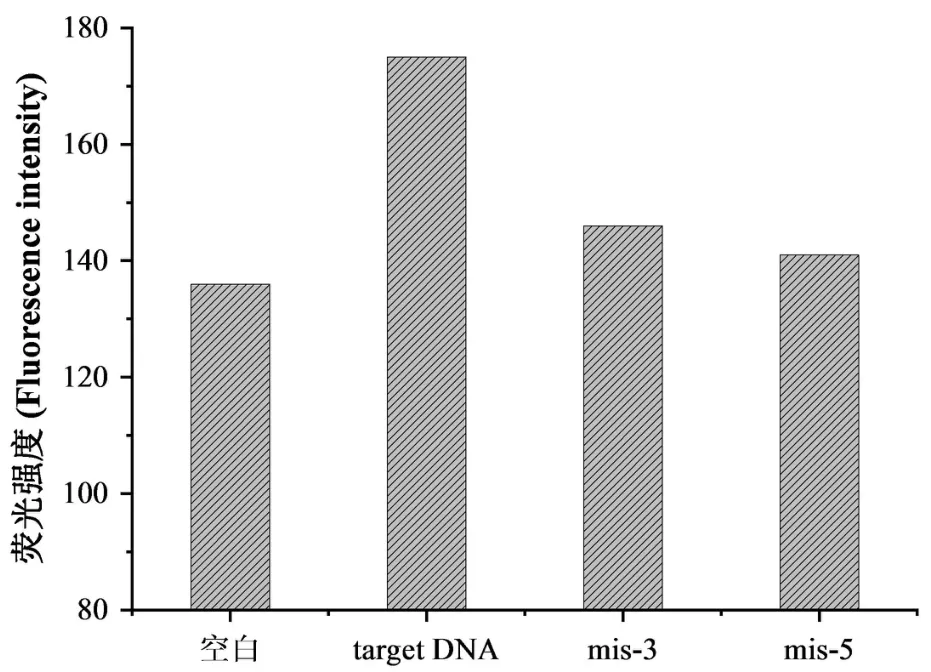
图8 方法的选择性Fig.8 Specificity of the target DNA assay over mismatched
3 总结
本文以GO 为荧光猝灭基底,以修饰了荧光染料的发卡结构DNA 为荧光探针,建立了一种新型ssDNA 荧光检测法.该方法线性范围为20 ~1 000 pM,检出限达到0.11 pM,是一种灵敏度高、操作简单易行,具有潜在的应用性的荧光生物分子检测法. 此外,通过改变荧光探针的序列,还可实现蛋白质、金属离子等的灵敏检测,因此,本文建立了一种具有通用性的荧光生物传感器,在生物分子分析和疾病早期诊断领域具有较大的应用前景.
