牦牛心脏原代成纤维细胞系的建立及鉴定
2022-04-20王玉玲张露露兰道亮吉文汇
王玉玲,张露露,周 珊,蒋 涛,兰道亮,2,吉文汇
(1. 西南民族大学畜牧兽医学院,四川 成都 610041;2. 青藏高原动物遗传资源保护与利用教育部重点实验室,四川 成都 610041)
成纤维细胞是多种多样的间质细胞,通过产生复杂的细胞外基质和通过生物物理和生物化学线索创造信号龛,参与组织的平衡和疾病的治疗[1]. 由于其在机体内广泛存在、易于获得、体外培养条件相对简易、增殖速度快等优势,因此在物种资源保存、胚胎移植及体细胞重编程等方面有着广阔的应用前景.在心脏中心脏成纤维细胞(Cardiac fibroblasts,CFs)是数量最多的细胞类型[2],约占心脏细胞总数的70%,对刺激心肌细胞增殖很重要,可合成及分泌胶原纤维、弹性纤维及有机基质,能够促进心脏正常发育. 因此心脏能够作为获取成纤维细胞的一个重要来源.
牦牛主要生活在高海拔地区3 000 ~5 000 米,以低氧低压、寒冷干燥、紫外线强、食物匮乏为主,特殊的生存环境导致牦牛群体形成了独有的高原适应性、肺活量大、觅食能力强、代谢能力强的特点不仅能够为当地牧民提供奶、肉、毛等丰富的生产生活资料[3],还是研究高原适应性的理想模型[4].依据现有的文献资料报道,目前在牦牛上未见有成体系的和商品化的细胞系,尤其是在牦牛上还未见较为有成熟的成纤维细胞系的报道,同时也未见有较为标准化的原代细胞分离培养和鉴定细胞系的方法,导致无法进一步开展牦牛分子生理层面相关的研究工作.鉴于此本研究以牦牛胚胎心脏作为成纤维细胞系的来源,通过建立牦牛心脏原代成纤维细胞系,并对其细胞外型以及分子学进行相关的鉴定,为今后牦牛进一步基础性生理等一系列研究提供可靠的细胞系平台.
1 材料和方法
1.1 材料
1.1.1 样品采集
在成都某屠宰场采集胎牛,迅速将胎牛使用75% 乙醇冲洗之后,放入装有1%双抗的无菌生理盐水以及冰袋的采样冷藏箱中,并尽快送回实验室.
1.1.2 主要试剂
DMEM 高糖培养基购自Gibco,胎牛血清 FBS 购自QuaCell,0.25%胰蛋白酶-EDTA 购自博士德,二甲基亚砜(DMSO)、苏木精-伊红染色试剂盒购自Solarbio,MTT 溶液、秋水仙素、姬姆萨染色液试剂盒、marker2000、反转录试剂盒 ExonScipt RT SuperMix、PCR 试剂盒 2xAccuProof HiFi HotStart SuperMix、RT-qPCR 试剂盒2xFast SYBR Green qPCR Master Mix UDG 均购自蓉为基因.
1.2 方法
1.2.1 牦牛胚胎心脏成纤维细胞系的原代分离培养及传代
将采集的胎牛泡在70% 的乙醇中进行体表消毒,之后将胎牛移至细胞房无菌环境中,用灭菌手术刀片剖开胎牛腹部,将心脏组织剪成小块之后用PBS缓冲液清洗3 遍,装入无菌1.5 mL 离心管中.将其剪成约1 mm3的组织块后,均匀的摆放在T25 培养瓶中,各个组织块之间有一定的距离便于原代成纤维细胞的生长.将成纤维细胞放入37 ℃、5% CO2的培养箱中培养.
待原代成纤维细胞在T25 培养瓶中生长至瓶底80% ~90%以上时,利用PBS 清洗3 次,使用胰酶消化15 s.在显微镜下观察大部分的细胞呈现圆形并脱离皿底,以DMEM 为基础培养液加入20% FBS 和1%的双抗终止消化,以一传三进行传代培养.
1.2.2 MTT 法检测原代牦牛胚胎心脏成纤维细胞生长曲线
取对数生长期细胞,每孔中有1 ×104个细胞. 将接种好的细胞培养板放入培养箱中培养过夜,每组设3 个复孔取均值,实验重复3 次[5].在培养7 d 后直接使用细胞技术仪进行细胞计数.
1.2.3 成纤维细胞形态的鉴定
利用HE 染色法鉴定细胞形态,待细胞密度约80%时,PBS 洗涤3 次,使用胰酶消化细胞并将细胞接种于圆玻片上,放入6 孔板中进行培养. 待细胞长满约80%之后取出,使用PBS 清洗爬片,4%多聚甲醛固定 15 min,PBS 清洗 3 次.纯水中浸泡 15 min,使用苏木素染液染色20 min,自来水清洗.将爬片置入0.2%氨水溶液中弥染5 s,自来水中浸泡2 min 复蓝.伊红染色2 min,自来水清洗. 乙醇梯度脱水透明,滴加中性树胶盖玻片,显微镜下拍照记录[6].
通过利用秋水仙素染色法对成纤维细胞染色体进行染色,待细胞密度约80%,加入秋水仙素培养4 h后离心留沉淀.进行低渗处理,预固定、固定、制片、封闭等常规细胞免疫荧光染色步骤,在光学显微镜下拍摄染色体图片.
1.2.4 荧光定量方法检测特异性标记基因
通过文献挑选出已报道的成纤维细胞系中的4 个特异性标记基因:Vimentin、TGFβ-1、FSP-1、S100A4,并用GAPDH当内参基因进行校正,每个样本进行3 次重复.利用Primer5.0 软件分别对这5 个基因设计PCR和荧光定量PCR 扩增引物的序列(表1).同时用NCBI中Primer-BLAST 在线比对工具检测引物的质量.

表1 引物信息Table 1 Primer information
以牦牛胚胎心脏成纤维细胞cDNA 为模版,利用普通 PCR 技术扩增Vimentin、TGFβ-1、FSP-1、S100A4、GAPDH基因. RT-PCR 反应体系为 25 μL:2 × Accu-Proof HiFi HotStart SuperMixa 为 12.5 μL,cDNA 为2 μL,上游和下游引物各 1.25 μL(10 μmol/L),ddH2O 为 8 μL.RT-PCR 反应程序:98 ℃预变性 30 s;98 ℃变性 10 s,退火 30 s(表 1),72 ℃延伸 30 s 共 35个循环,72 ℃延伸 5 min;4 ℃保存.
利用 RT-qPCR 技术对 Vimentin、TGFβ-1、FSP-1、S100A4 基因测定表达量. RT-qPCR 反应体系为10 μL:2 × Fast SYBR Green qPCR Master Mix UDG 为5 μL,cDNA 为 1 μL,上游和下游引物各 0.2 μL(10 μmol/L),ddH2O 为 3.4 μL,50 × ROX Reference Dye(optional)为 0.2 μL.RT-PCR 反应程序:50 ℃预变性2 min;95 ℃变性 2 min,退火 15 s(表 1),60 ℃延伸30 s共 40 个循环.
1.2.5 统计分析
采用 2-ΔΔct法对 RT-qPCR 得到的实验结果进行计算,利用Graphpad prism 9 软件绘制表达差异图,利用SPSS 25 统计软件,对实验结果进行单因素方差分析和差异显著性分析,所有实验进行三次重复.
2 实验结果
2.1 牦牛胚胎心脏成纤维细胞的原代培养及传代
使用倒置相差显微镜观察,可以看出成纤维细胞呈现典型的菱形或者网状连接在一起,呈不规则的三角形或放射状排列. 细胞贴壁生长5 ~6 d 观察到长梭状的细胞排列生长,胞体丰满,胞质均匀,核呈圆形或卵圆形(图1).随着培养时间的延长,待原代细胞长至80% ~90%时即可进行传代,连续进行11 次传代,在倒置显微镜下观察细胞状态基本能够保持一致.

图1 牦牛胚胎心脏成纤维细胞培养形态(胰酶消化法,10 × ,5d)Fig.1 Morphology of yak embryonic heart fibroblasts in culture(Trypsin digestion method,10 × ,5d)
2.2 MTT 法检测细胞生长曲线
P3 代牦牛胚胎心脏成纤维细胞生长曲线见下图2.细胞生长趋势呈现典型的“S”型生长,群体倍增时间约为6 h.传代之后,细胞进入潜伏期(1 ~2 d),这个时间大约持续24 h.之后的2 ~3 d 细胞进入对数生长期,此阶段细胞分裂旺盛,细胞数量快速增长.第4 ~7 d,细胞进入平衡期,此阶段细胞的数量维持不变,或是稍有下降,不再增长.该实验表明,牦牛心脏成纤维细胞传代之后依然保持旺盛的分裂和增殖能力.

图2 P3 代牦牛心脏成纤维细胞生长曲线Fig.2 Growth curve of P3 generation yak heart fibroblasts
2.3 成纤维细胞形态分析
牦牛心脏成纤维细胞HE 染色结果表明,成纤维细胞呈漩涡状排列,与周围界限比较清楚,胞质呈粉红色,胞核呈蓝紫色,本实验染色效果可能由于脱水原因,染色效果不理想(图3a、b).正常染色细胞应该呈典型的梭形、菱形、不规则形或者多角形,随着细胞的生长,细胞的形态变成了不规则的星形及编织状外观,呈现典型的成纤维细胞形态.
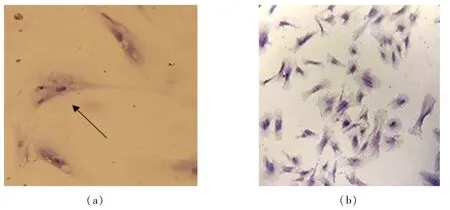
图3 成纤维细胞HE 染色(a)物镜 40 × ,(b)物镜 20 ×Fig.3 Fibroblast HE staining(a)objective lens 40 × ,(b) objective lens 20 ×
牦牛体细胞染色体核型为 2n =60,一共 30 对(图4). 其中常染色体有29 对,性染色体有1 对,性染色体分别为XX 和XY.除了X 和Y 性染色体是亚中端着丝粒染色体外,其余常染色体均为近端着丝粒染色体.
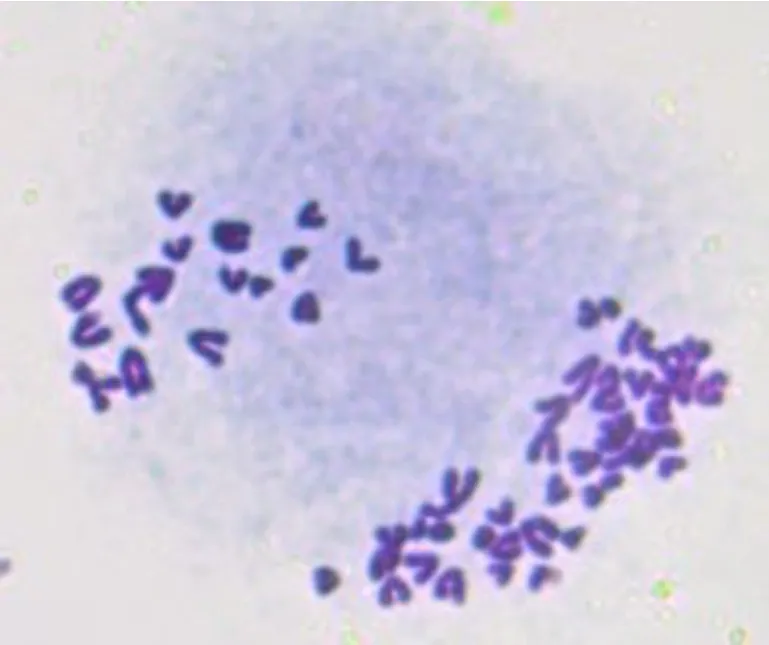
图4 心脏成纤维细胞中期染色体图Fig.4 Mid-stage chromosome map of cardiac fibroblasts
2.4 荧光定量PCR 测定特异性基因表达量
利用 RT-qPCR 技术对TGF-β、FSP-1、S100A4、Vimentin这4 个基因在2 至7 代成纤维细胞中的表达量进行检测,以GAPDH作为内参基因进行校对.结果表明在上述几代细胞中以上几个基因均有表达且表达量稳定.单因素方差分析结果表明,这几个基因在不同代数细胞中的表达量没有显著差异(P>0.05)(图5),因此这4 个基因可以以组合的形式鉴定其在牦牛心脏成纤维细胞中的表达.

图5 心脏成纤维细胞不同代数标记物的相对表达量(a):Vimentin 基因;(b):S100A4 基因;(c):FSP-1 基因;(d):TGF-β 基因Fig.5 Relative expression of different generation markers in cardiac fibroblasts(a):Vimentin gene;(b):S100A4 gene;(c):FSP-1 gene;(d):TGF-β gene
3 讨论
在成纤维细胞的培养中,主要使用的血清浓度有,10%、15% 以及20%. 本实验选择了20%的血清加入基础培养液中,观察到原代细胞的生长速度快,组织块培养法培养3 ~5 d 后已经大致长满培养皿皿底的80%左右. 而高美红等人在牛的成纤维细胞培养的过程中其加入15%的FBS,但是该实验的成纤维细胞使用组织块培养法需要经过17 d 才能够长满皿的80%左右[7]. 吉信阁等人在猪胎儿成纤维细胞的培养中发现,利用组织块法,在基础培养液中添加有10%的FBS,可以使成纤维细胞在7 d 内大量的生长[8]. 经过上述文献的比较,本实验选取的20%FBS,能够使成纤维细胞的生长速率与细胞生长情况比上述实验结果达到更好的效果,也为牦牛其他细胞系的建立提供了血清学依据.
本实验针对成纤维细胞系的生长情况进行了检验发现其符合基本的细胞生长规律.根据细胞的形态学观察,发现牦牛胚胎心脏成纤维细胞胞体较大,多呈现纺锤形或者不规则三角形状态,胞质外有长短不一的突起,总体呈漩涡状或者放射状. 这与西藏牦牛[9]、延边牛[10]以及天祝山牦牛[11]等其他牛属动物的成纤维细胞形态一致. 有研究发现,大鼠心脏成纤维细胞的伪足较多,部分细胞呈圆盘形、扇形[12],这与本实验牦牛心脏成纤维细胞的形态有所差异.由此可以证明牛属动物的成纤维细胞外形差异较小,这可能是由于物种之间的差异.
罗惠娜等人选取了Vimentin基因针对金毛犬睾丸成纤维细胞进行检测,F Strutz 等人对小鼠的成纤维细胞以及基因的上皮细胞基因进行了差异杂交,发现了对成纤维细胞具有相对特异性的新细胞内基因FSP1.Edie C Goldsmith 等人通过RT-PCR、蛋白免疫印迹、免疫组化等方法,证明了在小鼠心脏成纤维细胞中通过标记S100A4、FSP-1 基因能成功鉴定出小鼠胰腺癌模型中肿瘤微环境成纤维细胞群体[13]. 除此之外,Li Xiao 等人证明转化生长因子-β1(TGF-β1)是兔肺脏成纤维细胞增殖和纤维化的标志基因[14]. 就目前而言,暂未对成纤维细胞的标记基因进行综合检测,因此本实验首次将Vimentin、S100A4、TGF-β、FSP-1 这四个基因在牦牛心脏成纤维细胞中进行检测,实验结果发现以上四个基因均能够在牦牛心脏成纤维细胞中表达,说明本实验分离的细胞属于成纤维细胞系,进一步验证了该四个基因可以以组合的形式对成纤维细胞进行鉴定.
4 结论
本实验通过组织块法分离培养了牦牛胚胎心脏原代成纤维细胞并进行了传代,通过MTT 法对细胞活性进行了检测,利用HE 染色法和秋水仙素核染色对细胞的外型进行鉴定,利用RT-qPCR 技术检测了Vimentin、S100A4、TGF-β、FSP-1 四个基因在牦牛胚胎心脏成纤维细胞中的表达,成功建立了牦牛胚胎心脏原代成纤维细胞系,并验证了该四个基因能够以组合的形式鉴定成纤维细胞,为今后牦牛成纤维细胞的进一步研究奠定了基础.
