Tim-3/Galectin-9信号通路在消化道恶性肿瘤中的研究进展
2022-04-20王志远高峰
王志远,高峰
【提要】 近年来,消化道恶性肿瘤的发病率逐年增高,并且逐渐向年轻化、低龄化发展,对人类健康造成极大危害。因此,积极、有效地治疗对改善患者预后有重要意义。T 细胞免疫球蛋白及黏蛋白结构域分子-3(Tim-3)与其配体半乳糖凝集素-9 (galectin-9)结合,通过抑制IFN-γ、TNF-α和IL-2的产生来抑制Th1、Th17和Tc1细胞介导的免疫反应,同时维持Treg细胞功能,以此发挥抗肿瘤免疫的负性调控作用。本文围绕Tim-3/Galectin-9通路改变肿瘤免疫微环境,导致肿瘤细胞免疫逃逸这一机制,对其在消化道恶性肿瘤的研究进展做一综述。
消化道恶性肿瘤的发生、发展是一个多因素、多阶段、多种分子参与的过程,患者机体免疫状态在其中发挥重要作用。因此,从免疫学角度探讨肿瘤的发病机制,对开展治疗及预后的评估具有重要意义。T 细胞免疫球蛋白及黏蛋白结构域分子-3(T cell immunoglobulin and mucin domain containing molecule-3,Tim-3),是国际上新近发现的与程序性死亡受体-1(programmed death-1,PD-1)具有同等地位的抗肿瘤免疫的负性调控因子。半乳糖凝集素-9 (galectin-9)是Tim-3最早发现的配体,最初被鉴定为嗜酸性粒细胞趋化和活化因子,随后发现其可调节多种生物功能,如细胞聚集、黏附,以及肿瘤细胞的凋亡。Tim-3/Galectin-9的相互作用可能会改变肿瘤免疫微环境,导致肿瘤细胞的免疫逃逸。因此,本文就Tim-3/Galectin-9在消化道恶性肿瘤中的作用机制及研究进展做一综述。
1 Tim-3和Galectin-9功能与特点
1.1 Tim-3的功能与特点
Tim-3是Tim家族的一员,该家族由8个成员(Tim1-Tim8)组成,其中Tim-1、Tim-3和Tim-4在人体中被发现[1]。Tim-3是一种I型跨膜蛋白,在终末分化的CD4+T细胞亚群,如Th1细胞、Th17细胞、Treg细胞和1型CD8+T细胞(Tc1)上表达,其在Th2细胞上不表达。随着研究的不断深入,发现它在B细胞、巨噬细胞、树突状细胞、NK细胞、肥大细胞和单核细胞上也有所表达[2-5]。Tim-3由一个N端细胞外免疫球蛋白可变结构域(IgV)构成,该结构域具有FG-CC′环和N链聚糖,一个含有O链糖基化的黏蛋白结构域的位点,一个包含柄状结构域的N链聚糖,一个跨膜结构域和一个含有酪氨酸磷酸化基序的细胞质结构域[6-8]。Tim-3有四种不同的配体。Tim-3与galectin-9的结合可抑制Th1介导的免疫反应,并诱导Tim-3+T细胞的凋亡。表达Tim-3的T细胞可以通过与另一种配体Ptdser结合来识别凋亡细胞,Ptdser在凋亡细胞上表达,但不能吞噬凋亡细胞。然而,表达Tim-3的树突状细胞,当与Ptdser结合时,可以识别和清除凋亡小体。另一种Tim-3配体HMGB1,与树突状细胞中表达的Tim-3结合后,能够抑制肿瘤源性核酸向核内体的运输,从而抑制模式识别受体(PPR)介导的对这些核酸的免疫反应。然而,表达Tim-3的T细胞与HMGB1的相互作用尚未明确。CEACAM1与T细胞上表达的Tim-3的相互作用抑制了T细胞的效应功能,有助于维持T细胞的耐受性。在Tim-3配体中,Galectin-9与Tim-3 IgV结构域的N链聚糖结合,而其他配体结合到IgV结构域中的独特裂隙结构被称为FG-CC′环。虽然Galectin-9和CEACAM1在IgV结构域的结合位点不同,但研究表明,它们诱导了相同的下游信号事件[8-9]。
1.2 Galectin-9的功能与特点
半乳糖凝集素是一种由碳水化合物识别域组成的可溶性蛋白(CRD),它与β半乳糖结合[10]。根据CRD的数量,将半乳糖凝集素分为原型、串联重复序列型和嵌合型半乳糖凝集素[11]。Galectin-9是半乳糖凝集素超家族中“串联重复”型的成员,该家族由两个非同源的CRDs组成,由一个柔性肽连接子(长度为14~56个氨基酸)连接,在蛋白质-蛋白质相互作用、膜嵌入和CRDs的表达中发挥重要的作用[12]。该肽连接子包含一个金属蛋白酶位点,可以帮助Galectin-9分泌到细胞外基质中。Galectin-9在上皮细胞、内皮细胞、T细胞、B细胞、肥大细胞和巨噬细胞中高表达[10,13]。Galectin-9通过Tim-3/Galectin-9通路在嗜酸性粒细胞活化、血凝集和抗转移、凋亡、T细胞稳态和细胞因子产生、Treg和Th17细胞分化方面具有重要作用,使Galectin-9成为免疫应答的调节因子[14]。目前已经报道了四种具有Galectin-9亲和力的受体。在这些受体中,Tim-3是Galectin-9最具特征性的受体。Tim-3/Galectin-9相互作用在免疫系统中表现出抑制或刺激作用,这取决于表达Tim-3的细胞类型。正常生理状态下,在T细胞亚群(Th1、Th17和Tc1)和巨噬细胞上表达的Tim-3对Galectin-9结合具有抑制作用,而在NK细胞和树突状细胞上表达的Tim-3在与Galectin-9结合时表现出刺激作用。Galectin-9的其他受体还包括Dectin-1、4-1BB和CD40。Dectin-1在巨噬细胞上高表达,并与Galectin-9结合后发挥免疫抑制作用。此外,已知Galectin-9/CD40相互作用可以阻止CD40对CD4loCD40+效应T细胞的增殖和存活作用。Galectin-9与4-1BB结合,促进4-1BB的聚集,增强促炎途径和免疫应答[15]。
1.3 Tim-3/Galectin-9通路
PD-1等蛋白在它们细胞质尾部有一个抑制基序,与之不同,Tim-3在其细胞质尾部有5个酪氨酸残基。在5个酪氨酸残基中,Y265和Y272在Tim-3信号转导中发挥重要作用。Tim-3/Galectin-9之间的相互作用诱导了细胞质尾部Y265和Y272位点的磷酸化[16],导致结合的HLA-B相关转录本3(Bat3)从细胞质尾部中释放,Bat3释放的Tim-3与Src家族蛋白激酶之一的Fyn结合,与Bat3共享相同的结合位点。Tim-3胞质尾部的Fyn募集,磷酸化糖鞘脂微域1(PAG)相关的磷蛋白,从而促进C′-末端c-Src激酶(Csk)的募集。然后Csk磷酸化Lck的C′-末端酪氨酸,从而负调控Lck的活性,导致T细胞功能的抑制。因此,Tim-3/Galectin-9信号通路介导了抑制T细胞增殖、减少细胞因子产生和可能导致T细胞死亡等事件(见图1)。Tim-3/Galectin-9的相互作用也会影响近端T细胞受体(TCR)信号通路,增强了免疫突触中酪氨酸受体磷酸酶CD45和CD148的聚集。受体通过吞噬酶CD45使Lck的酪氨酸残基Y505和Y394去磷酸化,并降低其催化活性。同样,CD148低磷酸化连接适配蛋白(LAT)和磷脂酶γ1 (PLCγ1),抑制下游T细胞功能[17-18]。总之,Tim-3/Galectin-9的作用通过抑制IFN-γ、TNF-α和IL-2的产生来抑制Th1、Th17和Tc1细胞介导的免疫反应。在Treg中,许多研究报道了Tim-3/Galectin-9相互作用的下游效应,Tim-3/Galectin-9的相互作用被认为是维持和调节Treg的功能和发展的原因。在一项研究中,Tim-3/Galectin-9导致IL-10和TGF-β等细胞因子的过表达,这促进了CD4+CD25+Foxp3+Treg细胞的增殖,Treg的增殖进而抑制效应T细胞的活性[19]。Yan等[20]的研究表明,与CD4+Foxp3-T细胞相比,CD4+Foxp3+T细胞中Tim-3的表达显著升高(70%>20%)。他们还发现,Foxp3在肿瘤浸润性Tim-3+CD4+T细胞中表达,该细胞在肿瘤微环境中表现出Treg特性。一项使用CT26细胞进行的体外研究表明,50%的CD4+Foxp3+T细胞表达Tim-3,而只有10%的CD4+Foxp3-TILs表达Tim-3。还有报道称[21],在B16黑色素瘤和CT26结肠癌中,Tim-3+Treg产生的IL-10及免疫抑制活性是Tim-3-Treg的两倍。此外,Treg也表达Galectin-9,可能与Th1/Th17细胞上表达的Tim-3结合,抑制T细胞介导的免疫,诱导Th1/Th17细胞凋亡。在肿瘤相关的Treg中,Tim-3作为一种标记物可过表达[20]。Tim-3+Treg在肿瘤组织中高表现,但在外周血中水平较低。Tim-3/Galectin-9相互作用可增强同种异体移植耐受发展中的免疫抑制功能。Tim-3/Galectin-9相互作用通过增加IL-10和TGF-β的分泌来增强Treg在肿瘤微环境(TME)中的免疫抑制活性。
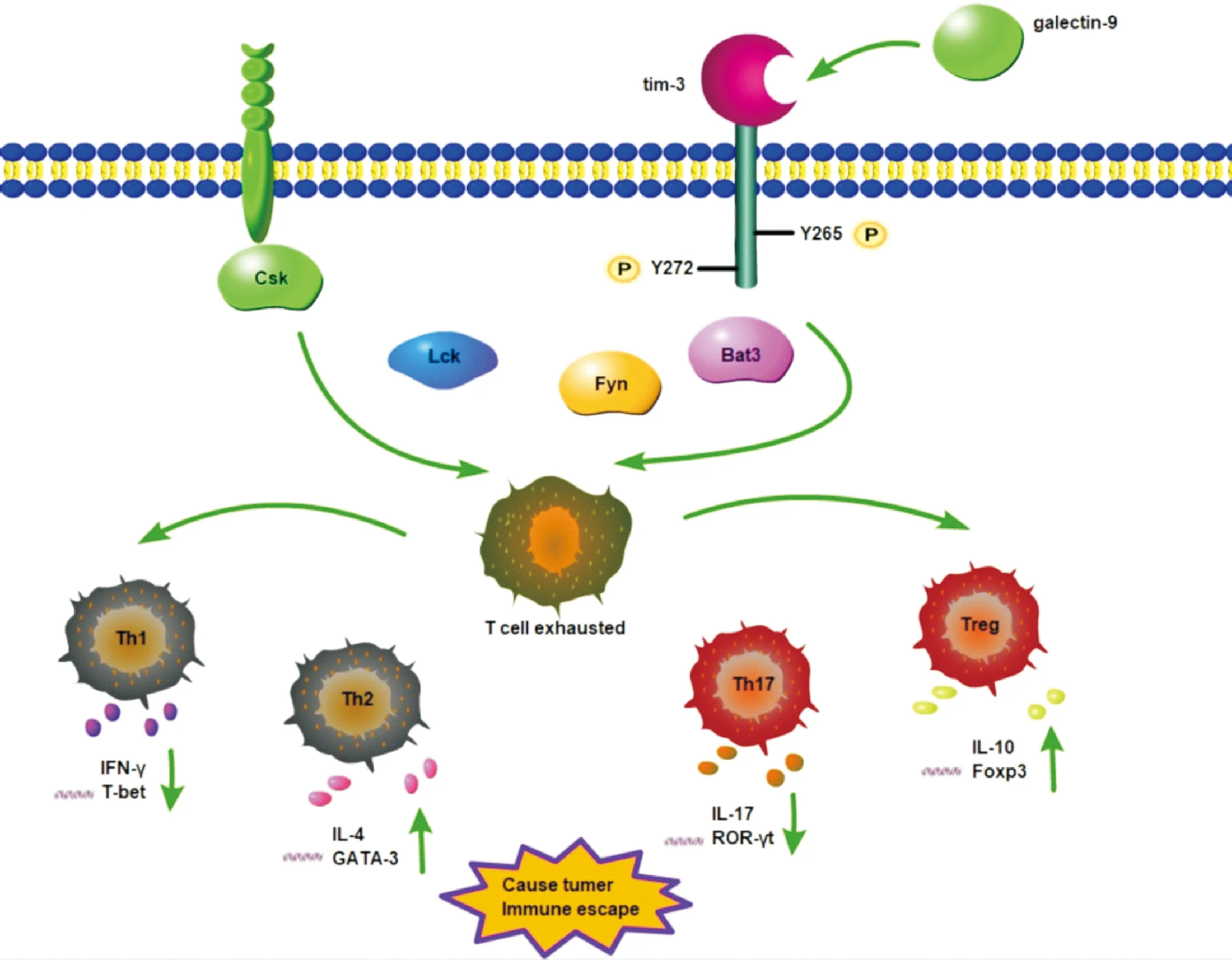
图1 Tim-3/Galectin-9信号通路
2 Tim-3/Galectin-9通路与消化道肿瘤
Tim-3/Galectin-9通路的干扰会导致多种疾病的发生,如自身免疫性疾病、感染、肿瘤。大量研究表明,在急性髓系白血病(AML)、前列腺癌、非小细胞肺癌(NSCLC)、乳腺细胞癌(ESCC)、胶质瘤、头颈部癌、黑色素瘤和肺腺癌中,Tim-3和Galectin-9水平升高。关于Tim-3/Galectin-9通路在消化道肿瘤中的研究也越来越受到学者们的关注,以期为肿瘤的治疗提供新的靶点。
2.1 食管癌
在Zhang等[22]的研究中,Tim-3在食管炎、低级别上皮内瘤变、早期食管癌及进展期食管癌组织中的表达平依次递增。且Tim-3表达与食管癌临床病理特征密切相关。TNM Ⅲ-Ⅳ期患者的Tim-3表达水平高于Ⅰ-Ⅱ的患者,有区域淋巴结转移的患者Tim-3表达水平高于无区域淋巴结转移的患者。这与Zheng[23]等的研究结论一致。另一项研究表明[24],Tim-3在食管癌鳞状细胞癌中高表达,但在不同的组织学分型中,Tim-3的表达也存在差异。另外,Tim-3表达阴性的食管癌患者,其总生存期明显高于Tim-3阳性的患者,提示Tim-3可以作为食管鳞状细胞癌预后的独立危险因素。Galectin-9的水平与食管癌的TNM分期、有无淋巴结转移无相关性,体外细胞实验发现,Galectin-9表达水平的下调,可能与肿瘤的迁移、侵袭相关,因此,Galectin-9可能是通过与Tim-3的相互作用来影响食管癌的发生、发展及预后。同样,Hou等[25]认为,高Tim-3和低galectin-9表达水平与食管鳞癌患者的不良预后相关,然而Tim-3和galectin-9的表达水平并不能直接作为为食管鳞癌预后的独立指标,仍需要深入论证。
2.2 胃食管结合部腺癌
胃食管结合部腺癌是一类距离胃食管结合部近端及远端5 cm以内的肿瘤的总称,在临床中并不少见。根据与EGJ线相对位置的不同,其临床病理学分型可表现为食管癌、贲门癌或胃癌。有学者提出[26],在胃食管结合部腺癌中,Tim-3主要在肿瘤组织浸润的免疫细胞中表达,而Galectin-9主要表达在肿瘤细胞的细胞质和细胞膜上。不同部位的肿瘤组织tim-3的表达水平也有所不同,而Galectin-9在肿瘤大小、侵犯血管神经的比例、TNM分期、肿瘤位置上表达的差异均无统计学意义。尽管胃食管结合部腺癌患者个体之间Tim-3/Galectin-9表达水平不同,但其生存预后却无明显差异,这与Tim-3/Galectin-9在单纯食管癌、胃癌中的报道有矛盾之处,建议大样本量、多中心研究进一步证实。
2.3 胃癌
Tim-3在胃癌T细胞中高表达,且T细胞的表达水平和衰竭程度在胃癌肿瘤组织中的肿瘤浸润淋巴细胞、胃癌患者外周血T细胞、正常人外周血T细胞依次递减[27]。还有报道称[28],胃癌患者Tim-3主要在NK细胞和巨噬细胞上表达,在rhlL-12刺激下,Galectin-9激活Tim-3,促进IFN-γ的分泌。动物实验表明,随着肿瘤负荷的增加,外周血和胃癌肿瘤组织NK细胞和巨噬细胞表达Tim-3的水平也随之增加。T-bet在NK细胞调控Tim-3表达中发挥重要作用。阻断Tim-3,能够影响单核巨噬细胞分泌TNF-α,而不会影响Thl、Th2和Thl7。在另一项临床研究中[29],77%(34/44)的胃癌患者Galectin-9 mRNA显著下调。而Galectin-9的异常表达已经出现在癌旁组织中。Galectin-9 mRNA的低水平表达与临床分期、肿瘤分期、细胞分化、淋巴结转移和患者生存率相关。提示Galectin-9的低表达参与了胃癌的肿瘤发生。而该项研究报道59%的患者胃癌组织中Tim-3 mRNA表达水平显著降低,但在25%的患者中Tim-3表达也高于正常。细胞实验显示Tim-3/Galectin-9在胃癌中无相关性。上述研究不乏矛盾之处,故Tim-3/Galectin-9通路在胃癌中的功能机制有待进一步研究。Jiang等[30]认为,Galectin-9在无淋巴管浸润、淋巴结转移和远处转移的患者中表达较高,Tim-3低表达与Galectin-9的高表达的患者生存率较高,Tim-3/Galectin-9联合表达是胃癌的独立预后标志物。这些研究结果都表明,Tim-3/Galectin-9通路可能在胃癌发生中发挥重要作用,甚至可以作为胃癌治疗的潜在靶点。
2.4 结直肠癌
结直肠癌患者(CRC) TILs的Tim-3表达水平也显著高于癌旁组织T细胞,这些结果都说明消化道肿瘤微环境可诱T 细胞表达Tim-3。Tim-3还能通过提高T细胞抗原受体信号转导通路导致T细胞衰竭[31]。CRC患者的Tim-3+PD-1+CD8+T细胞显著增高,且Tim-3+PD-1+CD8+T细胞分泌的干扰素IFN-γ显著低于Tim-3-PD-1-CD8+T细胞[32];CRC手术后,Tim-3和PD-1也会下调细胞免疫的能力提示在CRC术前、术后,Tim-3+PD-1+T细胞代表的是一群功能障碍的T细胞,Tim-3和PD-1可用于评价患者术后的恢复情况。有研究报道[33],galectin-9基因和蛋白在CRC中的表达均低于正常结直肠黏膜组织,同时,伴远处转移CRC的Galectin-9表达低于无远处转移CRC,说明Galectin-9低表达与结直肠癌的远处转移有关。还有学者提出[34],galectin-9在结直肠癌HT29细胞凋亡中发挥促进作用,其作用机制与SHH信号通路激活受阻有关。Galectin-9在结直肠癌中可能发挥抑癌蛋白的作用,但对于其是具体通过何种方式靶向调控 SHH 信号通路尚不明确。
2.5 肝癌
Tim-3在肝细胞癌(HCC)中高表达,并与患者的生存率呈负相关。Tim-3 /Galectin-9信号通路介导HBV相关HCC患者T细胞的消耗。阻断Tim-3 /Galectin-9信号通路可显著改善T细胞的功能, 增加T细胞的增殖和细胞因子的分泌[35]。因此,阻断Tim-3/Galectin-9信号通路可能是未来治疗HBV相关肝癌的有效治疗途径。一些研究发现[36],TLR配体脂多糖可抑制巨噬细胞中Tim-3蛋白的表达,并恢复部分细胞功能。这说明Tim-3的表达可能是由于TLRs及其下游信号通路的表达。此外,在HCC中,Tim-3蛋白调节M1巨噬细胞向M2巨噬细胞的转化,进一步抑制炎症反应。在体外培养的树突状细胞中,Galectin-9可以刺激Tim-3的表达,促进TNF-α的分泌[37]。这些结果都表明,Tim-3在免疫细胞的调控中起着复杂的作用。另外,肝脏炎症微环境中的HBV及IL-6可上调Tim-3表达,促进下游分子STAT3活化,上调的Tim-3同样可以活化NF-κB下游通路,上述机制都能改变肝癌炎症微环境,促进肝癌细胞增殖[38]。
2.6 胰腺癌
树突状细胞是功能最强大的专职抗原提呈细胞,而Tim-3对树突状细胞参与的肿瘤免疫起负性调节作用。有研究报道[39],胰腺癌组织中,Tim-3在肿瘤浸润树突状细胞上的表达水平显著高于癌旁组织及外周血,提示Tim-3可能改变了胰腺癌肿瘤微环境。阻断胰腺癌细胞培养液上清中VEGF、IL-10和PGE2的表达,Tim-3的表达水平也明显下调,说明上述三种细胞因子可能参与了对Tim-3表达的调控。相关作用机制有待进一步论证。

表1 Tim-3/Galectin-9在消化道肿瘤中的表达
3 问题与展望
Tim-3/Galectin-9通路作为一个新兴的免疫检查点正在被人们熟知,通过这些研究能让我们更好地了解该通路的各种作用机制,但目前关于Tim-3/Galectin-9通路在消化道肿瘤中的研究还存在以下局限性:①大部分研究还停留在临床试验阶段,仅通过外周血、肿瘤组织、癌旁组织中Tim-3/Galectin-9的差异性表达来说明该通路与肿瘤的相关性稍显单薄,缺乏更强有力的实验依据支持;②即便是体外细胞实验及动物实验也十分有限,更缺乏质粒转染技术、RNAi 干扰技术、受体特异性阻断技术等完善的设计方案;③应从临床层面、分子层面联合检测T细胞亚群(CD4+和CD8+T细胞)、NK细胞、巨噬细胞上Tim-3/Galectin-9的表达水平,了解其在肿瘤相关免疫细胞中的分布特点,阐明其作用机制,增加结果的可信度。
综上所述,Tim-3在消化道肿瘤中普遍上调,而Galectin-9则反之,Tim-3/Galectin-9平衡的改变会影响肿瘤细胞的生长、免疫逃逸、凋亡、侵袭和转移,同样对患者的诊疗和预后有重要意义。大量研究显示,Tim-3/Galectin-9在消化道肿瘤的靶向治疗上具有巨大潜力,寻找其上游非编码RNA(lncRNA、mi-RNA)及其下游调控的多个靶基因也是我们今后研究的方向和重点[40-41]。因此,我们有理由相信抑制Tim-3与Galectin-9的相互作用是治疗多种消化道恶性肿瘤的新靶点,在不久的将来,一定会有更多的消化道肿瘤患者从中获益。
