胆红素对脂多糖诱导肠上皮损伤修复作用研究
2022-04-20郭科航卓泽伟吴慧欢杨颀陈浩沙卫红
郭科航,卓泽伟,吴慧欢,杨颀,陈浩,沙卫红
坏死性小肠结肠炎(Necrotizing Enterocolitis, NEC) 是一种新生儿中常见的,破坏性极强的胃肠道炎症疾病,在低体重儿发病率高达10%,死亡率高达30%~50%[1-2]。研究表明,NEC患儿肠道上皮细胞诱导氧化应激和炎症反应,最终导致肠上皮细胞凋亡,影响肠黏膜功能[3-4]。过去几十年,NEC治疗策略几乎没有明显改善。目前,NEC治疗手段有限且疗效不佳,易导致短肠综合征、肠狭窄等并发症[5-6]。因此,亟需一种新的治疗手段,以促进受损肠黏膜的修复。
胆红素(Bilirubin)是血红素代谢的最终产物,具有极佳的有抗炎抗氧化作用。Stocker[7]首次发现胆红素可以清除氧自由基,发挥抗氧化作用。研究发现,胆红素在多种疾病中通过抗炎和抗氧化作用修复组织损伤,例如急性胰腺炎、急性肾损伤[8-9]。此外,胆红素在结肠炎模型中减轻氧化应激反应,调节炎症因子水平,促进损伤修复[10-11]。然而,胆红素在NEC中治疗作用尚未可知。本研究利用LPS诱导肠上皮损伤模拟坏死性小肠结肠炎体外细胞模型,通过观察炎症因子、氧化应激、细胞增殖与凋亡,探求胆红素对肠上皮细胞损伤修复作用,为NEC治疗提供新策略。
1 材料与方法
1.1 试剂
IEC-6细胞购自美国American Type Culture Collection(ATCC);DMEM培养基、胎牛血清、链霉素、青霉素均购于美国Gibco公司;Cell Counting Kit-8 (CCK-8)试剂购自dojindo公司(上海东仁);脂多糖(LPS,E.coli 0111:B4)、胆红素(Bilirubin,14370)、2′-7′-二氯荧光素二乙酸酯(DCFA-DA)购自德国sigma公司;ELISA(TNF-α、IL-1β、IL-6、IL-10)购自CUSABIO公司(武汉华美);TUNEL凋亡试剂盒(KGA7072)购自KeyGEN公司(江苏凯基);4%多聚甲醛、Triton X-100、DAPI均购自Leagene公司(北京雷根);大鼠单克隆PCNA抗体(ab29)购自英国abcam公司;Anti-rabbit IgG (Alexa Fluor® 594,8889S)购买于美国Cell Signaling Technology公司;丙二醛(Malondialdehyde,MDA)assay kit、超氧化物歧化酶(Superoxide dismutase,SOD) assay kit购自南京建成生物工程研究所。
1.2 方法
1.2.1 细胞培养
IEC-6细胞轻轻吹打均匀后加入10% FBS、1%链霉素、1%青霉素的DMEM培养基中,置于细胞培养箱(37 ℃,5% CO2)。待细胞密度为80%~90%,0.25%胰酶消化、1000 rpm离心,1∶3传代培养,用于后续实验。
1.2.2 实验分组
根据先前文献[12, 13],IEC-6细胞培养至合适密度,弃去培养基,PBS清洗3次。分为3组:(1)对照(Control)组:加入无血清培养基以及等量生理盐水;(2)LPS组:予以LPS(50 μg/mL)的无血清培养基,培养6 h,不加入胆红素;(3)LPS+胆红素(LPS + Bilirubin)组: LPS(50 μg/mL)刺激后,加入一定浓度的胆红素。
1.2.3 CCK-8测细胞活力
IEC-6细胞以5×103种于96孔板中,过夜培养,LPS刺激后,分别给予等量PBS、0~100 μM胆红素,培养24 h,吸去培养基,加入100 μL完全培养基(含有10 μL CCK-8试剂)。培养箱孵育2 h,利用酶标仪检测波长450 nm的光密度(OD)值。
1.2.4 炎症因子测定
IEC-6细胞种于96孔中。按照1.2.2方法分组处理,其中胆红素浓度为10 μM,孵育24 h。收集细胞上清,依据ELISA试剂盒说明书操作,测量450 nm OD值,建立标准曲线,计算TNF-α、IL-1β、IL-6和IL-10的水平。
1.2.5 氧化反应测定
细胞分组处理后,每孔加入10 μM DCFH-DA,置于37 ℃培养箱避光孵育30 min,PBS洗涤3次,使用荧光显微镜观察。MDA和SOD测量方法根据文献[14-15]。简之,收集细胞,胰酶消化、离心,移除上清,超声破碎仪破碎细胞,收集上清,按照试剂盒说明书加入相应试剂,酶标仪测定各孔吸光度值。
1.2.6 TUNEL实验
细胞处理后,弃去培养基,PBS洗涤3次。4%多聚甲醛室温固定30 min,漂洗3次(3 min/次),0.5% Triton X-100 通透液处理10 min。依次滴加说明书对应试剂染色,避光孵育。最后,DAPI染色液复染细胞核,室温避光反应8 min。洗去DAPI 染液,荧光显微镜观察。
1.2.7 免疫荧光
IEC-6细胞以2×104个/孔的密度种植于24孔板,分组处理。依次4%多聚甲醛固定、0.5% Trton-X100通透操作后,10% BSA封闭抗体30 min,滴加PCNA一抗4 ℃过夜孵育,移去溶液,用荧光标记二抗避光孵育细胞1 h。DAPI复染细胞核,荧光显微镜观察。
1.3 统计学方法

2 结果
2.1 胆红素浓度对LPS诱导的肠上皮细胞活性影响
如图1所示,0.1~10 μM胆红素对LPS诱导的肠上皮细胞的细胞活性逐渐增强,而胆红素浓度在10~100 μM之间时,细胞活性逐渐降低。当胆红素浓度为10 μM时,细胞活性最佳。
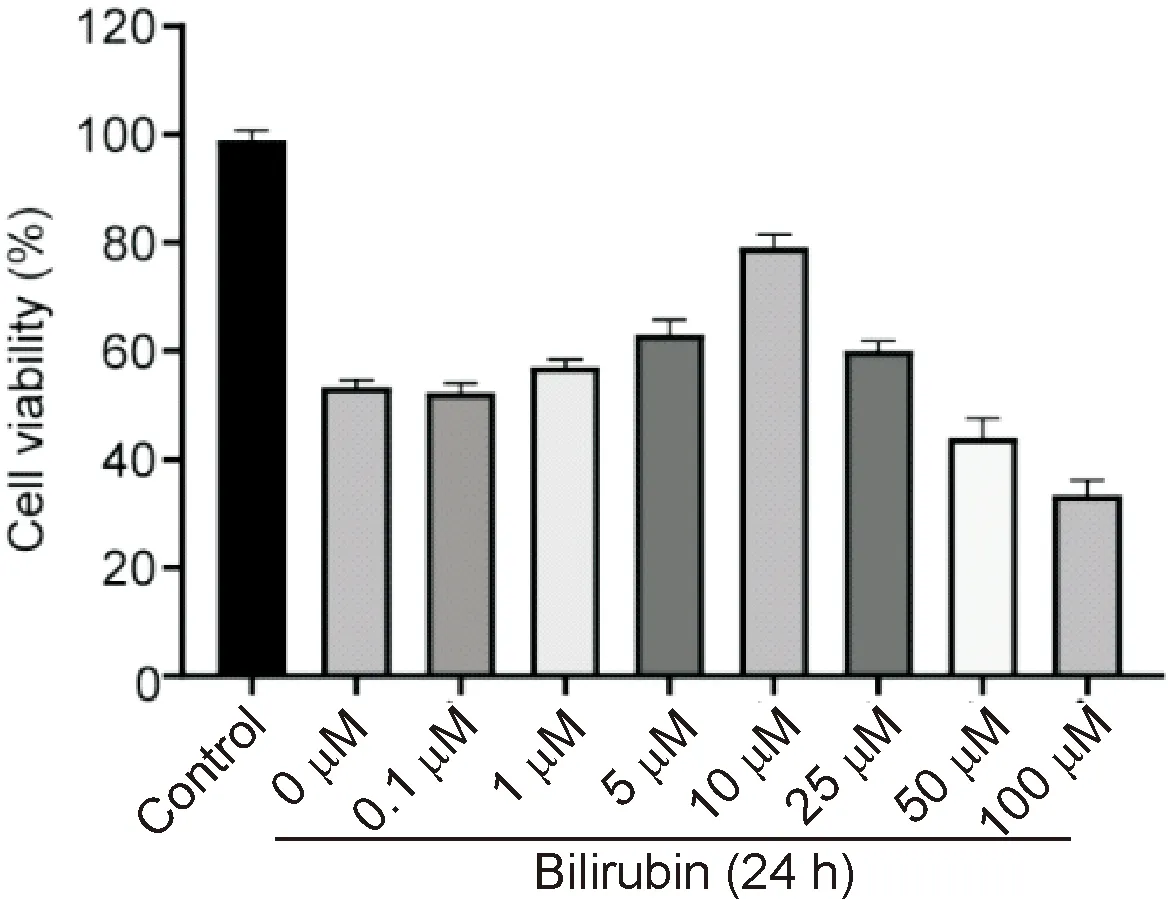
图1 CCK-8测定不同浓度胆红素对肠上皮细胞的影响
2.2 胆红素调节LPS诱导的肠上皮细胞炎症因子水平
与Control组相比,LPS组TNF-α、IL-6、IL-1β水平增加;与LPS组相比,LPS + Bilirubin组TNF-α、IL-6、IL-1β水平明显降低(P<0.05)。然而,对于IL-10水平,LPS组较Control组轻度降低,而LPS + Bilirubin组较LPS组明显升高(P<0.05),见图2。
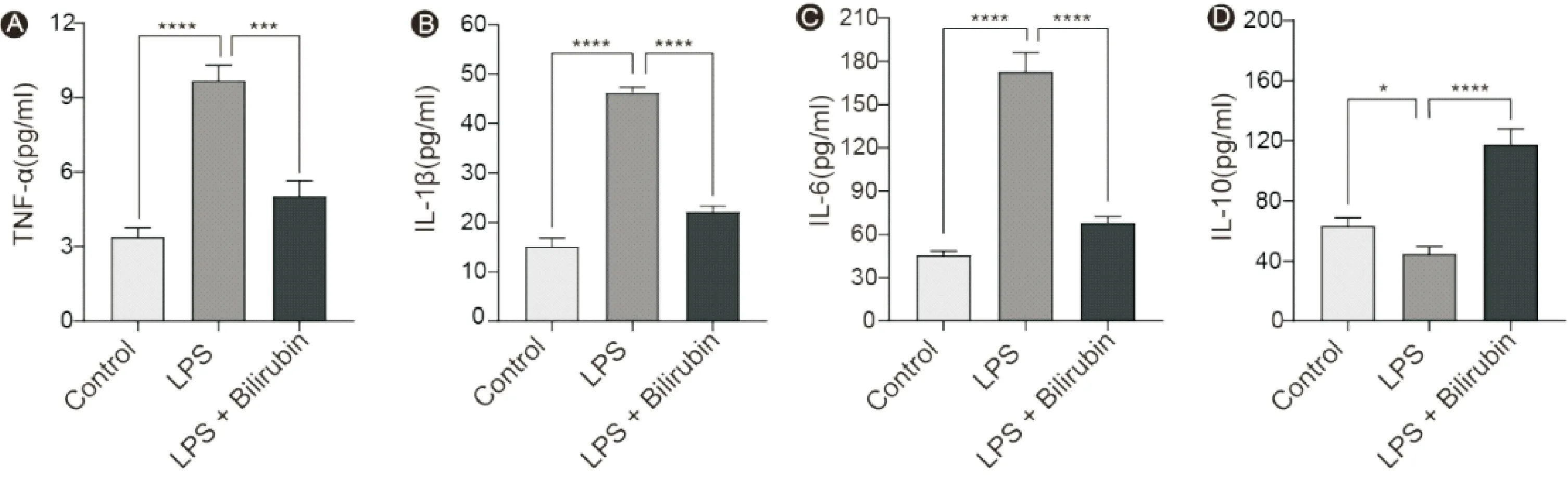
图2 肠上皮细胞炎症因子水平 A:TNF-α;B:IL-1β;C:IL-10; D:IL-10 (n=3;*P<0.05,***P <0.001,****P<0.0001)
2.3 胆红素降低LPS诱导的肠上皮细胞氧化应激反应
ROS荧光结果显示,与Control组相比,LPS组ROS阳性细胞明显增多(P<0.05);与LPS组对比,LPS + Bilirubin组ROS阳性细胞数明显降低(P<0.05)。同样,与Control组对比,LPS组MDA含量增加;与LPS组相比,LPS + Bilirubin组显著下降。与LPS组对比,LPS + Bilirubin组抗氧化指标SOD含量增加(P<0.05),见图3。
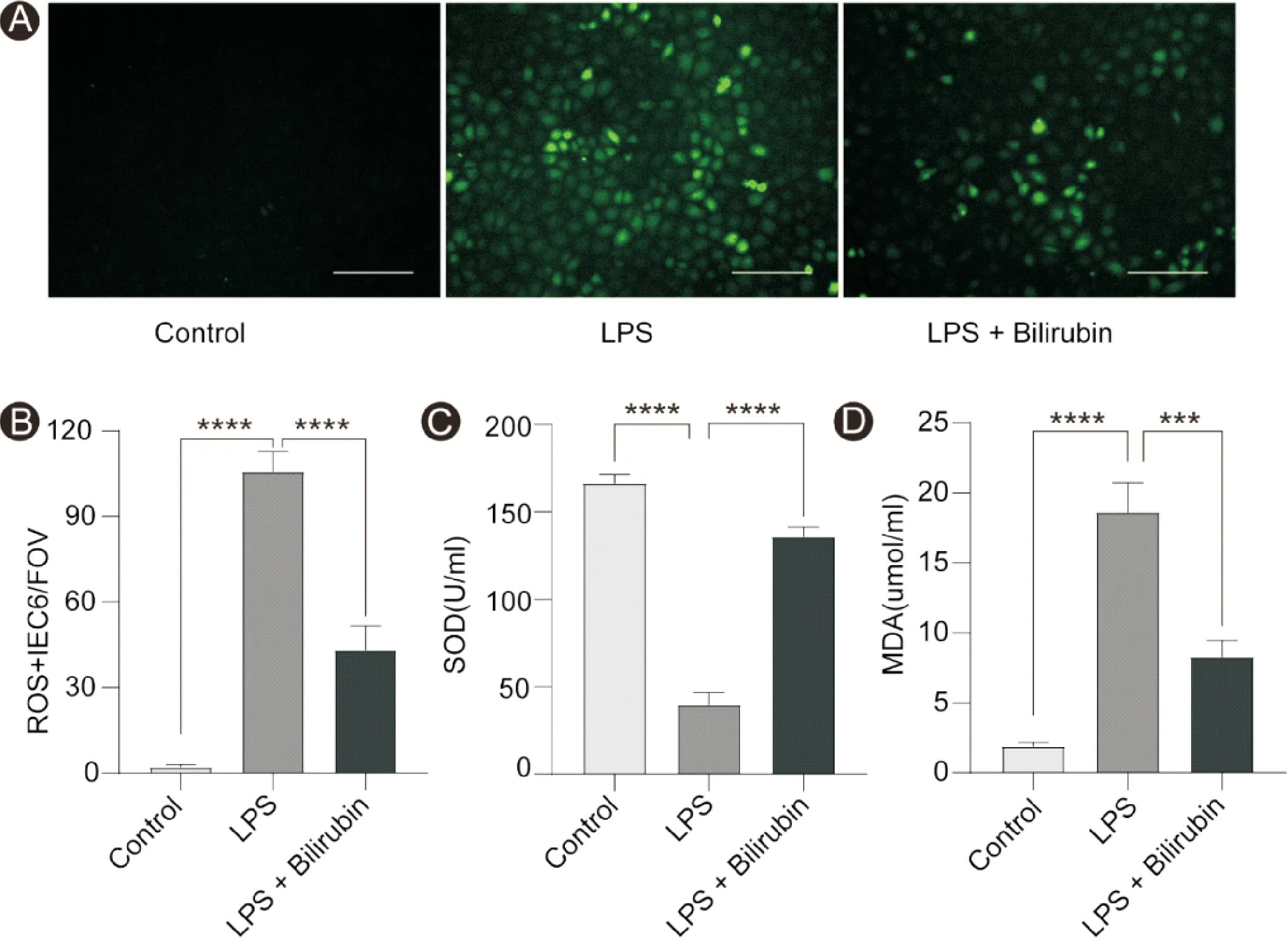
图3 肠上皮细胞氧化应激表达情况 A:DCFH-DA染色;B:ROS阳性细胞定量分析;C:SOD含量;D:MDA含量(比例尺=100 μm;n=3;***P<0.001, ****P <0.000 1)
2.4 胆红素促进LPS诱导的肠上皮细胞增殖且抑制凋亡
TUNEL凋亡结果显示,与Control组相比,LPS组凋亡阳性细胞显著增多(P<0.05);与LPS组对比,LPS+ Bilirubin组凋亡阳性细胞数显著降低(P<0.05)。PCNA免疫荧光结果显示,与Control组相比,LPS组PCNA阳性细胞明显减少(P<0.05);与LPS组对比,LPS + Bilirubin组PCNA阳性细胞数显著增加(P<0.05),见图4。

图4 肠上皮细胞凋亡与增殖 A:TUNEL染色;B:TUNEL阳性细胞定量分析;C:PCNA免疫荧光;D:PCNA阳性细胞定量分析(比例尺=100 μm;n=3;****P<0.000 1)
3 讨论
NEC严重威胁新生儿健康,尤其是早产与低体重儿。由于肠道喂养、缺血缺氧、炎症、细菌定植等诱因,NEC发病率逐年升高[16-17]。NEC的主要病理变化为氧化应激、肠道炎症浸润,最终导致肠上皮细胞坏死[18]。肠上皮由单层柱状上皮细胞组成,作为肠黏膜的第一道屏障,主要抵御外来抗原、微生物及其毒素等入侵。正常生理条件下,肠上皮细胞不断更新,维持肠上皮功能;而在病理条件下,肠上皮细胞损伤、凋亡,导致肠道功能障碍[19-20]。本研究中肠上皮细胞活力对胆红素浓度呈依赖型;当胆红素浓度为10 μM时,胆红素对肠上皮细胞保护作用最强。
新生儿肠道免疫系统不成熟,当受到外界刺激,促炎因子与抗炎因子之间平衡失调,导致过度炎症反应,诱发肠上皮凋亡。研究发现,NEC患儿肠组织、粪便、血清以及大鼠肠组织促炎因子TNF-α、IL-1β和 IL-6 水平显著升高,并与 NEC的肠道损伤严重程度有关[21-25]。我们的实验结果提示与Control组相比,LPS组IL-6、IL-1β和TNF-α水平明显升高,促进了肠上皮细胞损伤。既往研究表明,胆红素通过抗炎作用保护损伤组织。Huang等[8]发现胆红素通过调节IL-6、IL-1β和TNF-α水平减轻急性肾损伤炎症反应,抑制肾小管细胞凋亡。在急性胰腺炎模型中,胆红素抑制巨噬细胞聚集,降低促炎细胞因子TNF-α的表达[9]。本研究中,我们观察到胆红素明显下调促炎因子IL-6、IL-1β和TNF-α水平。IL-10是一种由 Th2 细胞分泌的抑制肠道免疫反应作用的抗炎细胞因子。与足月婴儿母亲母乳相比,NEC的早产儿母亲的母乳中未检测到IL-10;而且与足月婴儿相比,早产儿单核细胞和 T 细胞中IL-10的分泌减少[26]。这与本研究结果一致,我们还发现胆红素处理后肠上皮细胞分泌IL-10增多。因此,胆红素通过降低促炎细胞因子和上调抗炎因子发挥强大的抗炎特性,降低肠上皮细胞炎症反应。
肠道中ROS的产生和NEC的发展之间有密切联系。肠上皮是ROS产生的主要场所。MDA是多不饱和脂肪酸被ROS氧化的分解产物,而SOD是一种抗氧化酶,清除体内氧自由基。炎症发生时,ROS产生与清除之间平衡失调,导致组织和细胞损伤,包括膜脂过氧化、蛋白质功能和结构的改变以及DNA损伤[27]。本研究结果提示,LPS组ROS、MDA明显升高,而SOD含量降低,这与文献报道一致[28-30]。胆红素是一种天然的抗氧化剂,通过清除ROS,抑制MDA生成,修复组织氧化损伤[31-32]。本研究还发现胆红素治疗后ROS、MDA的含量下降,抗氧化酶SOD含量升高。这说明胆红素可通过强大的抗氧化功能,修复肠上皮细胞损伤。
肠上皮细胞的增殖与凋亡动态平衡维持结构与功能完整。肠上皮细胞在官腔紧密排列构成肠黏膜的屏障,主要抵御病原入侵以及促进营养物质吸收。肠上皮细胞的不断动态更新在肠道疾病的形成和发展中起着关键修复作用。NEC发病过程中,肠上皮细胞大量凋亡而细胞增殖能力受到抑制,致使肠上皮细胞大量坏死,绒毛脱落,功能受损[33-34]。Li等人[35]在实验性NEC模型中发现调节肠上皮细胞增殖与凋亡影响NEC发生发展,进一步研究发现促进肠上皮再生,减轻NEC组织损伤。同样地,在实验性NEC模型中,促进肠上皮细胞增殖和减少肠上皮细胞凋亡,致使NEC动物死亡率、组织损伤程度、肠绒毛形态以及细胞屏障功能显著改善[36]。研究表明,胆红素可以促进细胞增殖与抑制凋亡[37-38]。另外一项研究发现胆红素明显减少细胞凋亡,促进损伤组织修复[39]。本研究中,与LPS组比较,LPS + Bilirubin组细胞凋亡明显抑制,细胞增殖显著。因此,胆红素通过抑制细胞凋亡,促进细胞增殖,保护肠上皮细胞。
综上所述,胆红素通过调节炎症因子水平、氧化应激以及促进增殖、抑制凋亡修复LPS诱导的肠上皮损伤,为NEC临床治疗提供新策略。
