青砖茶渥堆发酵中嗜热细菌筛选、鉴定及产酶特性研究
2022-04-20朱雯吴双王文凤许文璨陈文君黄友谊
朱雯,吴双,王文凤,许文璨,陈文君,黄友谊
青砖茶渥堆发酵中嗜热细菌筛选、鉴定及产酶特性研究
朱雯,吴双,王文凤,许文璨,陈文君,黄友谊*
农业部华中都市农业重点实验室,华中农业大学园艺林学学院,湖北 武汉 430070
渥堆发酵是青砖茶独特品质形成的关键技术环节。对来自青砖茶渥堆发酵样品中的细菌进行高温筛选和鉴定。结果表明,通过筛选得到20株能在高温条件下良好生长的细菌,其中15株菌株能够在含茶汤的培养基中生长。3株菌株的最适生长温度为55℃,为嗜热细菌。结合嗜热菌株的形态特征和16 S rDNA基因序列分析,确定1株为枯草芽孢杆菌(),2株为地衣芽孢杆菌()。经嗜热细菌发酵晒青毛茶的产酶试验可知,嗜热菌株在发酵茶叶时能够产生纤维素酶、淀粉酶和单宁酶,其酶活力分别可达215.69、259.28、4.85 U。
青砖茶;嗜热细菌;枯草芽孢杆菌;地衣芽孢杆菌;产酶特性
青砖茶是湖北特色黑茶,为后发酵茶,主产于鄂南、湘北等地区[1],是西北高寒高脂饮食地区人们的生活必需品,具有减肥、降脂、抗氧化等多种保健作用[2-4]。青砖茶以晒青毛茶为原料,经过渥堆发酵、干燥、蒸压成型、陈化等工序而制成[5-6]。国内外研究表明,渥堆发酵是青砖茶独特品质形成的关键[7-9]。渥堆发酵是一种以微生物活动为中心的高温高湿发酵过程[10],在湿热作用条件下,微生物大量繁殖并分泌多种胞外酶,从而引发茶叶内含物质发生氧化、降解、甲基化、糖基化、聚合等一系列生化反应[11],进而形成青砖茶特有的汤色、香气和滋味品质。
近年来,关于青砖茶渥堆发酵中微生物的研究已有所报道。张丹丹等[12]对青砖茶渥堆发酵不同堆层的微生物种类及变化进行了研究,结果发现细菌数量最多,放线菌、霉菌其次,酵母最少。Hu等[13]研究青砖茶渥堆发酵中真菌群落结构和动态变化,其中曲霉属是整个过程中的优势属,而青霉属、德巴利酵母属、嗜热子囊菌属和嗜热丝孢菌属等在发酵的不同阶段产生。郑鹏程等[1]采用纯培养技术从青砖茶渥堆发酵样品中分离出青霉菌属、黑曲霉、塔宾曲霉、粉红黏帚霉、篮状菌属5株真菌。
青砖茶在渥堆发酵过程中,堆温保持在55~65℃,被认为有利于青砖茶品质的形成。因此,青砖茶的渥堆发酵是一种高温固态发酵过程。在此过程中,必然会存在着高温嗜热微生物,这些高温嗜热微生物对茶叶特有风味特征的形成具有重要意义[14]。Xu等[10]在青砖茶渥堆发酵样品中分离出、、sp.和等4种主要耐热微生物。目前,仍缺乏对青砖茶耐热菌特性的研究,也未见关于青砖茶渥堆发酵过程中嗜热微生物的报道,本研究拟对青砖茶渥堆发酵中的嗜热细菌进行高温筛选和鉴定,并对其产酶特性进行研究,以探明青砖茶渥堆发酵中嗜热细菌的种类与作用,为了解青砖茶渥堆发酵品质的形成提供基础。
1 材料与方法
1.1 材料与试剂
1.1.1 材料
赤壁青砖茶菌库中的菌株,分离自湖北洞庄茶业有限公司赤壁青砖茶规模化渥堆发酵中的在制品中[12],共分离得到细菌50株(菌株编号为:F1、F2-4、F4-1、F13、N1、N1-12、N4、N7-2、N9、N92-1、F1-1、F2-5、F5、F14、N1-1、N2、N5-1、N721、N9-1、N922、F2、F3-1、F6、F16、N1-2、N2-1、N6-1、N73、N911、N92-2A、F2-1、F3-2、F11、F17、N1-3、N3、N7、N731、N912、N9-3、F2-2、F3-3、F12、F18、N1-4、N3-1、N7-1、N74、N917、N9-5),保存于本课题组实验室,菌株保存在营养琼脂培养基中,每两周活化1次。发酵茶叶原料为晒青毛茶,购自湖北洞庄茶业有限公司。
1.1.2 试剂
琼脂购自赛国生物科技有限公司;DNS显色剂购自厦门海标科技有限公司;蛋白胨和牛肉浸膏购自海博生物技术有限公司;羧甲基纤维素钠、没食子酸丙酯、柠檬酸、柠檬酸三钠、冰乙酸、乙酸钠、葡萄糖、可溶性淀粉、氯化钠、罗丹宁、氢氧化钾、磷酸氢二钠、碳酸钠、福林酚、磷酸二氢钾、茚三酮、浓硫酸、蒽酮等均为分析纯,购自国药集团化学试剂有限公司;乙腈和甲醇均为色谱纯,购自赛默飞世尔科技公司;儿茶素各组分标样、没食子酸、咖啡碱(纯度>99%)均为标准品,购自上海源叶生物科技有限公司。
1.1.3 培养基
牛肉膏蛋白胨培养基:牛肉膏5.0 g、蛋白胨10.0 g、NaCl 5.0 g、琼脂20.0 g,用蒸馏水定容至1 000 mL,pH 7.0。液体培养基不含琼脂。
复筛培养基(含茶汤):晒青毛茶与沸腾蒸馏水按1∶50(∶)的比例配比,100℃水浴浸30 min,过滤后得滤液,加入牛肉膏5.0 g、蛋白胨10.0 g、NaCl 5.0 g、琼脂20.0 g,用蒸馏水定容至1 000 mL。
培养基均在121℃高压蒸汽灭菌20 min。
1.2 仪器与设备
紫外分光光度计,上海翱艺仪器有限公司;TS型恒温摇床,上海天呈实验仪器制造有限公司;SPL-250型生化培养箱,天津市莱玻特瑞仪器设备有限公司;SW-CJ-IFD型洁净工作台,苏州安泰空气技术有限公司;PTX-FA110型电子天平,福州华志科学仪器有限公司;YX-280A型手提式压力蒸汽灭菌器,合肥华泰医疗设备有限公司;LC-20A高效液相色谱仪,岛津仪器(苏州)有限公司;HYC-310型医用冷藏箱,青岛海尔特种电器有限公司;生物显微镜,重庆澳浦光电技术有限公司;FE20型实验室pH计,梅特勒-托利多仪器有限公司;冷冻离心机,赛默飞世尔科技有限公司;GFL-125型电热鼓风干燥箱,天津市莱玻特瑞仪器设备有限公司。
1.3 方法
1.3.1 菌株筛选
菌株初筛:在无菌条件下,挑取两环菌落,平板划线到牛肉膏蛋白胨培养基中,分别在45℃和50℃条件下恒温培养,观察各菌株的生长情况,初步筛选出能在高温条件下生长的菌株。
菌株复筛:在无菌条件下,将初筛得到的菌株,挑取两环菌落,平板划线到复筛培养基中,分别在45℃和50℃条件下恒温培养,观察各菌株的生长情况,筛选出在高温条件下生长能力强的菌株。
菌株最适生长温度测定:在无菌条件下,将复筛后得到的菌株,挑取少量菌落,接种于100 mL的牛肉膏蛋白胨液体培养基中,在37℃、150 r·min-1条件下,恒温培养12~18 h,测OD600。待OD值约为0.8时,制得菌株的种子液。吸取1 mL种子液,接种于100 mL的牛肉膏蛋白胨液体培养基中,分别在28、37、45、50、55、60℃的摇床(150 r·min-1)中培养相同时间,以空白培养基为对照,测OD600,绘制各菌株的温度曲线。
1.3.2 菌种鉴定
嗜热菌株的形态观察、革兰氏染色及生理生化实验参考《常见细菌系统鉴定手册》[15]。嗜热菌株的分子生物学鉴定在提取嗜热菌株基因组后,采用16 S rDNA基因的通用引物27F、785F和1492R进行PCR扩增、测序,结果提交至GenBank进行序列比对,利用生物学软件MEGA-X构建系统进化树[16]。
1.3.3 嗜热菌株发酵茶叶时产酶特性研究
嗜热菌株发酵样品制备:将晒青毛茶进行装罐处理,每罐20.0 g,加入10 mL无菌水后121℃灭菌20 min,冷却备用。在无菌条件下,将嗜热菌株各挑取两环接种于100 mL牛肉膏蛋白胨培养基中,在55℃、150 r·min-1条件下,恒温培养12~24 h,测OD600备用(OD600约为0.8)。将已制备的菌液在3 500 r·min-1条件下离心10 min,收集菌体,用无菌蒸馏水反复多次洗涤后再次离心,将收集的菌体重新混匀在100 mL无菌水中备用。吸取3 mL上述菌液,接种于每罐茶叶中,在55℃条件下恒温培养,在0、5、10 d时取样,每个菌株6次重复,测定各项酶活力。
粗酶液的提取:称取5.0 g发酵茶样品于150 mL容量瓶中,加入50 mL超纯水,置于25℃摇床中,180 r·min-1浸提2 h。随后用8层纱布过滤粗颗粒,滤液在4℃条件下8 000 r·min-1离心10 min,取上清液,即为粗酶液。
酶活力测定方法:纤维素酶、淀粉酶和单宁酶活力测定方法参照吴志超[17]的方法。纤维素酶活定义为在37℃条件下,每小时每克发酵茶催化羧甲基纤维素钠生成1 mg葡萄糖所需纤维素酶为一个酶活力单位(U)。淀粉酶活力定义为在50℃条件下,每小时每克发酵茶催化可溶性淀粉生成1 mg葡萄糖所需淀粉酶为一个酶活力单位(U)。单宁酶活力定义为40℃条件下,每分钟每克发酵茶生成1 μmol没食子酸所需单宁酶为一个酶活力单位(U)。
1.3.4 嗜热细菌发酵茶叶内含成分变化研究
嗜热细菌N3发酵样品制备:将晒青毛茶进行装罐处理,每罐20.0 g,加入10 mL无菌水后121℃灭菌20 min,冷却备用。在无菌条件下,将N3菌株挑取两环接种于100 mL牛肉膏蛋白胨培养基中,在55℃、150 r·min-1条件下,恒温培养12~24 h,测OD600备用(OD600约为0.8)。以3 500 r·min-1将已制备的菌液离心10 min,收集菌体,用无菌蒸馏水反复多次洗涤后再次离心,将收集菌体混匀重悬在100 mL无菌水中备用。吸取3 mL上述菌液,接种于每罐茶叶中,在55℃条件下恒温培养,在10 d时取样,以0 d为对照,试验重复3次。
理化成分测定:水浸出物含量测定参照GB/T 8305—2013[18];茶多酚含量测定参照GB/T8313—2018[19];游离氨基酸含量测定参照GB/T 8314—2013[20];可溶性糖含量测定参照蒽酮硫酸法[21];儿茶素组分、没食子酸和咖啡碱含量测定参照HPLC法[22]。
1.4 数据处理与分析
每组试验均3次重复,数据均采用Excel 2021和SPSS 19.0数据统计软件进行方差分析和显著性比较,所有数据均以平均值±标准差表示,<0.05,差异显著。
2 结果与分析
2.1 嗜热菌株的初筛与复筛
嗜热微生物一般是指能够在高温环境中生长的微生物[23]。通过初筛结果可知,共有20个菌株可在45℃或50℃条件下正常生长,具有耐高温活性(表1)。而复筛的结果表明,共有15个菌株,可在45℃或50℃条件下的含茶汤培养基中正常生长(表2)。因此,推测这15个菌株中存在着适合在茶叶中生长的嗜热细菌。
2.2 菌株的最适生长温度
将复筛后得到的15个菌株,接种到牛肉膏蛋白胨液体培养基中,在不同温度条件下,摇床培养相同时间后,测定其OD600值(图1)。
如图1所示,N4、N1-2、F3-3、N2为常温细菌(Normal temperature microorganism),最适生长温度为37℃(图1-A);N2-1、F1-1、F3-2、N1-4、N1为中温微生物(Mesophilic microorganisms),最适生长温度为45℃(图1-B);F1、N92-2A、N1-12为耐热微生物(Thermoduric microorganism),最适生长温度为50℃(图1-C);N1-3、N3、N3-1为嗜热微生物(Thermophilic microorganisms),最适生长温度为55℃(图1-D)。表明N1-3、N3、N3-1菌株为青砖茶渥堆发酵中的嗜热细菌。
2.3 菌种鉴定
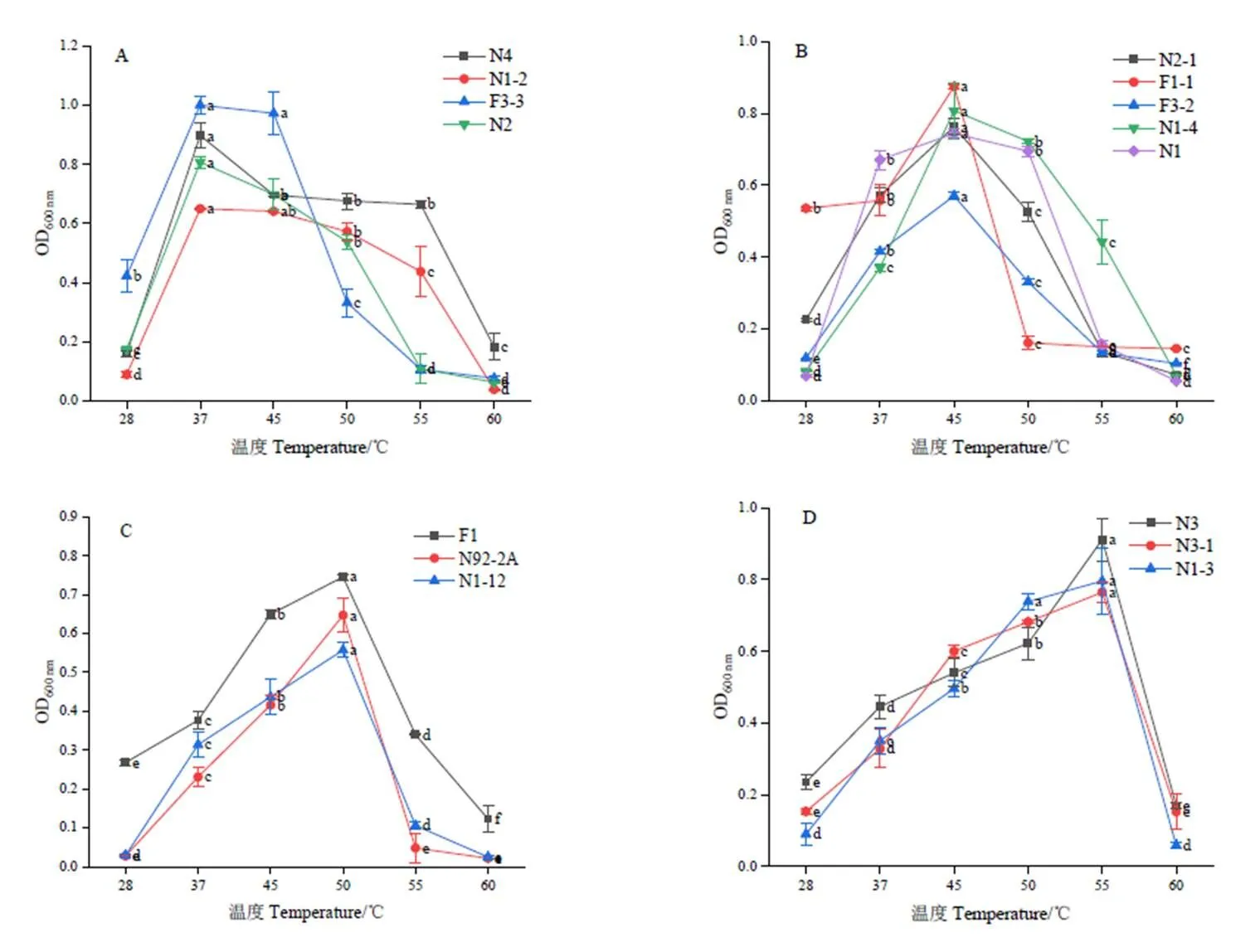
由图2可知,菌株N1-3在牛肉膏蛋白胨平板上30℃培养48 h后,菌落呈白色不透明,边缘光滑,不易挑取。
菌株N3和N3-1在牛肉膏蛋白胨平板上30℃培养48 h后,菌落呈白色不透明,边缘呈锯齿状,易挑取。3种嗜热菌株革兰氏染色均为阳性,菌体成杆状,室温放置3 d以上可观察到游离芽孢。3种嗜热菌株的生理生化结果为:V-P试验呈阳性;硝酸盐还原试验呈阳性;触酶试验呈阳性;脲酶、吲哚试验均为阴性;能利用葡萄糖、阿拉伯糖、甘露醇等碳源,但不产气;双水解酶试验呈阴性;反硝化作用呈阴性。由形态观察及生理生化特征结果可以初步确定这3种嗜热菌株为芽孢杆菌属(spp.)。对3种嗜热菌株的16 S rDNA序列进行测序,将拼接好的序列在NCBI数据库(Blast.ncbi.nlm.nih.gov)中进行比对,发现N1-3与枯草芽孢杆菌属()的16 S rDNA基因序列自然聚类,相似度为100%;N3和N3-1与地衣芽孢杆菌属()的16 S rDNA基因序列自然聚类,相似度为100%。与10条相似性较高的序列构建系统发育树。如图3所示,N1-3与菌株聚为一群,表明N1-3与的菌株亲缘关系最近;N3和N3-1与菌株聚为一群,表明N3和N3-1与的菌株亲缘关系最近。

表1 初筛中在45℃或50℃能正常生长的菌株
注:+,生长;-,不生长
Note: +, grow.-, not grow
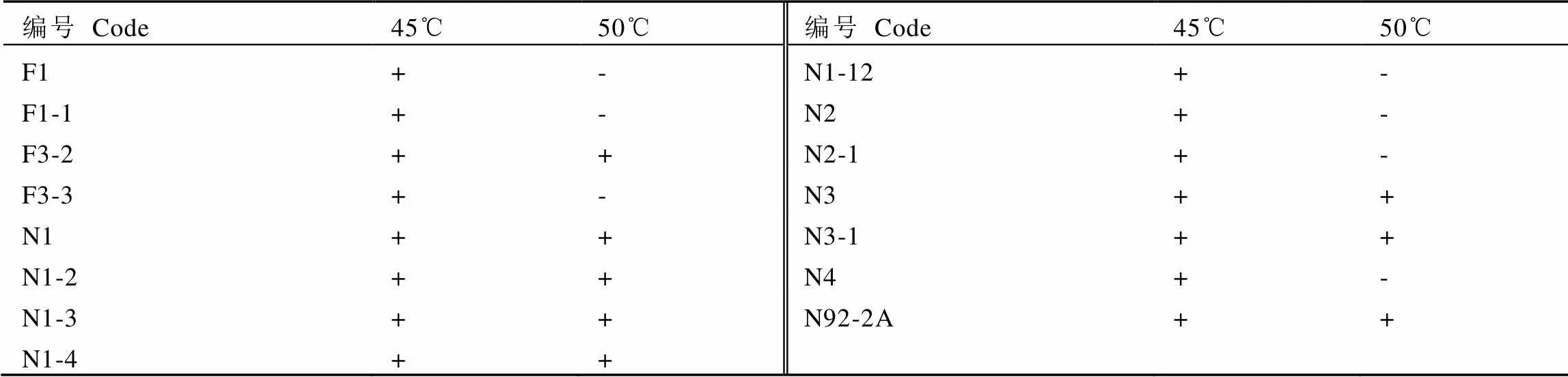
表2 菌株在含茶叶的培养基生长情况
注:+,生长;-,不生长
Note: +, grow; -, not grow
注:不同的小写字母表示在P<0.05水平差异显著。A:常温细菌,B:中温微生物,C:耐热微生物,D:嗜热微生物
2.4 嗜热菌株发酵茶叶时产酶特性
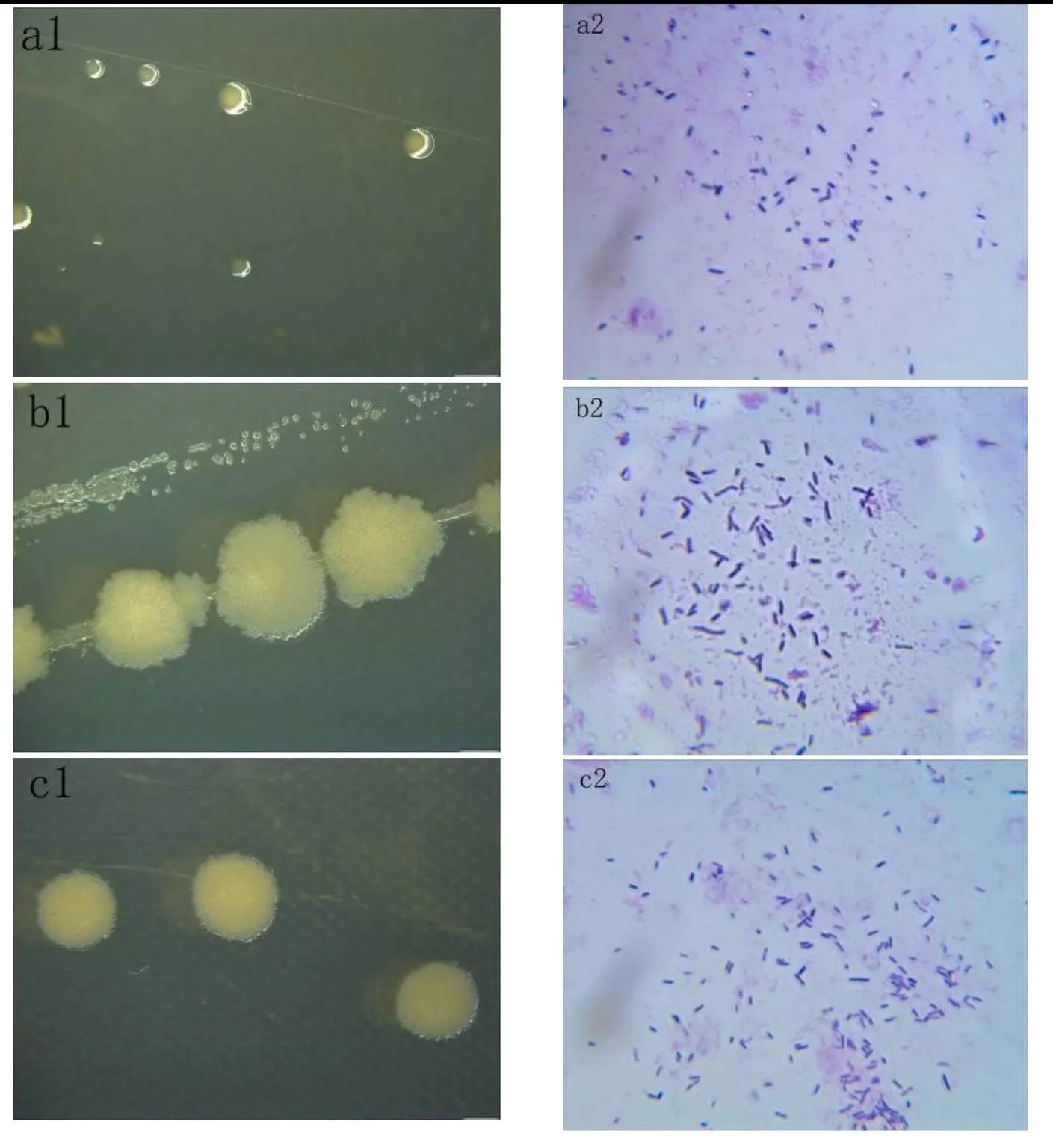
本研究对在嗜热细菌发酵样品可能产生的各种酶类进行了研究,包括多酚氧化酶、过氧化物酶、中性蛋白酶、碱性蛋白酶、果胶酶、纤维素酶、单宁酶、淀粉酶。试验结果表明,3种嗜热细菌在发酵茶叶时可产生纤维素酶、单宁酶和淀粉酶。在55℃条件下,N1-3菌株在发酵10 d时所产纤维素酶的活力最高,为215.69 U;N3和N3-1菌株所产纤维素酶的活力不存在显著性差异(图4-A)。在55℃条件下,N3菌株在发酵10 d时所产单宁酶活力最高,为4.85 U,且与N3-1菌株所产酶的活力不存在显著性差异(图4-B)。在55℃条件下,N3菌株在发酵10 d时所产淀粉酶的活力最高,为259.28 U。N1-3菌株在发酵5 d时不产淀粉酶,在发酵10 d时产酶能力与N3-1不存在显著性差异(图4-C)。因此,在55℃的高温条件下,N3菌株产酶能力较强,且发酵10 d有利于多种酶的产生。
注:a1:N1-3菌落形态;a2:N1-3革兰氏染色(100×);b1:N3菌落形态;b2:N3革兰氏染色(100×);c1:N3-1菌落形态;c2:N3-1革兰氏染色(100×)

图3 嗜热菌株基于16 S rDNA序列的系统发育树
注:不同的小写字母表示在P<0.05水平差异显著
2.5 嗜热细菌发酵茶叶时内含成分变化
对嗜热细菌N3发酵茶样品进行理化成分和儿茶素组分等含量测定,结果见表3和表4。由表3可知,与对照相比,发酵样品的水浸出物、茶多酚、游离氨基酸含量均降低,而可溶性糖含量增加,为50.68±2.17 g·kg-1。可能是嗜热细菌能够分泌纤维素酶和淀粉酶,有利于可溶性糖含量的积累。表4结果表明,儿茶素组分中,EGCG和EGC含量明显降低,GC含量明显增加;GA含量略有增加,CAFF含量略有下降。由于本研究中并未检测到多酚氧化酶含量,推测茶多酚含量的降低和儿茶素组分的变化可能是高温条件作用的结果。

表3 嗜热细菌N3发酵样品中理化成分含量

表4 嗜热细菌N3发酵样品中儿茶素组分、没食子酸、咖啡碱含量
注:C 儿茶素;GC 没食子儿茶素;EC 表儿茶素;EGC 表没食子儿茶素;EGCG 表没食子儿茶素没食子酸酯;GCG 没食子儿茶素没食子酸酯;ECG 表儿茶素没食子酸酯;GA 没食子酸;CAFF 咖啡碱
Note: C, catechin.GC, gallocatechin.EC, epicatechin.EGC, epigallocatechin.EGCG, epigallocatechin gallate.GCG, gallocatechin gallate.ECG, epicatechin gallate.GA gallic acid.CAFF Caffeine
3 讨论
3.1 青砖茶渥堆发酵中存在嗜热细菌
近年来,黑茶因其独特的陈香风味和保健作用,在全球范围内越来越受欢迎[24]。而渥堆发酵,是形成黑茶独特品质的关键工艺。以往研究[25-26]表明,渥堆发酵是在高温条件下进行的。因此,在黑茶渥堆发酵中存在大量耐高温或嗜热微生物。对普洱茶渥堆发酵中嗜热微生物的研究发现,嗜热微生物主要来自芽孢杆菌属、高温放线菌属、链霉菌属和脲杆菌属[27];而青砖茶渥堆发酵中的主要耐高温微生物有稻壳芽胞杆菌、枯草芽孢杆菌、链霉菌和烟曲霉[28]。且芽孢杆菌属是黑茶渥堆发酵的优势微生物属[5]。本研究采用纯培养方法,对来自青砖茶渥堆发酵中细菌的最适生长温度进行分析,结果表明青砖茶渥堆发酵中除了常温和中温微生物外,还存在耐热微生物和嗜热微生物。并通过菌株形态学观察、生理生化检测和分子生物学技术,鉴定出青砖茶渥堆发酵中的嗜热微生物为枯草芽孢杆菌和地衣芽孢杆菌。
3.2 微生物分泌多种酶类有利于黑茶内含成分的转化
黑茶的独特品质是以儿茶素为主体的多酚类、生物碱、氨基酸及其氧化产物等多种物质的综合体现[8]。在渥堆发酵过程中,茶叶中多酚、生物碱、萜烯类等物质在微生物分泌的多种胞外酶作用下,进行酶促反应,从而发生复杂的化学变化。对茯砖茶不同发酵过程微生物菌群和化学成分变化研究发现,酵母属微生物可以分泌降解苯酚的酶类,产生甜味的木糖醇类物质[29]。对普洱茶不同发酵过程微生物和酶的变化研究表明,发酵过程中主要的优势菌属是变形杆菌和曲霉属,茶多酚、游离氨基酸、儿茶素类和茶红素含量均呈下降趋势,而茶褐素和没食子酸含量上升,可能是微生物分泌的过氧化氢酶参与儿茶素的氧化分解导致[30]。本研究通过嗜热细菌发酵晒青毛茶产酶试验分析发现,在高温发酵过程中,嗜热菌株可以产生纤维素酶、淀粉酶和单宁酶;同时嗜热细菌发酵茶叶试验结果表明,可溶性糖含量增加,酯型儿茶素含量降低。纤维素酶可以降解纤维素生成葡萄糖,淀粉酶能将淀粉水解成低聚糖,进而提高茶叶中可溶性糖含量;单宁酶能水解单宁酸类物质,使茶叶的苦涩味降低。
4 结论
本研究对来自青砖茶渥堆发酵样品中细菌进行高温初筛和复筛,得到20株能够在高温条件下良好生长的耐高温细菌,且其中有15个菌株能在含茶培养基中良好生长。通过菌株最适生长温度分析,得到3株能够在55℃高温条件下良好生长的嗜热细菌。经过形态学、生理生化特性和16 S rDNA序列比对分析,确定N1-3菌株为枯草芽孢杆菌,N3和N3-1菌株为地衣芽孢杆菌。经嗜热细菌发酵晒青毛茶的产酶试验可知,嗜热菌株在发酵茶叶时能够产生纤维素酶、淀粉酶和单宁酶。同时,嗜热细菌发酵茶叶试验结果表明,可溶性糖含量增加,酯型儿茶素含量降低。综上所述,在青砖茶渥堆发酵中,存在着多种嗜热微生物,且能够产生各种胞外酶,影响茶叶内含成分的转化,具有良好的开发和应用前景。本研究可为青砖茶渥堆发酵高温作用的机理研究奠定基础。
[1] 郑鹏程, 谭荣荣, 刘盼盼, 等.青砖茶渥堆过程中真菌种类及品质变化研究[J].食品科技, 2017, 42(11): 22-26.
Zheng P C, Tan R R, Liu P P, et al.Study on the fungi species and quality changes of green brick tea during pile-fermentation process [J].Food Science and Technology, 2017, 42(11): 22-26.
[2] 张伟.青砖茶对实验大鼠的减肥和调节血脂作用及其机制研究[D].武汉: 华中农业大学, 2009.
Zhang W.Studies on anti-obesity, blood lipid regulation effects and mechanisms of dark brick tea on rats [D].Wuhan: Huazhong Agricultural University, 2009.
[3] 杨新河, 吕帮玉, 黄明军, 等.青砖茶清除DPPH·能力及其多酚和黄酮含量研究[J].食品研究与开发, 2016, 37(23): 1-5.
Yang X H, Lv B Y, Huang M J, et al.Studies on DPPH free radical scavenging capacity and polyphenols and flavonoids contents of Qingzhuan brick tea [J].Food Research and Development, 2016, 37(23): 1-5.
[4] 陈玉琼, 张伟, 倪德江, 等.湖北青砖茶辅助降血脂作用及其抗氧化效果[J].茶叶科学, 2010, 30(2): 124-128.
Chen Y Q, Zhang W, Ni D J, et al.Study on the hypolipidemic effect and antioxidative activity of Hubei Qingzhuan tea [J].Journal of Tea Science, 2010, 30(2): 124-128.
[5] Lin F J, Wei X L, Liu H Y, et al.State-of-the-art review of dark tea: from chemistry to health benefits [J].Trends in Food Science & Technology, 2021, 109: 126-138.
[6] 苏丹, 唐飞, 张善明, 等.不同嫩度青砖茶改善小鼠胃肠道功能研究[J].湖北农业科学, 2021, 60(14): 103-108.
Su D, Tang F, Zhang S M, et al.Effect of different tenderness of dark brick tea on improving gastrointestinal function in mice [J].Hubei Agricultural Sciences, 2021, 60(14): 103-108.
[7] Zheng W J, Wan X C, Bao G H.Brick dark tea: a review of the manufacture, chemical constituents and bioconversion of the major chemical components during fermentation [J].Phytochemistry Reviews, 2015, 14(3): 499-523.
[8] 胡帅.基于微生物组学及代谢组学技术的青砖茶渥堆过程品质形成机制研究[D].武汉: 华中农业大学, 2019.
Hu S.Study on Quality Formation mechanism of Qing Zhuan Tea pile fermentation based on microbiome and metabolomics [D].Wuhan: Huazhong Agricultural University, 2019.
[9] Cheng L, Wang Y, Zhang J, et al.Dynamic changes of metabolic profile and taste quality during the long-term aging of Qingzhuan tea: the impact of storage age [J].Food Chemistry, 2021, 359(11): 129953.doi: 10.1016/j.foodchem.2021.129953.
[10] Xu Q, Sun M, Ning J, et al.The Core Role of Bacillus subtilis andin Pile-Fermentation Processing of Qingzhuan Brick Tea [J].Indian Journal of Microbiology, 2019, 59(3): 288-294.
[11] Zhu M Z, Li N, Zhou F, et al.Microbial bioconversion of the chemical components in dark tea [J].Food Chemistry, 2019, 312: 126043.doi: 10.1016/j.foodchem.2019.126043.
[12] 张丹丹, 王佳佳, 朱雯, 等.青砖茶渥堆发酵中微生物的变化[J].食品科学, 2019, 40(6): 166-172.
Zhang D D, Wang J J, Zhu W, et al.Changes of microbial community during pile fermentation of Qingzhuan tea [J].Food Science, 2019, 40(6): 166-172.
[13] Hu S, He C, Li Y, et al.Changes of fungal community and non-volatile metabolites during pile-fermentation of dark green tea [J].Food Research International, 2021, 147(1): 110472.doi:10.1016/j.foodres.2021.110472.
[14] Zhang W, Yang R, Fang W, et al.Characterization of thermophilic fungal community associated with pile fermentation of Pu-erh tea [J].International journal of food microbiology, 2016, 227: 29-33.
[15] 东秀珠, 蔡妙英.常见细菌系统鉴定手册[M].北京: 科学出版社, 2001.
Dong X Z, Cai M Y.Manual of identification of common bacterial systems [M].Beijing: Science Press, 2001.
[16] 张妮, 张红岩, 杨梦莹, 等.一株海洋来源高效产角蛋白酶菌株的筛选、鉴定及其酶学性质研究[J].食品与发酵工业, 2020, 46(18): 98-104.
Zhang N, Zhang H Y, Yang M Y, et al.Isolation and identification of a highly efficient keratinase producing strain from marine environment and its enzymatic properties [J].Food and Fermentation Industries, 2020, 46(18): 98-104.
[17] 吴志超.黑茶发酵优势菌株的胞外酶检测及蛋白组学初探[D].福州: 福建师范大学, 2018.
Wu Z C.Detection of extracellular enzymes and initial research on proteomics of the dominant strain for dark tea's fermentation [D].Fuzhou: Fujian Normal University, 2018.
[18] 中国国家标准化管理委员会.茶水浸出物测定: GB/T 8305—2013[S].北京: 中国标准出版社, 2014: 1-5.
China National Standardization Management Committee.Tea: determination of water extracts content: GB/T 8305—2013 [S].Beijing: China Standards Press, 2014: 1-5.
[19] 中国国家标准化管理委员会.茶叶中茶多酚和儿茶素类含量的检测方法: GB/T 8313—2018[S].北京: 中国标准出版社, 2018: 1-5.
China National Standardization Management Committee.Determination of total polyphenols and catechins content in tea: GB/T 8313-2018 [S].Beijing: China Standards Press, 2018: 1-5.
[20] 中国国家标准化管理委员会.茶游离氨基酸总量的测定: GB/T 8314—2013[S].北京: 中国标准出版社, 2013: 1-5.
China National Standardization Management Committee.Tea: determination of water extracts content: GB/T 8305—2013 [S].Beijing: China Standards Press, 2014: 1-5.
[21] 张志良, 瞿伟菁.植物生理学实验指导[M].北京: 高等教育出版社, 2004.
Zhang Z L, Qu W J.Experimental guidance of plant physiology [M].Beijing: Higher Education Press, 2004.
[22] 张欢.茶叶厌氧发酵中高含量没食子酸形成以及茶蛋白降解促进活性肽释放的研究[D].武汉: 华中农业大学, 2021.
Zhang H.Research on the formation of high content gallic acid and degradation of tea protein promoting the release of active peptides in tea anaerobic fermentation [D].Wuhan: Huazhong Agricultural University, 2021.
[23] 姚潇婷.嗜热地衣芽孢杆菌特性的研究、改良及初步应用研究[D].长沙: 中南林业科技大学, 2017.
Yao X T.The research on characteristics, improvement and preliminary application of thermophilic[D].Changsha: Central South University of Forestry and Technology, 2017.
[24] Zhang W, Cao J, Li Z, et al.HS-SPME and GC/MS volatile component analysis of Yinghong no.9 dark tea during the pile fermentation process [J].Food Chemistry, 2021, 357: 129654.
[25] Zhu Y, Luo Y, Wang P, et al.Simultaneous determination of free amino acids in Pu-erh tea and their changes during fermentation [J].Food Chemistry, 2016, 194: 643-649.
[26] Cheng L, Yang Q, Chen Z, et al.Distinct changes of metabolic profile and sensory quality during Qingzhuan tea processing revealed by LC-MS-based metabolomics [J].Journal of agricultural and food chemistry, 2020, 68(17): 4955-4965.
[27] Guo W, Zhao M, Chen Q, et al.Citrinin produced using strains offrom Liupao tea [J].Food Bioscience, 2019, 28: 183-191.
[28] Chen C, Zhang W, Lv C, et al.Primary study on thermophiles during pile-fermentation of Pu-er tea [J].IEEE, 2011: 691-695.
[29] Li Q, Huang J, Li Y, et al.Fungal community succession and major components change during manufacturing process of Fu brick tea [J].Scientific Reports, 2017, 7(1): 6947.doi: 10.1038/s41598-017-07098-8.
[30] Ming Z, Zhang D L, Su X Q, et al.An integrated metagenomics/metaproteomics investigation of the microbial communities and enzymes in solid-state fermentation of Pu-erh tea [J].Scientific Reports, 2015, 5:10117.doi: 10.1038/srep10117.
The Screening, Identification and Enzyme Production of Thermophilic Bacteria in Pile-fermentation of Qingzhuan Tea
ZHU Wen, WU Shuang, WANG Wenfeng, XU Wencan, CHEN Wenjun, HUANG Youyi*
Key Laboratory of Urban Agriculture in Central China, Ministry of Agriculture, College of Horticulture and Forestry Science Huazhong Agricultural University, Wuhan 430070, China
Pile-fermentation (PF) is a key step for the formation of the unique quality of Qingzhuan tea.In this study, high-temperature screening and identification of bacteria from PF samples of Qingzhuan tea were carried out.The results show that 20 strains of bacteria that could grow under high temperature conditions were obtained through screening, of which 15 strains could grow on a tea-containing medium.The optimum temperature of 3 thermophilic bacteria strains was 55℃.Combined with the morphological characteristics and the 16 S rDNA gene sequence analysis, it was found that one strain wasand the other two were.The enzyme production test on raw tea by thermophilic bacteria shows that three thermophilic bacteria could produce cellulase, amylase and tannin during tea fermentation, and the enzyme activities reached 215.69 U, 259.28 U, and 4.85 U, respectively.
Qingzhuan tea, thermophilic bacteria,,, enzyme production characteristics
S571.1
A
1000-369X(2022)02-211-11
2021-12-16
2022-01-13
湖北省农业科技创新专项和中央高校基本科研业务费专项(2662020YLPY012)
朱雯,女,博士研究生,研究方向为茶叶生物技术与加工,516166123@qq.com。*通信作者:youyi@mail.hzau.edu.cn
(责任编辑:赵锋)
