茶树黄金芽CsHIPP26.1蛋白螯合离子的筛选与鉴定
2022-04-20刘富浩范延艮王域孟凡月张丽霞
刘富浩,范延艮,王域,孟凡月,张丽霞*
茶树黄金芽CsHIPP26.1蛋白螯合离子的筛选与鉴定
刘富浩1,2,范延艮1,2,王域1,2,孟凡月1,2,张丽霞1,2*
1.山东农业大学园艺科学与工程学院,山东 泰安 271018;2.作物生物学国家重点实验室,山东 泰安 271018
重金属相关异戊二烯化植物蛋白(HIPPs)由于其独特的重金属结合域和异戊二烯序列的结构特点,成为一类重要的金属分子伴侣。为鉴定茶树()黄金芽CsHIPP26.1蛋白的螯合离子,将重组质粒和空载体分别转入大肠杆菌BL21,在分别添加4 mol·L-1的单一金属离子(CuCl2、ZnCl2、MgCl2、FeCl3、CaCl2)或5种金属离子混合液以及1 mmol·L-1IPTG诱导的LB液体中培养,观测大肠杆菌的生长情况,并用His-tag蛋白纯化磁珠纯化获得融合目的蛋白,经原子吸收分光光度计分析融合蛋白中金属离子含量,计算蛋白螯合的离子数目。结果表明,CsHIPP26.1蛋白仅与Zn2+和Cu2+螯合,且螯合Zn2+的能力显著强于Cu2+。根据其结合金属离子与目的蛋白质量摩尔比推测,CsHIPP26.1蛋白螯合Zn2+、Cu2+金属离子的最大数目分别为2和1。
重金属异戊二烯植物蛋白;CsHIPP26.1;金属离子;茶树
重金属相关异戊二烯化植物蛋白(Heavy metal-associated isoprenylated plant protein,HIPP)是植物中一种特有的金属伴侣蛋白。本课题组前期从茶树[(L.) Kuntze]黄金芽品种中发现一个响应强光且高表达的CsHIPP26.1蛋白,并对该蛋白基因进行了克隆、生物信息学分析和功能验证[1],同时,发现过量表达的苹果愈伤组织对光胁迫的抗性增强,且CsHIPP26.1可与光敏色素互作因子CsPIF4(Phytochrome interacting factors)互作[2]。已有研究表明,HIPPs在植物体内主要有3个方面的功能:(1)与蛋白互作对代谢起调控作用;(2)参与重金属的解毒;(3)参与金属离子的转运[3]。而这些功能的发挥与螯合离子的种类密切相关。所以,明确CsHIPP26.1蛋白结合金属离子的种类,可为该蛋白功能的研究提供一定的基础,因而具有重要的理论意义。
有研究表明,HIPPs蛋白HMA结构域的核心基序M/LXCXXC能螯合Cu2+、Zn2+、Ni2+、Cd2+、Hg2+和Pb2+[4-5],但不与Co2+、Mn2+、Ca2+结合[6-7]。由于CsHIPP26.1蛋白表达响应高光强下的叶色黄化,与重金属离子(Ni2+、Cd2+、Hg2+和Pb2+)的毒害无关,而与光逆境胁迫和叶色变化相关[2],从而可能与光保护机制[8]、植物卟啉类化合物代谢[9]和植物信号通路[10]中涉及的离子(Zn2+、Cu2+、Fe3+、Mg2+、Ca2+)相关。
为筛选和鉴定CsHIPP26.1蛋白所螯合的金属离子,本研究构建含有质粒的大肠杆菌原核表达载体(pET-CHI),同时以空载体为对照(Control),分别在添加单一金属离子(CuCl2、ZnCl2、MgCl2、FeCl3、CaCl2)和5种混合金属离子培养液中培养,通过诱导表达、纯化获得目的蛋白CsHIPP26.1,进一步分析并确定融合蛋白中金属离子的种类和结合数。
1 材料与方法
1.1 试验材料
采摘种植于山东省泰安市茶园5年茶树黄金芽的芽下第二叶,液氮冷冻,置于–80℃冰箱保存,用于总RNA提取。
1.2 试剂与仪器
T100TMPCR仪,美国Bio-Rad;DYY-12核酸电泳仪,北京六一仪器厂;Tanon-3500凝胶成像仪,上海天能科技有限公司;YJ-VS-2超净工作台,无锡一净净化设备有限公司;Z216MK台式高速冷冻离心机,德国Hermle;ML204电子天平,美国METTLER TOLEDO;NanoDrop 2000紫外分光光度计,美国Thermo Scientific;ExceMagTM16孔金属磁力架,苏州莫纳生物科技有限公司;MARS6微波消仪,美国CEM;HNY-200B恒温培养震荡器,天津欧诺仪器股份有限公司;GI80TW灭菌器,美国Zealway;TAS-986原子吸收分光光度计,北京普析通用仪器有限责任公司。
1.3 试验方法
1.3.1 总RNA提取和cDNA合成
参照多糖多酚植物总RNA提取试剂盒说明书提取茶树总RNA,用1%琼脂糖凝胶电泳检测所提取RNA质量。提取的茶树总RNA按照反转录试剂盒说明书反转录合成cDNA,保存于–20℃冰箱备用。
1.3.2 融合蛋白表达载体的构建
目的基因克隆:根据NCBI(https://www.ncbi.nlm.nih.gov)中基因的编码序列MK654903,利用Primer Premier 5.0软件设计引物,上游引物(5'-3')为ATGGGTGCTCTGGATCATCTC,下游引物(5'-3')为CATGACAACACAAGCAGCAG。以黄金芽cDNA为模板,利用PCR扩增目的基因全长,回收目的片段连接到平末端克隆载体中,转化到大肠杆菌DH5感受态细胞中,挑取氨苄西林(Amp)抗性阳性单克隆测序。
重组载体的构建:用Steady Pure Plasmid DNA Extraction Kit试剂盒提取测序正确菌液中的质粒,将提取的质粒与载体同时进行SalI与BamHI双酶切,所获得的阳性克隆委托生工生物工程(上海)股份有限公司测序,确定其碱基序列的完整性。
设计新颖、技术前沿、风格独特、性能卓越,无论从美学上还是机械设计上,Defy系列无疑都是未来革新的风向标,代表着真力时的先锋巨制。尤其是2017年问世的Defy El Primero 21以及DefyLab表款则以其划时代的变革意义象征着品牌再攀制表巅峰,更为全球制表界指明未来的方
融合蛋白的诱导表达:将重组质粒()及对照质粒()分别转化到大肠杆菌BL21中。挑取重组菌株以及对照菌株单克隆,培养于LB+Amp培养基中。加入终浓度为1 mmol·L-1的IPTG,诱导His-tag融合蛋白的表达。分别于0、60、120 min和240 min收集菌液,提取菌液粗蛋白,利用SDS-PAGE进行蛋白质变性凝胶电泳检测。
1.3.3 不同金属离子溶液处理下大肠杆菌生长曲线的测定
分别在OD600=0.1的重组菌和对照菌株LB培养液中加入终浓度为1 mmol·L-1的IPTG和4 mol·L-15种金属离子单一溶液或其混合溶液(CuCl2、ZnCl2、MgCl2、FeCl3、CaCl2),同时以未添加金属离子培养的菌株为对照,在37℃、180 r·min-1条件下振荡培养,每隔2 h测定OD600值,试验重复3次,绘制生长曲线。
1.3.4 目的蛋白纯化
以OD600=0.6的重组菌(pET-CHI)及对照菌(Control)液为材料,经高速离心机按照5 000 r·min-1离心15 min,收集菌体,称重。将1 g湿质量的大肠杆菌加入10 mL Binding buffer(20 mmol·L-1PBS,500 mmol·L-1NaCl,20 mmol·L-1咪唑,pH7.4)重悬,依据一步法细菌活性蛋白提取试剂盒说明书,加入10 mL的裂解液,4℃下,混匀30 min。超声裂解后将液体转移至离心管,在高速冷冻离心机中4℃条件下以1 200 r·min-1转速离心20 min,收集上清液;然后加入His-tag蛋白纯化磁珠颠倒混匀,室温孵育15 min。将离心管置于磁力架上分离,待溶液澄清,移出上清液。向离心管中加入10 mL Wash buffer(20 mmol·L-1PBS,500 mmol·L-1NaCl,100 mmol·L-1咪唑,pH7.4),反复吹打5~10次进行洗涤,磁分离,吸出上清液。最后向离心管中加入10 mL Elution buffer(20 mmol·L-1PBS,500 mmol·L-1NaCl,500 mmol·L-1咪唑,pH7.4)进行洗脱,磁分离,待溶液澄清,收集上清液即为目的蛋白组分CsHIPP26.1。
1.3.5 目的蛋白中离子种类及配体数量确定
蛋白含量测定:取1 mL分离纯化后的目的蛋白,按考马斯亮蓝法测定目的蛋白的浓度,试验步骤参考文献[11],测得目的蛋白浓度(mmol·L-1)。
金属离子含量测定:取10 mL分离纯化液置于四氟乙烯微波消解罐的内罐中,加入10 mL HNO3-HClO4(5∶1)混合液,轻微振荡后静置20 min,放入微波消解仪中消解,消解完毕后冷却至室温,取出内罐,将消解液转移至100 mL容量瓶中并定容,最后将溶液通过原子吸收分光光度计,测得目的蛋白中各金属离子的浓度(mmol·L-1)。
蛋白中离子配体数计算:蛋白结合的离子配体数=金属离子浓度(mmol·L-1)/蛋白浓度(mmol·L-1)
1.3.6 数据处理
利用Excel 2016软件对数据进行统计分析,利用SPSS 19.0软件进行差异显著性检验(=0.05),利用GraphPad Prism 9软件作图。
2 结果与分析
2.1 茶树扩增
PCR扩增后,经琼脂糖凝胶电泳的检测,在460 bp左右的位置获得了目的条带(图1),与基因预测的CDS区域序列大小完全一致[1]。
图1 CsHIPP26.1基因RT-PCR扩增
2.2 pET-32a-CsHIPP26.1重组载体的构建
将PCR扩增获得的基因片段连接到大肠杆菌表达载体,并转化至大肠杆菌DH5感受态细胞,挑选阳性克隆的重组质粒,采用限制性内切酶BamHI和SalI进行酶切鉴定,结果如图2所示。由图2可知,在460 bp附近出现了目的基因条带,表明原核表达载体构建成功。
2.3 pET-32a-CsHIPP26.1重组载体的表达
将重组质粒转化到BL21中,利用1 mmol·L-1IPTG诱导表达茶树CsHIPP26.1融合蛋白。从图3可知,与空白载体相比,重组载体表达的蛋白谱带在37kDa处有新的条带,且随时间的延长表达量增加。由此表明,通过IPTG诱导,在大肠杆菌中重组的基因能被正确地表达。
2.4 重组菌生长情况分析
将重组菌和对照菌在单一或混合金属离子溶液中诱导培养,分析不同离子溶液培养条件下大肠杆菌的生长情况,结果如图4所示。除添加Zn2+对对照菌的生长具有明显的抑制作用外,其余处理对重组菌和对照菌的生长情况没有显著影响。由此表明,CsHIPP26.1与Zn2+存在一定的关联。
图2 pET-32a-CsHIPP26.1重组质粒的BamHI和SalI酶切鉴定
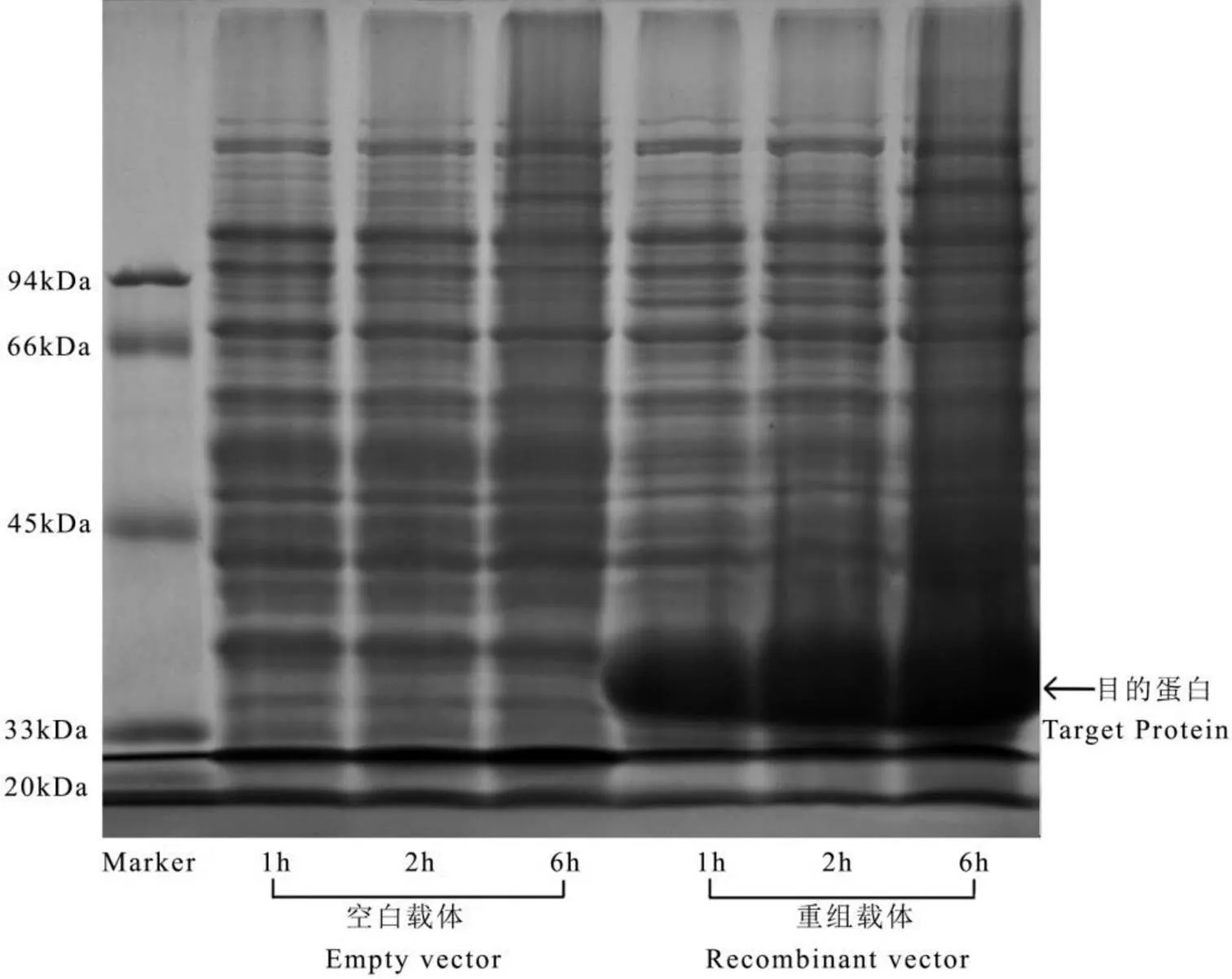
图3 重组载体pET-32a-CsHIPP26.1原核表达
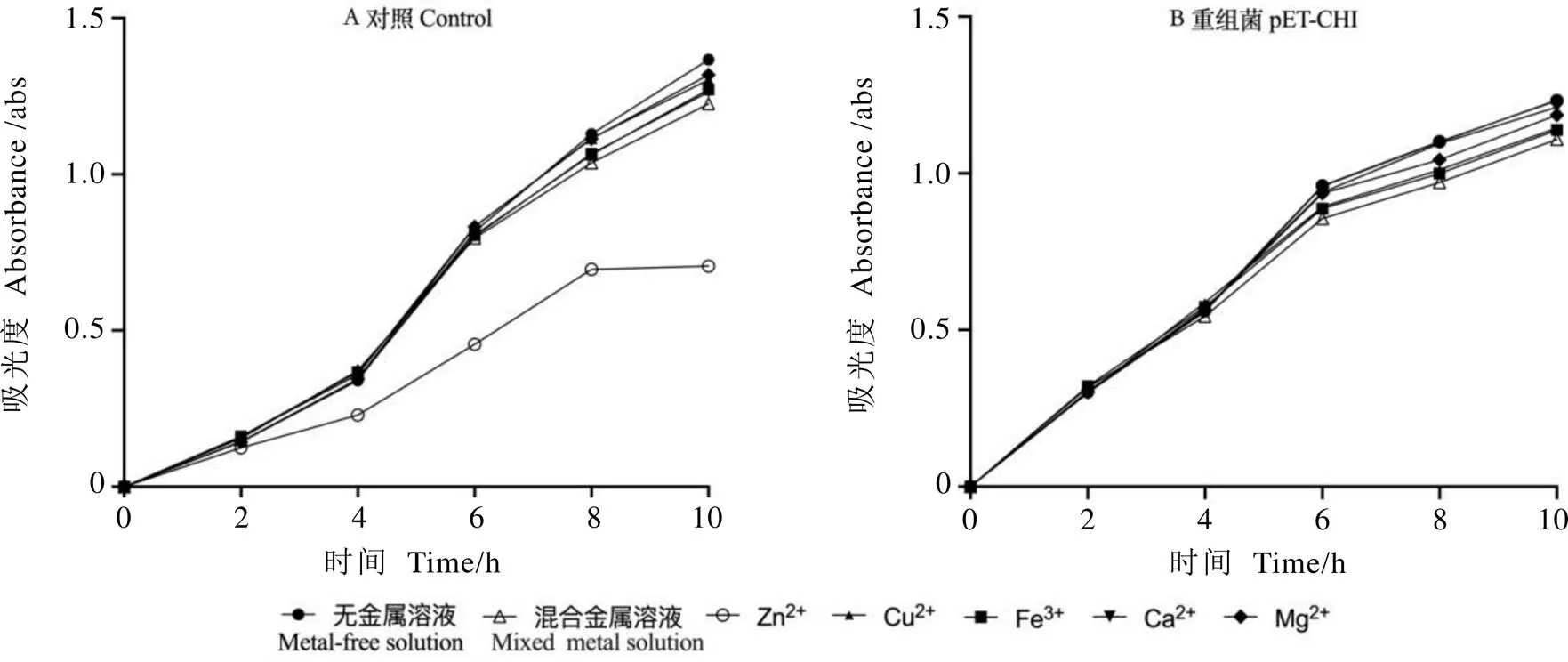
图4 不同金属离子下大肠杆菌生长曲线
2.5 CsHIPP26.1蛋白螯合金属离子种类和含量的分析
将重组菌和对照菌在单一或混合金属离子溶液中诱导培养,从菌液中提取纯化目的蛋白CsHIPP26.1,并对其螯合的离子含量进行分析,结果如图5和图6所示。结果表明,经单一金属离子溶液培养处理的重组菌目的蛋白中检测到的Zn2+、Cu2+含量显著高于对照(<0.000 1),分别为对照的34.9倍和13.7倍;而重组菌目的蛋白和对照蛋白中Fe3+、Ca2+、Mg2+含量相近,无显著差异。经混合金属离子溶液培养处理,获得的重组菌目的蛋白中也可检测到Zn2+、Cu2+含量显著高于对照(<0.000 1),分别为对照的42.9倍和6.7倍。与单一金属离子溶液处理相比,混合离子溶液处理获得的重组菌目的蛋白中Zn2+比例增加,而Cu2+比例下降,由此表明,CsHIPP26.1蛋白对Zn2+的结合能力显著强于Cu2+。
2.6 CsHIPP26.1蛋白螯合金属离子数分析
将重组菌分别在添加浓度为0、0.5、5 mol·L-1的ZnCl2、CuCl2溶液中诱导培养,提取纯化目的蛋白CsHIPP26.1,测定和分析蛋白的表达量及螯合金属离子含量,结果如表1所示。从表1可知,不同离子浓度培养条件下目的蛋白CsHIPP26.1的表达量无显著差异,但目的蛋白中Zn2+和Cu2+浓度随添加离子浓度的增加呈现显著上升趋势。当添加Zn2+和Cu2+的浓度从0.5 mol·L-1上升到5 mol·L-1时,Zn2+含量与CsHIPP26.1蛋白含量的比值从0.639 9上升到1.975 5,Cu2+含量与CsHIPP26.1蛋白含量的比值从0.406 3上升到0.952 1。根据CsHIPP26.1蛋白所结合的金属离子与目的蛋白质量摩尔比推测,每分子蛋白螯合的Zn2+、Cu2+数目分别为2和1。
3 讨论
本研究结果表明,CsHIPP26.1对Zn2+、Cu2+具有螯合能力,且对Zn2+的结合能力显著大于Cu2+,但对Ca2+、Fe3+、Mg2+无螯合能力。已有研究表明,HIPPs蛋白HMA结构域主要结合的金属离子有Cu2+、Zn2+、Ni2+、Cd2+、Hg2+和Pb2+[4-5],但不与Co2+、Mn2+、Ca2+离子结合[6-7]。另外,Dykema等[4]发现拟南芥中ATFP3(farnesylated protein 3)蛋白也含有HMA结构域,并且证明该类蛋白具有螯合Zn2+、Cu2+的特性,这与本研究CsHIPP26.1蛋白对Zn2+、Cu2+具有螯合能力但不结合Ca2+的结果相吻合。
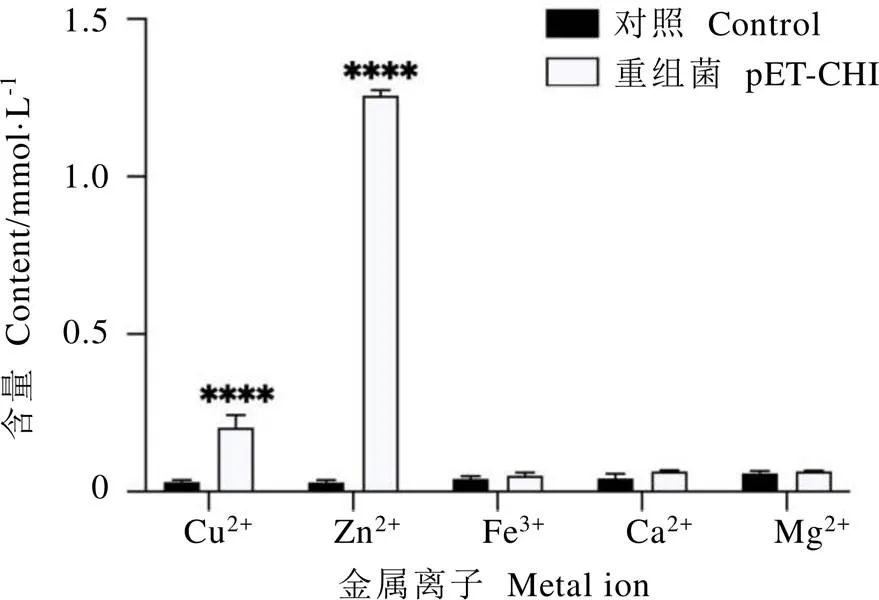
图6 多金属离子培养条件下目的蛋白中金属离子含量

表1 不同金属离子浓度培养条件下目的蛋白和其螯合的金属离子含量及比值
通过对CsHIPP26.1蛋白及螯合的金属离子含量分析,确定了每分子CsHIPP26.1螯合Zn2+、Cu2+数目分别为2和1。已有研究表明,HIPPs蛋白是通过HMA结构域核心基序CXXC中2个半胱氨酸的巯基与Zn2+、Cu2+结合[4]。在CsHIPP26.1蛋白的一级结构中,N端的第37—40位氨基酸具有CXXC核心基序[1],为Zn2+或Cu2+的结合位点。而本研究发现,CsHIPP26.1蛋白可以结合2分子的Zn2+,所以CsHIPP26.1蛋白中还存在其他Zn2+结合位点。根据金属离子螯合理论,除半胱氨酸(C)外,组氨酸(H)的咪唑基、谷氨酸(E)和天冬氨酸(D)的羧基也可与Zn2+螯合。前期研究结果显示,在CsHIPP26.1蛋白中还含有3个组氨酸、11个谷氨酸、8个天冬氨酸、2个半胱氨酸[1],可以为Zn2+提供结合位点,但具体位点还有待进一步研究。
茶树黄金芽CsHIPP26.1蛋白在强光下高表达,且与叶色黄化程度正相关。在响应强光时,CsHIPP26.1蛋白是与Zn2+和Cu2+等量结合还是选择性地与Zn2+或Cu2+结合?其功能主要是提高黄金芽在强光逆境的抗性?还是直接调控光信号传导途径或叶绿素代谢途径相关酶基因表达的转录因子?以上问题还有待深入研究。
[1] 范延艮, 刘富浩, 赵秀秀, 等.茶树‘黄金芽’基因克隆与光响应表达分析[J].植物生理学报, 2021, 57(5): 1087-1097.
Fan Y G, Liu F H, Zhao X X, et al.Cloning ofin‘Huangjinya’ and analysis of its expression level in response to light intensity [J].Plant Physiology Journal, 2021, 57(5): 1087-1097.
[2] 范延艮.‘黄金芽’茶树不同色泽新梢多组学比较及生理特性研究[D].泰安: 山东农业大学, 2019.
Fan Y G.Multiomics comparison and physiological characteristics of different colour shoots ofHuangjingya [D].Tai'an: Shandong Agricultural University, 2019.
[3] Neto J A, Turchetto-Zolet A C, Oliveira L, et al.Heavy metal-associated isoprenylated plant protein (HIPP): characterization of a family of proteins exclusive to plants [J].The FEBS Journal, 2013, 280(7): 1604-1616.
[4] Dykema P E, Sipes P R, Marie A, et al.A new class of proteins capable of binding transition metals [J].Plant Molecular Biology, 1999, 41(1): 139-150.
[5] Hung I H, Casareno R L B, Labesse G, et al.HAH1 is a copper-binding protein with distinct amino acid residues mediating copper homeostasis and antioxidant defense [J].Journal of Biological Chemistry, 1998, 273(3): 1749-1754.
[6] Suzuki N, Yamaguchi Y, Koizumi N, et al.Functional characterization of a heavy metal binding protein CdI19 from[J].Plant Journal, 2010, 32(2): 165-173.
[7] Chandran D, Sharopova N, Ivashuta S, et al.Transcriptome profiling identified novel genes associated with aluminum toxicity, resistance and tolerance in[J].Planta, 2008, 228(1): 151-166.
[8] Yamasaki H, Hayashi M, Fukazawa M, et al.SQUAMOSA promoter binding protein-like7 is a central regulator for copper homeostasis in[J].The Plant cell, 2018, 2009(1): 347-361.
[9] Jana K, Jan P, Vendula K, et al.Lack of phosphatidylglycerol inhibits chlorophyll biosynthesis at multiple sites and limits chlorophyllide reutilization insp.Strain PCC 6803 [J].Plant Physiology, 2015, 169(2): 1307-1317.
[10] Gao H, Chen G, Han L, et al.Calcium influence on chilling resistance of grafting eggplant seedlings [J].Journal of Plant Nutrition, 2005, 27(8): 1327-1339.
[11] 王孝平, 邢树礼.考马斯亮蓝法测定蛋白含量的研究[J].天津化工, 2009, 23(3): 40-42.
Wang X P, Xing S L.Determination of protein quantitation using the method of coomassie brilliant blue[J].Tianjin Chemical Industry, 2009, 23(3): 40-42.
Screening and Identification of Chaperone CsHIPP26.1 Chelating Ionsin Tea Cultivar‘Huangjinya’
LIU Fuhao1,2, FAN Yangen1,2, WANG Yu1,2, MENG Fanyue1,2, ZHANG Lixia1,2*
1.College of Horticulture Science and Engineering, Tai'an 271018, China; 2.State Key Laboratory of Crop Biology, Shandong Agricultural University, Tai'an 271018, China
Heavy metal-associated isoprenylated plant proteins(HIPPs) is an important metallochaperones due to its unique heavy metal binding domains(HMA) and the structural characteristics of isoprenylation motif.In order to identify the chelating ions of CsHIPP26.1 protein in(L.) cv.‘Huangjinya’, therecombinant plasmids and empty carriers were respectively transferred intoBL21, and then were cultured in LB liquid culture medium with 4 mol·L-1single metal ions (CuCl2, ZnCl2, MgCl2, FeCl3, CaCl2) or multiple metal ions and 1 mmol·L-1IPTG.The growth ofin different ion media was observed, meanwhile the fusion target protein was obtained by His-tag protein purification magnetic bead.The contents of metal ions in fusion protein were analyzed by atomic absorption spectrophotometer, and the number of ions chelated by the protein was calculated.The results show that CsHIPP26.1 protein was only chelated with Zn2+and Cu2+, and the chelating ability to Zn2+was significantly higher than Cu2+.Based on the molar ratio of its bound metal ionsto the target protein, the maximum number of Zn2+, Cu2+chelated by CsHIPP26.1 protein was 2 and 1, respectively.
heavy metal-associated isoprenylated plant protein, CsHIPP26.1, metal ions,
S571.1
A
1000-369X(2022)02-179-08
2021-12-06
2022-02-18
山东省“双一流”奖补资金项目(SYL2017YY03)、山东省现代农业产业技术体系创新团队项目(SDAIT-19-05)、鲁渝科技协作计划项目(2020LYXZ005)
刘富浩,男,硕士研究生,主要从事茶树分子生物学研究。*通信作者:lxzhang@sdau.edu.cn
(责任编辑:黄晨)
