大熊猫尿液成分的代谢组学研究
2022-04-19谢婷霞李才武邓雯文何永果吴代福张和民邹立扣
谢婷霞, 李才武, 邓雯文, 晋 蕾, 何永果, 吴代福, 张和民, 黄 炎, 邹立扣
(1. 四川农业大学资源学院, 成都611130; 2. 大熊猫国家公园珍稀动物保护生物学国家林业和草原局重点实验室(中国大熊猫保护研究中心), 都江堰611830)
大熊猫(Ailuropodamelanoleuca)具有独特的食性和消化道结构[1]。目前,鉴于大熊猫食性单一、肠道疾病致死率较高,其生理代谢及其相关领域的研究便成为大熊猫保护生物学研究的焦点[2-6]。
代谢组学作为系统生物学的重要组成部分,通过整体分析代谢图谱并结合模式分析揭示生物体在不同状态下代谢产物的变化,常用作寻找代谢物与生理病理变化的相对关系的研究方式。尿液是机体代谢终末产物,取样便捷、无创伤,是代谢组学研究的理想来源。周本宏等[7]采用HPLC-ESI-Q-TOF-MS 对地榆鞣质在尿液中的代谢产物进行鉴别,进而研究其代谢过程;张琳等[8]利用气相色谱-质谱联用技术在肾细胞癌患者和健康人尿液中筛选出14种差异代谢物,并推测这些代谢产物可能是肾细胞癌的诊断标志物。然而,目前对大熊猫机体代谢的相关性研究较少,刘玉良等[9]利用气相色谱-质谱联用技术对6只大熊猫尿液中的化学成分进行检测,共推定出38种物质,但对不同性别和年龄的大熊猫并未分别研究。大熊猫个体之间可通过尿液中不同化学成分的气味判别对方的身份、性别和年龄,在不同性别和不同发育阶段的大熊猫尿液中可能存在标志性代谢物,运用恰当则可能达到预防疾病、增进健康等有利效果,但是在大熊猫尿液中哪些物质能够编码这些信息依然是一个空白。本文利用超高效液相色谱串联飞行时间质谱UPLC-Q-TOF/MS技术,研究大熊猫尿液代谢产物随年龄和性别的不同而产生的变化,找出不同性别和不同年龄状态下大熊猫尿液可能存在的标志性代谢物,以期为了解大熊猫机体代谢情况及疾病预防等方面提供基础数据。
1 材料与方法
1.1 样品采集
2018年在中国大熊猫保护研究中心采集20个尿液样品(表1),采集方式是在圈养大熊猫个体排泄10 min内,使用无菌注射器立即采集新鲜干净的尿液5~10 mL于无菌离心管中,取样过程中尽量避免污染,尿液不进行任何化学处理,立即用封口膜密封,干冰储存,24 h内送回实验室,尿液缓慢解冻和离心去除尿液中干扰性物质[10]。划分1~5龄为亚成年组,5~20龄为成年组,>20龄为老年组。

表1 尿液样品基本信息
1.2 液相色谱-质谱(liquid chromatograph mass spectrometry, LC-MS)测定
LC-MS分析的仪器平台为Waters公司的超高效液相色谱串联飞行时间质谱UPLC- Q-TOF/MS。色谱条件:色谱柱为BEH C18柱(100 mm×2.1;Z1*2;Y1*2 mm i.d., 1.7 μm;Waters, Milford, USA);流动相A为水(含0.1%甲酸),流动相B为乙腈(含0.1%甲酸);梯度洗脱程序为0~1 min,1% B;1~5.5 min,1%~20% B;5.5~6 min,20%~30% B;6~8.5 min,30%~35% B;8.5~10.5 min,35%~70% B;10.5~11 min,70%~100% B;11.0~13.0 min,100% B;13.0~13.1 min,100%~1% B;13.1~15.0 min,1% B。流速为0.40 mL/min,进样量为3 μL,柱温为45 ℃。质谱条件:样品质谱信号采集分别采用正负离子扫描模式,电喷雾毛细管电压,进样电压和碰撞电压分别为1.0 kV、40 V 和6 eV。离子源温度和去溶剂温度分别为120 ℃和500 ℃,载气流量:900 L/h,质谱扫描范围:50~1 000 m/z,扫描时间和间隔时间分别为0.1 s和0.02 s。质控样本(QC)由不同组样本提取物混合制备而成,用与分析样本相同的方法处理和检测,在仪器分析的过程中,每8个分析样本中插入一个QC样本,以考察整个分析过程的重复性。
1.3 数据分析和处理
原始数据用代谢组学处理软件 progenesis QI (Waters Corporation,Milford, USA) 进行搜库鉴定。将以上数据文件导入SIMCA软件(版本14.1)进行偏最小二乘方-判别分析(PLS-DA)和正交过滤偏最小二乘方-判别分析(OPLS-DA)。在分析前对数据进行默认的平均中心化(Mean-centered)和UV(Unit variance)格式化处理,再自动计算最优主成分数和建立最优模型。结合OPLS-DA模型第一主成分的VIP值(Variable importance in the projection,变量投影重要性)大于1和单维统计分析的P值小于0.05相结合的方法筛选差异性代谢物。
2 结果与分析
2.1 多维统计分析
为区分各组差异,采用监督性的多维统计方法PLS-DA进行模型分析,其中不同性别模式下模型的评价指标为R2X[1]=0.246,R2X[2]=0.108[图1(a)];不同年龄模式下模型的评价指标为亚成年组与成年组R2X[1]=0.195,R2X[2]=0.184[图1(b)];亚成年组与老年组R2X[1]=0.245,R2X[2]=0.218[图1(c)];成年组与老年组R2X[1]=0.17,R2X[2]=0.101[图1(d)]。结果显示,所建立的模型有效,可用于后续组间差异成分的寻找与分析,并且不同组间有明显的分开。同时构建OPLS-DA数据模型,结果显示[图2(a)]不同性别的样本能够有效区分,不同年龄阶段的样本也能有效区分[图2(b)~(d)]。
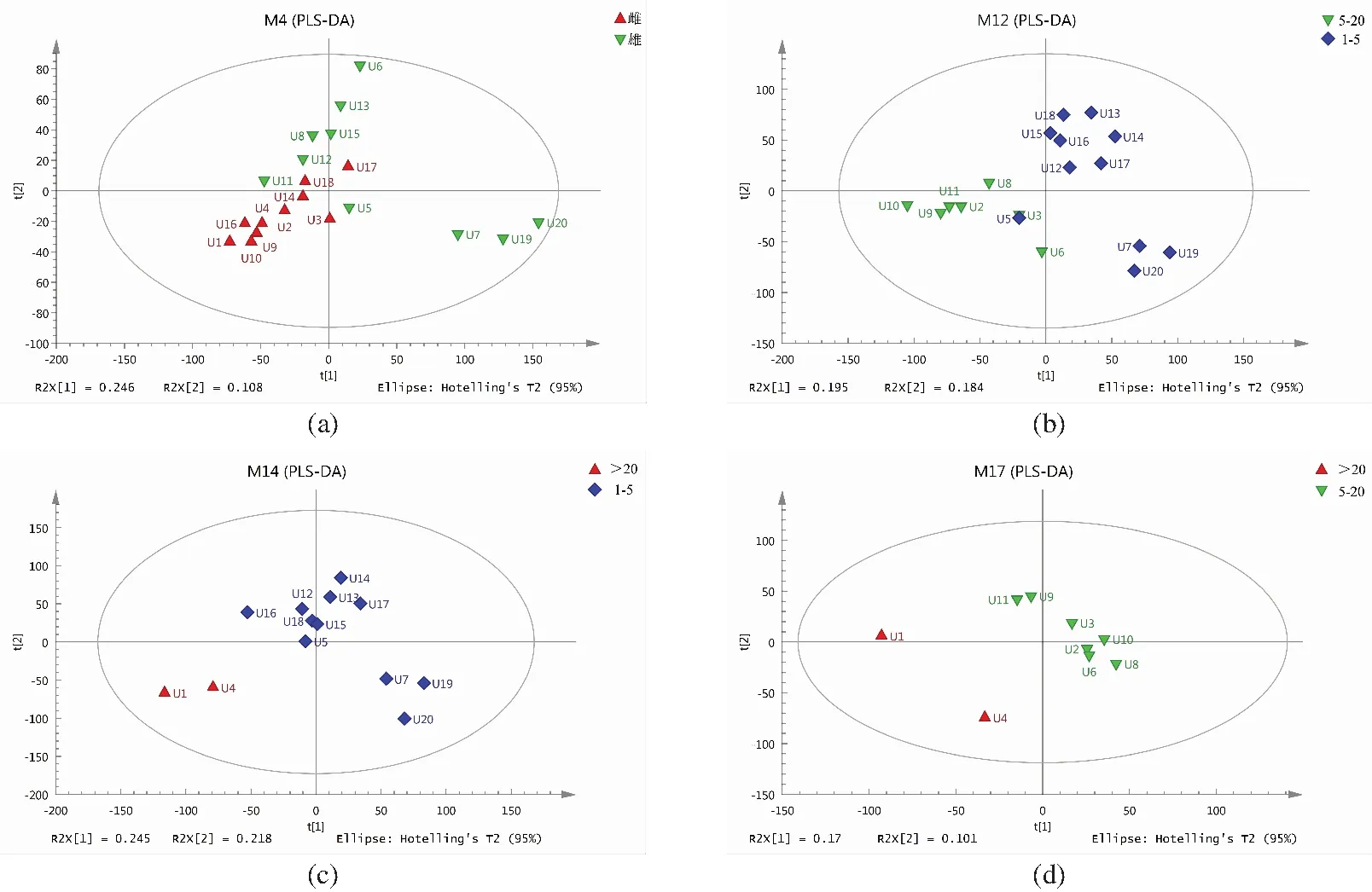
(a)▲代表雌性个体,▼代表雄性个体;(b)◆代表亚成年组(1~5龄),▼代表成年组(5~20龄);(c)◆ 代表亚成年组(1~5龄),▲代表老年组(>20龄);(d)▼代表成年组(5~20龄),▲代表老年组(>20龄)。
2.2 筛选差异代谢物
在雌雄性别组间共筛选出12种具有显著差异的代谢物,芹菜素在雌性尿液中相对含量显著高于雄性(图3),其余11种代谢物在雌性尿液中显著低于雄性尿液。在亚成年组与成年组间筛选出25种具有显著差异的代谢物,仅核黄素和精氨酸在亚成年个体尿液中相对含量显著高于成年个体(图4);亚成年与老年组间、成年组与老年组间,分别共鉴定得10种、3种显著差异代谢物,其相对含量均在老年个体尿液中更高(图5和图6)。其中图3、图5和图6以各代谢物相对含量为纵坐标,而图4由于各代谢物相对含量差异较大,为使在同一张图中表示,将各代谢物相对含量×log 10作为纵坐标进行作图。所有的显著性差异均由差异代谢物的标准差得出。

(a)▲代表雌性个体,▼代表雄性个体;(b)◆代表亚成年组(1~5龄),▼代表成年组(5~20龄); (c)◆代表亚成年组(1~5龄),▲代表老年组(>20龄);(d)▼代表成年组(5~20龄),▲代表老年组(>20龄)。图2 不同组间比较的OPLS-DA得分图Figure 2 OPLS-DA score chart for comparison between different groups
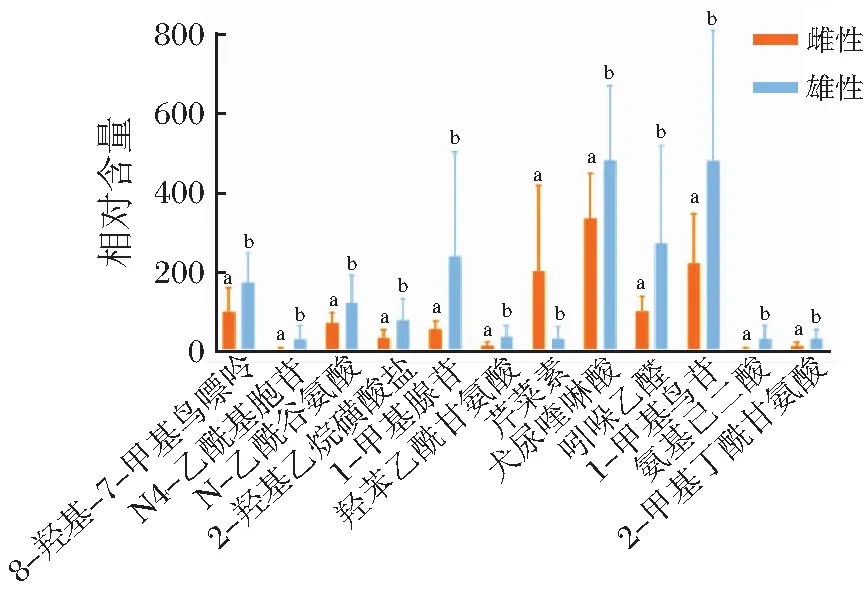
a,b代表显著差异 (P<0.05)。图3 差异代谢物在雌雄性别组间的相对含量Figure 3 The relative expression of metabolites between male and female groups
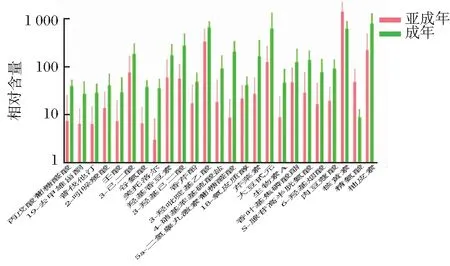
25种差异代谢物均在亚成年与成年组间含量呈显著性差异(P<0.05),未用不同字母表示。图4 差异代谢物在亚成年与成年组间的相对含量Figure 4 The relative expression of metabolites between sub-adult and adult groups
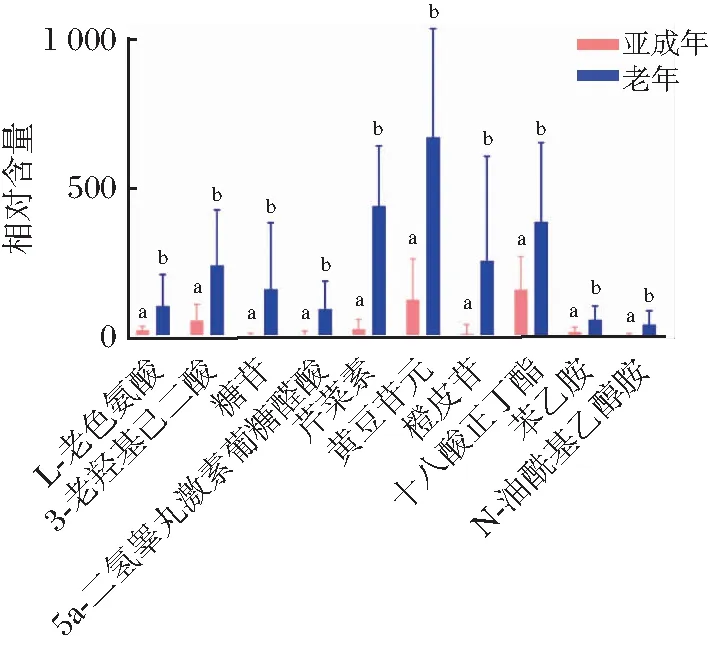
a,b代表显著差异 (P<0.05)。图5 差异代谢物在亚成年与老年组间的相对表达量Figure 5 The relative expression of metabolites between sub-adult and geratic group
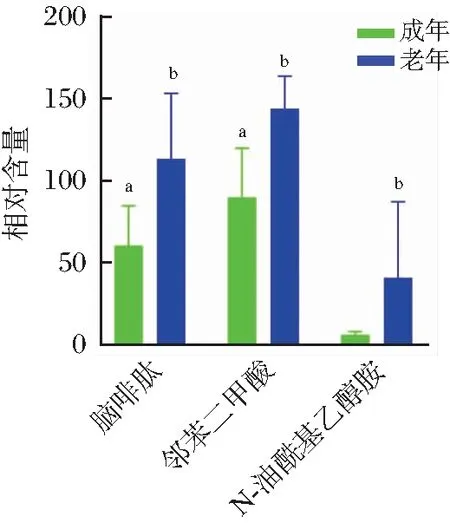
a,b代表显著差异 (P<0.05)。图6 差异代谢物在成年与老年组间的相对表达量Figure 6 The relative expression of metabolites differences between adult and geratic groups
在KEGG数据库中查找相应代谢通路,各组间具有显著差异的代谢物所对应的代谢通路主要集中在氨基酸代谢通路、次生代谢物的生物合成通路及黄酮、黄酮醇和类黄酮的生物合成通路(表2)。

表2 不同组间差异代谢物在KEGG数据库相应代谢通路
3 讨论
大熊猫视力和听力较弱,主要利用化学通讯系统进行定位、配偶、觅食等社会活动[11-12]。尿液作为化学通讯系统中较重要的信号物质,其化学组成及物质含量可能反映动物生理状况[13-14]。胡锦矗等[15]研究发现大熊猫主要利用来自其尿液和肛周腺分泌物的气味进行个体间的相互交流,同时这些气味还能够编码有关个体身份、性别、年龄以及性活跃能力等信息。雄性大熊猫的尿液包含与亲缘关系有关的信息,雌性大熊猫发情期尿中雌激素含量变化和发情行为相关联[16-18]。本实验采用UPLC-Q-TOF/MS技术对大熊猫尿液代谢成分进行检测,发现芹菜素是唯一在雌性尿液中相对含量显著高于雄性的物质,这可能是由于芹菜素作为一种常见的黄酮类化合物,主要通过下丘脑-垂体-性腺轴影响内分泌系统调节,具有雌激素样作用[19]。田原等[20]研究发现芹菜素通过影响雌激素受体而使下丘脑的促性腺激素释放激素(GnRH)和腺垂体的卵泡刺激素(FSH)、黄体生成素(LH)分泌增加,从而促进雌性生殖过程。在不同性别尿液组成差异比较分析中,相对含量最高的物质为1-甲基鸟苷和犬尿喹啉酸。1-甲基鸟苷是尿液中含量较高的修饰核苷之一[21],尿中1-甲基鸟苷的测定对癌症的早期诊断和治疗有极大临床价值[22];犬尿喹啉酸作由L型犬尿氨酸代谢生成经尿液排出,犬尿喹啉酸参与中枢性血压调节,犬尿喹啉酸代谢可能与高血压的发生发展有关[23-24]。随着大熊猫圈养水平的提高,大熊猫寿命延长的同时,老年病亦增加[25],通过检测大熊猫这类标志性尿液代谢物的变化,可能作为疾病的早期无损伤诊断新方法,同时通过识别与疾病相关的特殊代谢产物和代谢途径,也可为探索机制提供新思路。
随着大熊猫年龄的增长,其肛周腺分泌物和尿液中的脂肪酸含量逐渐增加[26]。核黄素和精氨酸在亚成年尿液中的相对含量高于成年,因核黄素不易在体内蓄积,通常以外界食物来补充,体内排出核黄素的量可能受机体需要和蛋白质流失程度的影响[27]。大熊猫从亚成年向成年发育阶段,尿液代谢物主要对应在氨基酸代谢通路上,氨基酸在动物体内发挥着调节生理生化功能、促进生长等作用[28]。精氨酸能促进动物生长,强化机体抗氧化功能并提高胚胎存活率[29-31]。郑萍等[32]研究发现精氨酸能够促进动物胰岛素、IGF-I、IGF-I R和IGFBP3的分泌进而上调生长相关因子的基因表达从而促进动物的生长。万孟春等[33]研究发现精氨酸是维持新生哺乳动物最佳生长的必需氨基酸。在老年个体尿液中黄豆苷元和橙皮苷的相对含量均显著高于成年个体,黄豆苷元存在于天然葛根和大豆等植物之中,与人体分泌的雌激素在结构上比较相似,具有治疗高血压和高血脂的药理作用[34]。橙皮苷也广泛存在于豆科植物中,具有抗炎、抗氧化和保护心血管等作用[35]。研究表明在饲料中添加黄豆苷元或橙皮苷后对养殖动物具有促生长作用[36-38]。另外,脑啡肽和邻苯二甲酸在老年个体尿液中的相对含量均显著高于成年个体。脑啡肽无论是在啮齿动物还是人类中都已被证明是有效的生长激素释放剂[39-42]。
在不同性别和年龄组间大熊猫尿液代谢物存在差异,恰当运用标志性代谢产物对预防疾病、增进健康等起积极作用。探索这些代谢物质的作用和代谢通路有助进一步研究大熊猫尿液代谢生化的变化原因。接下来需进一步对这些代谢产物及其代谢通路进行深入研究,建立不同年龄、不同性别大熊猫尿液代谢物检测的参考值范围,掌握大熊猫尿液代谢物的差异原因和影响因素,对今后大熊猫尿液检测的标准化有重要意义。
