线粒体与神经退行性疾病
2022-04-19施蕴渝
施蕴渝, 张 亮
(1. 教育部无膜细胞器重点实验室, 合肥230001;2. 中国科学技术大学生物医学部生命科学学院, 合肥230001)
中国正步入老龄化社会。国际上通常看法是,当一个国家或地区60岁以上老年人口占人口总数的10%,或65岁以上老年人口占总人口的7%,即意味着这个国家或地区的人口处于老龄化社会[1]。第七次人口普查数据显示,截至2020年11月,60岁以上中国老年人占总人口比例为18.70%[2],预计该数字至2050年将为30%[3]。各种老年性疾病,包括神经退行性疾病、糖尿病、心血管疾病、癌症等,将严重影响人民健康,极大增加社会负担。健康中国,是2016年8月习近平总书记在全国卫生与健康大会上发表的重要讲话内容[4]。2017年10月18日,习近平同志在中共十九大报告中提出实施健康中国战略[5]。研究老年性疾病机理和干预方法是国家的重大需求。
神经退行性疾病,包括阿尔茨海默病、帕金森病、肌萎缩侧索硬化症、多系统萎缩、亨廷顿舞蹈症、老年性黄斑变性等[6]。神经退行性疾病的特点是突触丧失和神经元死亡,导致认知功能下降、痴呆和运动功能丧失[7]。
线粒体是一种重要的细胞器,存在于几乎所有真核细胞中,具有重要的生物学功能,在真核生物的能量产生和代谢中起重要作用。它整合了细胞中各种代谢途径,通过呼吸链氧化磷酸化产生ATP为机体提供能量[8]。除此之外线粒体还有其他一些重要功能,与细胞凋亡、坏死、焦亡密切相关[9-11]。线粒体与反应氧自由基(reactive oxygen species,ROS)产生,与脂代谢、铁代谢、氨基酸、血红素合成、钙离子稳态、天然免疫等有密切关系。线粒体参与了许多信号转导通路(图1)[12]。
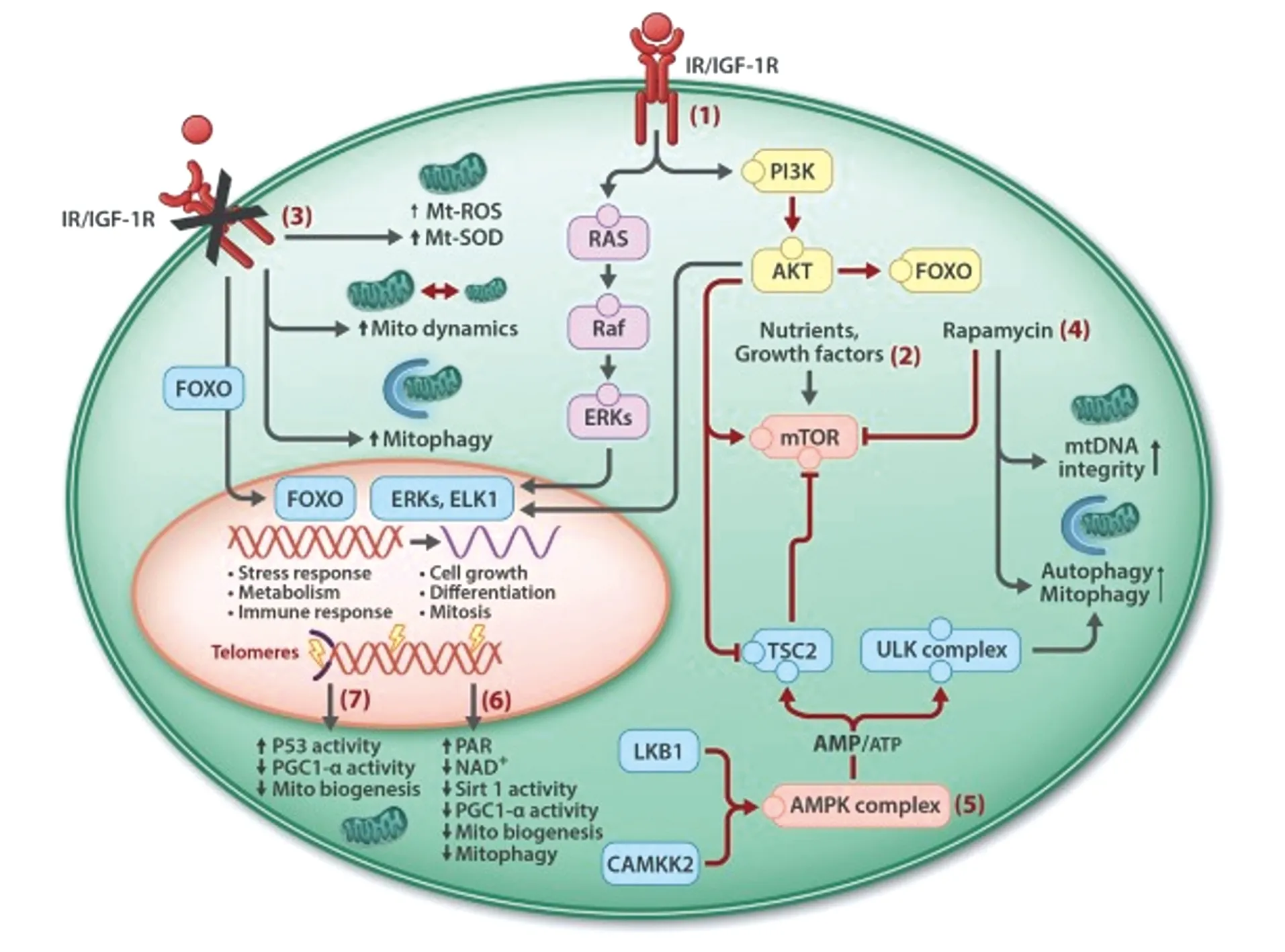
图1 影响衰老的线粒体调节机制的信号转导级联[12]Figure 1 Linking signal transduction cascades that influenceageing with mitochondrial regulatory mechanisms [12]
衰老引起的线粒体功能障碍是许多神经退行性疾病的重要原因。为了对神经退行性疾病有更深入地了解,以达到诊治的目的,需要对线粒体的生理、病理功能有更深入的了解。
1 线粒体基因组及线粒体基因转录,翻译的遗传与表观遗传调控
作为真核生物中特有的细胞器,线粒体在进化上保留了独特的大约16.5 kb的双链环形线粒体DNA(mtDNA),线粒体DNA编码了22个线粒体tRNA,2个线粒体rRNA,以及线粒体内膜上氧化磷酸化系统(OXPHOS)5个复合物中的13个蛋白质组分对应的mRNA[13]。线粒体有其独特的RNA聚合酶体系,对线粒体环状DNA基因组进行转录[14]。
线粒体转录出来的前体RNA需要被加工以获得22个tRNA、2个rRNA和13个mRNA;这些RNA还要被进一步修饰[15]。线粒体有其自身独特的线粒体核糖体。人线粒体核糖体由28S小亚基(mt-SSU,含12S rRNA) 与39S大亚基(mt-LSU, 含16S rRNA) 装配构成线粒体中的55S核糖体,核糖体大小亚基需要组装[16]。这些都发生在线粒体RNA颗粒中(mitochondrial RNA granules,MRGs) 。线粒体中的蛋白质有两大类:一类是核编码的,基因承载在细胞核染色体上,经转录、出核、在细胞质核糖体上翻译成蛋白质后进入线粒体;另一类包括13个蛋白质,是线粒体基因组编码的,它们是线粒体内膜氧化磷酸化体系5个大复合物中的重要组分(图2)[15, 17]。这两类基因若发生突变,都会引起疾病。其中线粒体RNA颗粒是线粒体中的无膜亚细胞器。它是线粒体基因处理、加工,修饰,以及线粒体核糖体组装的重要场所(图3)。在成纤维细胞中,线粒体RNA颗粒中重要的RNA结合蛋白GRSF1敲低会造成细胞衰老,炎症因子白介素6(IL6) 升高,从而引起慢性炎症[18]。
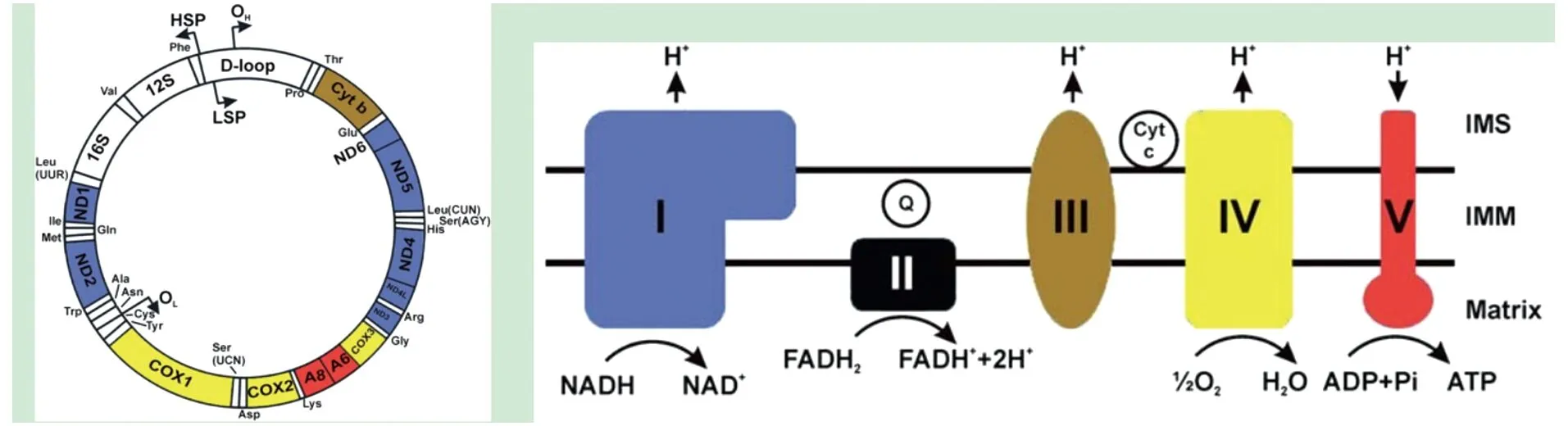
图2 人线粒体环形DNA及线粒体内膜上的氧化磷酸化系统[15]Figure 2 Human mtDNA represented by a circle and OXPHOS[15]
随着对表观遗传学的深入研究,RNA转录后修饰逐渐在细胞中被发现。已经在tRNA,rRNA和mRNA以及在其他类型的非编码RNA上鉴定了超过100种不同的RNA修饰(图4)。在线粒体中,对线粒体rRNA及tRNA的修饰对于基因转录、翻译起了关键作用,影响线粒体核糖体大小亚基的生成与组装,进而影响线粒体基因表达[19]。


图3 线粒体中的RNA颗粒[18]Figure 3 Mitochondrial RNA granules (MRGs)[18]

图4 修饰人线粒体tRNA的酶及其修饰位点(a); 在人线粒体核糖体(PDB3J9M)上rRNA 修饰的分布[19] (b)Figure 4 Multiple mt-tRNA modification enzymes are associated with modification sites and human diseases (a); distribution of rRNA modifications on the human mitochondrial ribosome (PDB code: 3J9M)[19] (b)
MRM1、MRM2(FtsJ2)、MRM3(RNMTL)是3个对人的线粒体39S核糖体大亚基中16SrRNA上3个不同位置的核苷酸MRM1 (Gm1145)、MRM2(FtsJ2, Um1369)、MRM3(RNMTL, Gm1370)的2位核糖(2′-O-ribose)进行甲基化修饰的甲基转移酶。其中MRM2及MRM3修饰的位点在16S rRNA的A-loop上,敲低MRM2及MRM3,影响线粒体rRNA A-loop上的甲基化修饰,由于A-loop是肽酰转移酶中心的主要组成部分,是氨酰tRNA结合的A位点,敲低MRM2及MRM3会影响线粒体氧化磷酸化复合物主要组成蛋白质的翻译,引起线粒体功能障碍[27-29]。
线粒体基因组上基因的表达,除了与rRNA甲基化修饰有关外,还与一些被称为核糖体装配因子相关。它们与线粒体rRNA结合,调控核糖体组装,从而调控基因表达。其中包括起RNA分子伴侣作用的小GTP酶ERAL1,它与12S rRNA的3′末端的茎环末端结合,敲除它影响线粒体核糖体小亚基的生成,影响线粒体呼吸链复合物上蛋白质的表达[30-31]。还包括具有ATP酶活性的RNA解旋酶,如DDX28,它与线粒体核糖体大亚基中16S rRNA相互作用[32-33],DHX30也参与人线粒体小亚基的装配,它们也与线粒体呼吸链复合物上蛋白质的表达密切相关[34-36]。
2 线粒体动力学,融合,分裂,线粒体自噬
线粒体在代谢中起了关键作用,它通过氧化磷酸化产生ATP,调节细胞程序性死亡,钙离子稳态,控制反应氧的产生。因此在各种组织中保持线粒体的稳态是健康所必需的。线粒体的稳态与线粒体的形态密切相关。线粒体形态可以为球形、短管、长管、网状。而这都由线粒体的质量控制系统调控,平衡线粒体融合 (fusion)、分裂(fission)、线粒体自噬 (mitophagy)[37-39]。
线粒体融合是指两个临近的线粒体可以融合为一个长的线粒体,这是一个两步过程,需要3个Dynamin超家族的GTP酶 (GTPase) 参与(图5)。首先由mitofusin 1和mitofusin 2(MFN1和MFN2)介导外膜融合,然后由Optic Atrophy 1 (Opa1) 介导内膜融合。Opa1有两种形式,一种是长型 (L-Opa1) 和一种较短的加工型 (S-Opa1)[37, 40]。

图5 MFN1和MFN2介导的线粒体外膜融合及Opa1介导的线粒体内膜融合[37]Figure 5 MFN1 and MFN2 mediate mitochondriaouter membrane(OM) fusion; Opa1 mediates mitochondria inner membrane(IM) fusion[37]
线粒体分裂是指一个线粒体分裂为两个较小的线粒体。线粒体分裂的中介物是Dynamin相关蛋白质 1 (Drp1) ,它也是GTP酶。Drp1被应激信号激活,并易位到线粒体表面,结合受体蛋白 (Mff,Fis1,Mid49/Mid51) 。Drp1的寡聚化使其在线粒体表面形成环,线粒体小管收缩并最终导致线粒体分裂,线粒体分裂又是线粒体自噬的前提[41]。
另一个与线粒体分裂有关的蛋白就是MFF(线粒体分裂因子,mitochondrial fission factor) 。MFF是一种线粒体分裂所需的线粒体外膜 (OMM) 蛋白质,通过招募上文提到的Drp1和SLC6A6(一种质膜牛磺酸丙氨酸转运体)发挥调节线粒体分裂,进而调节线粒体自噬过程。而前人的研究通过对比年老和年轻人的肌肉组织、老鼠的肌肉组织和老鼠的脑皮层组织样品,发现在衰老的组织样品中,mff基因的调控蛋白PUM2的表达量均有所提高。并通过一系列细胞实验证实在衰老的过程中,PUM2蛋白的高表达会造成MFF的表达量降低,从而使线粒体的分裂能力降低,最终导致线粒体自噬过程受到影响,使衰老细胞无法清除受损的线粒体,线粒体稳态无法维持(图6)[42-43]。

图6 在衰老组织细胞中PUM2和MFF介导的线粒体自噬改变[42]Figure 6 The alternation of mitophagy induced by expression changesof PUM2 and MFF in the aged tissue and cells[42]
线粒体自噬 (mitophagy) 是指衰老,受损伤的线粒体会被线粒体自噬机器吞噬,然后被溶酶体清除。线粒体自噬是细胞清除受损线粒体的重要机制。
2.1 PINK1/Parkin依赖性的线粒体自噬路径(mitophagy pathway)
这是Parkin(E3 ubiquitin-protein ligase parkin)与线粒体外膜蛋白PINK1(PTEN-induced putative kinase 1)介导的线粒体自噬机制,是一种研究得比较清楚的线粒体自噬机制(图7)。
在正常线粒体中,蛋白激酶PINK1通过线粒体外膜TOM/TIM复合体进入线粒体,会被转移至线粒体内膜,被线粒体内膜蛋白酶PARL( presenilin-associated rhomboid-like protein)切割,随后被蛋白酶体清除。因此,正常情况下PINK1含量极低,很难被检测到。Parkin是E3泛素连接酶,线粒体稳态条件下,parkin处于被抑制的状态。然而,在应激情况下,线粒体受损,线粒体膜电位降低,PINK1进入线粒体内膜的路径被阻断,PINK1聚集于线粒体外膜,PINK1在228位和402位丝氨酸可以发生自磷酸化,从而使PINK1超激活[44]。而超激活态的PINK1可以使得泛素65位丝氨酸被磷酸化。另一方面,parkin的N端包含一个类泛素结构域 (UBL domain) 也会被超激活态的PINK1磷酸化,从而使得parkin 的空间构象发生改变,起催化作用的半胱氨酸暴露,parkin转化为激活状态的 E3泛素连接酶。Parkin被募集至受损线粒体,泛素化线粒体外膜蛋白,这些泛素化的线粒体外膜蛋白可被自噬小体识别,进而被溶酶体降解,引发线粒体自噬[39,45-46]。
2.2 PINK1/Parkin 非依赖性的线粒体自噬路径
人们发现除了PINK1/Parkin依赖性的线粒体自噬路径外,还存在PINK1/Parkin 非依赖性的线粒体自噬路径(图8)。目前知道4种PINK1/Parkin 非依赖性的线粒体自噬路径。
(1)受体介导的线粒体自噬:BNIP3、NIX/BNIP3L、FUNDC1、FKBP8、Bcl2L12和AMBRA1。其中Bcl2L12是线粒体外膜上的受体,包含Lir结构域,可以与自噬小体中的LC3结合,使得自噬小体招募受损的线粒体,将其降解。AMBRA1定位到线粒体,也可以与LC3结合选择性地消除受损的线粒体[47-50]。(2)脂质介导的线粒体自噬:线粒体内膜上的心磷脂可以通过PLS3的作用转运到线粒体外膜,一旦在线粒体外膜心磷脂结合LC3A招募自噬小体,消除受损的线粒体[51-52]。(3)E3泛素连接酶介导的线粒体自噬:MUL1、ARIH1和SIAH1是3种E3泛素连接酶。它们可定位于受损的线粒体,泛素化线粒体外膜蛋白质,进而招募自噬小体,消除受损的线粒体[50,53-54]。(4)泛素结合蛋白质DRP1,以及Vps13D通过其泛素结合结构域UBA结合到泛素K63链上,诱导受损的线粒体自噬[55]。
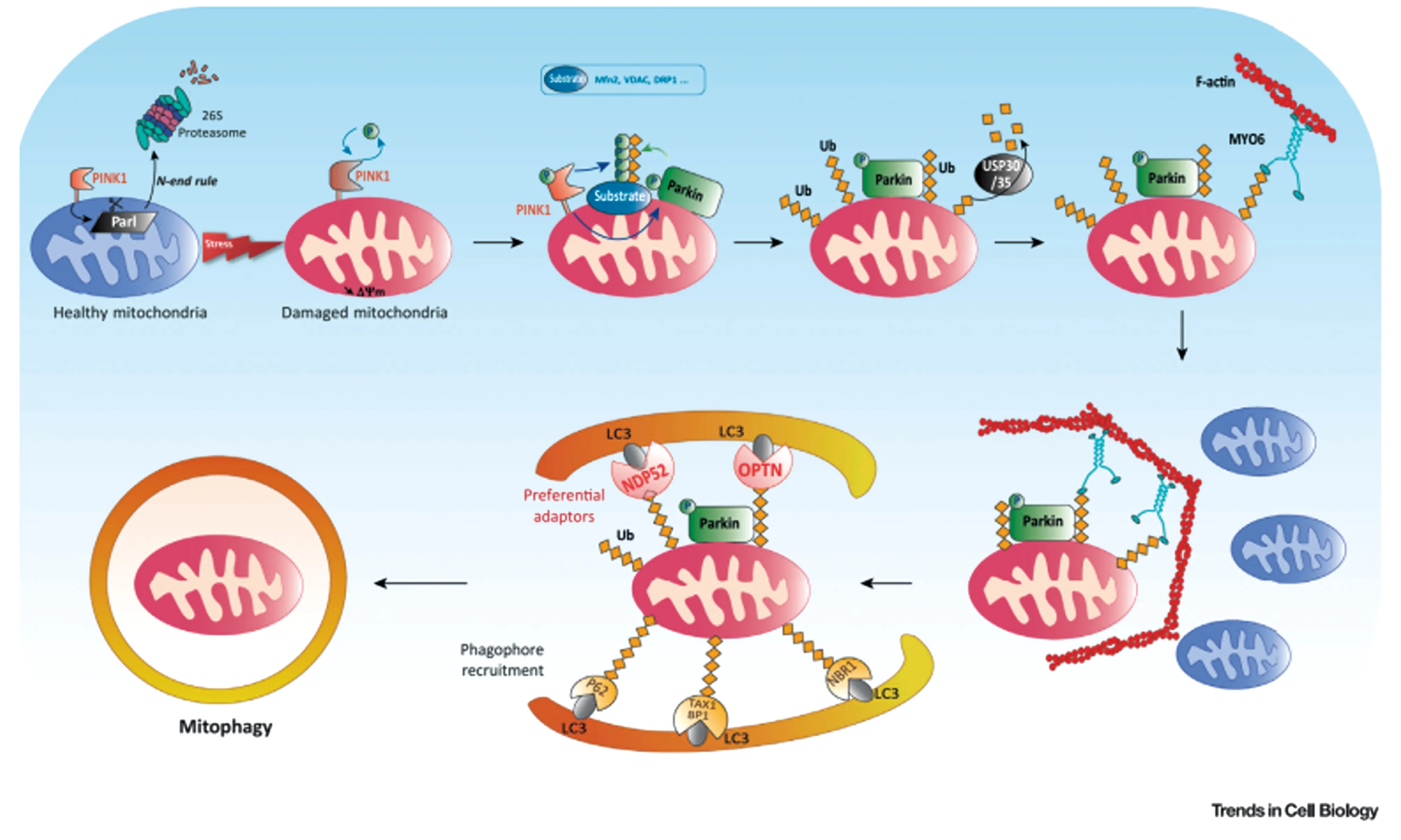
图7 PINK1/Parkin 依赖的线粒体自噬路径[39]Figure 7 The Parkin/PINK1 dependent mitophagypathway[39]

图8 PINK1/Parkin 非依赖性的线粒体自噬路径[39]Figure 8 Parkin-independent mitophagy pathways can be induced through four main mechanisms[39]
线粒体通过融合、分裂、线粒体自噬,在生理和病理条件下频繁改变其形状,改变线粒体间的网络连接,将损伤的线粒体通过自噬小体清除。线粒体动力学对保持其功能至关重要。线粒体自噬受损将会使得功能障碍的线粒体增多,ATP减少,反应氧ROS增多,导致Aβ斑块和神经元纤维缠结的形成。导致神经系统突触功能障碍,认知功能缺陷。
3 线粒体在神经突触上的输运
线粒体是细胞的动力学工厂,为大脑和神经系统的生长、功能、再生提供ATP。神经细胞有很长的轴突,复杂的树突,在神经细胞生长发育过程中突触、生长锥、郎飞氏结都需要大量能量。因此需要将线粒体输运及锚定到这些区域,以保证给这些代谢活跃区域提供ATP。人脑质量只占人体质量的2%,但人脑消耗的ATP量占总产生ATP量的20%。在大脑皮层77%的ATP用于灰质,在其中96%被神经元消耗掉。ATP的主要来源是线粒体通过电子传递链和氧化磷酸化将葡萄糖和丙酮酸转化为ATP。线粒体还在维持Ca2+稳态中起作用。在神经细胞中线粒体主要在胞体中产生,通过微管在轴突和树突中输运。这实际上是一个十分困难的任务。神经元使用特殊的机制根据代谢状况、生长状态及突触活性将健康的线粒体输送到特定位置。而将老化的或受损的线粒体清除掉[56]。
轴突中线粒体依赖Kinesin 及 Dynein 这两种马达蛋白沿着微管分别向两个不同方向输运线粒体,微管是有极性的,微管作为轨道用于线粒体长距离输运(图9)。将线粒体从神经元胞体向神经轴突远端顺向输运主要由马达蛋白kinesin-1 family (KIF5A, B,C)家族驱动,马达蛋白结合的ATP水解为线粒体输运提供能量。分子马达蛋白Kinesin是一个四聚体复合物,由两条重链 (KHC) 和两条轻链(KLC)组成。KHC的N端有一个motor结构域,可以结合微管,水解ATP[57-58]。C端可以与KLC相互作用,也可以通过适配体蛋白与线粒体相互作用。适配体蛋白主要是Miro(Miro-1, Miro-2)及Milton,它们将线粒体装载到马达蛋白上。Miro是Rho-GTPase,它有一对可与Ca2+结合的EF-hand motif,2个GTPase结构域,1个羧端跨膜结构域,整合到线粒体外膜上。Milton有1个可与Miro结合的结构域,及1个与Kinesin结合的结构域,它将Miro,线粒体与马达蛋白KHC联系起来[59]。哺乳动物中有两个Milton直系同源物TRAK1、TRAK2。马达蛋白kinesin与适配体蛋白质Miro-TRAK1 组成复合物,这是线粒体在微管上顺向输运的蛋白质机器[60]。在轴突中线粒体依赖马达蛋白Dynein沿着微管朝反向输运。Dynein有两条重链 (DHC) ,它具有ATP酶的活性。还有 intermediate (DIC)、light-intermediate (DLIC)及轻链(DLC)。线粒体通过适配体蛋白质TRAK1、TRAK2与Dynein结合。Ca2+浓度增加会使得马达蛋白脱离微管,或者脱离线粒体[61-62]。Syntaphilin可将线粒体锚定在微管上,也可以使得马达蛋白脱离线粒体。线粒体短距离输运依赖肌动蛋白 (actin) 微丝[63-64]。深入研究在神经系统发育与成熟过程中,线粒体如何在轴突、树突上输运至特定的位置,并锚定在正确的位置,分布在神经突触、生长锥、郎飞氏结,为神经系统发育与成熟提供能量十分重要。当神经元受到生理或病理应激,如在衰老或受伤,线粒体输运将会发生改变,如何重新分布以保证能量供应的稳态,使得神经再生。这些都是重要的前沿科学问题。

图9 线粒体通过马达蛋白沿着微管在神经轴突上输运[55]Figure 9 Mitochondrial transport in neurons[55]
4 线粒体功能障碍-激活天然免疫系统-引起慢性炎症-导致神经退行性疾病
线粒体是行使能量代谢的重要细胞器,它对调节细胞凋亡、坏死,钙离子稳态、磷脂代谢,以及天然免疫等方面也起关键作用(图10)。

图10 cGAS-STING天然免疫路径[65]Figure 10 cGAS-STING innate immunity pathway[65]
天然免疫系统是生物体对病原体(病菌、病毒),以及环境中各种危险因素(紫外辐射、放射性射线、化学药物)的天然防卫系统[65]。它通过各种模式识别受体 (pattern recognitionreceptor,PRR)起作用。模式识别受体包括:Toll样受体(Toll—like receptors,TLR)、C型凝集素受体 (C-type lectin receptors,CLRs)、NOD样受体 (NOD-like receptors,NLRs)、AIM样受体 (AIM2-like receptors,ALRs)、RIG-I样受体 (RIG-I-like receptors,RLRs,包括RIG-I、MDA5、LGP2)、DNA sensors、STING[66]。
线粒体与固有免疫响应密切相关。病原体感染、衰老、环境毒物均可直接或间接引起线粒体功能障碍。线粒体功能障碍的表现包括氧化磷酸化过程受损,代谢异常、非折叠蛋白积累、线粒体膜电位改变、活性氧 (mROS) 产量增加等,这些过程会破坏线粒体膜的完整性,导致线粒体配基包括N-甲酰化多肽的释放,心磷脂暴露,线粒体DNA(mtDNA)的释放。它们作为模式识别受体的配体,分别被天然免疫系统中的不同模式识别受体,炎症小体或者cGAS/STING特异性识别,病原体的DNA或者受损的线粒体或细胞核的DNA都可以激活细胞质中的cGAS, cGAS生成2′-3′环状GMP-AMP(cGAMP),它与内质网蛋白质STING结合。细胞也可以通过位于质膜上的cGAMP的转运蛋白,或通过细胞间缝隙从邻近细胞中输入cGAMP。与cGAMP结合的STING将离开内质网膜,输运到高尔基氏体或后高尔基氏体间隔。在那里激活激酶TBK1。TBK1磷酸化转录因子IRF3。STING可激活NF-κB,它进入细胞核在那里起作用。STING与IRF3一起诱导I型干扰素及许多与免疫及炎症反应相关的基因表达(图11)。天然免疫系统被激活,诱导激活NF-κB,干扰素信号通路,产生细胞因子,趋化因子,触发一系列炎症反应,包括中性粒细胞活化与迁移,NF-κB,白介素IL-1β, IL-18等炎症因子加工与分泌,引起慢性炎症。在中枢神经系统中,固有免疫反应发生在小胶质细胞中,上述各种风险因子会使得小胶质细胞或星型细胞活化,进而引起神经元细胞死亡(凋亡/坏死/焦亡),这些可能是神经退行性疾病的病因[67-70]。

图11 线粒体功能障碍引起帕金森病的代表性病理生理路径[70]Figure 11 Representative pathways of mitochondrial dysfunction involved in Parkinson’s disease pathophysiology[70]
4.1 线粒体功能障碍与帕金森病的发病机制
可能与帕金森病相关的机制:线粒体损伤影响线粒体生成,活性氧增加,线粒体在微管上输运受影响,电子传递链功能障碍,钙离子浓度失衡,线粒体动力学改变,线粒体自噬受影响。多种复杂因素相互作用,最终导致帕金森病发生发展(图11)[71]。
lrrk2基因编码的蛋白质LRRK2具有犰狳重复序列 (ARM) 区域、锚蛋白重复序列 (ANK) 区域、富含亮氨酸重复序列 (LRR) 域、激酶域、RAS域、GTPase域和WD40域。LRRK2主要存在于细胞质中,但也与线粒体外膜及线粒体泛素连接酶parkin有关。LRRK2的COR结构域与parkin的C末端R2RING结构域相互作用。突变LRRK2的表达诱导神经母细胞瘤细胞和小鼠皮层神经元凋亡。G2019S和R1441C是广泛存在于帕金森病人中的LRRK2突变,而这两个突变都会导致突触后钙失衡,导致线粒体通过有丝分裂吞噬从树突过度清除,从而导致体内和体外培养的神经元中树突的缩短和复杂度的降低[72-74]。目前针对LRRK2研究的帕金森病相关药物也已经在临床阶段实验中[75-76]。
4.2 阿尔茨海默症病人大脑小胶质细胞线粒体异常(图12)
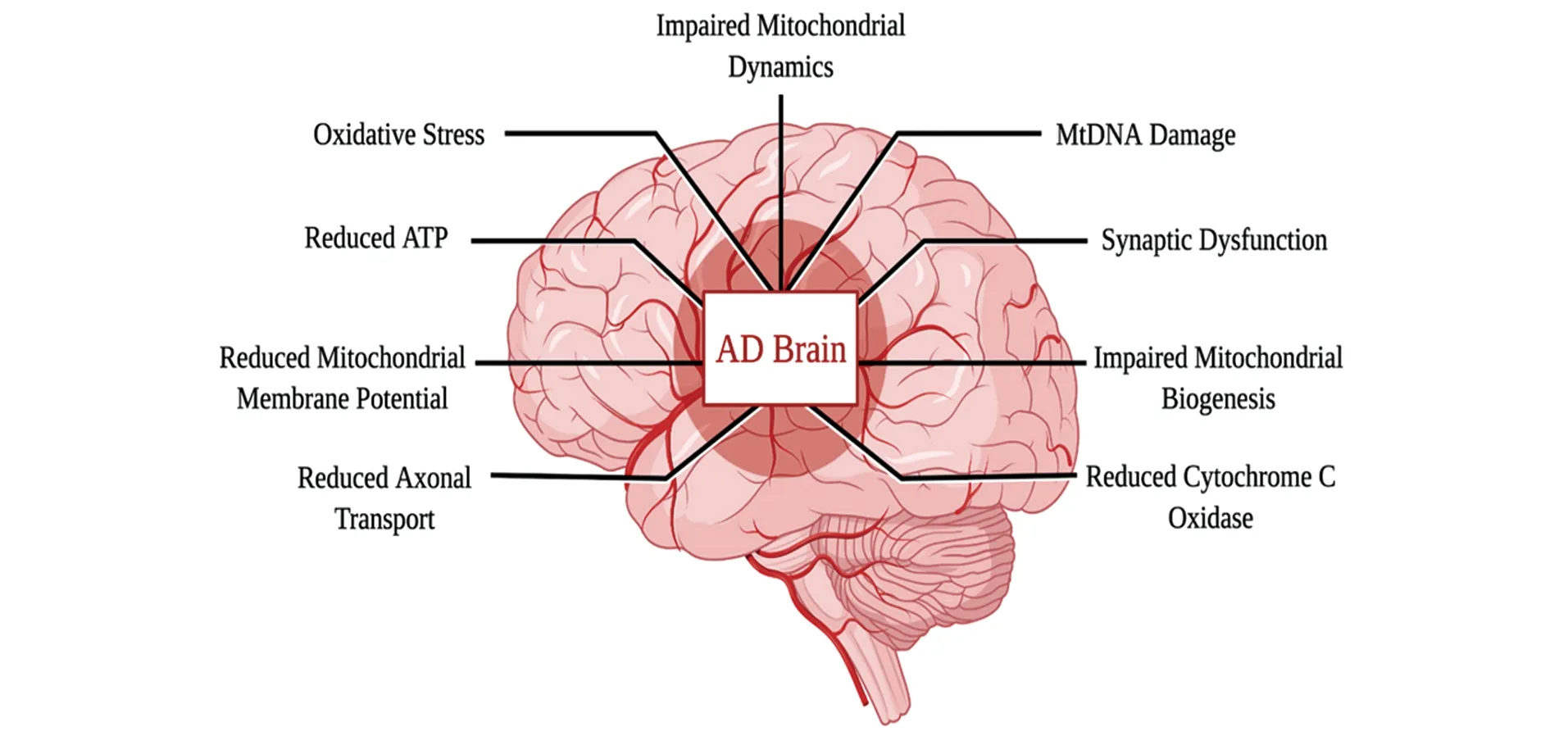
图12 阿尔茨海默氏症患者大脑中的线粒体异常[76]Figure 12 Mitochondrial abnormalities in an Alzheimer’s diseasebrain[76]
阿尔茨海默症病人大脑小胶质细胞线粒体功能障碍(图13)[77]。淀粉样蛋白-β (Aβ)与小胶质细胞上的不同受体相互作用[78]。受损的TREM2导致哺乳动物雷帕霉素靶蛋白(mTOR)通路受损。受损的mTOR通路增加自噬并减少线粒体的数量进一步减少ATP的产生。Aβ与P2X7相互作用激活NF-κB,导致NLRP3的激活和释放细胞色素c (cytc)来源于线粒体(机制不明)和细胞凋亡。Aβ通过不同的受体被吞噬,如TREM2, toll样受体(TLRs),晚期糖基化终末产物(RAGE)的受体和CD36,以及内化的Aβ与线粒体钙单胞体(MCU)相互作用线粒体导致细胞毒性。通过未知受体,Aβ减少线粒体自噬,并增加活性氧(ROS)的产生。所有这些机制通过炎症或其他机制促进阿尔茨海默病(AD)的发病[79-82]。

图13 阿尔茨海默氏症患者大脑中小胶质细胞线粒体功能障碍[77]Figure 13 Mitochondrial dysfunction of microglia in the brain ofAlzheimer’s disease patients[77]
其中的TREM2,尤其是2016年报道的在AD病人中广泛存在的TREM2的R47H突变[83],使得TREM2成为AD的高风险因子,也成为针对AD靶向药物研发的明星分子,但是TREM2的激活机制至今仍不是很明确,潜在的激活分子包括Aβ、载脂蛋白ApoE、Clu以及TDP-43。同时,针对TREM2胞外区的特异性抗体分子的筛选工作也取得了一定的进展,为将来针对阿尔茨海默病的预防及早期干预治疗提供理论基础[84-85]。
5 未来与展望
综上,在衰老的发生和发展过程中,线粒体的功能和内环境稳态的破坏是关键因素,也是临床诊断的一个重要指标及可能的治疗靶点。线粒体的功能障碍会导致神经系统的损害,并与多种神经退行性疾病直接相关。但调节线粒体状态以缓解衰老相关功能异常的潜在益处尚未被明确描述。所以,研究线粒体在神经退行性疾病的发生、发展、转变、恢复的过程中所起的重要作用仍然任重道远。与此同时,在近10年的研究过程中,用于神经保护和神经再生的线粒体疗法正在迅速从一个理论概念转变为一种可能的临床方法[86]。因此,利用线粒体为对象,针对神经退行性疾病的早期诊断、干预及后期的线粒体疗法将成为下个十年可预见的突破。
