脑小血管病患者外周血Hcy,VILIP-1和UA水平与病情严重程度及认知障碍的相关性研究
2022-04-19张春丽赵殿兰刘亚静张春和
李 璐,张 颖,张春丽,赵殿兰,刘亚静,王 辉,张春和
(1.沧州市人民医院医专院区a.医学检验中心;b 神内五区;c.急诊科,河北沧州 061000;2.沧州市人民医院本部院区神内三区,河北沧州 061000)
脑小血管病(cerebral small vessel disease,CSVD)发病率约占脑卒中30%,若未积极处理,极易引起认知障碍,导致病情恶化[1-2]。近年研究证实,血管内皮细胞功能中同型半胱氨酸(homocysteine,Hcy)水平变化与CSVD 患者认知障碍、病情程度有关[3-4]。尿酸(uric acid,UA)属于抗氧化剂和氧自由基清除剂,UA水平升高提示认知障碍[5]。视椎蛋白样蛋白1(visinin-like protein 1,VILIP-1)是神经细胞内高度表达蛋白质,新近研究发现,VILIP-1 可能参与缺血性脑卒中发病过程,其水平高低提示患者伴有不同程度认知障碍[6],但尚未见其与CSVD 患者认知障碍、病情程度研究报道,因此本研究检测CSVD 患者外周血Hcy,VILIP-1和UA水平,分析其与病情程度、认知功能关系,以期为CSVD 患者认知障碍、病情程度提供有效预测因子,指导临床治疗。结果如下。
1 材料与方法
1.1 研究对象 经我院伦理委员会审核通过,选取2017年6月~2019年6月沧州市人民医院医专院区70 例CSVD 患者作为观察组,纳入标准:①符合CSVD 诊断标准[7]:头颅MRI 显示多发腔隙型脑梗死或脑白质变性、脑微出血,颈动脉狭窄<50%,无皮层下、分水岭区域梗死及大血管病变病灶;②入组前1 个月未服用维生素制剂及促智药物;③患者家属知晓并签署同意书。排除标准:①血管性痴呆;②其他原因(颅内感染、帕金森病)所致认知障碍;③肝、肾等脏器器质性病变;④颅脑肿瘤;⑤颅内大血管狭窄;⑥入组前1 个月外科手术史及创伤史;⑦临床资料不完整。同期选取30例健康体检者作为对照组。观察组:男性37 例,女性33 例;年龄40~81(61.03±6.84)岁;其中19 例吸烟史,20 例饮酒史;对照组:男性15 例,女性15 例;年龄41~81(60.47±7.31)岁;其中8例吸烟史,7 例饮酒史。两组性别、年龄、吸烟史、饮酒史等临床资料比较,差异无统计学意义(P>0.05)。
1.2 仪器与试剂 Hcy,UA 试剂盒购自罗氏诊断产品(上海)有限公司,所用仪器为日本奥林巴斯1700 全自动生化分析仪;VILIP-l 试剂盒购自南京卡米洛生物工程有限公司,所用仪器为美国BIORAD680 酶标仪及美国DEM-3 型自动洗板机;JIDI-20D 台式多用途高速离心机(广州吉迪仪器有限公司);1.5 ml 离心管(北京苏博生物科技有限公司)。
1.3 方法
1.3.1 检测方法:入院后24~72h 抽取4ml 空腹肘静脉血,静置20min,离心15min(2 500r/min),取上清液,-20℃保存待测。酶比色法测定外周血Hcy,UA水平。酶联免疫吸附法(ELISA)测定外周血VILIP-l水平。
1.3.2 评估标准:①认知障碍:采用蒙特利认知评估量表(Montreal cognitive assessment,MoCA)[8]评估认知障碍,总分30分,<26分为认知障碍,≥26分为无认知障碍;②病情程度:参照美国国立卫生研究所脑卒中量表(the national institutes of health stroke scale,NIHSS)[9]分为轻度(NIHSS 评分<4分,n=36)、中度(NIHSS 评分4~15分,n=24)、重度(NIHSS 评分>15分,n=10)三组;根据脑动脉搏动指数(PI)[10]分为轻度(PI <1.0,n=24)、中度(PI 1.0~1.5,n=29)、重度(PI >1.5,n=17)三组。③高Hcy,VILIP-1,UA:根据认知障碍患者中外周血Hcy,VILIP-1,UA水平平均值进行界定,分别为28 例,20 例,26 例。
1.4 统计学分析 通过SPSS22.0 处理数据,计量资料以均数±标准差(±s)表示,行t检验,多组间比较用单因素方差分析,两两比较用LSD-t检验,Spearman,多元线性回归模型分析外周血各指标与病情程度、认知障碍相关性,P<0.05 为差异有统计学意义。
2 结果
2.1 两组外周血Hcy,VILIP-1,UA水平 独立样本t检验,观察组外周血Hcy(20.83±6.25μmol/L),VILIP-1(671.05±201.32pg/ml),UA(352.21±78.66μmol/L)水平均高于对照组(10.05±3.02μmol/L,475.12±142.54pg/ml,241.25±40.86μmol/L),差异有统计学意义(t=8.989,4.831,7.698,均P<0.05)。
2.2 观察组不同病情程度外周血Hcy,VILIP-1,UA水平 见表1。观察组PI及NIHSS 评分重度者外周血Hcy,VILIP-1,UA水平高于PI及NIHSS评分轻中度者,差异均有统计学意义(均P<0.05)。
表1 观察组不同病情程度外周血Hcy,VILIP-1,UA水平比较(±s)
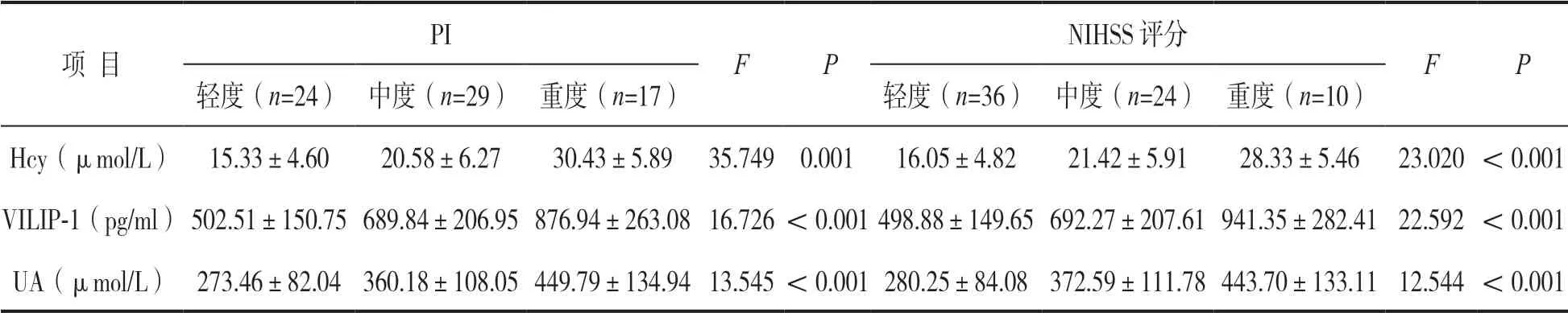
表1 观察组不同病情程度外周血Hcy,VILIP-1,UA水平比较(±s)
项 目PI F P NIHSS 评分FP轻度(n=24)中度(n=29)重度(n=17)轻度(n=36)中度(n=24)重度(n=10)Hcy(μmol/L)15.33±4.6020.58±6.2730.43±5.89 35.749 0.00116.05±4.8221.42±5.9128.33±5.46 23.020 <0.001 VILIP-1(pg/ml)502.51±150.75 689.84±206.95 876.94±263.08 16.726 <0.001 498.88±149.65 692.27±207.61 941.35±282.41 22.592 <0.001 UA(μmol/L)273.46±82.04 360.18±108.05 449.79±134.94 13.545 <0.001 280.25±84.08 372.59±111.78 443.70±133.11 12.544 <0.001
2.3 观察组有无认知障碍外周血Hcy,VILIP-1,UA水平 见表3。独立样本t检验,观察组认知障碍者Hcy,VILIP-1,UA水平均高于无认知障碍者,差异有统计学意义(均P<0.05)。
表2 观察组有无认知障碍外周血Hcy,VILIP-1,UA水平比较(±s)
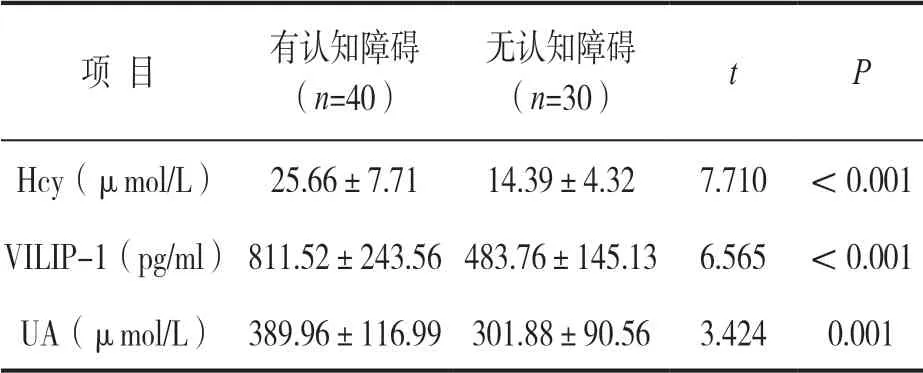
表2 观察组有无认知障碍外周血Hcy,VILIP-1,UA水平比较(±s)
项 目有认知障碍(n=40)无认知障碍(n=30)tP Hcy(μmol/L)25.66±7.7114.39±4.327.710 <0.001 VILIP-1(pg/ml)811.52±243.56 483.76±145.13 6.565 <0.001 UA(μmol/L)389.96±116.99 301.88±90.56 3.4240.001
2.4 外周血Hcy,VILIP-1,UA水平与病情程度、认知障碍相关性 见表3。外周血Hcy,VILIP-1,UA与PI及NILIP-1 呈正相关,与认知障碍呈负相关。
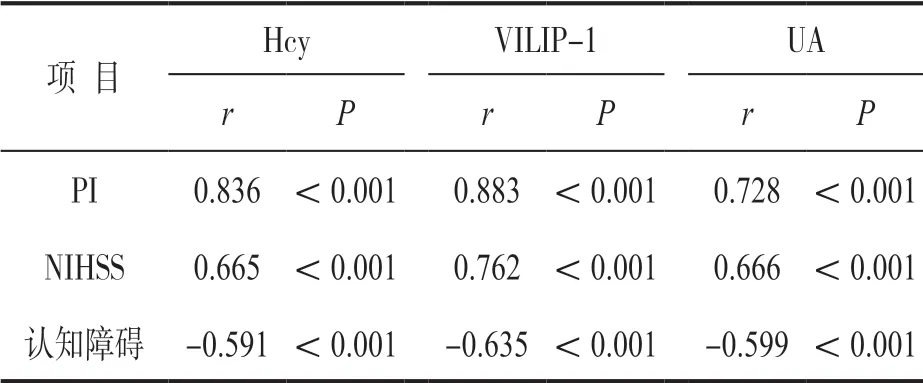
表3 外周血Hcy,VILIP-1,UA水平与PI,NIHSS及认知障碍的相关性
2.5 多元线性结果 见表4。在控制年龄、性别等其他因素后,外周血Hcy,VILIP-1,UA与PI,NIHSS 评分、认知障碍显著相关(均P<0.05)。
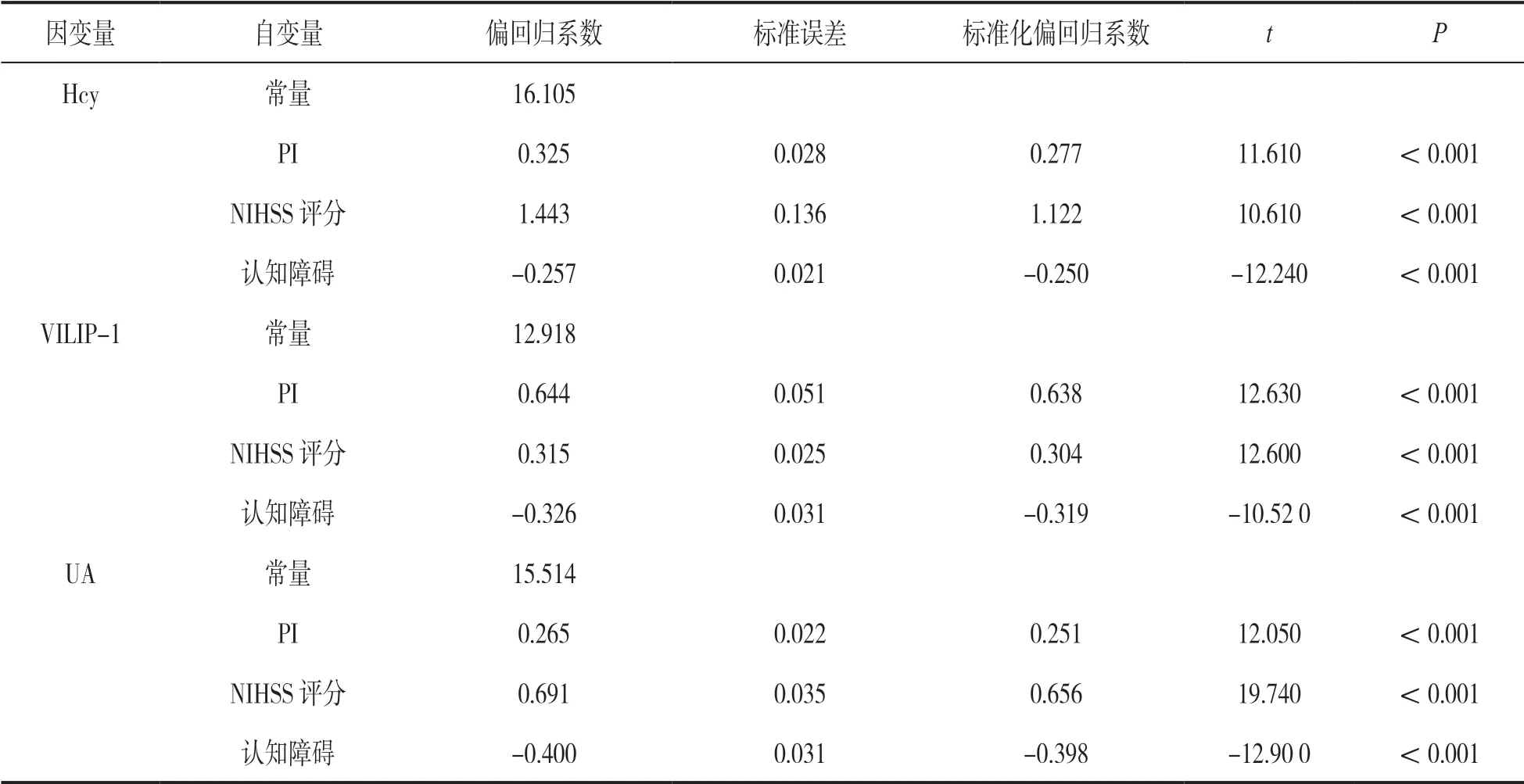
表4 多元线性结果
3 讨论
脑小血管病(CSVD)是颅内小血管病变所致缺血或出血性疾病,早期临床表现轻微,随疾病进展,出现认知障碍,甚至痴呆[11]。据统计,50%血管性认知障碍由CSVD 所致,但由于其症状隐匿,早期发现率及就诊率极低[12]。因此,临床需探索敏感度高、检测方便指标来评估CSVD 患者认知功能及病情程度。
CSVD 发病机制尚未阐明,临床普遍认为与遗传、代谢、感染、创伤等因素综合作用所致脑部小血管内皮功能病变有关,可损伤血脑屏障,引起淀粉样沉积[13]。UA 是脑组织最重要内源性抗氧化剂,可抑制过氧亚硝基,产生促氧化作用,减少一氧化氮(Nitric oxide,NO)生成量,导致血管内皮细胞功能紊乱,破坏血脑屏障,提示UA 可能参与CSVD 发病过程,与本研究结论相符。文献报道,在控制脑血管病其他危险因素外,高UA 可增加血管性痴呆发生风险[14]。在此基础上,本研究分析UA水平与认知障碍关系,发现观察组认知障碍者UA水平高于无认知障碍者,且UA水平与认知障碍呈正相关,与王学颖等[15]研究观点相似,究其原因,UA 升高可诱发脑血管内皮细胞炎症反应和氧化应激反应,损伤血管内皮,加剧血脑屏障破坏,致使UA 促氧化作用覆盖抗氧化作用,从而增加认知障碍发生风险。同时发现,观察组PI及NIHSS评分重度者外周血UA水平高于PI及NIHSS 评分轻中度者(均P<0.05),主要机制为高UA水平可影响内皮功能所致脑部小血管硬化,从而导致脑白质改变,而脑白质改变可影响前额叶-皮质下路结构功能,抑制神经元间、前额叶皮质和皮质下中枢信号传递,损害CSVD 患者认知功能及神经功能。由上述结果可知,高UA水平对评估CSVD 病情变化具有显著现实意义,可为CSVD 预防提供科学依据。
Hcy 是人体构成中必需氨基酸之一,当前研究证实,高Hcy 是心血管疾病形成的独立危险因素[16]。高Hcy 可通过氧自由基生成、氧化应激、内皮祖细胞功能障碍等途径加剧血管炎性反应,损伤内皮细胞,参与心脑血管疾病发生发展。多项研究结果表明,Hcy 损伤脑小动脉内皮功能损伤所需浓度远低于其在主动脉产生类似效应浓度,提示高Hcy 对CSVD的影响远远超过脑大血管病变[17-18]。胡康等[19]进一步研究发现,血清Hcy水平升高是CSVD 患者认知障碍危险因素。高Hcy 可抑制内皮依赖性血管舒张反应,降低一氧化氮合成酶免疫活性,损伤内皮功能,导致血小板聚集于血管壁破损处,形成血栓;高Hcy 可促进血管平滑肌增长,增加血管内膜中层厚度,降低血管扩张能力。PI,NIHSS 是反映CSVD 患者病情变化重要指标,根据其分值进行分组,便于临床医师准确掌握CSVD 病情进展。本研究数据显示,观察组PI及NIHSS 评分重度者外周血Hcy水平高于PI及NIHSS 评分轻中度者,且外周血Hcy与PI,NIHSS 评分呈正相关,提示高Hcy 有望成为CSVD 患者病情程度分级的血清标志物,为临床诊治提供新思路。
VILIP-1 是神经元钙传感蛋白视锥蛋白家族成员之一,可通过结合钙离子参与神经信号传导、细胞死亡途径及基因表达等病理过程。既往关于VILIP-1研究多集中于大鼠,多为脑脊液标本,近年研究发现,缺血性脑卒中患者血清VILIP-1水平呈高表达[20]。本研究推测血清VILIP-1在CSVD中亦呈升高趋势,故对此展开研究,发现观察组外周血VILIP-1水平高于对照组,且认知障碍、PI及NIHSS 评分重度者外周血VILIP-1水平高于无认知障碍、PI及NIHSS评分轻中度者。考虑与下述两方面原因有关,一方面是VILIP-1 参与磷酸化taud 蛋白病理过程,导致表达VILIP-1的神经元细胞出现损伤,引起神经元细胞功能障碍,出现注意力无法集中、记忆丢失等认知障碍表现,加剧病情进展[21]。另一方面是其可调节烟碱型乙酰胆碱受体,增强在细胞表面表达及受体激动剂敏感度,影响钙离子失活速率及神经突触生长,进而导致神经缺损,诱发认知障碍。Spearman及多元线性回归分析显示,外周血VILIP-1与认知障碍呈负相关,与PI,NIHSS 呈正相关(P<0.05),提示检测外周血VILIP-1水平变化有助于了解CSVD 患者病情变化、认知障碍,指导临床治疗。
综上所述,CSVD 患者外周血Hcy,VILIP-1,UA水平呈高表达,与病情程度、认知障碍密切相关,联合检测其水平变化有助于指导临床治疗。
