菌丝霉素抗菌肽高密度发酵生产及其特性研究
2022-04-19宋士良陆克文
宋士良 陆克文



摘要 [目的]開发菌丝霉素抗菌肽,以替代抗生素在饲料生产中添加使用。[方法]以高产菌丝霉素毕赤酵母基因工程菌PPle-BC01为供试菌株,在15 L实验室发酵罐优化发酵工艺的基础上,通过50 L、5 t、60 t发酵罐高密度发酵工艺进一步优化放大试验,实现了60 t罐规模的稳定生产。经层析柱分离、纯化,得到相对纯度≥90%的纯品。纯品水解后的游离氨基酸样品,经PITC衍生化处理后,再经过HPLC检测及氨基酸组成摩尔百分比计算与氨基酸混合标准品比对,分析其氨基酸组成。纯品经多肽蛋白质相对分子质量分析测试,测得plectasin单同位素相对分子量。纯品经蛋白浓度、抗菌效价测定、比活计算以及产品抗菌效价测定,获得产品中plectasin含量,同时测试了解其产品特性。[结果]60 t发酵罐稳定3批次试生产发酵液菌体湿重峰值分别为43.34%、43.78%和43.78%,抗菌效价峰值分别为10 566.99、10 986.45和10 788.56 U/mL;喷雾干燥产品收率分别为12.19%、12.30%和12.50%,抗菌效价分别为100 672.10、103 561.20和99 765.50 U/g。3批次试生产产品中plectasin含量分别为2.26%、2.32%和2.24%。纯品经检测符合plectasin由40个氨基酸组成的多肽的理论氨基酸残基个数值,分子量为4.440 7 kD。产品在95 ℃温度以下具有良好的热稳定性;pH 3.0~9.0具有良好的酸碱稳定性;在0.03%~0.30%猪胆盐浓度具有较好的胆盐耐受性;对胃蛋白酶、胰蛋白酶和蛋白酶K均具有良好的抗降解性。[结论]发酵终产品收率达10%,产品抗菌效价达8万U/g以上,产品中plectasin含量达2%以上,实现了60 t罐规模的产业化稳定生产。
关键词 菌丝霉素抗菌肽;高密度发酵工艺;菌丝霉素含量检测;产品特性
中图分类号 Q939.92 文献标识码 A 文章编号 0517-6611(2022)07-0078-10
doi:10.3969/j.issn.0517-6611.2022.07.019
开放科学(资源服务)标识码(OSID):
Study on High-density Fermentation Production and Characteristics of Plectasin Antimicrobial Peptide
SONG Shi-liang,LU Ke-wen
(Shanghai Bornsun Bioengineering Co.,Ltd., Shanghai 201506)
Abstract [Objective]To develop plectasin antimicrobial peplide to replace antibiotics in feed production.[Method]In this study, a high-yield plectasin-producing Pichia pastoris strain PPle-BC01 was used as the experimental strain,the steady production of 60-ton fermenters were realized by the scale-up experiments of high-density fermentation process in 50 L ,5 t and 60 t fermentor that based on the optimization of fermentation process in 15-liter fermentor.The purified sample of plectasin with relative purity above 90% was obtained by chromatographic column separation and purification.The amino acid composition of the purified sample were analyzed by HPLC determination,calculation of molar percentage of amino acid composition and comparison with reference standards for amino acid mixtures after it’s hydrolyzed free amino acid sample and reference standards for amino acid mixtures were derivatized by PITC.The single-isotope relative molecular weight of plectasin was measured by the relative molecular mass analysis of polypeptide proteins.The content of plectasin in spray-dried products were obtained by determining the concentration, antibacterial titer of pure protein and the antibacterial titer of spray-dried products.The characteristics of spray-dried products were known through the property test.[Result]Peak values of wet weight and antibacterial titer of fermentation broths were 4334%,43.78%,4378% and 10 566.99,10 986.45,10 788.56 U/mL,the yield and antibacterial titer of spray-dried products were 1219%,1230%,12.50% and 100 672.10,103 561.20,99 765.50 U/g ,the content of plectasin in spray-dried products were 2.26%,232% and 224%, respectively in stable three batchs trial production of 60-ton fermentors.The purified sample was determined to be composed of 40 amino acids and the molecular weight was 4.440 7 kD.The spray-dried product had good thermal stability under 95 ℃, had good acid-base stability in the pH 3.0-9.0 range,had good tolerance at the salt concentration of 0.03%-0.30% in pig bile,had good anti-degradability to pepsin, trypsin and proteinase K.[Conclusion]The yield of the final spray-dried products reached 10%,the antibacterial titer was over 80 000 U/g,the content of plectasin in spray-dried products was more than 2%.The industrial and stable production of 60-ton fermenters was realized.
Abstract Plectasin antimicrobial peptide;High-density fermentation process;Determination of plectasin content;Product characteristics
2019年7月10日,《农业农村部公告第194号》指出,2020年7月1日起,除中草药外,饲粮中禁用其他促生长类药物饲料添加剂。因此,开发替代抗生素的绿色、生态、安全、高效的新型饲料添加剂是我国畜禽养殖业的热点及重点。益生菌、中草药、多糖、抗菌肽等无抗药性、无残留、毒副作用小,具有良好的市场开发及应用前景,是高效、绿色环保型饲料添加剂[1]。抗菌肽(antimicrobial peptide,AMPs)是由12~50个氨基酸组成的小生物分子肽,是先天免疫系统的重要组成部分,具有分子量小、易溶于水、耐热性、抗菌谱广和不易产生耐药性等特点[2];还具有一定的免疫学活力[3]。因此,开发利用抗菌肽取代传统抗生素,对提高畜产品品質、推动绿色畜牧业的发展、保障食品安全具有重要意义。目前获得抗菌肽的方式主要有从生物体内直接分离提纯有生物活性的抗菌肽,再对其结构和功能进行研究。这种方法比较烦琐,且得到的抗菌肽含量普遍很低,不适合规模化生产。人工合成抗菌肽。根据已知的抗菌肽基因序列,用化学方法合成抗菌肽。这种方法成本高,不适于普及应用。酶解法。主要是通过将有抗菌活性的蛋白用特定的蛋白酶切割下其有抗菌活性的部分进行纯化,继而得到抗菌肽。这种方法得到的抗菌肽活性较高,但产量低,成本高。利用基因工程菌生产抗菌肽,可以在一定程度上解决这些困难,通过这种方法得到的抗菌肽目的性强,技术上有提高产量的空间,成本低,应用广,是生产抗菌肽的一条理想途径[4]。目前用于基因工程的异源表达系统在生产不同大小、折叠和复杂性的异源抗菌肽方面取得了很大的进步,抗菌肽生产的主要表达系统是细菌和酵母表达系统。毕赤酵母是酵母表达系统中应用最广泛的表达系统[4]。乔莹等[5]通过Eco31 I限制性内切酶定向连接方法合成大黄鱼与美国红鱼抗菌肽Piscidin串联基因,以毕赤酵母的穿梭表达载体pPICZαA构建重组表达质粒pPICZαA-PSP,转化入毕赤酵母SMD1168菌株中,实现了PSP重组串联肽的诱导表达和纯化,初步鉴定Piscidin抗菌肽对大肠杆菌、金黄色葡萄球菌和爱德华氏菌等均有抑制生长的活性。邓赣奇等[6]将优化的目的蛋白碱基序列与标签MBP基因序列融合,通过双酶切将重组基因序列插入到毕赤酵母pGAPZaA表达载体上并进行连接反应,成功获得一种能分泌菌丝霉素的毕赤酵母,对其分泌蛋白进行Western blot检测、纯化、活性分析和质谱鉴定,得到的重组蛋白为55 ku左右,浓度为700 mg/L,纯度达80%以上,质谱鉴定结果表明,蛋白序列的覆盖率达98%,纯化后的蛋白对金黄色葡萄球菌具有抑制作用。到该研究实施前为止,重组菌丝霉素抗菌肽尚处于研发阶段,国内尚未见产业化报道。通过毕赤酵母表达系统生产抗菌肽是一种有效的生产方法,相对于细菌表达系统生产抗菌肽,表现出更多的优势。因此,开展重组菌丝霉素基因工程抗菌肽产业化研发具有现实意义。该研究通过高产菌丝霉素毕赤酵母基因工程菌高密度发酵工艺优化及其特性研究,完成菌丝霉素抗菌肽工艺放大试生产、产品试制、试运行,成果转化达到产业化目标。如何提高基因工程菌丝霉素抗菌肽菌株发酵生物表达量,提高生产效率、降低成本,实现廉价、规模化生产,已成为目前抗菌肽研究开发产业化过程中,亟待需要解决的关键问题。笔者通过补料高密度发酵工艺优化试验,并完成菌丝霉素结构、分子量及产品中菌丝霉素成分含量检测,实现在实验室15 L发酵罐基础上发酵菌体鲜生物量提高到400 g/L、抗菌效价表达量提高到8 000 U/mL以上,使发酵终产品收率达10%、产品抗菌效价达8万U/g、产品中菌丝霉素含量达2%以上,实现60 t罐规模的产业化稳定生产的要求。该产业化成果,经上海科学技术情报研究所科技查新,国内外未见有同类研究。
1 材料与方法
1.1 试验地点
试验于2017年1月—2018年12月在上海邦成生物工程有限公司微生物及发酵研究所发酵实验室及发酵中试、生产车间进行。
1.2 主要仪器
超低温冷冻柜(DW-86L338J,青岛海尔特种电器有限公司);生物显微镜(XSP-BM-2CA,上海彼爱姆光学仪器制造有限公司);超净工作台(YJ-1340,苏州苏信环境科技有限公司);隔水式恒温培养箱(GHF-9270,上海一恒科学仪器有限公司);立式压力蒸汽灭菌器(YXQ-50SⅡ,上海博迅实业有限公司);冷冻干燥机(TF-FD-1,上海田枫实业有限公司);分析天平(Sartorius SQP,赛多利斯科学仪器(北京)有限公司);pH计(PHS-3C,上海雷磁仪器有限公司);电导率仪(DDS-307,上海雷磁仪器有限公司);恒温摇床(TS-211C,常州冠军仪器制造有限公司);紫外分光光度计(752N,上海仪电分析仪器有限公司);实验室喷雾干燥机(WPG-1500,常州市永昌制粒干燥设备有限公司);水分测定仪(SYF-6D,深圳冠亚水分仪科技有限公司);低速台式离心机(TDL-5-A,上海安亭科学仪器厂);高速台式离心机(TCL-18G-C,上海安亭科学仪器厂);核酸蛋白检测仪(HD-21-88,上海琪特分析仪器有限公司);酶标仪(Multiskan MK3,赛默飞世尔(上海)仪器有限公司);电热恒温水浴锅(HWS28,上海一恒科学仪器有限公司);高效液相色谱仪(LC-20AT,日本岛津公司);质谱仪(AB Sciex 5800 MALDI-TOF/TOF,美国爱博才思公司);实验室发酵罐(15 L、50 L,上海洋格生物工程设备有限公司);中试、试生产发酵罐(50 L、100 L、0.5 t、1 t、5 t、10 t、60 t,镇江东方生物工程设备技术有限责任公司);压力喷雾干燥设备(水分蒸发量1 000 kg/h,无锡市现代喷雾干燥设备有限公司)。
1.3 试剂、标准品和测试专用附件
氨基酸混合溶液标准物质(中国北京)购自中国计量科学研究院;浓盐酸、冰醋酸、无水乙酸钠(中国上海)购自国药集团化学试剂有限公司;三乙胺、乙腈、PITC、CHCA、ProteoMass Peptide & Protein MALDI-MS Calibration Kit购自Sigma(美国);甲醇购自Fisher Scientific(美国);SA购自Fluka(美国);SP Sepharose填料购自GE(美国);2.6 cm×10 cm层析柱(中国上海)购自上海锦华层析设备厂;HL-1B数显恒流泵(中国上海)购自上海沪西分析仪器厂有限公司;Symmetry C 18色谱柱购自Waters(美国);氨基酸分析柱(中国北京)购自北京迪科马科技有限公司;水解管购自CNW Technologies GmbH(德国);Block Heater(中国上海)购自上海比朗仪器有限公司;样品靶购自AB Sciex(美国);BCA蛋白定量分析试剂盒购自Thermo(美国)。
1.4 试验方法
1.4.1 菌种保藏。
高产菌丝霉素(plectasin)毕赤酵母(Pichia pastoris)基因工程菌PPle,菌株编号BC01。冷冻干燥管、甘油管菌种保藏于上海邦成生物工程有限公司微生物及发酵研究所菌种保藏库-80 ℃低温冷冻柜。菌落特征为在YPD平板上,菌落乳白色,平板培养时间较长,泛微黄,菌落光滑圆润,有酒香。
1.4.2 菌丝霉素基因工程菌构建。
1.4.2.1 基因工程菌构建技术路线。基因工程菌构建技术路线见图1。
1.4.2.2 技术路线中关键技术。
(1)菌丝霉素是由40个氨基酸组成的多肽,其结构式(即氨基酸组成)为GFGCNGPWNEDDLRCHNHCKSIKGYKGGYCAKGGFVCKCY。
(2)构建诱导型毕赤酵母基因工程菌株前后酵母发酵过程中生物量的变化情况。
通过构建诱导型高产菌丝霉素毕赤酵母基因工程菌株后,采用实验室15 L发酵罐,经正交试验、响应面分析、补料高密度发酵工艺优化,有效提高发酵过程中菌体的生物量,结果发酵液菌体鲜生物量可达300 g/L。
(3)构建诱导型毕赤酵母基因工程菌株前后菌丝霉素表达能力的变化情况。
通过构建诱导型高产菌丝霉素毕赤酵母基因工程菌株后,采用实验室15 L发酵罐,经正交试验、响应面分析、补料高密度发酵工艺优化,有效提高发酵过程中发酵液的抗菌效价,结果发酵液抗菌效价可达到6 000 U/mL。
1.4.3 高密度发酵工艺优化试验
1.4.3.1 50 L罐工艺。培养基:
①固体斜面培养基(W/V)。葡萄糖2.00%,蛋白胨200%,酵母浸粉1.00%,琼脂200%,pH自然。
②摇瓶种子培养基(W/V)。葡萄糖200%,蛋白胨200%,酵母浸粉1.00%,pH自然。
③50 L罐发酵培养基(W/V)。甘油4.00%,磷酸100%,七水硫酸镁1.00%,氢氧化钾0.60%,硫酸铵0.17%,氯化钠 0.05%,泡敌0.05%,微量元素0.20%,pH 5.0。微量元素(W/V)有硫酸亚铁6.50%,氯化锌2.0%,硫酸铜0.60%,碘化钾0.08%,浓硫酸0.50%,硫酸锰0.30%,氯化钴005%,钼酸钠002%,硼酸0.02%,生物素0.02%(以上培养基均经121 ℃灭菌20 min)。
培养方法:
①固体斜面培养。28~30 ℃培养72 h。
②摇瓶种子培养。取斜面菌种,无菌操作接种1环斜面菌苔,接入已经灭菌处理冷却,装有120 mL培养基的500 mL三角瓶中,置摇床以转速170 r/min、28~30 ℃培养24 h。
③50 L罐发酵。将培养好的二级摇瓶种子液以5%(V/V)的接种量,无菌操作接入已经灭菌处理冷却、装有30 L培养基的50 L发酵罐中。培养条件为25~30 ℃,转速350~750 r/min,风量600~2 500 L/h,罐压0.02~0.05 MPa。
1.4.3.2 5 t罐工艺。培养基:
①摇瓶种子培养基。蛋白胨20.00 g/L,酵母浸粉1000 g/L。121 ℃灭菌20 min,灭菌完毕后加入终浓度为2000 g/L葡萄糖(115 ℃,15 min单独灭菌),pH自然。
②50 L罐发酵培养基。一级种子同摇瓶种子培养基。装液量30 L。
③500 L罐发酵培养基。二级种子同摇瓶种子培养基。装液量300 L。121 ℃灭菌20 min,滅菌后100 L罐分装80 L(分装前100 L罐先进行空罐灭菌处理)。
④5 t罐发酵培养基。甘油40.00 g/L,磷酸10.00 g/L,七水硫酸镁 10.00 g/L,氢氧化钾6.00 g/L,硫酸铵1.72 g/L,氯化钠 0.50 g/L,泡敌0.50 g/L,微量元素0.20 g/L,pH 5.0。微量元素(W/V)有硫酸亚铁6.50%,氯化锌2.00%,碘化钾008%,硫酸铜0.60%,浓硫酸0.50%,氯化钴0.05%,硫酸锰0.30%,钼酸钠0.02%,硼酸0.02%,生物素0.02%。装液量3 t。121 ℃灭菌20 min,灭菌后1 t罐分装800 L(分装前1 t罐先进行空罐灭菌处理)。
发酵条件:
①摇瓶。28~30 ℃,转速170 r/min,培养周期24 h。
②50 L罐发酵。28~30 ℃,转速350 r/min,风量40 L/min,罐压0.02~0.05 MPa,培养周期24 h。
③500 L罐发酵。28~30 ℃,转速290 r/min,风量25 m3/h,罐压0.06~0.08 MPa,培养周期24 h。
④5 t罐发酵。25~30 ℃,转速170 r/min,风量400 m3/h,罐压0.06~0.08 MPa。
1.4.3.3 60 t罐工艺。培养基:
①摇瓶种子培养基。同5 t罐工艺中摇瓶种子培养基。
②500 L罐发酵培养基。一级种子同摇瓶种子培养基。装液量300 L。
③5 t罐发酵培养基。二级种子同摇瓶种子培养基。装液量3 t。121 ℃灭菌20 min,灭菌后1 t罐分装800 L(分装前1 t罐先进行空罐灭菌处理)。
④60 t罐发酵培养基。同5 t罐发酵培养基。装液量30 t。灭菌后10 t罐分装8 t(分装前10 t罐先进行空罐灭菌处理)。
发酵条件:
①摇瓶。28~30 ℃,转速170 r/min,培养周期24 h。
②500 L罐发酵。28~30 ℃,转速290 r/min,风量25 m3/h,罐压0.06~0.08 MPa,培养周期24 h。
③5 t罐发酵。28~30 ℃,转速170 r/min,风量400 m3/h,罐压0.06~008 MPa,培养周期24 h。
④60 t罐发酵。25~30 ℃,转速80 r/min,风量3 000 m3/h,罐压0.06~0.08 MPa。
1.4.4 发酵液喷雾干燥方法。
进风温度控制在170~190 ℃;出风温度控制在70~90 ℃;水分蒸发量控制在1 000 kg/h。
1.4.5 菌丝霉素分离、纯化方法。
1.4.5.1 样品处理。
菌丝霉素发酵液→10 000 r/min,4 ℃离心15 min→上清液95 ℃热处理15 min →冷却→10 000 r/min,4 ℃离心15 min→收集上清液→等体积加入20 mmol/L pH 6.7的磷酸钾缓冲液 →加入2倍体积的纯水(电导率≤4 mS/cm)→0.45 μm的滤膜过滤→置4 ℃冰箱保存备用。
1.4.5.2 层析柱准备。
10 mL的SP Sepharose FF填料装入26 cm×10 cm层析柱中,用5倍柱体积的纯水平衡柱子,然后用3倍柱体积的20 mmol/L pH 6.7的磷酸钾缓冲液平衡柱子。
1.4.5.3 纯化。
上样→上样结束后用3倍柱体积的20 mmol/L pH 6.7的磷酸钾缓冲液冲洗柱子→然后用3倍柱体积含0.2 mol/L NaCl的20 mmol/L pH 6.7的磷酸鉀缓冲液洗杂 → 再用3倍柱体积含0.5 mol/L NaCl的20 mmol/L pH 6.7的磷酸钾缓冲液洗脱→收集峰值→最后用3倍柱体积含1 mol/L NaCl的20 mmol/L pH 6.7的磷酸钾缓冲液冲洗柱子。
1.4.6 菌丝霉素抗菌肽特性。
1.4.6.1 热稳定性试验。
菌丝霉素发酵液→分别于40、50、60、70、80、95 ℃水浴加热15 min → 5 000 r/min离心10 min → 检测效价。
1.4.6.2 pH稳定性试验。
产品 → 加水复溶 → 分别将pH调至2.0、3.0、4.0、5.0、6.0、7.0、8.0、9.0→ 5 000 r/min离心10 min→ 检测效价。
1.4.6.3 耐胆盐试验。
产品 → 加水1∶9复溶 → 分别加入猪胆盐0.03%、0.10%、0.20%、0.30%、1.00% → 25 ℃反应4 h → 6 000 r/min离心10 min → 检测上清液效价。
1.4.6.4 抗蛋白酶降解测试。
产品 → 加水复溶 →调最适pH(胃蛋白酶pH 2.0、胰蛋白酶pH 7.5、蛋白酶K pH 75)→ 按终质量浓度1.0 mg/mL加入3种酶 → 分别水浴40 ℃(胃蛋白酶)、37 ℃(胰蛋白酶)和58 ℃(蛋白酶K)酶解2 h → 调pH至5.9 → 5 000 r/min离心10 min → 检测效价。
1.5 测定项目与方法
1.5.1 OD 600 nm的测定。
取发酵液,用蒸馏水稀释至适宜菌浓度,用分光光度计,在600 nm波长处,用比色管定时测定发酵液的吸光度(OD 600 nm),测定时用蒸馏水作空白。
1.5.2 pH的测定。
取一定量的发酵液,用pH计测定发酵液的pH,测定前用标准缓冲溶液校正。
1.5.3 菌体湿重的测定。
取发酵液,将一定体积的待测发酵液(25 mL)倒入离心管中,设定一定的离心时间和转速(3 000 r/min,15 min),进行离心处理,处理完倒掉上清液并称重,计算菌体湿重(W/V,%)。
1.5.4 发酵液抗菌效价的测定。
从甘油管中取革兰氏阳性菌(G+),金黄色葡萄球菌指示菌ATCC25923(Staphylococcus aureus ATCC25923)菌种平板划线,37 ℃培养过夜,将单菌落接种至无抗LB液体培养基中,37 ℃、200 r/min培养过夜,将菌液稀释OD 600 nm至1.0,然后将稀释菌液按1∶1 000的比例加入温度不高于50 ℃融化的无抗LB琼脂培养基中,混匀倒平板,冷却备用。用Ф2.7 mm打孔器在LB平板上打孔,每皿至少打3个孔,每孔接种5 μL发酵液(使用前吸1.5 mL至2 mL离心管中,10 000 r/min离心5 min,再用0.22 μm过滤器用针筒吸取过滤),用无菌水作空白对照,37 ℃培养过夜。根据抑菌圈大小计算抗菌效价。
计算公式:抗菌效价U(U/mL)=2x×1 000×稀释倍数,x=(y-2.7)/2.1。
其中,y为抗菌肽抑菌圈直径(Φmm),取平均值;
2.7为孔穴直径(Φmm);
2.1为抗菌肽浓度与抑菌圈直径的比值常数。
1.5.5 产品抗菌效价的测定。
准确称取1.000 0 g产品至9 mL无菌生理盐水中(10倍稀释),充分振荡溶解,溶解后吸1.5 mL至2 mL离心管中,10 000 r/min离心5 min,再用0.22 μm滤膜过滤器用针筒吸离心上清液过滤。测定方法同“1.4.4”方法。
计算公式:抗菌效价U(U/g)=2x×1 000×稀释倍数,其他同“1.4.4”。
1.5.6 菌丝霉素纯品纯度鉴定方法。
1.5.6.1 纯品收集。
在用含0.5 mol/L NaCl的20 mmol/L pH 6.7的磷酸钾缓冲液洗脱时,共收集10管(每管4~5 mL);HPLC测得第4~10管菌丝霉素的含量较高,其中第4管含量最高菌丝霉素的峰面积最大,因此单独保留第4管,进行HPLC法纯度鉴定。
1.5.6.2 HPLC法纯度鉴定。
流动相A:取1 mL三氟乙酸,加入1 000 mL乙腈,充分混匀。流动相B:取1 mL三氟乙酸,加入1 000 mL纯水(电导率≤4 mS/cm),充分混匀。Symmetry C 18色谱柱(250.0 mm×4.6 mm,5.0 μm),流速1 mL/min,波长280 nm,柱温35 ℃,进样量20 μL。
1.5.7 菌丝霉素氨基酸组成分析。
1.5.7.1 纯品酸水解。
取一定量纯品,转移至水解管中,加入1 mL 6 mol/L的盐酸,充入N 2约10 min,之后密封放置于Block Heater干式加热器模块中,110 ℃水解反应24 h。反应完毕后,将游离氨基酸溶液转移至1.5 mL EP管中,抽真空浓缩至干。
1.5.7.2 异硫氰酸苯酯(PITC)衍生方法。
(1)混合氨基酸标准品衍生化处理。取25 μL混合氨基酸标准品溶液,加入12.5 μL 1 mol/L三乙胺涡旋混合振荡,之后加入12.5 μL 1 mol/L PITC涡旋混合振荡室温静置1 h,加入100 μL正己烷剧烈混合振荡后静置10 min,取下层溶液20 μL,加入180 μL流动相A溶液,混合后0.22 μm过滤处理待测试。
(2)纯品溶液衍生化处理。取适量流动相A液复溶已冻干样品游离氨基酸,取25 μL样品游离氨基酸溶液,其他操作同(1)。
(3)HPLC测试。衍生化好的氨基酸衍生物进行液相色谱测试。A液为0.05 mol/L乙酸钠水溶液;B液为甲醇乙腈水溶液[甲醇∶乙腈∶水=20∶60∶20(V∶V∶V)]。流速为1.0 mL/min;柱温35 ℃;色谱柱以95%的A液平衡后,样品由自动进样器上样到氨基酸分析柱。
1.5.8 菌丝霉素相对分子质量分析方法。
1.5.8.1 点样。
将1 μL纯品样点至样品靶上,自然干燥后,再取0.6 μL CHCA(Sigma)基质溶液点至对应靶位上并自然干燥,用相同方法在样品靶位相邻位置点标准样。
1.5.8.2 校准。
在正离子模式下,选择反射方法对样品测试范围进行校准测试。
1.5.8.3 相关参数。
标准物质校准范围为1 046.54±050、1 533.86±0.50、2 465.20±0.50、3 494.65±0.50。
1.5.8.4 測试样品。
在正离子模式下,选择反射方法测试样品分子量。
1.5.8.5 质谱数据及图谱处理。
5800MALDI-TOF/TOF产生的原始数据及图谱由4000Series Explorer V3.5软件导出。
1.5.9 纯品的蛋白浓度C 1(mg/mL)测定方法。
采用BCA蛋白定量分析试剂盒法(Thermo Scientific Pierce 23225型)测定。
1.6 数据分析
试验数据无特别标注均为2次测定值的平均值,数据经过Excel 2016处理后,定量测定数据利用SPSS 21.0统计软件进行方差分析,差异显著时采用Duncan’s法进行多重比较,试验结果以“平均值±标准差(x±s)”表示,显著性水平为0.05。
2 结果与分析
2.1 高密度发酵工艺优化试验
2.1.1 50 L罐试验结果。
50 L罐发酵过程控制:发酵18~24 h后液体内溶氧(DO)开始上升后定量流加甘油,再补甘油8~10 h,菌体湿重达25%以上。流加完甘油后,开始流加甲醇,5 h后降温至25 ℃进行维持,利用氨水调节pH 50左右,诱导至下罐。50 L试验罐进行发酵工艺优化试验,3批次稳定发酵试验结果见图2~4。
从图2~4可以看出,3批次50 L罐稳定小试发酵试验,在发酵液达到最高OD 600 nm时,分别取样测定菌体湿重和抗菌效价,检测结果见表1。
从表1可以看出,3批次发酵液最高OD 600 nm值相对应的菌体湿重和抗菌效价分别为(43.98±0.52)%、(43.91±008)%、(43.57±0.38)%和(8 736.18±135.76)、(8 226.29±244.66)、(8 286.31±140.01)U/mL;3批次之间菌体湿重和抗菌效价均无显著差异。
2.1.2 5 t罐试验结果。
5 t罐中试发酵过程控制:发酵12~18 h后液体内溶氧(DO)开始上升后定量流加甘油,流加甘油8~10 h,菌体湿重达25%以上。流加完甘油后,开始流加甲醇,5 h后降温至25 ℃进行维持,利用氨水调节pH 50左右,诱导至下罐。5 t罐3批次稳定中试发酵检测结果分别见图5~7。
从图5~7可以看出,3批次5 t罐稳定中试发酵试验,在发酵液达到最高OD 600 nm值时,分别取样测定菌体湿重和抗菌效价,检测结果见表2。
从表2可以看出,3批次发酵液最高OD 600 nm值相对应的菌体湿重和抗菌效价分别为(43.45±0.34)%、(44.45±034)%、(43.88±0.42)%和(10 350.54±438.41)、(10 564.35±328.10)、(11 001.81±202.23)U/mL;3批次之间菌体湿重和抗菌效价均无显著差异。
2.1.3 60 t罐试验结果。
2.1.3.1 60 t罐试生产发酵。
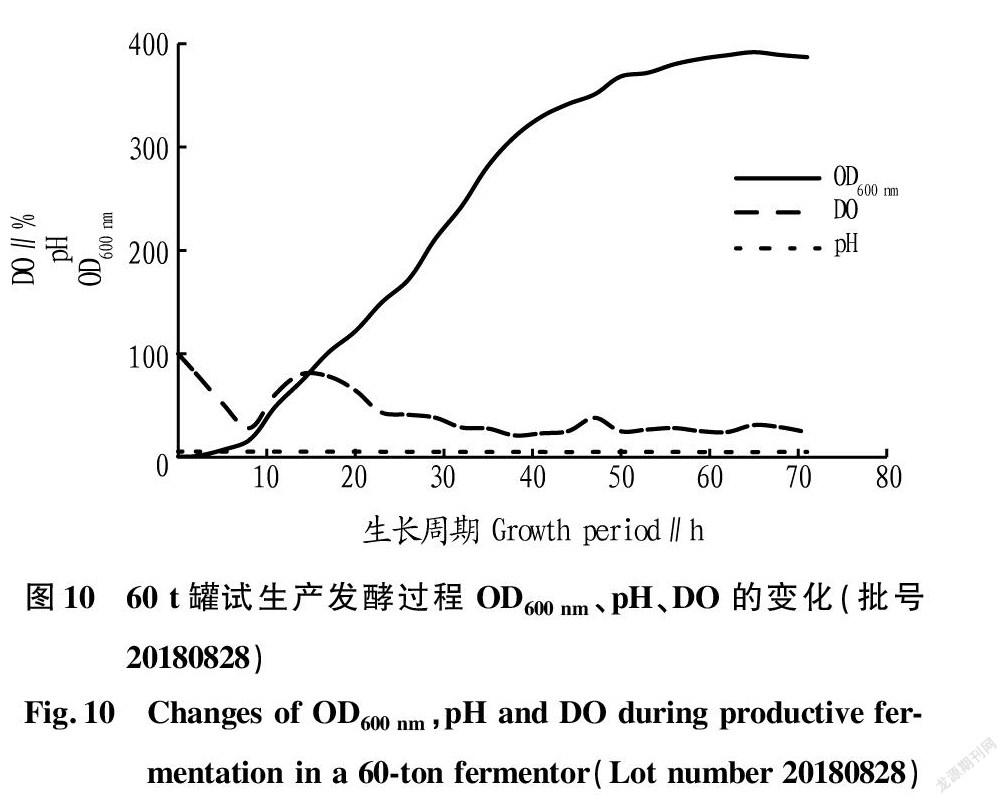
60 t罐试生产发酵过程控制:发酵10~14 h后液体内溶氧(DO)开始上升后定量流加甘油,流加甘油8~10 h,菌体湿重达25%以上。流加完甘油后,开始流加甲醇,5 h后降温至25 ℃进行维持,利用氨水调节pH 5.0左右,诱导至下罐。60 t罐3批次稳定试生产发酵结果见图8~10。发酵过程发酵液最高菌体湿重和抗菌效价测定结果见表3~5。
从图8~10及表3~5可以看出,3批次60 t罐稳定试生产发酵试验,批号20180627发酵64 h菌体生长进入稳定期,菌体积累达到峰值,此时菌体湿重为(43.34±0.27)%;批号20180721发酵67 h菌体生长进入稳定期,菌体积累达到峰值,此时菌体湿重为(43.78±0.40)%;批号20180828发酵65 h菌体生长进入稳定期,菌体积累达到峰值,此时菌体湿重为(43.98±0.38)%。批号20180627发酵64 h发酵液抗菌效价达到峰值,此时抗菌效价为(11 002.12±217.79)U/mL;批号20180721发酵70 h发酵液抗菌效价达到峰值,此时抗菌效价为(11 579.37±147.38)U/mL;批号20180828发酵68 h发酵液抗菌效价达到峰值,此时抗菌效价为(10 820.91±18364)U/mL。菌体湿重与抗菌效价之间相关联,但并非线性相关关系。
2.1.3.2 60 t罐试生产结果。
高产菌丝霉素毕赤酵母基因工程菌PPle-BC01,60 t罐3批次稳定试生产,发酵液及喷雾干燥产品抗菌效价及收率,结果见表6。从表6可以看出,60 t罐3批次稳定试生产发酵液菌体湿重、抗菌效价峰值,喷雾干燥产品抗菌效价之间均无显著差异。喷雾干燥产品的收率在12%以上。
2.2 菌丝霉素结构、分子量及含量检测
2.2.1 菌丝霉素纯品纯度鉴定。
HPLC法鉴定,检测波长280 nm,检测结果显示,菌丝霉素可以在4.756 min的峰处检测到,纯品相对纯度≥90%(图11)。
2.2.2 菌丝霉素氨基酸组成分析。
纯品水解后的游离氨基酸样品,经PITC衍生化处理后,经过HPLC分析,得到的原始数据经过Labsolution(SHIMADZU)经外标法自动积分标峰,所得的标峰图谱见图12。
经纯品氨基酸组成摩尔百分比计算与氨基酸混合标准品比对,测试结果符合菌丝霉素(plectasin)是由40个氨基酸组成的多肽的理论氨基酸残基个数值。
2.2.3 菌丝霉素相对分子质量分析。
标准品校准测试通过后,测试纯品相对分子质量,纯品测试图谱见图13。
菌丝霉素(plectasin)是由40个氨基酸组成的多肽,其结构式(即氨基酸组成)的序列是GFGCNGPWNEDDLRCHNHCKSIKGYKGGYCAKGGFVCKCY。菌丝霉素的理论分子量为4.400 0 kD。图13质谱图测得单同位素相对分子量为4.440 7 kD。该分子量与理论分子量相似,因此Plectasin被检测到。
2.2.4 菌丝霉素含量。
2.2.4.1 纯蛋白的比活。
(1)纯品的蛋白浓度C 1(mg/mL)测定。
蛋白浓度标准曲线测定结果见图14。
37 ℃反应30 min,用酶标仪测定492 nm处的吸光度值,测得菌丝霉素纯品的吸光度值,计算得到蛋白浓度C 1=(161±0.04)mg/mL。
(2)纯品的抗菌效价U 1(U/mL)测定。
在用含0.5 mol/L NaCl的20 mmol/L pH 6.7的磷酸钾缓冲液洗脱时,共收集10管(每管4~5 mL);HPLC检测结果表明,第4~10管菌丝霉素的含量较高,其中第4管含量最高菌丝霉素的峰面积最大,将各管混合后混合液进行抗菌效价检测,测得混合液的效价U 1=(7 174.12±101.44)U/mL。
(3)纯蛋白的比活计算。
纯蛋白比活计算公式为RU=U 1/C 1(U/mg)。计算纯蛋白的比活RU=U 1/C 1=4 455.98 U/mg。
2.2.4.2 产品抗菌效价。U 0(U/g)测定结果见表6。
2.2.4.3 菌丝霉素含量。
1 g产品中菌丝霉素含量(mg/g)=U 0/RU。60 t罐3批次稳定试生产产品中菌丝霉素含量检测值分别为批号20180627的1 g产品中菌丝霉素含量U 0/RU=22.59 mg/g,折算百分含量2.26%(W/W)。批号20180721的1 g产品中菌丝霉素含量U 0/RU=23.24 mg/g,折算百分含量2.32%(W/W)。批號20180828的1 g产品中菌丝霉素含量U 0/RU=22.39 mg/g,折算百分含量2.24%(W/W)。
2.3 菌丝霉素抗菌肽产品特性
2.3.1 热稳定性。
热稳定性测试结果见图15。
从图15可以看出,菌丝霉素抗菌肽产品在95 ℃以下抗菌效价无显著差异,说明其具有较良好的热稳定性。
2.3.2 pH稳定性。
pH稳定性测试结果见图16。
从图16可以看出,菌丝霉素抗菌肽产品在pH 3.0~9.0时抗菌效价测试结果无显著差异,说明在此pH范围内具有良好的稳定性(pH 2.0抑菌效价测试结果偏高,应该是酸影响的结果)。
2.3.3 耐胆盐试验。
耐胆盐试验结果见图17。
从图17可以看出,菌丝霉素抗菌肽产品在0.03%~030%胆盐浓度下抗菌效价无显著差异,说明其对胆盐具有较好的耐受性。
2.3.4 抗蛋白酶降解测试。
抗蛋白酶降解测试结果见图18。
从图18可以看出,菌丝霉素抗菌肽产品对胃蛋白酶、胰蛋白酶和蛋白酶K的抗菌效价无显著差异,说明其对上述3种蛋白酶均具有良好的抗降解性。
3 结论与讨论
3.1 讨论
Mygind等[7]首先从腐生子囊菌假黑盘菌菌丝体中克隆到菌丝霉素的cDNA,将其转化至米曲霉表达系统中,分泌出菌丝霉素,并进行了其结构和活性研究。之后,人们开展了一系列针对菌丝霉菌的研究。Yang等[8]研究表明,菌丝霉素具有强抗革兰氏阳性菌、无溶血性等作用,可作为一种潜在的治疗革兰氏阳性菌感染的非抗菌素类药物。王少然[9]在毕赤酵母X-33中融合表达单体Plectasin。将设计的单体基因重组到载体pPICZaA上,转入毕赤酵母X-33中进行诱导表达,诱导表达120 h后,X-33(pPICZaA/PPD)分泌表达的总蛋白浓度为339 μg/mL,X-33(pPICZaA/PN)分泌表达的总蛋白浓度为307 μg/mL。表达产物经镍柱纯化、化学试剂切割后,进行抑菌活性鉴定,发现切割后获得的单体PPD和PN均可以抑制金黄色葡萄球菌的生长。万津[10]将Ple多聚体基因克隆加入毕赤酵母分泌型表达载体pPICZaA,转化毕赤酵母X-33后得到一株基因工程菌PPle;在1%甲醇诱导下,其表达产物Plectasin能够有效分泌到培养基中;重组菌丝霉素分子大小约为4.1 kD;在摇瓶中诱导,毕赤酵母基因工程菌PPle分泌水平为143 μg/mL。体外抑菌试验表明,重组菌丝霉素对猪链球菌和金黄色葡萄球菌有强烈的抑制作用,最小抑菌浓度显示其对猪链球菌最为敏感,最小抑菌浓度为4 μg/mL;能从pH 2.0~10.0保持抗菌活性;经胃蛋白酶消化处理后仍能保持较强的抑菌活性。试验采用60只4周龄健康SD大鼠,按体重相近、雌雄各半原则,随机分为6个处理,单笼饲养进行动物试验。分别通过腹腔连续注射重组菌丝霉素、万古霉素和培养上清液(对照)后,对其中一半大鼠进行金黄色葡萄球菌攻毒(另一半作为对照注射生理盐水),所有大鼠继续饲养14 d后宰杀取样,结果表明,腹腔注射菌丝霉素和万古霉素均能提高大鼠血清免疫球蛋白含量,改善大鼠免疫功能。叶滔等[11]构建表达菌丝霉素NZ2114蛋白的真核重组表达质粒pPicZα-NZ2114,并转化毕赤酵母GS115,Zeocin抗性筛选阳性重组子,通过PCR鉴定、Tricine-SDS-PAGE分析和琼脂孔穴扩散法筛选获得菌丝霉素NZ2114组成型表达菌株,结果发现在4.4 kD处有明显的目的条带,经50 L罐中试发酵,甲醇诱导96 h,菌体湿重达151.23 g/L,菌体细胞数达37亿个/mL,蛋白浓度达606 μg/mL,重组转化子甲醇诱导发酵上清液对金黄色葡萄球菌CMCC26003具有明显的抑制作用。万津等[12]采用30 L液体发酵罐对毕赤酵母基因工程菌PPle进行高密度诱导培养,采用分批-补料式发酵工艺和甘油基础盐培养基,研究了毕赤酵母工程菌生长及重组蛋白表达规律,并考察了重组菌丝霉素对金黄色葡萄球菌感染大鼠肠道健康和免疫功能的影响。结果表明,在30 ℃下,经甲醇连续诱导72 h,其最大菌体湿重达402 g/L,最高发酵上清蛋白总浓度为3.94 g/L。李延等[13]利用30 L发酵罐对毕赤酵母基因工程菌(PPle)进行液体发酵,采用分批-补料式发酵工艺,比较低盐、基础甘油和基础可溶性淀粉3种不同培养基对重组菌丝霉素分泌表达的影响。结果表明,发酵114 h,低盐组、基础甘油组和基础可溶性淀粉组菌体湿重达到最高,分别为450、402、277 g/L。发酵114 h,测得发酵上清液蛋白总浓度低盐组0.38 g/L、基础甘油组3.94 g/L、基础可溶性淀粉组5.63 g/L。选用30头24日龄健康的“杜长大”断奶仔猪,按体重一致原则随机分配各组进行动物试验。结果表明,与对照组(无抗饲粮)相比,菌丝霉素抗菌肽能显著提高ADFI(P<0.05)和ADG(P<0.05),显著降低F/G(P<005),显著提高回肠食糜双歧杆菌的含量(P<0.05),并有降低腹泻率、提高能量和干物质表观消化率的趋势(0.05<P<0.10)。李连彬[14]以牛奶来源的金黄色葡萄球菌为供试菌株,研究菌丝霉素源抗菌肽(NZ2114和MP1102)在培养基、牛奶和奶牛乳腺上皮细胞内的杀菌效果,并选用常规抗生素四环素作对照。结果表明,8株牛奶来源的金黄色葡萄球菌对2种抗菌肽均敏感,2种抗菌肽在牛奶和奶牛乳腺上皮细胞中具有对金黄色葡萄球菌E48高效杀菌能力,且效果优于四环素处理组。通过牛奶源金黄色葡萄球菌诱导小鼠乳腺炎模型,然后据此评估抗菌肽(NZ2114和MP1102)在體内乳腺环境中的杀菌和抗炎效果。结果表明,经过抗菌肽或四环素治疗后乳腺组织中金黄色葡萄球菌数量显著下降,且抗菌肽效果优于四环素(四环素、NZ2114和MP1102分别下降了1.481、2.901和3.151 g单位的数量)。张清娟等[15]研究了菌丝霉素源抗菌肽(NZ2114)对奶牛乳房炎源停乳链球菌的体外杀菌效果及其作用机制,结果发现抗菌肽NZ2114对奶牛乳房炎源停乳链球菌杀菌活性强,其破坏细菌细胞膜后可直接作用于胞内的基因组DNA并改变其二级结构。Ma等[16]为了评估日粮中添加重组菌丝霉素(Ple)对肉仔鸡生长性能、肠道健康和血清免疫参数的影响,开展了288 d的动物试验,采用1日龄肉仔鸡进行饲喂试验,试验分4组,包括饲喂基础日粮(NC),添加10 mg/kg恩拉霉素(PC)、100 mg/kg菌丝霉素(LPle)和200 mg/kg菌丝霉素(HPle)。结果显示,与NC组相比,Ple能极显著提高ADG(P<0.01)、显著降低F/G(21 d,P<0.05),极显著提高十二指肠脂肪酶(42 d,P<0.01)和胰蛋白酶活性(P<0.01)。与PC组类似,Ple还能提高空肠绒毛高度和隐窝深度(21 d);与NC组相比,空肠绒毛高度与隐窝深度比值(V/C)极显著提高(42 d,P<0.01)。PC与Ple均能显著提高IgG(21和42 d,P<005)和IgM值(42 d,P<0.05)。与NC组相比,PC、LPle和HPle组都能极显著降低空肠内丙二醛含量(21 d,P<0.01)。此外,Ple还能极显著降低回肠和盲肠中E.coli和总需氧菌的数量(21和42 d,P<0.01)。
该研究以高产菌丝霉素毕赤酵母基因工程菌PPle-BC01为供试菌株,通过50 L、5 t、60 t发酵罐高密度发酵工艺优化试验,实现了60 t罐规模的稳定生产,3批次稳定试生产发酵液菌体湿重峰值分别为43.34%、43.78%和43.78%,抗菌效价峰值分别为10 566.99、10 986.45和10 788.56 U/mL;喷雾干燥产品收率分别为12.19%、12.30%和12.50%,抗菌效价分别为100 672.10、103 561.20和99 765.50 U/g。经层析柱分离、纯化,得到相对纯度≥90%的纯品。纯品水解后的游离氨基酸样品,经PITC衍生化处理后,再经过HPLC分析及氨基酸组成摩尔百分比计算与氨基酸混合标准品比对,分析纯品在水解过程中,门冬酰胺和谷氨酰胺易转化为门冬氨酸和谷氨酸,故将其理论个数合并计算;色氨酸、甲硫氨酸和胱氨酸易被破坏;故检测氨基酸个数与理论个数有所减少,但从氨基酸组成总摩尔百分比计算仍符合Plectasin由40个氨基酸组成的多肽的理论氨基酸残基个数值。纯品经多肽蛋白质相对分子质量分析测试,测得Plectasin单同位素相对分子量为4.440 7 kD,该分子量与理论分子量4.400 kD一致。纯品经蛋白浓度、抗菌效价测定、比活计算以及产品抗菌效价测定,计算3批次试生产产品中Plectasin含量分别为2.26%、2.32%和2.24%。产品经性质测试,95 ℃温度以下具有良好的热稳定性;pH 3.0~9.0具有良好的酸碱稳定性;在0.03%~0.30%猪胆盐浓度下具有较好的胆盐耐受性;对胃蛋白酶、胰蛋白酶和蛋白酶K均具有良好的抗降解性。
3.2 结论
该研究以高产菌丝霉素基因工程毕赤酵母PPle-BC01为供试菌株,通过50 L、5 t、60 t罐规模补料高密度发酵工艺优化试验,并完成菌丝霉素(Plectasin)结构、分子量及产品中含量检测,实现在实验室15 L发酵罐基础上发酵菌体鲜生物量提高到400 g/L,抗菌效价提高到8 000 U/mL以上。发酵终产品收率达10%,产品抗菌效价达8万U/g以上,产品中Plectasin含量达2%以上,实现了60 t罐规模的产业化稳定生产。
参考文献
[1] 田志梅,崔艺燕,杜宗亮,等.抗生素替代物在畜禽养殖中的研究及应用进展[J].动物营养学报,2020,32(4):1516-1525.
[2] KIM M K,KANG H K,KO S J,et al.Mechanisms driving the antibacterial and antibiofilm properties of Hp1404 and its analogue peptides against multidrug-resistant Pseudomonas aeruginosa[J].Scientific reports,2018,8(1):1-16.
[3] TING C H,CHEN Y C,CHEN J Y.Nile tilapia fry fed on antimicrobial peptide Epinecidin-1-expressing Artemia cyst exhibit enhanced immunity against acute bacterial infection[J].Fish & shellfish immunology,2018,81:37-48.
[4] 黄佳明,姜宁,张爱忠.基因工程菌生产抗菌肽的研究进展[J].微生物学通报,2019,46(3):654-659.
[5] 乔莹,王军,马笑晚,等.大黄鱼与美国红鱼抗菌肽Piscidin串联基因的构建、酵母表达及抗菌活性鉴定[J].厦门大学学报(自然科学版),2020,59(1):43-48.
[6] 邓赣奇,陈柏东,黄增颖,等.重组菌丝霉素在毕赤酵母中的分泌表达及活性研究[J].江苏农业科学,2020,48(18):86-91.
[7] MYGIND P H,FISCHER R L,SCHNORR K M,et al.Plectasin is a peptide antibiotic with therapeutic potential from a saprophytic fungus[J].Nature,2005,437(7061):975-980.
[8] YANG Y L,TENG D,ZHANG J,et al.Characterization of recombinant plectasin:Solubility,antimicrobial activity and factors that affect its activity[J].Process biochemistry,2011,46(5):1050-1055.
[9] 王少然.二硫键对菌丝霉素抗菌活性的影响及菌丝霉素聚体在毕赤酵母中的表达[D].北京:中国农业科学院,2011:27-36.
[10] 万津.菌丝霉素在毕赤酵母中的分泌表达及其对大鼠肠道健康和免疫功能的影響[D].雅安:四川农业大学,2015:13-45.
[11] 叶滔,杨静美,闫凯,等.菌丝霉素NZ2114基因在毕赤酵母中表达及中试发酵研究[J].饲料工业,2015,36(16):54-59.
[12] 万津,陈代文,余冰,等.重组菌丝霉素高密度发酵制备及其功效研究[J].农业生物技术学报,2015,23(12):1625-1631.
[13] 李延,万津,晨光,等.重组菌丝霉素发酵培养基筛选及重组菌丝霉素在断奶仔猪上的应用[J].动物营养学报,2016,28(1):208-216.
[14] 李连彬.菌丝霉素源抗菌肽对金黄色葡萄球菌乳腺炎的防治及其耐药产生机制的研究[D].杨凌:西北农林科技大学,2018:20-28.
[15] 张清娟,马炫炫,滕达,等.抗菌肽NZ2114对奶牛乳房炎源停乳链球菌的杀菌作用研究[J].中国畜牧兽医,2020,47(8):2603-2614.
[16] MA J L,ZHAO L H,SUN D D,et al.Effects of dietary supplementation of recombinant plectasin on growth performance,intestinal health and innate immunity response in broilers[J].Probiotics and antimicrobial proteins,2020,12(1):214-223.
