益生菌与益生元组合的筛选及体外发酵特性研究
2022-04-18李雅丽王默涵赵雯段素芳刘伟贤陈萌刘义凤段盛林洪维鍊
李雅丽,王默涵,赵雯,段素芳,刘伟贤,陈萌,刘义凤,段盛林*,洪维鍊*
1(中国食品发酵工业研究院有限公司,北京,100015) 2(功能主食创制与慢病营养干预北京市重点实验室,北京,100015)3(内蒙古伊利实业集团股份有限公司,内蒙古 呼和浩特,010110)4(内蒙古乳业技术研究院有限责任公司,内蒙古 呼和浩特,010110)
益生菌是对人体有益的微生物的统称,其中占比最大的是乳酸菌。乳酸菌能发酵碳水化合物产生大量乳酸,在自然界中的分布极其广泛,至今已发现至少18个属,共计200余种[1]。被人们熟知的乳酸菌主要集中在乳杆菌属、双歧杆菌属和链球菌属等[2]。除极少数外,绝大部分乳酸菌都被人体所必需,可定殖于人体肠道,具有抑制有害菌生长、改善肠道微环境、增强免疫系统功能等多种益生功能[3]。正因其显著促进人体健康的功能特性,联合国粮食及农业组织/世界卫生组织(Food and Agriculture Organization of the United Nations/World Health Organization,FAO/WHO)将乳酸菌定义为益生菌,广泛应用于食品工业[4]。在益生产品的开发中,制品中的乳酸菌必须达到足够的活菌数才能获得预期的益生功效,且需要确保其通过消化道后仍可大量存活[5]。此外,乳酸菌在肠道发酵产生的乳酸及其他短链脂肪酸可显著改善肠道微环境从而达到保健效果[6]。因此,如何促进乳酸菌增殖、产酸及其发酵特性研究成为食品研发工作者关注的重点。
益生元是指不可被人体消化利用但可选择性促进肠道益生菌增殖和代谢的碳水化合物,首次由国际“益生元之父”格伦·吉布索于1995年提出[7]。益生元对宿主肠道健康起重要作用,添加一定量的益生元可增强乳酸菌功能[8]。目前被广泛认可的益生元有低聚果糖和低聚半乳糖,其他益生元的研究虽然相对较少,但它们都具有人体不能分解但可被乳酸菌利用的特殊糖苷键。BOGER等[9]的研究表明,当以低聚果糖为唯一碳源时,唾液乳杆菌W57的生长情况较差,但低聚果糖可显著促进副干酪乳杆菌W20的生长增殖。可见,不同乳酸菌对特定益生元的嗜好性存在较大差异。
基于以上特性,益生菌与益生元结合使用的生物制剂或微生态制剂又被称为合生元[10]。合生元以协同增效的形式相结合,益生元为益生菌提供营养,选择性刺激其生长、激活代谢,赋予益生菌在肠道中的竞争优势,从而有益地影响宿主[11]。研究结果显示,补充合生元能够提高益生菌通过消化道时的存活率,使之更有效地定殖于结肠[12]。因此,合生元常被用做膳食补充剂添加于各类食品中,用于维持肠道稳态和人体微生态健康。
由于益生菌对益生元嗜好性的不同,为探究合生元的最佳组合,本研究选择乳双歧杆菌BL-99、婴儿双歧杆菌YLGB-1496、副干酪乳杆菌K56、副干酪乳杆菌ET-22等4种益生菌,及低聚半乳糖、低聚果糖、棉子糖、低聚木糖、低聚甘露糖、水苏糖、低聚异麦芽糖、异构化乳糖、乳糖、抗性糊精、聚葡萄糖、塔格糖等12种益生元,通过微生物菌落自动化工作站高通量筛选生长速率较为典型的组合。4株实验菌株均已在先前研究中进行菌种水平鉴定研究[13-14],为对照其益生作用,本研究引入市售经典益生菌菌株乳双歧杆菌BB-12和鼠李糖乳杆菌LGG作为对比。分析各典型组合中益生元对益生菌的促增殖和促产酸能力,通过测定益生元的降解率及发酵液中代谢产物乙酸、乳酸的浓度分析各组合体外发酵特性,以期为合生元产品配伍及食品开发奠定数据基础。
1 材料与方法
1.1 材料与试剂
1.1.1 益生菌及益生元
研究所用益生菌及益生元样品信息如表1所示。
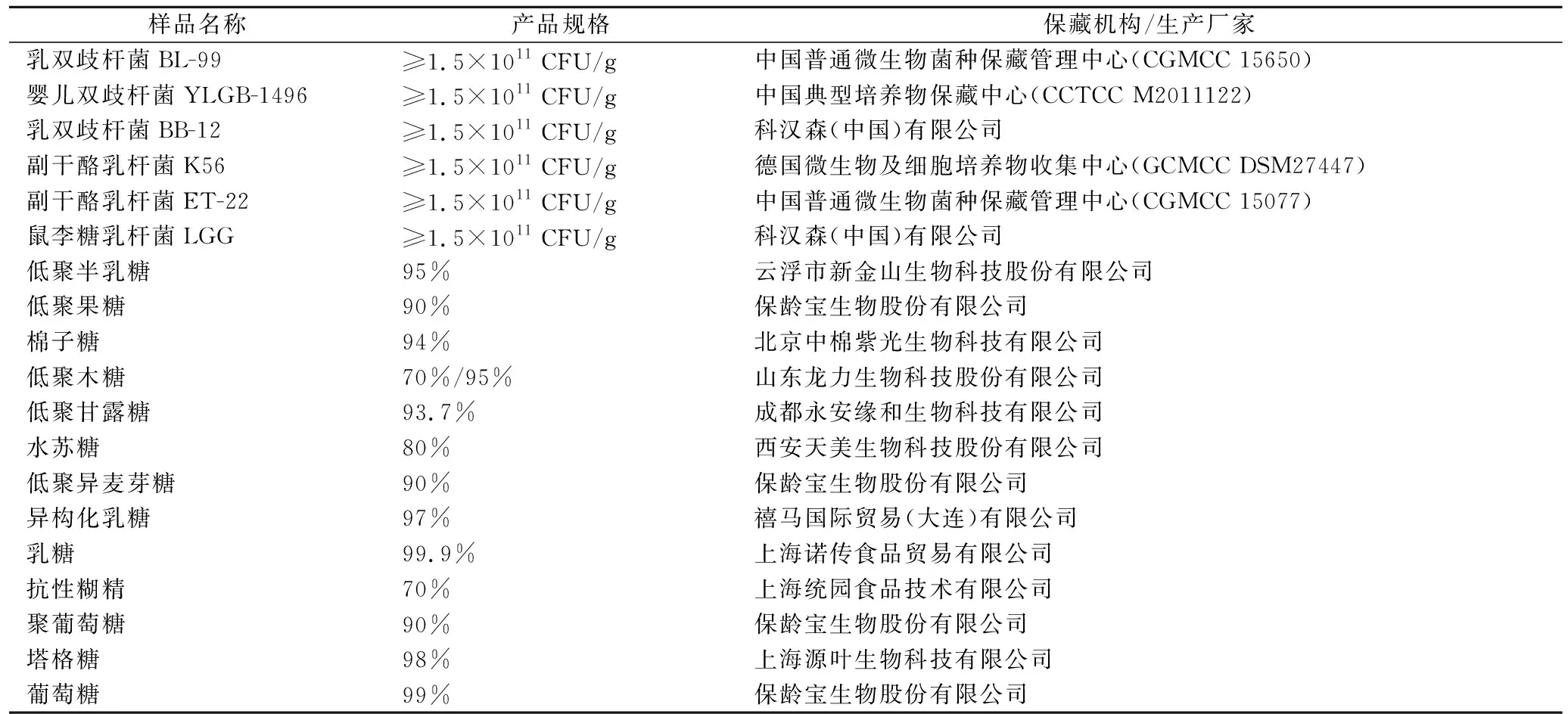
表1 益生菌及益生元样品信息Table 1 Sample information of probiotics and prebiotics
1.1.2 试剂
NaCl、甲酸、正丁醇、3,5-二羟基甲苯、乙醇、浓硫酸,均为分析纯,天津永大化学试剂有限公司;蛋白胨、牛肉粉、酵母粉、葡萄糖、吐温80、K2HPO4·7H2O、CH3COONa·3H2O、柠檬酸三铵、MgSO4·7H2O、MnSO4·4H2O、琼脂粉,国药集团化学试剂有限公司;乙酸、乳酸、丙酸、异丁酸、丁酸标准品,均为色谱纯,西格玛奥德里奇(上海)贸易有限公司。实验用水符合GB/T 6682—2016《分析实验室用水规格和试验方法》一级水指标。
1.2 仪器与设备
FE20型pH计、AL204型电子天平,梅特勒-托利多仪器有限公司;Blue Pard隔水式培养箱,上海一恒科学仪器有限公司;DL-CJ-2 ND I型洁净工作台,北京东联哈尔仪器制造有限公司;Spectra Max i3酶标仪,美谷分子仪器(上海)有限公司;2010 Plus气相色谱仪,岛津仪器有限公司;Rotor HDA微生物菌落自动化工作站,英国Singer公司。
1.3 实验方法
1.3.1 培养基的配制
计数培养基:MRS液体培养基。参照GB 4789.35—2016《食品安全国家标准 食品微生物学检验 乳酸菌检验》配制。
活化培养基:改良的MRS液体培养基。将原MRS培养基的缓冲剂乙酸钠用2.0 g/L Na2HPO4·12H2O代替,避免发酵过程中由于缓冲体系产生乙酸而影响发酵代谢产物分析。同时加入0.5 g/LL-半胱氨酸盐酸盐作为还原剂保证菌落生长的厌氧环境。
增殖固体培养基:向不含葡萄糖的活化培养基中加入琼脂至15 g/L,121 ℃高压灭菌15 min;配制0.4 g/mL的益生元母液(益生元浓度均按照有效纯度计算),无菌操作下过0.22 μm滤膜后分别加入灭菌培养基中至5 mg/mL;倒入Singer Rotor HAD高通量筛选设备中待用。
发酵液体培养基:不含葡萄糖的活化培养基121 ℃高压灭菌15 min后,分装于15 mL离心管中,按照增殖固体培养基的相同方法配制以各益生元为单一碳源的液体培养基。
1.3.2 菌种活化
将冷冻保藏的0.1 g益生菌冻干粉接入活化培养基中,充分振荡使菌体混合均匀,厌氧条件下37 ℃振荡培养24 h。所得菌液按体积分数10%接入新的活化培养基,37 ℃厌氧培养24 h,得到菌种母液。
1.3.3 不同培养基中益生菌生长曲线的高通量测定
将108CFU/mL活化后的菌液接入96孔母板,微生物菌落自动化工作站将母板样品对应接种至增殖固体培养基,而后置于37 ℃中厌氧培养,每隔一定时间拍照分析菌落尺寸,各菌落尺寸随时间变化的曲线即为该菌的生长曲线,生长曲线的斜率为该菌的生长速率。
1.3.4 益生元对益生菌促增殖及促产酸能力的测定
将活化后的菌液按体积分数1%接入发酵液体培养基中,厌氧条件下37 ℃连续培养48 h,分别于第0、6、20、30、48 h测定OD600值和pH值,并以不含碳源的发酵液体培养基为阴性对照,以未接种菌液的发酵液体培养基为空白对照,以葡萄糖为唯一碳源的发酵液体培养基为阳性对照,分析发酵过程中益生元对益生菌促增殖和促产酸能力的影响。
1.3.5 益生元降解率的测定
参照GB 4789.34—2016《食品安全国家标准 食品微生物学检验 双歧杆菌检验》附录B糖降解率检测:薄层色谱法中的方法进行。以甲酸∶正丁醇∶水=6∶4∶1(体积比)为展开剂,准确称取900 mg 3,5-二羟基甲苯溶于25 mL水中,加入375 mL无水乙醇,冰浴中缓慢加入50 mL浓硫酸,作为显色剂,点样0.2 μL进行薄层层析。用TLC软件对层析图进行处理,生成Excel文件。益生元的降解率按公式(1)计算:
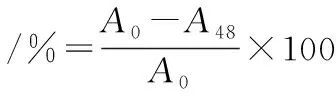
(1)
式中:A0, 0 h的灰度平均值;A48,48 h的灰度平均值。
1.3.6 代谢产物的测定
分别测定各组合0、6、12、24、30 h发酵液中乙酸和乳酸浓度。准确吸取2 mL发酵液于2 mL 的0.25 g/mL磷酸溶液中,振荡混匀,静置半小时后通过0.22 μm滤器注入进样瓶,通过气相色谱分析乙酸和乳酸产量。分别配制质量浓度为1、100、200、300、400、500 μg/mL的乙酸标准溶液和质量浓度为1、10、20、30、40 mg/mL的乳酸标准溶液。气相色谱载气(氮气)流速1.0 mL/min,进样口和检测器温度均为240 ℃,进样量1 μL,起始柱温90 ℃,保留0.5 min后10 ℃/min升温至110 ℃保留2 min,6 ℃/min升温至130 ℃保留0 min,10 ℃/min升温至200 ℃保留5 min,15 ℃/min升温至230 ℃保留2 min,方法共计23.83 min。得到乙酸和乳酸的标准曲线分别为:y=33 794x-1 590.5(R2=1)和y=20 853x+267.46(R2=1)。
1.4 数据统计分析
本研究的所有组合均设计了2个生物学重复并进行平行测定。数据使用SPSS 22.0进行单因素方差分析和Duncan法多重比较,以P<0.05表示差异显著。图片均采用Excel 2016 软件绘制。
2 结果与分析
2.1 益生菌与益生元组合的体外筛选
2.1.1 不同培养基中益生菌生长曲线的高通量测定
微生物菌落自动化工作站各培养基中益生菌生长速率如表2所示。使乳双歧杆菌BL-99生长速率较快的益生元有低聚果糖、水苏糖、低聚异麦芽糖、乳糖;使婴儿双歧杆菌YLGB-1496生长速率较快的益生元有乳糖;使乳双歧杆菌BB-12生长速率较快的益生元有低聚异麦芽糖;使副干酪乳杆菌K56生长速率较快的益生元有棉子糖、低聚甘露糖、水苏糖、异构化乳糖、乳糖;使副干酪乳杆菌ET-22生长速率较快的益生元有水苏糖;使鼠李糖乳杆菌LGG生长速率较快的益生元有低聚甘露糖、水苏糖。综合来说,本研究中的4株实验菌种与益生元组合后,与商业益生菌相比,最大生长速率均高于乳双歧杆菌BB-12,而与鼠李糖乳杆菌LGG相比,仅乳双歧杆菌BL-99与乳糖或水苏糖组合的生长速率可与之相当,其余3株菌的生长速率均低于鼠李糖乳杆菌LGG。
益生元促进益生菌生长增殖的机理是菌体可通过分泌相关酶将益生元分解为基础营养物质,以促进其生长繁殖与代谢[15]。由于每种益生菌含有的基因不同导致表达产生的酶系不同,因而对不同益生元的嗜好性差异较大,即体现出不同的生长速率。即使是同种菌株(如本研究中的乳双歧杆菌BL-99和婴儿双歧杆菌YLGB-1496、副干酪乳杆菌K56和副干酪乳杆菌ET-22)基因数量、分泌酶活性和利用方式也可能不同而反映出对同一益生元的利用效率不同[16]。同属双歧杆菌的3株益生菌均在以聚葡萄糖为唯一碳源的培养基中均无法生长,在以塔格糖为唯一碳源的培养基中生长速率也很低,而副干酪乳杆菌和鼠李糖乳杆菌则可以生长,表明不同属的益生菌代谢途径和分泌酶系不同。而同属双歧杆菌的乳双歧杆菌BL-99和婴儿双歧杆菌YLGB-1496生长趋势类似,但生长速率仍存在差异,体现出益生菌对益生元嗜好性筛选的必要性。
高通量筛选、计算生长速率作为一种便捷筛选和精简测试组数的手段,基于以上结果和市场上常见复配组合,进一步选择乳双歧杆菌BL-99与低聚果糖、低聚木糖、乳糖、水苏糖的组合,婴儿双歧杆菌YLGB-1496与低聚半乳糖、异构化乳糖、乳糖、水苏糖的组合,副干酪乳杆菌K56与低聚甘露糖、低聚半乳糖、低聚木糖、水苏糖的组合,副干酪乳杆菌ET-22与低聚甘露糖、低聚半乳糖、低聚木糖、水苏糖的组合进行后续实验。
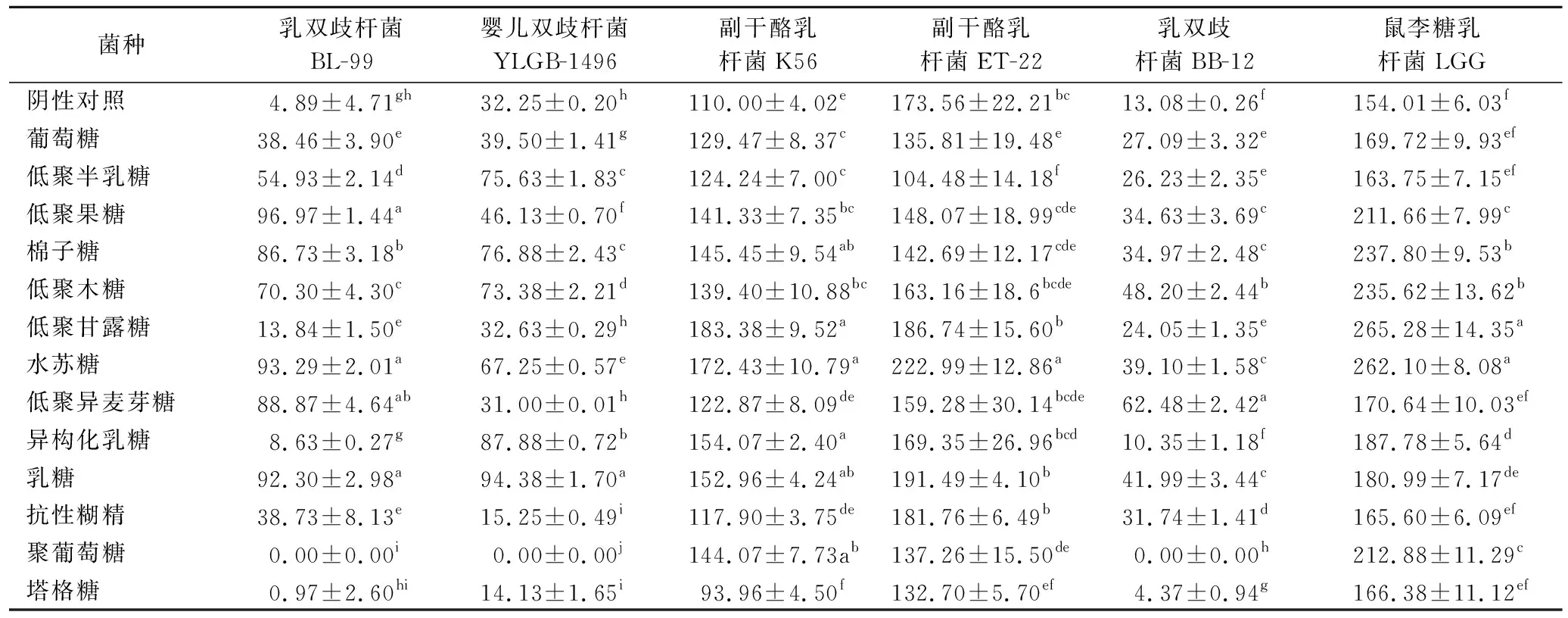
表2 不同益生元对益生菌生长速率的影响 单位:h-1
2.1.2 益生元对益生菌促增殖能力分析
益生元对益生菌的促增殖能力通常以发酵液的OD600值作为指标以评价菌体数量,结果如图1所示。相较于阴性对照,4种益生元均对益生菌有显著促增殖作用,且4种益生元作用效果有显著差异。对乳双歧杆菌BL-99促增殖效果较好的益生元是低聚果糖与乳糖;对婴儿双歧杆菌YLGB-1496促增殖效果较好的益生元是低聚半乳糖与乳糖,而异构化乳糖起效速度略慢;对副干酪乳杆菌K56促增殖效果较好的益生元是低聚半乳糖;对副干酪乳杆菌ET-22促增殖效果较好的益生元是水苏糖与低聚半乳糖。
与本研究结果类似,PÉREZ-CONESA等[17]研究也发现低聚半乳糖和低聚果糖能促进多种双歧杆菌的生长,这可能与双歧杆菌属可产生β-呋喃果糖苷酶和β-半乳糖苷酶且活性较高有关。低聚半乳糖也可极大地促进本研究中2种副干酪乳杆菌的增殖,表明它们也可产生高活性的半乳糖苷酶,而副干酪乳杆菌ET-22可能因为高产α-半乳糖苷酶而可以高效利用水苏糖[16]。
2.1.3 益生元对益生菌促产酸能力分析
益生菌在代谢益生元快速生长的同时会产生短链脂肪酸,能有效降低培养环境的pH值[18]。在人体中,适宜的肠道微环境pH值有助于维持益生菌的黏附能力,直接促进它的定殖和生长,肠道微环境pH值的降低也可通过抑制有害菌的生长增殖而间接促进乳酸菌的生长繁殖[19]。
如图2所示,相较于阴性对照,4种益生元均对益生菌有显著促产酸作用,且4种益生元作用效果有显著差异。4种益生元对实验菌种的促产酸规律与促增殖规律基本一致,即对乳双歧杆菌BL-99促产酸效果较好的益生元是低聚果糖与乳糖;对婴儿双歧杆菌YLGB-1496促产酸效果较好的益生元是低聚半乳糖与乳糖,异构化乳糖起效速度略慢;对副干酪乳杆菌K56促产酸效果较好的益生元是低聚半乳糖;对副干酪乳杆菌ET-22促产酸效果较好的益生元是水苏糖,低聚半乳糖、低聚甘露糖与低聚木糖促产酸效果差异不显著。由促生长效果数据分析,低聚甘露糖对副干酪乳杆菌ET-22的促生长效果好于低聚木糖,但促产酸效果差异不显著,说明低聚甘露糖促进菌落生长的同时主要产生的可能是酸类物质以外的代谢产物。
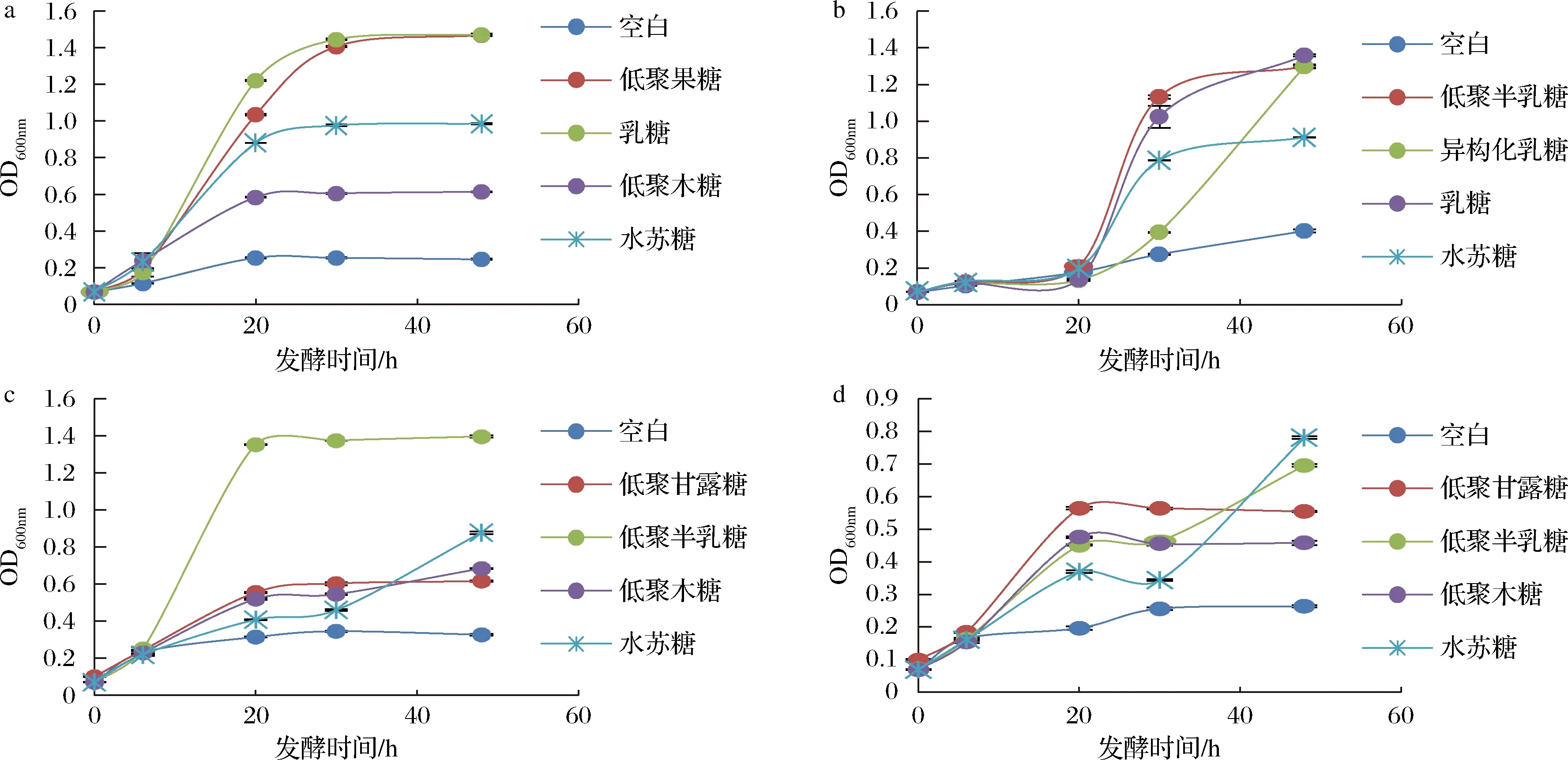
a-双歧杆菌BL-99;b-婴儿双歧杆菌YLGB-1496;c-副干酪乳杆菌K56;d-副干酪乳杆菌ET-22图1 不同益生元对益生菌OD600值的影响Fig.1 Effect of different prebiotics on the OD600 nm of probiotics
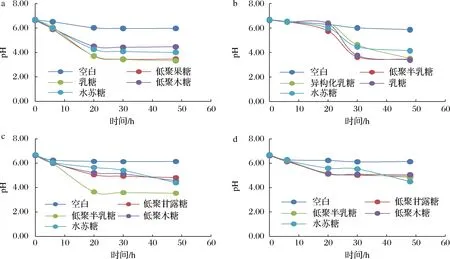
a-双歧杆菌BL-99;b-婴儿双歧杆菌YLGB-1496;c-副干酪乳杆菌K56;d-副干酪乳杆菌ET-22图2 不同益生元对益生菌pH值的影响Fig.2 Effect of different prebiotics on the pH value of probiotics
2.2 不同合生元组合的体外发酵特性研究
2.2.1 不同益生菌对益生元的降解率
采用薄层色谱法分析不同益生菌对益生元的降解率。研究中使用的益生元均为单糖或多糖类物质,可与3,5-二羟基甲苯结合显色,而有机酸等代谢产物无法与该显色剂结合。以0 h未发酵的原培养液为阴性对照,发酵48 h的培养液与阴性对照相比若灰度降低则表明糖原被降解。几种特征组合中益生元降解率的薄层色谱图如图3所示。低聚果糖、低聚半乳糖、低聚甘露糖、低聚木糖是多种聚合度的混合物,在薄层色谱上会显示多个点位,与两侧的阴性对照相比,各组合中的益生元被不同程度降解,且不同益生元作用有显著差异。
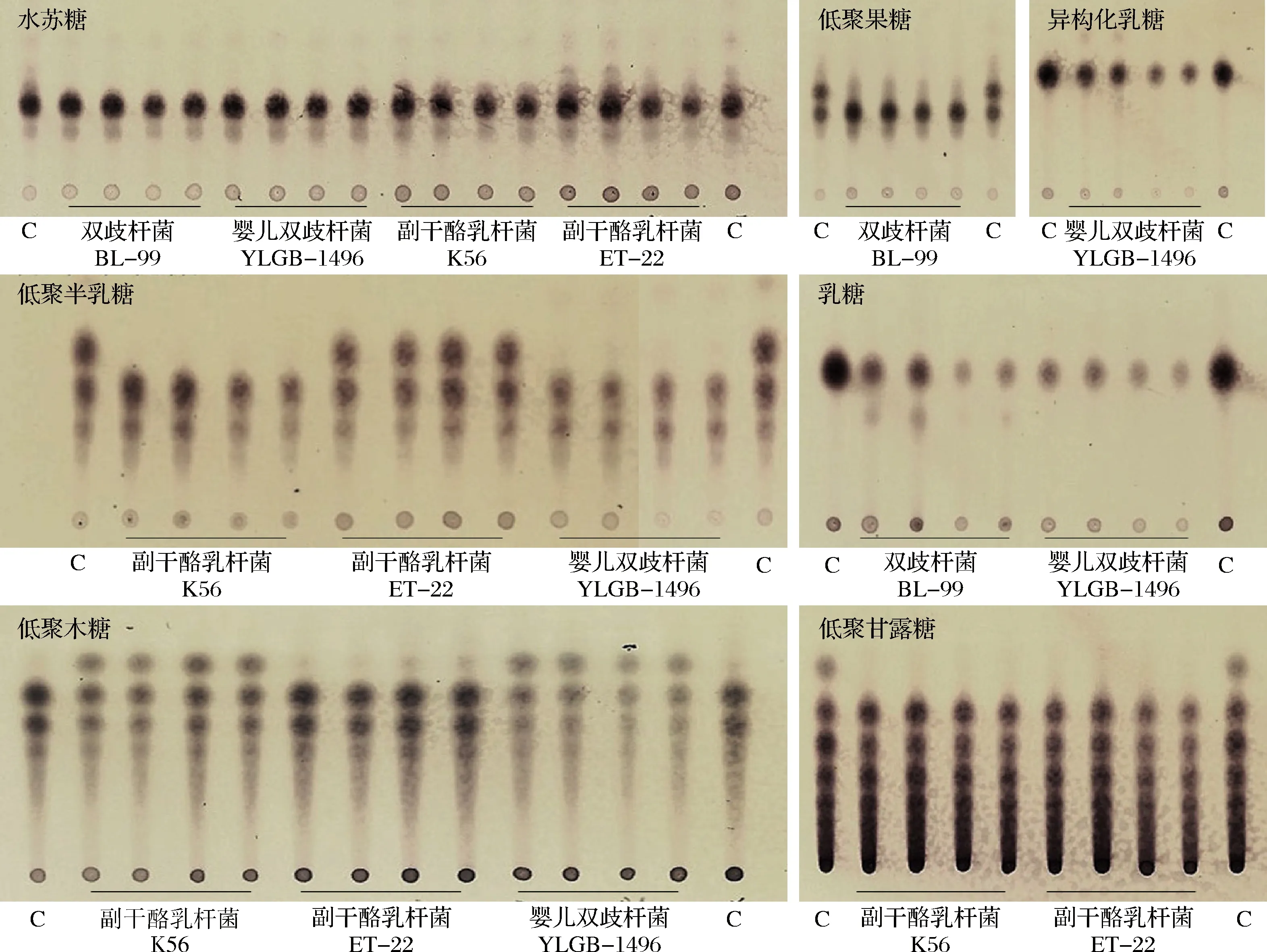
图3 四株益生菌对不同益生元的代谢降解率(薄层色谱图)Fig.3 Metabolic degradation rate of different prebiotics by four strains of probiotics(thin layer chromatogram)注:C表示0 h未发酵的原培养液,即阴性对照;中间为发酵48 h的培养液;每个菌株点2个重复样品,每个样品点2次平行
扫描后的图片经TLC软件处理可以得到各列灰度的平均值,按照1.3.5中的方法来量化益生元的降解率,结果如表3所示。乳双歧杆菌BL-99和婴儿双歧杆菌YLGB-1496对乳糖的降解率最高,对水苏糖的降解率最低,副干酪乳杆菌K56对益生元的降解率从高到低依次为低聚半乳糖、低聚甘露糖、低聚木糖、水苏糖,而副干酪乳杆菌ET-22对益生元的降解率从高到低依次为低聚甘露糖、低聚半乳糖、水苏糖、低聚木糖,表现出不同副干酪乳杆菌菌株对相同益生元的代谢速率不同。

表3 不同益生菌对益生元的降解率 单位:%
2.2.2 发酵代谢产物分析
表4列出了部分实验菌株对应的嗜好益生元发酵体系,经过48 h发酵,发酵液中乙酸及乳酸的最大产生量。由表4可知,不同的益生元对菌株的促产乙酸及乳酸效果显著不同。如乳糖对于双歧杆菌BL-99产生乳酸效果非常显著,但低聚木糖对于双歧杆菌BL-99产生乙酸效果更好。低聚半乳糖对于副干酪乳杆菌K56、副干酪乳杆菌ET-22产生乳酸效果非常显著,但水苏糖、低聚木糖对于2种菌产乙酸效果更好。综合乙酸和乳酸的最大产生量,得到乳双歧杆菌BL-99与乳糖组合的生长效果较好,而婴儿双歧杆菌YLGB-1496、副干酪乳杆菌K56、副干酪乳杆菌ET-22则与低聚半乳糖组合的生长效果较好,乳双歧杆菌BL-99和副干酪乳杆菌K56的结果与益生元降解率的结果相同,而副干酪乳杆菌ET-22与低聚甘露糖虽然有最大降解率,但乙酸和乳酸的产生量不及低聚半乳糖,这与促增殖、促产酸的结果相似,印证了副干酪乳杆菌ET-22与低聚甘露糖组合可能产生更多的是乙酸及乳酸以外的物质。
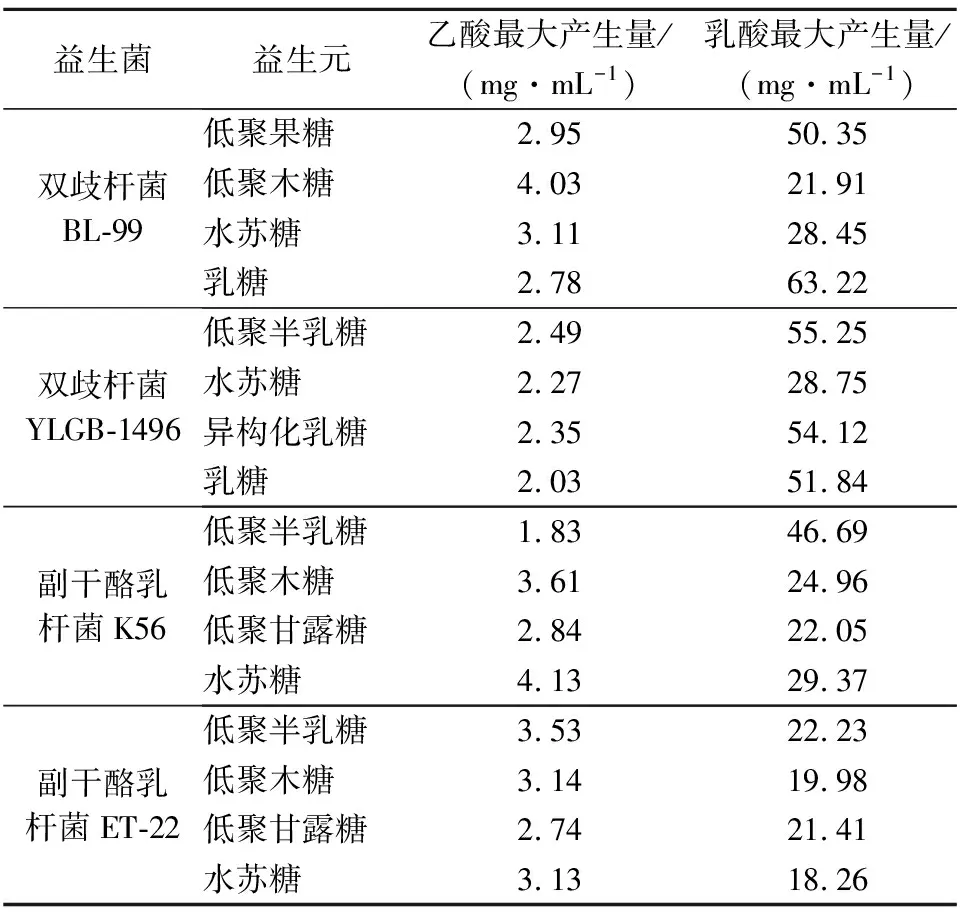
表4 益生元对益生菌发酵体系中乙酸及乳酸最大产量的影响Table 4 Effect of prebiotics on the maximum yield of acetic acid and lactic acid in the fermentation system of probiotics
3 结论
本研究通过微生物菌落自动化工作站高通量筛选、促增殖及促产酸能力分析、益生元降解率分析、发酵代谢产物分析等方法,研究了双歧杆菌BL-99、婴儿双歧杆菌YLGB-1496、副干酪乳杆菌K56、副干酪乳杆菌ET-22共4株益生菌与12种益生元的体外发酵特性,得到了差异显著的实验结果。考虑到体外生长速率、促产酸及促增殖能力评价对益生菌、益生元组合的体外筛选具有一定局限性,故以发酵代谢产物及益生元降解率为主要评价指标,得到乳双歧杆菌BL-99与乳糖组合的效果较好,婴儿双歧杆菌YLGB-1496、副干酪乳杆菌K56、副干酪乳杆菌ET-22与低聚半乳糖组合的效果较好,且与商业菌株乳双歧杆菌BB-12和鼠李糖乳杆菌LGG相比,本研究中的益生菌具有相当甚至更高的生长速率,可为本实验中菌株的后续研究与产品开发提供基础数据支持。