真菌β-1,3-葡聚糖基转移酶研究进展
2022-04-18付鑫朱鸿安崔凤杰昝新艺孙文敬
付鑫,朱鸿安,崔凤杰,2 *,昝新艺,孙文敬,2
1(江苏大学 食品与生物工程学院,江苏 镇江,212013) 2(江西省德兴市百勤异VC钠有限公司,江西 德兴,334299)
葡聚糖是一大类由α/β-1,3、1,4或1,6-糖苷键连接葡萄糖单体形成的大分子多聚体,作为植物和真菌细胞壁的重要结构组分之一,在维持细胞形状和完整性、保护细胞免受内部膨胀压力和外部环境的影响等方面发挥关键性作用[1]。常见的β-1,3-葡聚糖包括可得然胶、普鲁兰多糖、昆布多糖、酵母细胞壁葡聚糖和香菇多糖等。真菌葡聚糖的免疫调节活性受到分子质量、构型、支链及分支度等的显著影响,特别是含有β-1,3-链接的主链、β-1,6-链接的侧链的葡聚糖具有良好的水溶性、免疫增强、调节肠道菌群和降血糖等功能[2]。MORALES等[3]发现,香菇子实体中含有β-1,6-的葡聚糖G1、β-1,3/1,6-的葡聚糖G2和α-1,3-的葡聚糖G3,其中G1具有较高的抗氧化活性。
当前,葡聚糖的合成途径还未被系统地研究和阐明,但基因组学、分子遗传学等学科的发展,很大程度加快了对真菌葡聚糖合成途径和结构重构机制的认知。有关真菌葡聚糖生物合成的研究主要集中在菌体结构相对简单、遗传操作效率相对较容易的酿酒酵母(Saccharomycescerevisiae)、构巢曲霉(Aspergillusnidulans)和粗糙脉孢菌(Neurosporacrassa)等低等真菌中[4-5]。以酿酒酵母葡聚糖的合成为例,通常认为,胞外葡萄糖被摄入后经过糖磷酸转移酶系统(phosphotransferase system,PTS)转化为葡萄糖-6-磷酸;进而通过葡萄糖-6-磷酸变位酶将其异构为葡萄糖-1-磷酸;再由UDP-葡萄糖焦磷酸化酶催化合成为UDP-葡萄糖,经葡聚糖合成酶将其转移到葡聚糖主链的非还原端合成β-葡聚糖。新合成的β-葡聚糖经特定糖基转移酶和水解酶的共同作用进行重构、交联,形成不同分子量和分支结构的β-葡聚糖,与壳聚糖等共同构成细胞壁[6]。目前已有GH16、GH17和GH72等家族的糖基水解酶或者糖基转移酶被证明在细胞壁组分的交联中发挥作用。其中,GH16 家族水解酶(β-葡聚糖酶)主要参与葡聚糖和几丁质的交联,GH17 家族水解酶(β-葡聚糖酶)在葡聚糖之间的交联中起作用,GH76 家族的甘露聚糖酶在细胞壁的生物发生中起作用,而GH72家族的β-1,3-葡聚糖转移酶则被认为通过形成多分支的β-1,3-葡聚糖,主要参与细胞壁的重构。这些细胞壁重构酶中,属于GH72 家族的β-1,3-葡聚糖转移酶为重塑细胞壁的结构做出了重要的贡献。因此,本文就近年来GH72 家族的β-1,3-葡聚糖转移酶领域的主要研究结果进行综述和展望。
1 β-1,3-葡聚糖基转移酶及其分类
糖基转移酶是指将单糖共价连接到多种有机底物上的一大类酶,这些酶驱动复杂的寡糖的合成,在细胞的整个生命周期中起着关键作用。β-1,3-葡聚糖基转移酶能够以β-1,3-糖苷键连接的葡聚糖为转糖苷的受体和供体,通过转糖苷作用生成新的糖苷键[7]。
GH72家族 β-1,3-葡聚糖基转移酶是指能够以β-1,3-糖苷键连接的葡聚糖为转糖苷的受体和供体的一类葡聚糖基转移酶,其通过内部切割 β-1,3-葡聚糖,将新生成的还原端转移到另一个 β-1,3-葡聚糖分子的非还原端,使受体和供体分子之间产生新的 β-1,3-键,延伸和分支 β-1,3-葡聚糖的糖链[7-8]。截止目前,来源于细菌、丝状真菌及酵母的 157种蛋白被鉴定为β-1,3-葡聚糖基转移酶家族成员,均属于糖基化磷脂酰肌醇(glycosyl phosphatidylinositol, GPI)锚定的膜蛋白[9-10]。常见的β-1,3-葡聚糖基转移酶主要为烟曲霉、酿酒酵母和白色念珠菌中的同源基因Gel、Gas和Phr编码的蛋白。
GH72家族成员包括72+和72-两个亚家族(图1),均含有1个GH72结构域和1个连接区,GH72结构域包含2个对催化至关重要的保守谷氨酸残基和3个保守的酪氨酸残基。对其家族的蛋白质序列的多重比对发现,除了典型的催化结构域外,72+和72-亚家族的区别主要在于其C-端是否有无半胱氨酸的碳水化合物结合模块(carbohydrate-binding module family 43,CBM43,在Pfam数据库中又被注释为X8结构域)[11]。GH72+亚家族同时拥有GH72结构域和CBM43域;GH72-亚家族缺少CBM43/X8,其在C-末端有1个低复杂性区域。尽管二者存在区别,但GH72+和 GH72-均表现出相同的体外转糖苷酶的活性,这也提示CBM43域在 GH72+酶的催化过程中起到更微妙的作用。在一些GH72家族成员中,在 C -端 GPI 连接信号之前的 C-端区域中存在1个高度O-甘露糖基化且对活性是可有可无的富含丝氨酸/苏氨酸的区域(Ser/Thr-box)。另外,GH72酶还共享1个由规则间隔的半胱氨酸残基组成的保守模式,这些残基形成分子内的二硫键。在GH72+亚家族中,存在2个二硫键簇:簇I由3个二硫键组成,涉及GH72结构域和连接区保守的半胱氨酸残基,簇II由4个二硫键组成,连接位于CBM43/X8的半胱氨酸残基。而在GH72-酶中缺少簇II,这表明GH72结构域和CBM43构成了一个完整的结构和功能单元[12]。只有GH72+蛋白(如Gas1p、Gas2p和AfGel4p)具有延长和分支活性,而GH72-酶(如Gas5p、AfGel1p和AfGel2p)具有延长而不具有分支活性,表明CBM43对于正确识别催化底物、定位催化位点和形成分支结构必不可少[13]。
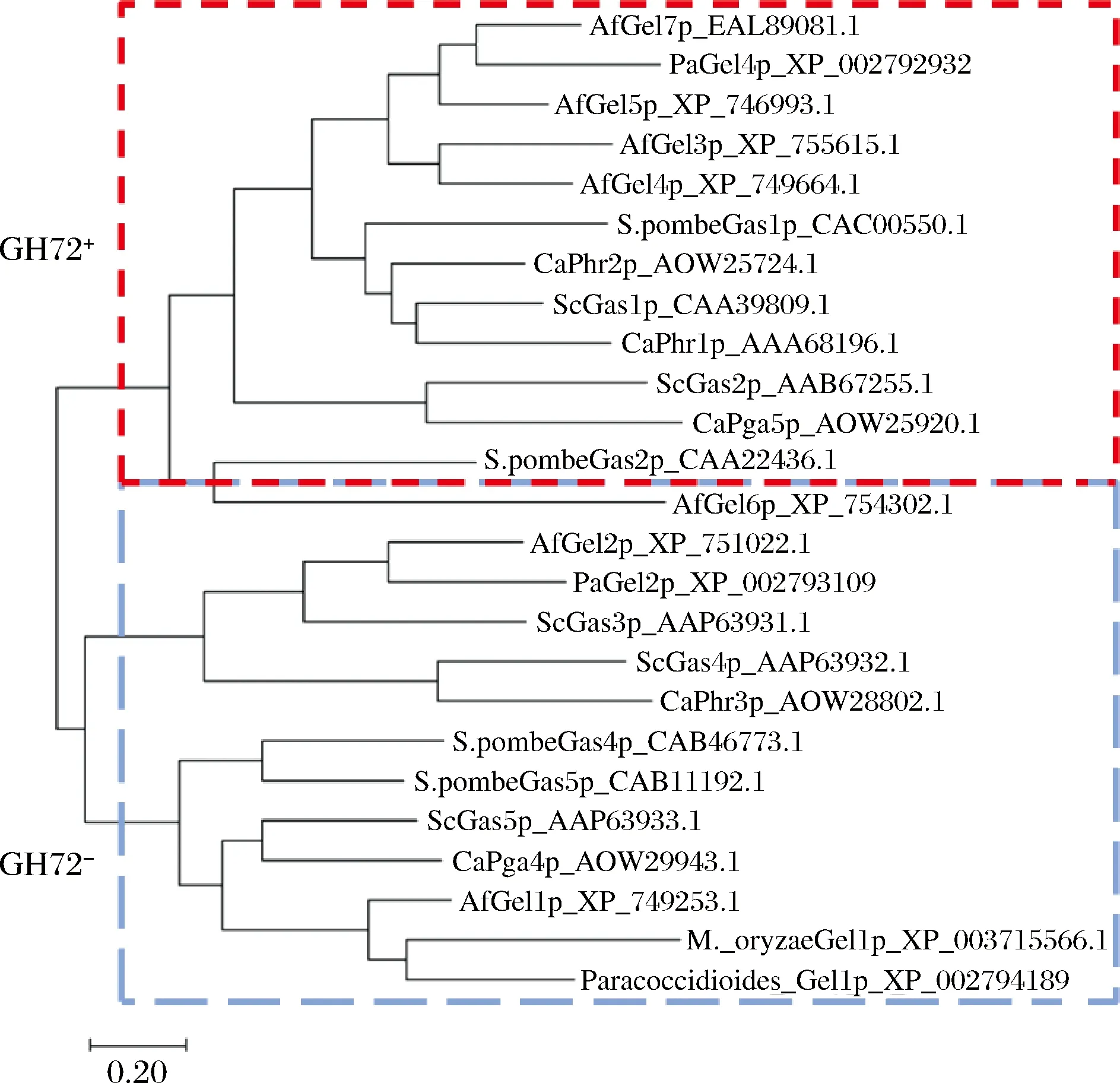
图1 GH72家族系统发育树Fig.1 Phylogenetic tree of GH72 family
2 真菌β-1,3-葡聚糖基转移酶
2.1 烟曲霉β-1,3-葡聚糖基转移酶Gel家族
烟曲霉(Aspergillusfumigatus)的细胞壁构成主要是由 β-1,3-葡聚糖聚合物作为骨架,β-1,6分支点的支链葡聚糖作为侧支,共价结合甲壳素、半乳甘露聚糖等其他组分[14]。GH72家族 β-1,3-葡聚糖基转移酶在葡聚糖内切割糖链,并将新产生的还原端转移到另一个β-1,3-葡聚糖分子的非还原端,实现其β-1,3-葡聚糖链的延长[14]。烟曲霉含有编码GH72家族蛋白的7个基因Gel1~Gel7;其中Gel1(AFUA_2G01170)、Gel2(AFUA_6G11390)、Gel6(AFUA_3G13200)属于GH72-亚家族,Gel3 (AFUA_2G12850)、Gel4(AFUA_2G05340)、Gel5(AFUA_8G02130)、Gel7(AFUA_6G13200)属于GH72+亚家族。Gel1、Gel2和Gel4等3个基因在一系列的生长条件下,在菌丝生长过程中组合型表达,分别对葡聚糖的合成、菌丝形态发生、细胞壁完整性和致病能力等有着不同程度的影响[15]。在烟曲霉细胞壁中分离得到 β-1,3-葡聚糖基转移酶Gel1p,克隆和测序编码该酶的Gel1基因,结果表明,纯化重组的GEL1p 通过GPI以与酵母同源蛋白相似的方式附着在烟曲霉细胞膜[16]。Gel1p在体外催化β-1,3-葡聚糖基转移酶的两步反应:首先,切断供体β-1,3-葡聚糖链的内部糖苷键,释放还原部分;然后将新的还原端转移到受体 β-1,3-葡聚糖链的非还原端,从而延长其长度。Gel2p与Gel1p类似,属于GPI锚定蛋白,包含4个内含子、5个N-糖基化位点,也具有 β-1,3-葡聚糖基转移酶活性。有研究表明,Gel1p与Gel2p都能够补充酿酒酵母中 ΔGas1p的缺失,充分证实了Gel1p、Gel2p与Gas1p具有类似的催化功能。然而,Gel1的缺失不会导致表型的改变,而ΔGel2突变体和ΔGel1ΔGel2双突变体则表现出生长缓慢、分生孢子发生异常和细胞壁组成变化的现象。
烟曲霉Gel4p含有碳水化合物结合域CBM43[17],具有延伸 β-1,3-葡聚糖和分支糖链的双重功能[18]。敲除Gle4会导致β-1,3-葡聚糖分支的消失,进而影响菌株生长。Gel4p在所有生长时期表达量最多。通过构建插入了Gel4 ORF的含有潮霉素抗性标记的敲除盒用于转化烟曲霉原生质体,但未能成功获得突变体,提示Gel4是其生长过程中必不可少的基因[17]。
β-1,3-葡聚糖基转移酶的正常活性表达需要N-糖基化。N-糖基化缺失显著下调突变株的细胞壁中 β-葡聚糖含量。为验证这一功能,在ΔCwh41突变体中缺失编码 β-1,3葡聚糖基转移酶基因Gel1或Gel2的基因,构建双突变体ΔGel1ΔCwh41或ΔGel2ΔCwh41,其生长表型与单突变体 ΔCwh41 相似,表明 Gel1和 Gel2是主要受ΔCwh41 中N-糖基化加工缺陷影响的蛋白质。通过定点突变去除了突变体ΔGel1Gel1-NMΔGel2Gel2-NM中Gel1p或Gel2p上所有潜在的N-糖基化位点后,其表现出与单一突变体ΔGel1或ΔGel2相似的表型。因此,N-糖基化对于 Gel1p 或 Gel2p 发挥功能必不可少[19]。
烟曲霉Gel7p是一种带有N-末端连接碳水化合物的锚定蛋白,主要通过GPI锚定结合到细胞膜和细胞壁上,不受N-糖基化的影响,这表明在N-糖链加工缺陷的突变体中,Gel7可能参与维持N-糖链加工缺陷突变体细胞壁的完整性,特别是在高温条件下。在突变菌株 ΔCwh41或 ΔGel1ΔCwh41中进一步敲除Gel7,导致其异常分生,细胞壁 β-1,3-葡聚糖含量显著减少,萌发延迟;与野生株相比,ΔGel7在37 ℃时 β-葡聚糖和甲壳素的含量分别下降了21.5%和11.1%,50 ℃时β-葡聚糖和甲壳素的含量分别下降了25.6%和26.2%[20]。同时Gel7是烟曲霉分生孢子发生所必需的,Gel7p与Gel1p和Gel2p的序列相似,包括催化区FF(A/S)GNEV(用于催化酸碱)和F(F/L)(S/A)EYGCN(用于亲核残基)的两个保守的天冬氨酸残基,表明Gel7p也具有 β-1,3-糖基转移酶活性[21]。在菌丝萌发阶段Gel2和Gel7的表达量显著提高,在菌丝生长阶段它们的表达则被抑制;Gel1则在菌丝生长阶段被诱导表达,表明在菌丝生长发育过程中Gel1、Gel2和Gel7的表达均受到一定程度的调节,其在不同时期表现出不同的功能。据此可推测,Gel7是烟曲霉分生孢子发生所必需的,同时在ΔGel7中可明显诱导出Gel1~Gel6,表明Gel家族之间存在着密切的联系。
2.2 副球孢子菌Paracoccidioides β-1,3-葡聚糖基转移酶Gel家族
副球孢子菌ParacoccidioidesGel家族Gel1p(XP_002794189)和Gel2p(XP_002793109)属于GH72-亚家族,Gel4p(XP_002792932)属于GH72+亚家族。Gel1p、Gel2p和Gel4p具有相同的保守序列,其N-端相连的信号肽序列以及C端相连的GPI锚定区域与GH72蛋白家族中存在的保守结构域相同。其中Gel3p还包含1个Cys-Box的结构域,该结构域包含6个保守的半胱氨酸残基[12]。研究结果表明,Gel1p与细胞壁合成密切相关,Gel2p可能在细胞质中合成,与细胞壁形成相关。遗传互补研究显示,Gel2p能够恢复ΔGas1突变体中Gas1p活性的缺失,提示其参与维持真菌细胞壁的完整性;而Gel1p则无类似的功能。然而,Gel1p可恢复ΔGas1突变体中的端粒沉默,表明Gel1p可能参与了拟南芥中的转录沉默。而Gel4p具有恢复酿酒酵母ΔGas1突变表型的能力,表明其在真菌的细胞壁生物合成和形态变化过程中起积极作用[22]。
2.3 酵母β-1,3-葡聚糖基转移酶Gel家族
酵母细胞壁中含量最丰富的多糖为β-1,3-葡聚糖,主要由1个催化亚基FKS和至少1个调节亚基Rho-1组成的葡聚糖合成酶复合体(glucan synthase complex,GSC)催化合成[23]。在细胞膜外空间,GH72家族酶催化β-1,3-葡聚糖的线性伸长以及延长分支点形成糖链侧支[24]。
酿酒酵母Gas多基因家族含有编码GH72家族蛋白的5个基因Gas1~Gas5。Gas1p和Gas2p属于GH72+亚科,而Gas3p、Gas4p和Gas5p属于GH72-亚科。序列分析发现,酿酒酵母中5个同源Gas蛋白Gas1~Gas5蛋白共享一个分泌信号序列和一个名为NtD的N-末端结构域,但各蛋白具有不同的C-末端延伸。另外仅在Gas1p和Gas2p中存在类似于碳水化合物结合域CBM43的Cys-Box结构域,其对于Gas蛋白的功能和稳定性必不可少。鉴于在所有 Gas 蛋白和所有 GH72 家族成员中保守的两个谷氨酸残基已被证明对催化至关重要,推测NtD 为Gas家族的主要催化结构域[25]。
Gas1p是一种GIP锚定蛋白,主要定位于细胞膜上,在营养生长过程中表达,在细胞壁组装中起关键作用。Gas1p的缺失导致细胞形态发生缺陷和细胞壁葡聚糖分支交联比例的减少[26]。目前已经证明酵母蛋白Gas1p、Phr1p和Phr2p具有与烟曲霉Gel1p、Gel2p蛋白和白色念珠菌的ScGas1、CaPhr1和CaPhr2蛋白相同的催化残基和体外活性,此外,AfGel1、AfGel2和CaPhr1可以恢复酿酒酵母Gas1缺失突变体的缺陷表型[19]。转录组分析表明,Gas1+Gas5基因对在营养生长过程中表达,在减数分裂和产孢过程中受到抑制,而Gas2+Gas4基因则相反,其在孢子形态发生过程中起着重要的作用[27]。在营养生长过程中,Gas1p和Gas5p是细胞壁形成所必需的,其中Gas1p起主要作用,而Gas5p只起辅助作用。Gas2p和Gas4p是形成孢子壁所必需的,其机制是使孢子内壁层和外壁层相互连接,二者的缺失会导致无法正常形成孢子[28]。Gas3p作为酿酒酵母中一种高度甘露糖化发育调剂蛋白,但未呈现相关活性,在营养生长和孢子形成期间弱表达[29-30]。
粟酒裂殖酵母(Schizosaccharomycespombe)基因组中存在4个编码 β-1,3-葡聚糖基转移酶的基因Gas1+、Gas2+、Gas4+和Gas5+,包含保守转移酶结构域[31],同时还含有CBM43以及富含Ser或Cys的结构域,并在C-末端存在GPI部分结合位点的疏水区[25]。在营养生长过程中,只有Gas1+、Gas2+和Gas5+表达,且其随细胞周期变化呈周期性变化,提示各基因在细胞营养生长周期的不同阶段发挥不同的功能。例如,Gas1+和Gas5+的转录水平在有丝分裂期间最高,而Gas2+转录水平在分裂前期较高;而在营养生长期Gas4+的表达水平最低,但在孢子形成期间显著增加[32]。此外,Gas1+在维持细胞的完整性和活力以及细胞形态发生等过程均起到重要作用;ΔGas1突变体在没有渗透稳定剂的情况下无法存活并不能经历细胞裂解。在敲除Gas1后,细胞裂解发生在活跃的生长区域(极点和隔区),不裂解的细胞表现为形态发生缺陷,即两极变宽或内侧区域变宽,提示Gas1p是裂殖酵母营养生长所必需。相反,ΔGas2突变体和ΔGas5突变体,甚至双ΔGas2ΔGas5突变体,在所有培养温度均可正常生长,并未显示出明显的生长缺陷[19]
2.4 稻瘟病菌(Magnaporthe oryzae) β-1,3-葡聚糖基转移酶Gel家族
通过与酵母中编码Gas蛋白的基因序列相似性比对,现已推测出M.oryzae中含有5种Gelp,分别是Gel1p(MGG_07331.7)、Gel2p(MGG_06722.7)、Gel3p(MGG_08370.7)、Gel4p(MGG_11861.7)和Gel5p(MGG_03208.7)。该Gel家族含有一个N-端信号肽,其后是一个催化的GH72结构域(GH72 Pfam:PF03198),一个连接C-端低复杂度区域,Ser/Thr为29%~40%和一个公认的GPI锚点[33]。而Gel3p和Gel4p还包含一个X8结构域(PF07983)。据此,Gel3和Gel4属于GH72+亚家族,而Gel1、Gel2和Gel5属于GH72-亚家族。
ΔGel1ΔGel3ΔGel4M.oryzae突变体的细胞壁呈显著变化,其中β-1,3-葡聚糖的聚合度比野生型菌株更高,分支更少。该突变体在基因表达的整体模式、超分支表型和无孢子形成方面均表现出显著的差异,缺失3个Gel编码基因ΔGel1ΔGel3ΔGel4的突变体不能引起稻瘟病,并且表现出超支菌丝和无孢子发育表型,表明Gelp在真菌细胞壁的结构修饰中起着重要作用,下调β-1,3-葡聚糖基转移酶的活性可显著干扰细胞壁的结构完整性和灵活性。分析ΔGel3ΔGel4M.oryzae突变体的细胞壁多糖结构也显著变化,其中β-1,3-连接的葡萄糖残基比例增加,末端葡萄糖和在分支点(1,3,6-Glcp)的残基比例较低。这些数据表明,Gel3p与Gel4p在β-1,3-葡聚糖链的延伸过程中发挥作用,并参与分支结构的形式。
2.5 白假丝酵母(Candida albicans) β-1,3-葡聚糖基转移酶Gel(Phr/Pga)家族
在Candidaalbicans中,Phr家族含有编码GH72家族蛋白的5个基因Phr1~Phr3、Pga4、Pga5。其中Phr1p、Phr2p和Pga5p是GH72+亚家族的成员,Phr3p和Pga4p是GH72-亚家族的成员。
进化分析结果表明,Phr1和Phr2是Gas1的同源基因,Phr3与Gas4同源,Phr1和Phr2缺失显著影响C.albicans的细胞形态;Pga4和Pga5则分别与Gas5和Gas2同源。目前,Phr家族功能的研究主要集中在Phr1p、Phr2p和Pga4p。结果表明,培养基成分、温度和细胞形态对Phr1的转录水平影响不显著[34];但在pH为7.5~8.0条件下,Phr1表达水平最高;而Phr2的表达水平变化趋势与Phr1相反,其在pH 4.0时最高,随着pH的增加而降低[35]。与Phr1和Phr2不同,其他家族成员的表达完全不受环境pH的影响。Phr3被认为是该家族中唯一包含内含子并编码缺乏可识别的GPI附着位点的蛋白质的基因[36]。通常认为,Phr3p和Pga5p与孢子形成有关,因此,在C.albicans繁殖和生长过程中,Phr3和Pga5并未发挥出相应的功能;另外,研究显示,缺失Prh3、Pga4或Pga5并未显著影响C.albicans的生长、形态或毒力,而Phr1、Phr2和烟曲霉菌的Gel1、Gel2被证明与小鼠感染模型致病密切相关[37-38]
3 真菌β-1,3-葡聚糖基转移酶的催化机制
为了探究 β-1,3-葡聚糖基转移酶的延长与分支糖链的功能,在酿酒酵母中鉴定出GH72家族糖基转移酶Gas1p和GH17家族糖基转移酶Bgl2p分别参与 β-1,3-葡聚糖分支。之前的研究表明,在 β-1,3-葡聚糖上引入 β-1,6-键是由GH17家族Bgl/Bgt蛋白完成的,其可从 β-1,3-寡糖的还原端切割葡萄糖单元,将酶结合的低聚糖转移到受体 β-1,3-寡糖或非还原端的C-6或内部葡萄糖单元的C-6上形成分支[39]。
以酿酒酵母为模型,通过建立定量测定β-1,3-葡聚糖上β-1,6-支链的方法,主要是通过放射性标记底物UDP-(14C)葡萄糖,对其中分支减少的缺失突变体进行筛选。结果发现,与野生型菌株相比,ΔBgl2突变体和ΔGas1突变体的分支分别减少了15%和70%[18]。野生型菌株呈椭圆形,芽痕集中在一极[24]。而ΔGas1突变体表现出轻微的生长缺陷,细胞形态发生改变,细胞呈球形,芽痕分散[40]。ΔGas1ΔBgl2双突变体表现为没有分支,表现为生长速度慢、细胞形状圆、出芽方式随机。而ΔGas1突变体和ΔGas1ΔBgl2双突变体细胞壁中的β-1,6-葡聚糖含量分别比野生型菌株降低了90%和98%,在细胞壁上没有β-1,3-葡聚糖和β-1,6-葡聚糖的分支,表明 β-1,6-葡聚糖的生物合成发生在细胞壁,β-1,3-葡聚糖的衍生物是β-1,6-葡聚糖生物合成所必需的[41]。ΔBgl2突变体没有表现出 β-1,3-葡聚糖分支缺陷或明显的生长问题,这表明存在额外的替代分支机制[42]。而研究表明,GH72家族中ScGas1p、ScGas2p和AfGel4p具有双重的β-1,3-葡聚糖伸长和分支活性,其在其C-末端都含有CBM43,同样属于GH72家族但缺乏CBM43的ScGas5p、AfGel1p和AfGel2p只显示了延伸β-1,3-葡聚糖的活性。
综上所述,在酿酒酵母中,Gas1p和Bgl2p都参与了细胞壁的β-1,3-葡聚糖的 β-1,6-分支的形成,Gas1p负责主要的分支活性,但在Gas1p和Bgl2p同时存在的情况下表现出最佳的分支活性,这表明它们在 β-1,3-葡聚糖分支过程中具有协同作用(如图2所示)。Bgl2p优先使用短链(≥5),而Gas1p的分支活性首先需要形成长葡聚糖(≥11)。β-1,3-葡聚糖线性伸长是前提条件,CBM43对伸长的 β-1,3-葡聚糖的定位是Gas蛋白后续分支活性所绝对需要的。
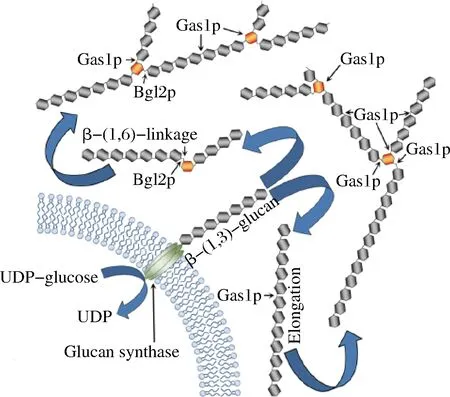
图2 酿酒酵母细胞壁β-(1,3)-葡聚糖分支的可能机制[18]Fig.2 Predicted mechanism of S.cerevisiae cell wall β-(1,3)-glucan branching[18]
4 展望
近20年来的研究已显著提高了对真菌葡聚糖结构和功能的认识。然而,有关葡聚糖糖链的延伸和分支化的形成仍认识不足。例如,GEL家族是否也具有切割β-(1→6)-葡聚糖糖链的功能?能否转移β-(1→6)-糖链至β-(1→3)-葡聚糖糖链或转移β-(1→3)-糖链至β-(1→6)-糖链,形成多分支的β-(1→3)/β-(1→6)-葡聚糖?这些过程还有待进一步系统研究和全面揭示。为此,今后还可以在以下几个方面做进一步分析:(1)准确检测β-1,3-葡聚糖转移酶催化产物(中间产物)的结构性质是解析其切割和转移糖链的规律和机制的基础;(2)β-1,3-葡聚糖转移酶的生化性质、晶体结构等尚需进一步准确解析;(3)不同来源的真菌β-1,3-葡聚糖转移酶的催化形成β-(1→3)/β-(1→6)-分支化葡聚糖的机制的共性和区别还需系统对比;(4)可构建CRISPR-Cas9基因编辑系统靶向敲除真菌β-1,3-葡聚糖转移酶,通过观察菌丝形态和细胞壁微观结构、葡聚糖分支化位点以及分支度等,明确其在葡聚糖合成和细胞壁形成过程中发挥的作用。这些研究将为真菌葡聚糖,特别是食药用真菌多分支葡聚糖的靶向合成以及高经济价值的开发与利用提供一定的理论依据。