木薯叶片多肽的制备与抗氧化功能研究
2022-04-18张作达王琴飞吴若娜牛晓磊张振文
张作达,王琴飞,吴若娜,牛晓磊*,张振文*
1(海南大学 热带作物学院,海南 海口,570228)2(中国热带农业科学院 热带作物品种资源研究所,海南 海口,571101)
木薯(ManihotesculentaCrantz)是大戟科木薯属植物,其叶片含有丰富的蛋白质(9.2%~12.5%,鲜重)[1],在非洲,木薯叶是人们膳食蛋白质的重要来源[2]。随着我国特色热带作物产业的快速发展,农业副产物资源综合开发利用成为研究热点,植物源功能活性多肽产品的开发倍受关注。木薯作为我国重点发展的热带作物,开展木薯叶片的资源化开发利用技术研究是服务热区、乡村振兴、推动木薯产业可持续发展和服务“一带一路”倡议的重要举措,具有良好的社会和经济效益。
目前,植物源多肽的制备方法主要有酶解法、化学合成法、微生物发酵法和直接提取法,其中酶解法具有反应条件温和,专一性较强的特点,是当前最常用的多肽制备方法[3]。活性多肽的生理功能较多,包括抗氧化、调节血脂、抗高血压和抗肿瘤等[4],其中抗氧化是其重要的生理功能之一[5]。本研究通过优化木薯叶片的蛋白质提取方法,利用3种常用蛋白酶(碱性蛋白酶、中性蛋白酶和胰蛋白酶),对提取的木薯叶蛋白质进行酶解优化,对目标活性多肽进行初步分离和抗氧化功能验证。
1 材料与方法
1.1 实验材料
木薯叶,品种为华南9号,中国热带农业科学院热带作物品种资源研究所国家木薯种质圃;中性蛋白酶100 U/mg、碱性蛋白酶200 U/mg、胰蛋白酶250 U/mg,上海源叶生物科技有限公司;BCA试剂盒、超滤管、铁氰化钾、硫酸亚铁、水杨酸和DPPH等常规试剂,海口龙华衍生生物科技中心;三水合乙酸钠、三氯乙酸、三氯化铁、石油醚,氢氧化钠、盐酸、乙腈、2,4-二硝基氟苯,海口宇图科技有限公司。
1.2 主要仪器
电子天平、梅特勒pH计,梅特勒-托利多仪器(上海)有限公司;KQ-6000DE型数控超声波清洗器,昆山市超声仪器有限公司;数显恒温水浴锅,国华(常州)仪器制造有限制造公司;酶标仪、真空冷冻干燥机,建发(广州)有限公司;Agilent 1 260高效液相色谱仪,美国Agilent公司。
1.3 实验方法
1.3.1 样品脱脂
参照殷丹等[6]的脱脂方法,并加以改进。木薯叶片通过液氮研磨,并于50 mL锥形瓶中称取1 g木薯叶片粉末,加入5 mL石油醚,用保鲜膜封口,30 ℃超声15 min,置于150 r/min的摇床中室温反应2 h,用1层纱布将石油醚滤出,氮吹15 min除去剩余石油醚,冷藏备用。
1.3.2 蛋白质提取
参考张灿[7]的蛋白质提取方法,并稍作修改。称取1 g脱脂木薯叶片粉末,加入20 mL去离子水,用1 mol/L的NaOH溶液调节pH值,置于摇床中于一定温度下反应一段时间,4 000 r/min离心20 min,取上清液。用1 mol/L的HCl溶液调pH酸沉,静置30 min,5 000 r/min离心30 min,提取的蛋白质真空冷冻干燥后称重。
1.3.2.1 单因素试验
对蛋白质提取的影响因素温度(20~60 ℃)、碱溶pH值(9.0~11.0)、酸沉pH值4.0~5.2和反应时间0.5~2.5 h进行单因素试验,称取1 g脱脂木薯叶片粉末,固定任意3个因素,改变另外1个因素,对蛋白质进行提取。所提取到的木薯叶片蛋白质冷冻干燥后进行称重并计算得率。
1.3.2.2 正交试验
以温度、碱溶pH值、酸沉pH值和反应时间作为影响因素,设计4因素5水平的正交试验,优化木薯叶片蛋白质提取方法,各因素水平见表1。
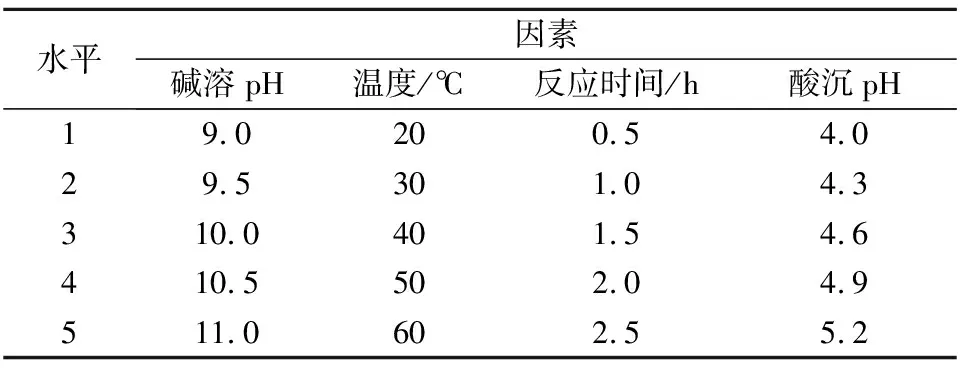
表1 正交设计因素水平表Table 1 Factors and levels of orthogonal design
1.3.2.3 蛋白质纯度测定
参考张妮[8]的方法,采用BCA法测定粗蛋白中的蛋白含量。蛋白质纯度计算如公式(1)所示:

(1)
1.3.3 蛋白质酶解
参考李素云等[9]和肖怀秋等[10]的酶解方法,并加以改进。称取100 mg脱脂蛋白粉,溶于20 mL去离子水中,分别加入碱性蛋白酶、中性蛋白酶、胰蛋白酶3种蛋白酶,加酶量为10 000 U/g,将其混合均匀,反应一定时间后,95 ℃水浴10 min灭酶,4 000 r/min离心15 min,收集上清液,以多肽浓度为考察指标,进行酶解条件的响应曲面优化。
利用Design expert 软件,以温度、pH值和反应时间为自变量,以多肽浓度为因变量。对中性蛋白酶、碱性蛋白酶和胰蛋白酶进行3因素3水平的响应面实验设计,优化3种酶各自的酶解条件,因素水平见表2。
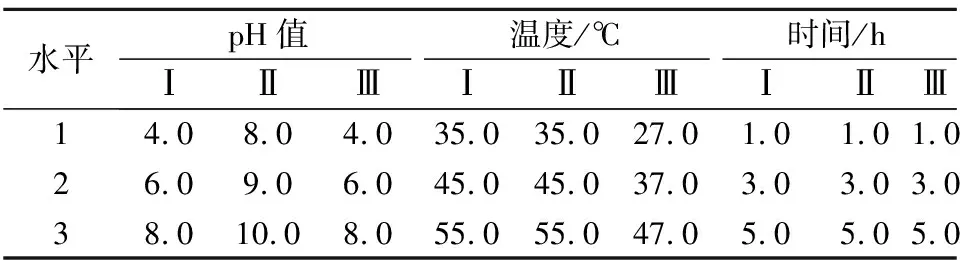
表2 三种蛋白酶酶解因素水平表Table 2 Factors and levels enzymatic hydrolysis by three proteases
1.3.4 多肽分离和多肽测定
采用超滤法对多肽混合液进行分离,选用Millipore的超滤离心管(15 mL,3 kDa),超滤离心后收集外管溶液。多肽浓度采用Biosharp的BCA试剂盒进行测定。
多肽得率测定参考王子秦[11]的方法,按公式(2)计算:

(2)
1.3.5 游离氨基酸测定
游离氨基酸的提取参考ZANG等[12]的方法并稍作修改,移取15 mL多肽溶液,用质量分数15%的三氯乙酸定容至20 mL,超声提取30 min后,12 000 r/min离心15 min,取上清液过0.45 μm的微孔滤膜后,4 ℃保存。
以2,4-二硝基氟苯作为柱前衍生试剂,参考李艳[13]的衍生方法并稍作修改,取氨基酸混标、NaHCO3缓冲溶液与体积分数0.5%的2,4-二硝基氟苯-乙腈溶液各0.5 mL,混匀后于60 ℃水浴暗反应60 min。反应结束后避光冷却至室温,再加入pH值为7.0的磷酸缓冲溶液0.5 mL,静置15 min,取10 μL进样分析。
色谱柱:氨基酸专用色谱柱(250 mm×4.6 mm,5 μm);流动相A:称取13.6 g三水合乙酸钠,溶于1 000 mL水中,采用冰醋酸调节pH值至6.5。流动相B:V(乙腈)∶V(水)=4∶1;流速1 mL/min;检测波长360 nm;柱温40 ℃;进样量10 μL。梯度洗脱程序如表3所示。
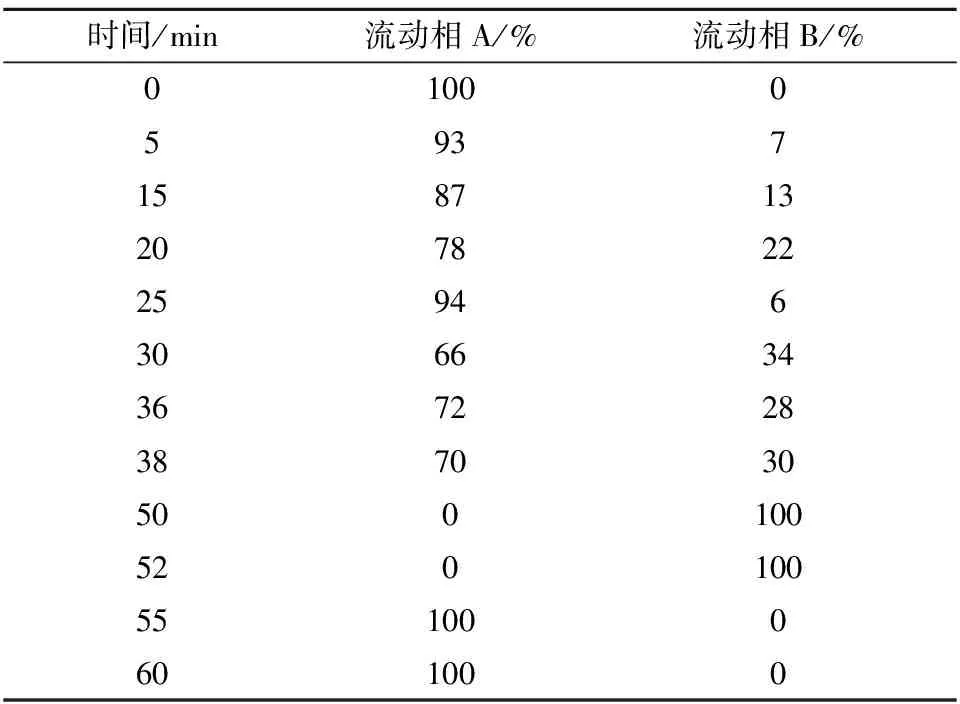
表3 梯度洗脱程序Table 3 Gradient elution procedure
1.3.6 多肽抗氧化活性评价
1.3.6.1 DPPH自由基清除活性
参考夏吉安等[14]的测定方法,并稍作修改。分别取0.2 mL不同浓度的待测样品与等体积0.2 mmol/L DPPH-无水乙醇溶液混合均匀,常温避光反应30 min,于517 nm处测其吸光度,记为A1;测定0.2 mL样品与0.2 mL无水乙醇混合液的吸光度,记为A2;将0.2 mL的0.2 mmol/L DPPH溶液与0.2 mL蒸馏水的吸光度记为A3。以维生素C作为阳性对照。每组3个重复,DPPH自由基清除率按公式(3)计算:
(3)
1.3.6.2 ·OH清除活性
参考袁艳超等[15]和赵旭彤[16]的方法,并稍加改进。分别配制不同浓度的木薯叶多肽提取液,取0.2 mL的多肽提取液依次加入3 mmol/L FeSO4溶液,6 mmol/L水杨酸-乙醇溶液和6 mmol/L H2O2各0.2 mL,混匀后常温反应30 min。反应结束后于517 nm处测定吸光值,记为A1;以去离子水代替样品测其吸光值,记为A0。·OH清除活性按公式(4)计算:
(4)
1.3.6.3 总还原力测定
参考夏吉安等[14]和马菲菲[17]的方法,并稍作改进。配制不同浓度的木薯叶多肽溶液,取0.2 mL样品溶液,依次加入0.2 mL PBS缓冲液和0.2 mL质量分数1%的铁氰化钾溶液,50 ℃水浴反应30 min后,加入质量分数10%的三氯乙酸溶液0.2 mL,混合均匀,静置10 min,3 000 r/min离心5 min,取0.4 mL上清液,加入0.4 mL去离子水和0.2 mL质量分数0.1%的FeCl3溶液,混匀后静置10 min,在700 nm处测其吸光度。
1.4 数据处理
数据处理采用SPSS 20.0进行方差分析和正交分析;酶解实验利用Design expert对数据进行响应面分析。
2 结果与分析
2.1 蛋白质提取
2.1.1 单因素试验
由图1-a可知,随着碱溶pH的升高,蛋白质得率随之增加,可能是由于碱性条件下蛋白质与水分子之间的作用增大,蛋白质的溶解性随之升高[18];然而,据报道,当pH>11.0时,蛋白质提取率不会有显著性增加,而且蛋白质会发生褐变[19]。在本研究中,为了避免提取的蛋白质褐变和过高的pH值导致蛋白质降解,影响蛋白质酶解效果,故选择pH 11.0为最佳碱溶pH。从提取温度看(图1-b),随着温度的升高,蛋白质提取率呈现增加的趋势,并在温度60 ℃时,蛋白质提取量达到最大值。然而,温度过高容易导致蛋白质的结构发生变化[20],影响后期蛋白质的酶解效果,故将60 ℃作为最佳提取温度。从提取时间看(图1-c),在2.5 h时,蛋白质提取量达到了最大值,然而提取时间在2.0、2.5 h所得蛋白质的质量差别不大,为提高效率、降低成本,选择2.0 h为最佳提取时间。从酸沉pH看(图1-d),随着酸沉pH的升高,所得蛋白质的质量先增加后下降,在pH为4.6时,蛋白质提取量达到了最大值,故选择4.6为最佳酸沉pH值。
2.1.2 正交试验与蛋白质纯度
采用正交设计对蛋白质的提取条件进行分析,方差分析结果表明(表4),温度和碱溶pH均对蛋白质的提取量具有极显著影响,但提取时间和酸沉pH对蛋白质提取量影响不显著。在25组正交试验中(表5),第7组的蛋白质提取量最高,除酸沉pH外,均与单因素试验结果相同,因为酸沉pH对蛋白质提取量无显著影响,综上,蛋白质提取最佳条件为碱溶pH 11.0,温度60 ℃,反应时间2 h,酸沉pH 4.6。所提取的蛋白质纯度达到了92.57%。
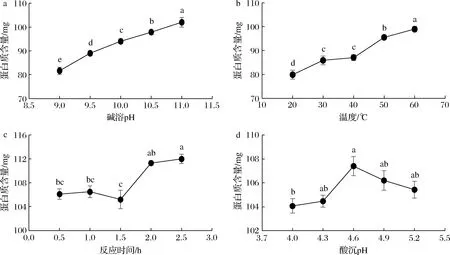
a-碱溶pH;b-温度;c-反应时间;d-酸沉pH图1 各单因素对蛋白质提取量的影响Fig.1 Effect of single factor on protein extraction
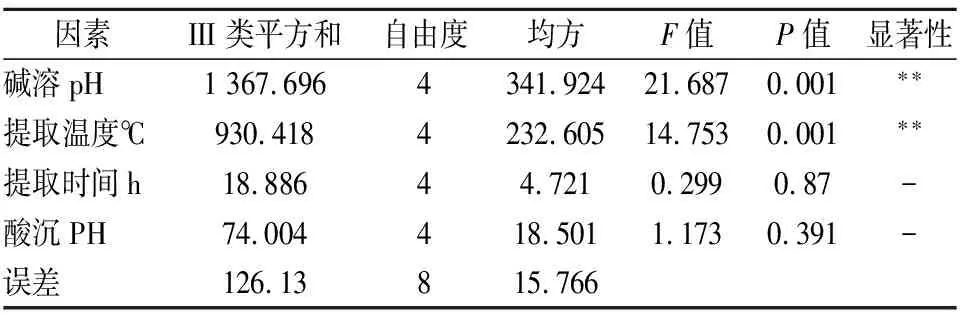
表4 蛋白质提取正交试验分析结果Table 4 Orthogonal test analysis results of protein extraction
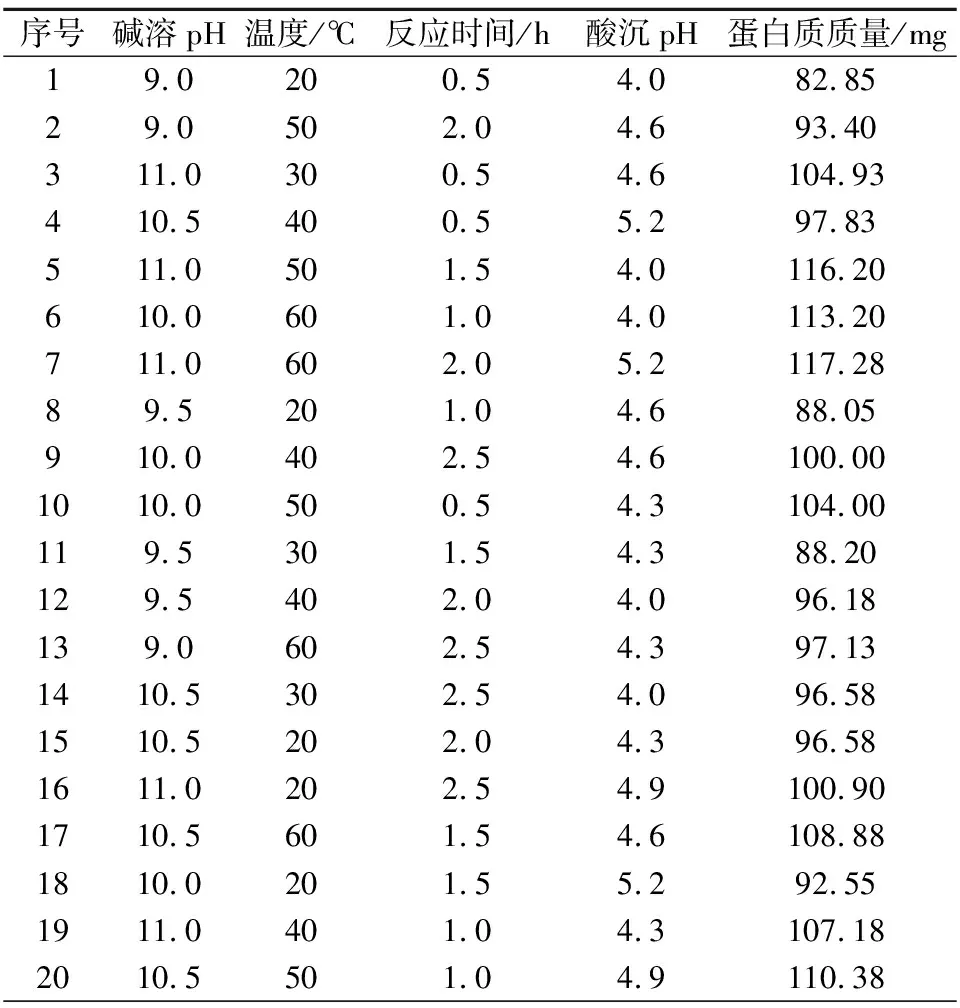
表5 蛋白质提取正交试验结果Table 5 Orthogonal test results of protein extraction
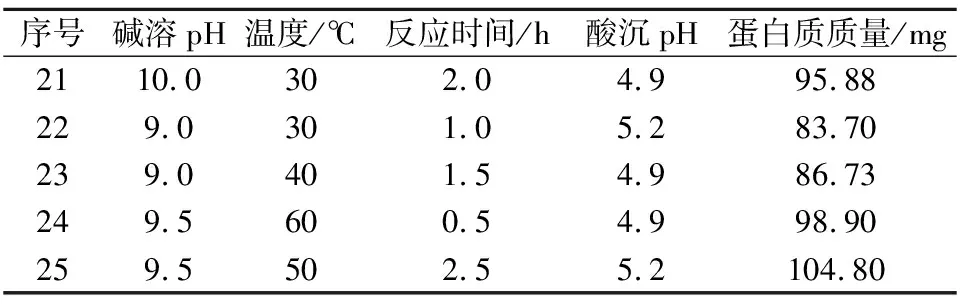
续表5
2.2 蛋白质酶解
选择反应温度、pH值和反应时间3个因素作为3种酶Box-Behnken实验因素,以多肽浓度为响应值,对提取的蛋白质进行酶解。采用Design expert软件分别对3种酶的酶解结果进行多元回归拟合,得到的二次多项回归模型:
中性蛋白酶:Y=6.37-0.225A-0.405B+0.290C-0.115AB-0.065AC+0.035BC-0.016A2-0.346B2-1.09C2
碱性蛋白酶:Y=6.62-0.575A-0.255B-0.278C-0.068AB-0.018AC+0.228BC-0.334A2-0.454B2-0.684C2
胰蛋白酶:Y=5.18-0.13A+0.191B+0.286C-0.083AB+0.133AC+0.035BC-0.305A2-0.282B2+0.003C2。
3个模型的方差分析结果表明(表6),回归模型的P值均小于0.01,说明回归模型达到了显著水平,失拟项的P值均大于0.05,说明不显著。中性、碱性和胰蛋白酶方差分析的复相关系数R2分别为0.988 2、0.946 4和0.952 4,校正系数R2adj分别为0.973 0、0.877 4和0.891 1,说明模型的拟合度好,可以分别解释3种蛋白酶的酶解效果,并用于预测3种蛋白酶酶解的实际情况。
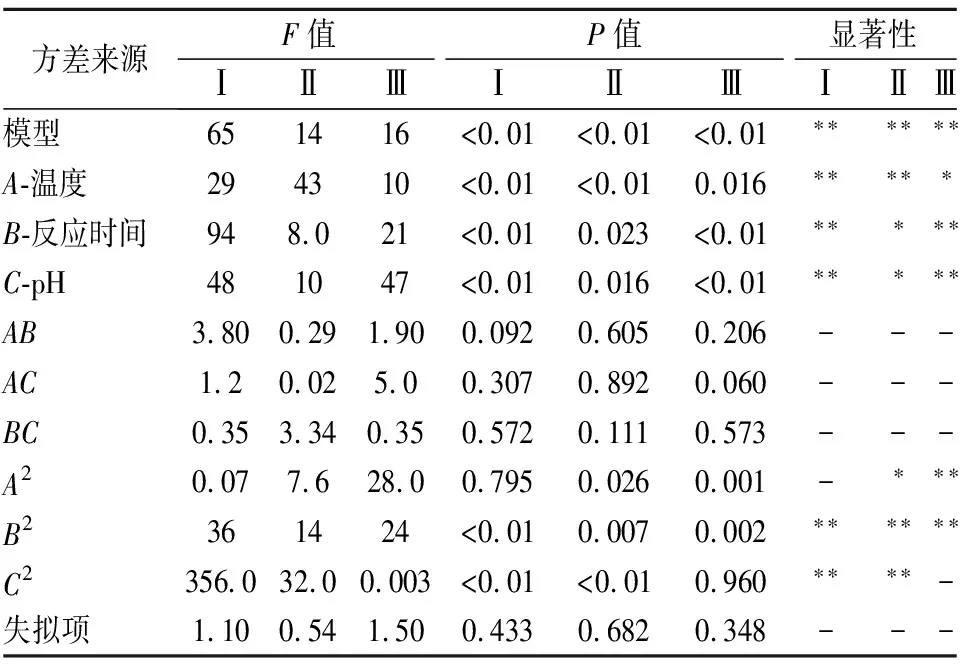
表6 回归模型方差分析Table 6 Regression model analysis of variance
通过软件进一步分析得到了3种酶的最适反应条件,中性蛋白酶最适酶解反应条件为:温度35.00 ℃,pH 6.31,反应时间2.18 h;碱性蛋白酶为:温度36.75 ℃,pH 8.76,反应时间2.44 h;胰蛋白酶为:酶解温度36.45 ℃,pH 8.00,反应时间3.82 h。
2.3 多肽得率
由图2可知,3种酶酶解后多肽得率在40%左右,其中胰蛋白酶酶解所得多肽得率最高,为41.89%,与碱性蛋白酶相比,多肽得率无显著差异;中性蛋白酶酶解所得多肽得率最低,为39.57%,显著低于其他2种酶的多肽得率。
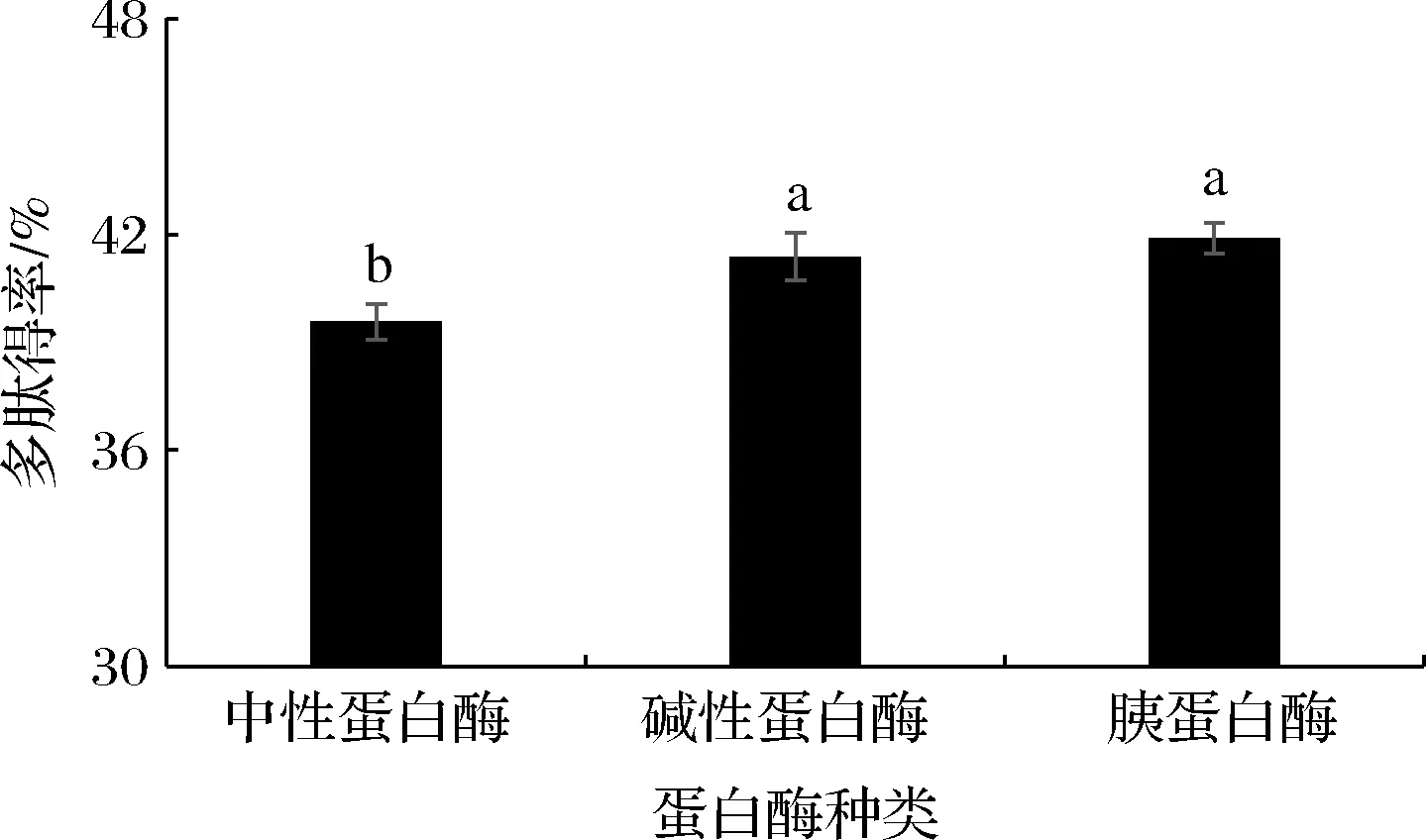
图2 多肽得率Fig.2 Yield of polypeptide
2.4 游离氨基酸测定
由图3可知,氨基酸标准品有18个峰(a),其中第16个峰为衍生试剂与氨基酸反应后产生的衍生峰,其中3号峰为丝氨酸,同时衍生试剂也会在这个位置出峰,当衍生试剂被标品中的氨基酸消耗后,3号峰的丝氨酸就会显示出来。在多肽溶液中(b),由于其游离氨基酸含量极低,因此3号峰为衍生试剂的残留峰。在3种酶的酶解样品中仅检测到了极少量的酪氨酸(16号峰),质量浓度为9.90 μg/mL。
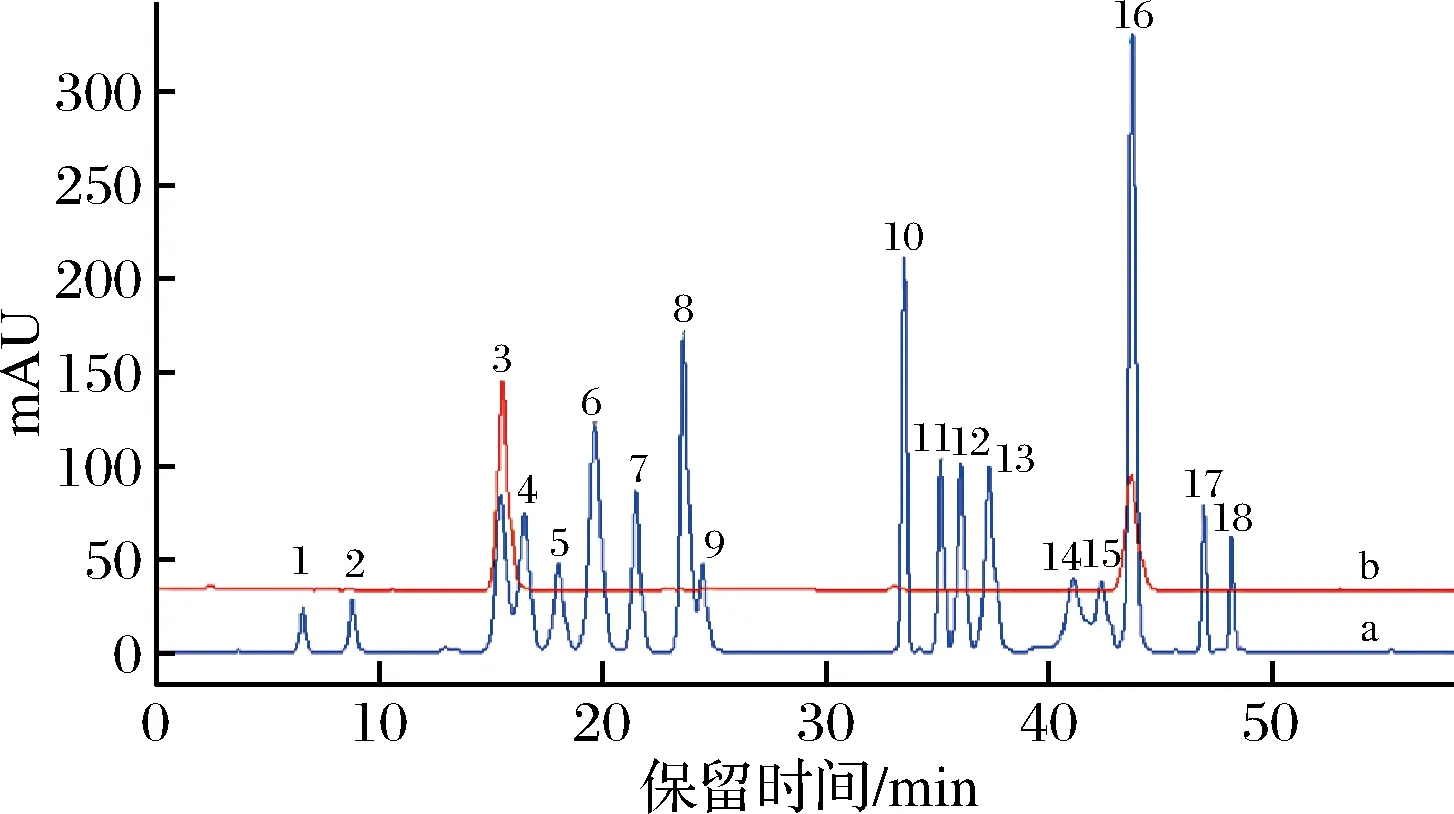
1-天冬氨酸;2-谷氨酸;3-丝氨酸;4-甘氨酸;5-组氨酸;6-精氨酸;7-苏氨酸;8-丙氨酸;9-脯氨酸;10-酪氨酸;11-缬氨酸;12-蛋氨酸;13-半胱氨酸;14-异亮氨酸;15-亮氨酸;16-衍生峰;17-苯丙氨酸;18-赖氨酸a-氨基酸标准品;b-多肽溶液图3 氨基酸标准品、多肽溶液衍生化后的HPLC图谱Fig.3 HPLC chromatograms of standard and polypeptide solution after derivatization
2.5 抗氧化功能验证
以DPPH自由基清除率、·OH清除率和总还原力为指标,来评价多肽抗氧化成分的体外抗氧化活性,以维生素C溶液作为阳性对照。由图4可知,当酶解液的多肽质量浓度为0.35 mg/mL时,碱性蛋白酶所得多肽的DPPH自由基清除率最高,达了58.54%;但是,当多肽质量浓度高于0.35 mg/mL时,3种酶解液DPPH自由基清除率无显著差异,中性蛋白酶所得多肽的DPPH自由基清除率略高,且在多肽质量浓度为1.5 mg/mL时,DPPH自由基清除率达到了91.83%;3种酶所得多肽的DPPH自由基清除活性与维生素C相比仍有一定差距。
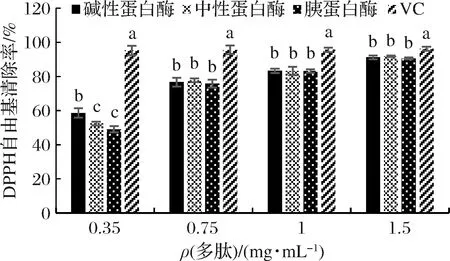
图4 DPPH自由基清除率Fig.4 DPPH free radical scavenging rate
由图5可知,中性蛋白酶所得多肽的·OH清除活性显著高于碱性蛋白酶和胰蛋白酶所得多肽;当中性蛋白酶所得多肽的质量浓度为1.5 mg/mL时,其·OH清除活性达到了79.32%;当维生素C质量浓度低于1.5 mg/mL时,其·OH清除活性显著低于多肽溶液的·OH清除活性;当维生素C质量浓度达到1.5 mg/mL时,其·OH清除活性明显升高,显著高于多肽溶液的·OH清除活性。吸光值越高总还原力越强,由图6可知,中性蛋白酶所得多肽的总还原力略高,在多肽质量浓度为1.5 mg/mL时,吸光度达到了0.558,但与维生素C相比,总还原力较低。综上所述,3种酶中,中性蛋白酶所得多肽抗氧化活性最强。
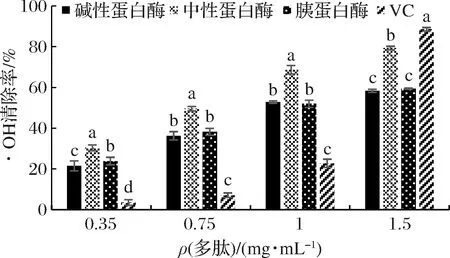
图5 ·OH清除活性Fig.5 Hydroxyl radical scavenging rate
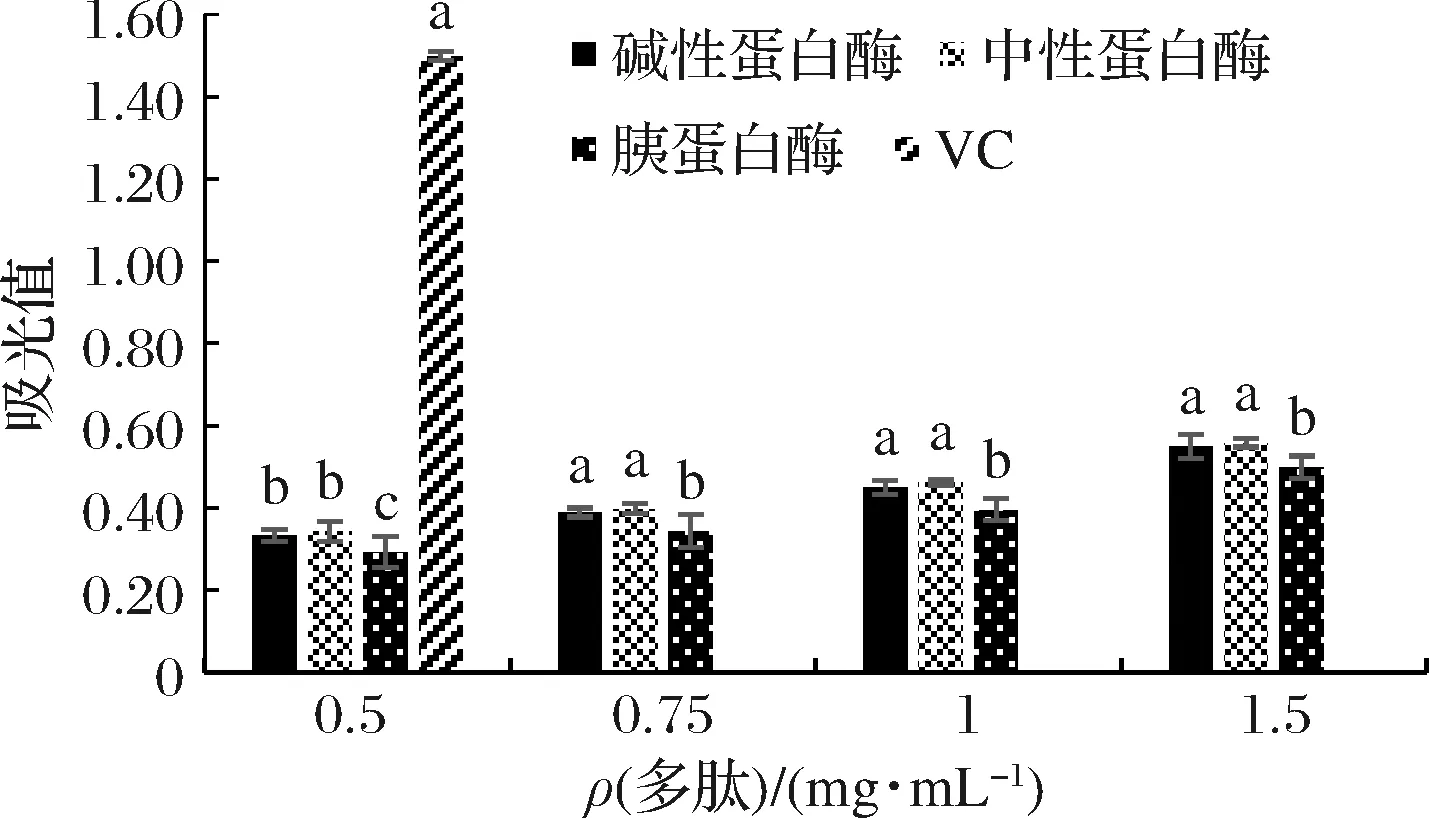
图6 总还原力Fig.6 Total reducing force
3 讨论与结论
大部分蛋白质溶于稀盐、稀碱和稀酸,部分与脂类相结合的蛋白质溶于乙醇等有机溶剂。本文采用碱溶酸沉法对木薯叶片中的蛋白质进行提取。吕凯波等[21]以红花籽粕为原料,对盐提、碱提、碱溶酸沉和超声波辅助碱溶酸沉法进行对比,结果表明,超声波辅助碱溶酸沉法蛋白提取率最高,碱溶酸沉法次之,蛋白质提取率仅相差4%。值得注意的是,吕凯波的研究中碱溶酸沉法的反应温度为25 ℃,超声辅助碱溶酸沉法的反应温度为50 ℃。然而,本研究结果表明反应温度对蛋白质提取率有显著影响,因此在同等温度下超声辅助碱溶酸沉法不一定会比碱溶酸沉法提取率高。研究发现高温条件下大豆分离蛋白的高溶解性是由于7S和11S之间的亚基通过二硫键重新结合,疏水作用力使得疏水性基团向新聚合物中间聚集,形成可溶性聚合物,因此温度对蛋白质提取率有显著影响[22]。
多肽的制备方法主要有酸碱水解法、酶解法、微生物发酵法、化学合成法和直接提取法。酸碱水解法会影响所得多肽的结构与功能,目前很少使用;化学合成法成本高,并且反应过程中容易产生残留化合物;直接提取法所得多肽含量较低,难以满足需求;酶解法和微生物发酵法反应条件温和,是目前最常用的多肽制备方法[3];袁艳超等[15]采用混菌发酵法制备芝麻多肽,芝麻多肽的质量浓度为14.412 mg/mL时,DPPH自由基清除率达到了87.622%;马利华等[23]在不同菌种制备大豆抗氧化肽的实验中发现,不同菌种发酵的大豆肽DPPH自由基清除率的IC50分别为0.887、2.562、0.614 mg/mL;夏吉安等[14]的研究表明,在中性蛋白酶、碱性蛋白酶和胰蛋白酶中,由中性蛋白酶所制备的多肽DPPH自由基清除活性最高,与本文研究结果一致。
研究表明,在大多数情况下,肽段分子质量越小,其抗氧化活性越高[24]。并且研究表明N端氨基酸的疏水性与抗氧化活性呈正相关[25]。研究发现,当多肽N端为疏水性氨基酸Val或Leu时,其抗氧化活性较高[26];当Pro、Tyr和His在肽段中的位点合适时也能在一定程度上提高抗氧化活性[27-29]。芳香族氨基酸的存在也会大大提高肽段的抗氧化活性,色氨酸侧链中的吲哚环和脯氨酸侧链中的吡咯烷环可以通过羟基作为供氢体,从而起到抗氧化的作用[30]。因此,中性蛋白酶所得多肽抗氧化活性最高,可能是中性蛋白酶酶解过程中产生了更多N端为疏水性氨基酸的肽段,或者产生了更多含有芳香族氨基酸的肽段。因此,后期实验中,将对分离后的多肽氨基酸进行测序,进一步研究多肽肽段大小和不同氨基酸组成对其功能活性的影响。
本研究表明,木薯叶片蛋白质最佳提取条件为:温度60 ℃、碱溶pH 11.0、提取时间2 h,酸沉pH 4.6,其所得蛋白质的纯度达到了92.57%。碱性、中性和胰蛋白酶3种酶酶解蛋白质的最佳条件分别为温度36.74、35.00、36.45 ℃;pH值8.76、6.31、8.00;反应时间2.44、2.18、3.82 h,胰蛋白酶多肽得率最高,为41.89%。在中性蛋白酶、碱性蛋白酶和胰蛋白酶中,中性蛋白酶所得多肽的抗氧化活性最强,更适合制备木薯叶抗氧化肽。