以黄色瘤就诊的谷固醇血症患儿临床特征
2022-04-18陈秋莉李燕虹郑如江马华梅
张 军,陈秋莉,郭 松,李燕虹,李 川,郑如江,马华梅
(1.中山大学附属第一医院儿科,广东广州 510080;2.广西医科大学第二附属医院儿科,广西南宁 530000)
谷固醇血症,又称为植物固醇血症(sitosterolemia,STSL,OMIM #210250,#618666),是一种罕见的常染色体隐性遗传的脂质代谢疾病,其特征是植物固醇经肠道的吸收增加,经胆汁排泄减少,导致血清中植物固醇(如β-谷固醇、油菜固醇、豆固醇)的显著升高。1974 年,美国Bhattacharyya 和Connor 首次报道了两名患STSL 的阿米什姐妹,她们均表现为血浆植物固醇水平增加,伴有肌腱黄色瘤[1]。后来,在1998 年Patel 等[2]发现该病基因位于染色体2p21 上,随后,在2000 年Berge 等[3]和2001 年Lee 等[4]证实STSL 与两个相邻的三磷酸腺苷结合盒(adenosine triphosphate-binding cassette,ABC)亚家族G 成员5 和8(ABCG5和ABCG8)基因的变异有关。STSL 的患病率之前被认为在百万分之一以下[5],但有学者认为被低估[6],基于人群携带ABCG5或ABCG8失功能型变异的概率大约是1/220,可推算出STSL 的患病率约为1/20 万[7],据此,仅中国估计有接近7 千人,全世界超过3 万人患病。但目前全世界报道的STSL 仅100 多例,因此,推测该病的误诊率和漏诊率高[8],应当引起重视。STSL 的诊断之所以延迟,原因在于:首先,其临床表现以黄色瘤、早发动脉粥样硬化性疾病为特征[9],与家族性高胆固醇血症(familial hypercholesterolemia,FH)有相似之处,因而,在早期的文章中,STSL 也被称为假性FH[10],因此易误诊[11-12];其次许多医生不熟悉其临床表现,譬如黄色瘤、血液学表现特征;第三,临床常用的血脂检测方法(如酶比色法)无法区分胆固醇和植物固醇[13]。这种延迟诊断危害巨大,因为这些患者可能相当长时间处于不适当的高风险治疗中,他们可能会错过从低胆固醇和低植物固醇饮食或药物治疗的巨大获益[11]。尤其是在治疗上,STSL 要求严格控制胆固醇和植物固醇摄入,而FH 欧洲指南推荐FH患者每日植物固醇摄入为2 g[14]。且常规的他汀类降血脂药物对于STSL 患者无效[15]。而长期延误诊治,可能会增加早发动脉粥样硬化性等疾病的风险[16-18]。因此,早期识别和诊断显得尤为重要。目前较好的诊断方法是血植物固醇的检测,但很多地区和医院尚未开展气相色谱法检测植物固醇,且我国植物固醇的实验室检测方法并未在临床实验室普及,也尚未建立基于中国人群的植物固醇参考区间[19],这一方法的实施难度系数非常高。另一较好的诊断工具是基因测序,但基因测序耗时、花费大,尽管如此,在血植物固醇无法检测的地区或者国家,不失为一个可早诊断的可靠办法。STSL 还有一些少见的临床表现,如巨大血小板伴血小板减少(巨型血小板计数减少),溶血性贫血[20-21]。因此,本研究拟探讨在以黄色瘤为主要临床表现、无明显血液系统受累的STSL和FH 患儿的胆固醇(cholesterol,Chol)、低密度脂蛋白胆固醇(ow-density lipoprotein cholesterol,LDL-c)、平均血小板体积(mean platelet volume,MPV)、贫血比例有无差异,并探讨他们在STSL的诊断价值,以及总结STSL 其他临床特征,以期为临床早诊断提供线索。
1 材料与方法
1.1 对象
回顾性、连续性纳入2016 年1 月至2021 年10月以黄色瘤为首发表现的STSL患儿为病例组,9例来自中山大学附属第一医院儿科生长发育中心,1例来自广西医科大学第二附属医院。回顾性、连续性纳入同时期中山大学附属第一医院儿科生长发育中心以黄色瘤为首发表现,诊断为纯合子家族性高胆固醇血症(homozygous familial hypercholesterolemia,HoFH)的患儿10例作为对照组。
STSL 病例纳入标准:①0~14 岁。②以黄色瘤为主诉就诊。③基因测序确诊为STSL:ABCG5、ABCG8的纯合变异,或复合杂合变异[22]。排除标准:①有典型溶血和出血临床表现者。②以黄色瘤为表现的其他疾病,例如脑腱性黄瘤病、沃尔曼病、FH 等。③以低密度脂蛋白升高的其他继发性高脂血症,例如甲状腺功能低下,肾病综合征等。④资料严重缺失者。
FH病例纳入标准:①0~14岁。②以黄色瘤为主诉就诊。③实验室检查提示LDL-c≥3.6 mmol/L[23]。④基因测序确诊为FH:LDLR、ApoB、ApoE、PCSK9的纯合变异或者杂合变异;LDLRAP1的纯合变异或者复合杂合变异[14]。排除标准:①以黄色瘤为表现的其他疾病,例如脑腱性黄瘤病、沃尔曼病、STSL 等。②以低密度脂蛋白升高的其他继发性高脂血症,例如甲状腺功能低下,肾病综合征等。③资料严重缺失者。
本研究经中山大学附属第一医院及广西医科大学第二附属医院医学伦理委员会审核批准,所有患者均知情同意。
1.2 方法
病例资料:搜集并记录患儿性别、祖籍、父母身高、父母血脂数值,确诊时间,首次来中山大学附属第一医院或者广西医科大学第二附属医院就诊时年龄、病史、病程、有无行黄色瘤活检、用药情况,身高、体质量,黄色瘤部位、数目、最大直径(cm),基因测序结果。
血常规、血脂等指标测定:纳入血常规中Hb(hemoglobin,Hb)、平均红细胞体积(mean corpuscular volume,MCV)、血小板(platelets,PLT)、MPV(希氏美康,XN9000,日本);Chol、甘油三酯、高密度脂蛋白胆固醇、LDL-c(贝克曼(BECKMAN),AU5800,美国);心脑血管并发症评估情况,包括心脏彩超、冠状动脉、颈动脉、主动脉彩超(EPIC7C,飞利浦,荷兰),颅脑MRI 血管成像(Verio,syngo MR B19,Siemens Healthcare,德国)。
1.3 基因测序
经患儿和父母同意,用乙二胺四乙酸(EDTA)抗凝管抽取患者和父亲、母亲外周静脉血各2 mL。采用QIAamp DNA 提取试剂盒(QIAGEN 公司,Hilden,Germany)抽提患儿基因组DNA,并测量其吸光度值及浓度。
1.3.1 第二代高通量测序 提取的DNA用DNA酶片段化后用磁珠法进行纯化,随后进行PCR扩增并连接上接头序列,使用试剂盒xGen Exome Research Panel v1.0(IDT,USA)经两次捕获及纯化,再经PCR 扩增和纯化后获得的最终文库在Novaseq6000 测序仪(illumina Inc.,USA)对目标基因(LDLR,PCSK9,APOB,LDLRAP1,LIPA,CH25H,SREBF1,ABCG5,ABCG8,SCAP,STAP1,MYLIP,APOE,NPC1L1,LPA,LPL,APOA5,GPIHBP1,GPD1,LMF1,CREB3L3)的外显子及外显子内含子交界区进行测序分析。
1.3.2 数据分析 所有数据用BWA 算法比对到参考序列(UCSC hg19),采用仪器默认设置,使用文献报道方法对数据进行注释。根据ACMG 指南,并结合患儿临床资料和生物信息学软件(PolyPhen2、LRT、Mutation Taster等)预测结果,对各个基因的功能、变异情况以及遗传模式进行分析,得到可疑候选变异。
1.3.3 Sanger 测序验证 对可疑候选变异的位点设计PCR 引物进行扩增及进行Sanger测序验证,并对患儿父母相应位点进行检测、验证。
1.4 统计学分析
运用SPSS 26.0 进行统计学分析。计量资料符合正态分布采用均数±标准差,两组间比较采用独立样本t检验;非正态分布计量资料采用M(P25~P75)表示,两组组间比较采用Mann-WhitneyU检验;配对资料(STSL 组Chol、LDL-c 与父母的比较;身高SDS 与遗传靶身高SDS 比较)采用配对样本t检验或Wilcoxon符号秩和检验。计数资料比较采用卡方检验(或Fisher 精确概率法)。绘制受试者工作特征曲线(ROC),分析Chol、LDL-c、MPV、贫血的诊断价值。利用最大约登指数(maximum of Youden’sJstatistic=敏感性+特异性-1),寻找Chol、LDL-c、MPV 的最优诊断界值。检验标准P<0.05差异具有统计学意义。
2 结果
2.1 临床特征
纳入了以黄色瘤为首发表现的STSL 患儿10例为病例组(表1),5 例男性,5 例女性,来自9 个家系,病例10 来自广西壮族自治区,余均来自广东省。所有病例既往无出血、溶血病史,父母均非近亲婚配,无黄色瘤的家族史。STSL 组黄色瘤表现多样,大部分为结节状,部分结节融合(图1,1B,9A),有巨大结节呈现分叶状(图1,4A),有在婴幼儿时期起病呈现线状(图1,7A-C,8A-C),亦有呈现斑片状(图1,7A);分布部位以掌指关节、腕关节、肘关节、膝关节、踝关节伸侧,股沟、臀部、眼睑、跟腱多见(图1)。有5 例(50%)有轻度贫血,已排除缺铁性贫血、地中海贫血。除血脂异常、贫血外,其他检查如尿常规、肝肾功及甲状腺功能均未显示异常。STSL 组有6 例(60%)在确诊前均行黄色瘤病理组织学检查,组织学检查结果均提示为黄色瘤。有2例出现血管狭窄的影像学表现,病例4:右锁骨下动脉起始段狭窄<50%,双侧颈总动脉狭窄<50%;左右冠状动脉节段性狭窄;肠系膜上动脉至肾动脉狭窄,范围1 cm;双侧肾动脉近端、腹腔干和肠系膜上动脉开口处变窄。病例6:左侧大脑前动脉起始部重度狭窄。

图1 STSL病人黄色瘤Fig.1 Xanthomas of the STSL patients
纳入了以黄色瘤为首发表现的FH 10 例作为对照组(表2),来自8 个家系(有一对双胞胎,一对姐妹),女孩6例,男孩4例。FH 组黄色瘤亦通常表现为多发结节性,部分融合,也有呈现线状者,两组表现类似(图2)。无贫血患儿。FH 组有4 例(40%)在确诊前行黄色瘤病理组织学检查,组织学检查提示亦为黄色瘤。无论STSL 还是FH 组,血清Chol和LDL-c均明显升高(表1-3)。
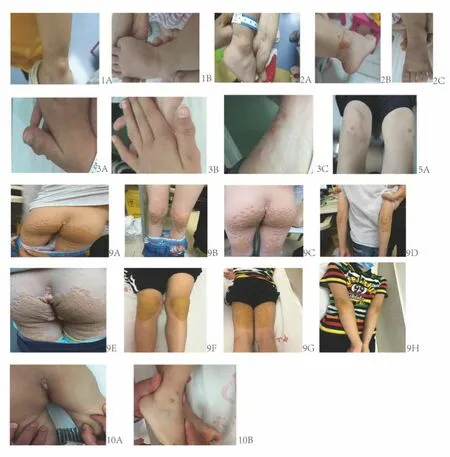
图2 FH病人黄色瘤Fig.2 Xanthomas of the FH patients


表2 FH组临床资料Table 2 Clinical characteristics of the FH group
比较STSL 组Chol&父亲Chol,STSL 组Chol&母亲Chol,Z分别为-2.52、-2.37,P分别为0.012、0.018。比较STSL 组LDL-c&父亲LDL-c,STSL 组LDL-c&母亲LDL-c,t分别为5.21,6.29,P均为0.001,提示STSL 组的Chol 与LDL-c 均显著高于其父亲和母亲。虽STSL 是常染色体隐性遗传性疾病,但STSL组患儿父亲和母亲Chol均值亦偏高(表3)。两组病人均无明显血小板减少(表1-2),且有4例STSL血小板计数升高。
2.2 基因测序结果
10 例STSL 基因检测结果中(表1),ABCG5基因纯合变异1 例(病例9),复合杂合变异8 例,ABCG8基因的复合杂合变异1 例(病例8)。共10种基因变异,均为已报道的变异(见表1),本组中,发生频次最高的为IVS7+1G>A(4 次),其次是Gln251*(3次)和Val113fs(3次)。10例FH,基因测序结果为LDLR的纯合(1 例,病例7)或者复合杂合(9 例)变异,因此,对照组以黄色瘤为首发表现的患儿均为HoFH。
2.3 STSL与FH组临床资料比较
在STSL 组和FH 组分别有1 例(表1-病例4)、(表2-病例10)患儿身高达到矮小症诊断标准。但STSL 和FH 组所有患儿的身高标准差分值(standard deviation score,SDS)为(-0.84±1.02),与遗传靶身高SDS(-0.38±0.60)[男孩遗传靶身高=(父亲身高+母亲身高)/2+6.5 cm;女孩遗传靶身高=(父亲身高+母亲身高)/2-6.5 cm,再换算成相应SDS]无差异,P=0.063(t=-1.98)。STSL组和FH组身高SDS之间亦无差异(表3)。STSL 和FH 组的体质量指数(body mass index,BMI)、PLT、病程、MCV 无差异(P>0.05)。父亲和母亲Chol、LDL-c 在FH 组均显著升高(表3)。FH 组Chol、LDL-c 亦明显升高(表3,图3A、3B)。同时,MPV(表3,图3D)和贫血比例在STSL组显著升高,Hb显著降低(表3,图3C)。

图3 STSL组和FH组之间Chol、LDL-c、Hb、MPV的差异Fig.3 Differences in Chol,LDL-c,Hb,MPV between the STSL and FH group
表3 STSL组和FH组资料比较Table 3 Comparison between the STSL group and FH group [(),M(P25~P75)]

表3 STSL组和FH组资料比较Table 3 Comparison between the STSL group and FH group [(),M(P25~P75)]
SDS:standard deviation scores;BMI:body mass index;Chol:cholesterol;LDL-c:low-density lipoprotein cholesterol;Hb:hemoglobin;MCV:mean corpuscular volume;PLT:platelet;MPV,mean platelet volume.1)showed by xˉ±s,compared by t-test;2)showed by M(P25~P75),compared by U test.The rest are compared by χ2.
2.4 绘制受试者工作曲线
为更好地区分黄色瘤为首发表现就诊患儿是STSL 还是FH,用Chol、LDL-c、MPV、是否贫血,以及父亲和母亲的Chol、LDL-c 绘制诊断STSL 的受试者工作曲线(图4),他们的AUC 值,除贫血外,都在0.80 以上,均具有较好的诊断价值(表4)。分别计算他们的约登指数,在约登指数最大时(maximum of Youden’sJstatistic),取各个值的诊断界值,当Chol≤15.41mmol/L、LDL-c≤13.22mmol/L、MPV≥9.05 fl、贫血,为诊断STSL最佳界值。亦发现当父亲的Chol≤7.25 mmol/L,LDL-c≤5.02,母亲的Chol≤5.25 mmol/L,LDL-c≤3.44 mmol/L 时,为诊断STSL的最佳界值。

表4 Chol、LDL-c、MPV、贫血诊断STSL的AUC值和界值Table 4 AUC values and cutoff values for the diagnosis of STSL

图4 诊断STSL的受试者工作曲线Fig.4 ROCs for the diagnosis of STSL
3 讨论
本研究报道了10例以黄色瘤为首发表现STSL患儿的临床特点、血脂特点、基因测序结果,在与以黄色瘤为首发表现的FH 病例对比中发现,更低的血Chol 和LDL-c 水平,尤其是当MPV≥9.05 fl,贫血,高度提示为STSL。
STSL 的黄色瘤表现多样,尤其要注意临床相对少见的巨大分叶状,斑片状的黄色瘤,黄色瘤一般好发于四肢关节的伸侧面、眼睑、股沟等处,黄色瘤在这些部位的发生发展,推测与皮肤经常磨擦、易受轻微创伤等有关系[24]。本研究中连续性纳入首发表现为黄色瘤的对照组均为HoFH,出乎我们的意料。在西班牙FH 长期前瞻性的,横断面的队列研究中,随访年龄在(44.1±15.2)岁的杂合子FH仅<15%出现黄色瘤,因此杂合子FH 常起病隐匿而被漏诊,但在未接受治疗的个体中,黄色瘤发生率随着年龄的增长而增加[25]。因此,推测对照组全部为HoFH 可能与我们纳入患儿年龄在0~14岁之间有很大关系。STSL 组有1 例患儿身高达到矮小症诊断标准,这与Wang 等[26]观察到13 例STSL 病人,有2 例为矮身材病人,以及Rees 等[27]报道10 例STSL 病人中,有4 例有生长迟缓是一致的,提示高脂血症可能对身高有负性影响。
本研究中有2 例STSL 病例发现血管狭窄,这也是STSL 的临床特点之一,即早发心血管事件,目前报道的发生心肌梗死的最小病例,是一位5 岁儿童[28]。植物固醇可以穿透动脉壁,刺激泡沫细胞的形成和促炎细胞因子的分泌,吸引更多的单核细胞,加速动脉粥样硬化[29]。这些发现与β-谷固醇在人内皮细胞中的细胞毒性活性高于胆固醇[30]相一致。同时,β-谷固醇的积累导致巨噬细胞死亡,可能加速粥样斑块坏死[29]。此外,与胆固醇相比,植物固醇对氧化过程高度敏感,植物固醇氧化产物可促炎和促动脉粥样硬化[31]。尽管如此,植物固醇具体致动脉粥样硬化潜能尚不清楚[22]。
基因测序结果提示10 例中有9 例为ABCG5基因的纯合或者复合杂合变异,仅1例为ABCG8基因的复合杂合变异。这与既往的报道,白种人常携带ABCG8变异,而中国、日本和印度患者多携带ABCG5变异[15,32]是一致的。另外,本研究中发生频次最高的致病变异为IVS7+1G>A,而Su 等总结文献报道的28 例中国人STSL 显示,超过一半的为R446X 变异[12]。亦有其他研究提示ABCG5基因最常见的变异为R389H 和R419H[4,33]。因此,ABCG5基因常见的致病变异,仍需更多大样本病例的研究。另外,Bastida等学者总结有血液学异常的基因变异,发现巨大血小板伴血小板减少的基因变异有Arg446*、Arg446Gln、IVS7+1G>A、IVS9+1delG等[34],但本研究中这些基因变异对应STSL 患儿的血小板计数均正常,且还有高于正常者,可见相同的基因型,可能具有不同的临床表型,这可能是由于其他共存基因参与植物固醇代谢和/或环境对造血细胞的影响。
虽然STSL 是隐性遗传性疾病,但本研究观察到STSL 组父亲和母亲的Chol 均值水平均升高,这与一些学者的报道一致,ABCG5/8杂合变异的胆固醇和植物固醇水平高于正常水平[35]。还有一篇病例报道,一位48 岁女性,从20 岁开始,因LDL-c 升高一直被误诊为杂合子FH,使用他汀类药物治疗效果欠佳,对依折麦布效果极好,最后发现是ABCG5杂合变异导致LDL-c升高,伴有植物固醇升高[11],由此可见,ABCG5/8杂合变异可能对胆固醇和植物固醇代谢亦有影响。但与FH组的父亲和母亲的Chol、LDL-c 相比,发现在STSL 组的父母的Chol、LDL-c 的明显降低,从AUC 值,可见父母的Chol、LDL-c 均具有较好的诊断价值,当父亲Chol≤7.25 mmol/L,LDL≤5.02 mmol/L,母 亲Chol≤5.25 mmol/L,LDL≤3.44 mmol/L 时,伴有黄色瘤时,可更好辅助诊断是STSL。
本研究发现,同样具有黄色瘤,与STSL 组相比,FH 组有更高Chol 和LDL-c 水平(p<0.05),提示在FH 病例中,黄色瘤常常出现在更高水平胆固醇的患儿。同时,STSL 组Chol 和LDL-c 也明显升高。这与Wang 等报道一致,其报道了13 例因血小板减少而就诊STSL 患者,有8 例LDL-c 升高,10 例Chol升高[26]。这可能跟儿童肠道吸收不成熟,儿童饮食和母乳中的胆固醇含量高有关系[36];也有可能因为固醇调节元件结合蛋白(sterol regulatory element binding protein,SREBP)途径介导合成的LDLR 活性受到抑制[37]。但常规实验室检测无法区分是胆固醇还是植物固醇,这同时也给临床鉴别诊断带来困难。因此,利用Chol 和LDL-c 受试者工作曲线,探索最佳的界值来区分是STSL 还是FH。Chol 和LDL-c 诊 断STSL 的AUC 值分别0.910、0.890,均具有较好的诊断价值,当Chol≤15.41 mmol/L、LDL-c≤13.22 mmol/L 时,可帮助更好区分患儿在以黄色瘤为首发表现就诊时,STSL 可能性更大。
STSL 合并典型的巨大血小板伴血小板减少或溶血性贫血文献报道渐多[20,26,38-39],在本研究的10例STSL 病人中,50%有轻度贫血,且已排除常见的缺铁性贫血和中国南方地区常见的地中海贫血,考虑可能跟原发病相关。另外,STSL 组与FH 组相比,MPV 更大,提示虽然未发生血小板减少,但是血液中植物固醇的升高,可能对血小板亦造成了形态影响。在ABCG5和ABCG8缺陷小鼠的研究表明,循环植物固醇在血液细胞膜中的积累促进细胞膜僵硬,使其容易破裂,导致形态和功能异常[40]。因此,本研究首次探讨了在以黄色瘤为首发表现,无明显血液学异常时,MPV 和是否贫血诊断STSL的价值,发现MPV、贫血诊断STSL 的AUC 值分别为0.869、0.750,具有较好的诊断价值,当MPV≥9.05 fl、贫血可很好鉴别出STSL。
治疗方面,胆固醇吸收抑制剂,如依折麦布(Ezetimibe)可抑制NPC1L1,降低植物固醇和胆固醇的吸收,是一线药物治疗,可降低植物甾醇10%~50%,并可稳定黄瘤[11,22,41]。溶血性贫血和血小板异常也有报道得到改善[42]。但对2 岁以下儿童无效,因为他们的肝脏葡萄糖醛酸化系统还没有成熟[42]。胆汁酸螯合剂,如消胆胺(8~15 g/d),可使STSL 患者的血浆PS 水平降低40%~60%[43]。但需注意,胆汁螯合剂的依从性问题,因其需一天服用3~4 次,胃肠道的不良反应,包括腹胀和食欲不振,以及可能干扰了脂溶性维生素的吸收[44]。STSL 患者预后取决于诊断时间、治疗的时间,大多数通过适当的管理,如限制植物甾醇的摄入和服用胆固醇吸收抑制剂,可以改善预后[22,45],因此,早期诊断,对于STSL至关重要。
本研究不足之处,首先,本研究为回顾性病例对照研究,有部分数据缺失;其次,STSL 组无植物固醇水平检测,未能反应有黄色瘤STSL 组植物固醇水平;最后,本研究样本数量少,尚需未来前瞻性更大样本的临床研究,来进一步揭示Chol、LDL-c、贫血,尤其是MPV在STSL中的诊断价值。
综上所述,STSL 与FH 的黄色瘤等临床表现类似,由于临床上植物固醇检测没有作为常规开展的检测项目,而易误诊。本项研究初步显示以黄色瘤为首发表现的患儿,当血Chol≤15.41 mmol/L、LDLc≤13.22 mmol/L、MPV≥9.05 fl、贫血时,可能可作为区分STSL 及FH 的检测指标,此外,患者父母双方Chol,LDL-c 的检测也有可能为STSL 与FH 的鉴别提供依据。尤其是在无条件开展血植物固醇检测的欠发达国家或地区或等待基因测序结果的空隙期,可得到初步诊断,并及时给予病人以适当的饮食和治疗方案。由于本项研究病例少,尚有待临床进一步验证。
