稻秆生物炭对稻田土壤Cd形态转化和微生物群落的影响
2022-04-16梅闯蔡昆争黎紫珊徐美丽黄飞
梅闯,蔡昆争,黎紫珊,徐美丽,黄飞, *
1. 华南农业大学资源环境学院,广东 广州 510542;2. 广东工业大学环境科学与工程学院,广东 广州 510006
根据 2014年《全国土壤污染状况调查公报》报道,污染最严重的土壤重金属是Cd,Cd超标率高达7.0%(中华人民共和国环境保护部,2014)。稻田土壤中Cd移动性强、毒性大,易被农作物吸收,通过食物链累积于人体中,进而威胁人体健康(Gray et al.,2006;Xiao et al.,2019)。针对土壤重金属污染,化学钝化是常用修复方法之一(Khalid et al.,2017)。在众多的钝化剂中,近年来生物炭在吸附固定重金属Cd等方面应用潜力巨大,引起国内外研究者的广泛关注(Kavitha et al.,2018;Ali et al.,2020;陈志良等,2016)。
生物炭不但可以通过表面官能团直接吸附、固定重金属,而且还可以通过改变土壤理化性质和微生物群落结构来影响土壤 Cd形态(张华纬等,2017;梁妮等,2021;刘娟等,2021)。譬如,Ma et al.(2020)研究表明,椰子壳生物炭可以显著降低土壤中有效态Cd含量,提高土壤脲酶活性,以及增加土壤微生物群落的相对丰度。类似地,黄家庆等(2020)研究报道,花生壳生物炭可以通过提高土壤 pH,增强土壤中过氧化氢酶、脲酶和磷酸酶活性,以及提高细菌群落多样性,从而降低重金属Cd的毒害作用。然而,有研究表明,稻秆生物炭可以通过降低土壤细菌和真菌总量来降低有效态Cd含量(梁妮等,2021)。以上这些研究表明,生物炭可影响土壤重金属形态转化和土壤性质变化,而对土壤微生物群落结构与多样性的影响研究鲜见报道。
本研究以韶关某地实际 Cd污染稻田土为研究对象,通过添加稻秆生物炭进行120天的室内土培实验来分析土壤Cd形态、化学性质及微生物群落多样性的变化特征,研究不同土壤化学性质与Cd形态之间的相互关系以阐明土壤Cd形态转化的关键影响因素,同时探讨了生物炭作用下微生物群落多样性变化对Cd形态转化的影响,从而揭示稻秆生物炭对稻田土壤 Cd形态转化的作用特征与机制,为重金属污染稻田修复实践提供理论依据。
1 材料与方法
1.1 实验材料
供试土壤采自广东省韶关市某区稻田土(表层0—20 cm),土样经风干处理后,混合均匀并过筛。土样基本性质为:pH 5.67,有机质9.39 g·kg−1,全碳 5.45 g·kg−1,全氮 1.10 g·kg−1,全磷 0.29 g·kg−1,全钾 32.20 g·kg−1,总镉 0.46 mg·kg−1,总锌 133.56 mg·kg−1,总铅 103.14 mg·kg−1,总镍 10.89 mg·kg−1,总铬含量59.41 mg·kg−1。根据土壤环境质量农用地土壤污染风险管控标准(GB 15618—2018),稻田土属于轻度Cd污染。原材料取自华南农业大学生态农场。将水稻秸秆冲洗干净并烘干,粉碎过筛后置于热解炉,在热解温度为700 ℃,时间为2—4 h的限氧条件下制备稻秆生物炭(BC),pH为11.23,比表面积230 m2·g−1,其他具体参数性质见Gao et al.(2019)。
1.2 实验设计
根据前期的预实验结果(Huang et al.,2020),处理组的生物炭(BC)投加量设置为5%,同时设实验空白对照处理组(CK),每个处理设置3个平行组。保持田间持水量为60%,置于25 ℃的培养箱中,分别在第7、14、21、28、45、60、90、120天取样。样品分成两份,一份风干,一份置于4 ℃冰箱保存,之后根据土壤分析测定方法步骤进行下一步的指标测定;另外,还需将土壤样品用干冰保存以进行环境微生物多样性的测序分析(委托上海美吉生物科技有限公司测序)。
1.3 实验分析方法
1.3.1 土壤化学性质与酶活性
土壤 pH、有机质(SOM)、阳离子交换量(CEC)、全氮(TN)、全磷(TP)、全钾(TK)、碱解氮(AN)、有效磷(AP)、速效钾(AK)指标的测定方法参照《土壤农化分析》(鲍士旦,2000)。采用BCR连续提取法测定土壤中不同化学形态Cd的含量,提取顺序为弱酸提取态、可还原态和可氧化态,将提取后的土壤残渣采用HNO3-HClO4微波消解。土壤重金属全量以及各形态Cd含量用ICPOMS测定。土壤过氧化氢酶活性测定用高锰酸钾滴定法,活性单位为 mL·g−1(25 ℃,20 min);脲酶活性测定用苯酚钠比色法,活性单位为 mg·g−1(37 ℃,24 h);蔗糖酶活性测定采用3, 5−二硝基水杨酸比色法,活性单位为 mg·g−1(37 ℃,24 h)(关松荫,1986)。
1.3.2 高通量测序
高通量测序土样的取样时间为试验土中酸提取态Cd含量变化稳定时,即为第120天。土壤总DNA采用 E.Z.N.A. ® soil DNA kit(Omega Bio-tek,Norcross,GA,U.S.)按说明书进行提取操作。采用Nanodrop 2000(Thermo,UAS)测定提取后土壤DNA浓度和纯度。纯化、质控后,建立Illumina测序文库,采用Illumina Mi Seq平台进行Paired-end 250测序(美吉生物,上海,http://www.majorbio.com)。测序引物选取细菌16S rRNA V4—V5区域的338F(5′-ACTCCTACGGGAGGCAGCAG-3′) /806R ( 5′-GGACTACHVGGGTWTCTAAT-3′)和真菌 ITS1F(5′-CTTGGTCATTTAGAGGAAGTAA-3′)/ITS2(5′-GCTGCGTTCTTCATCGATGC-3′)。 使 用 fastp(https://github.com/OpenGene/fastp,version 0.20.0)软件和 Flash(http://www.cbcb.umd.edu/software/flash,version 1.2.7)软件对测序结果进行指控和拼接,根据序列两端的序列结构和引物序列得出有效序列,校正序列方向。使用 UPARSE(http://drive5.com/uparse/,version 7.1)软件,根据97%的相似度对序列进行 OTU聚类并剔除嵌合体。利用RDP classifier(http://rdp.cme.msu.edu/,version 2.2)对每条序列与Silva 16S rRNA(version 138)数据库进行比对,获得各个OTU的物种分类信息。
使用MOTHUR(v.1.30.1)对OTU进行α多样性指数分析:
(1)Shannon指数用来反映群落多样性,其值越大,说明群落多样性越高:
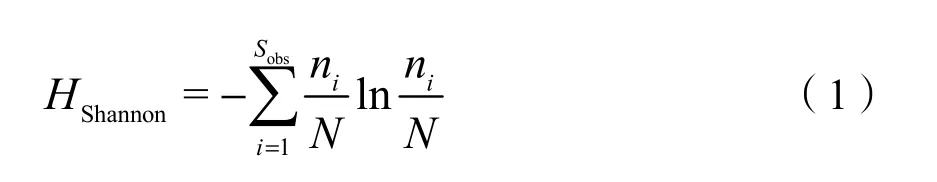
式中:
Sobs——实际观测的OTU数目;
ni——第i个OTU所含的序列数;
N——所有序列数。
(2)Simpson指数通常用来定量描述某一区域的生物多样性,与Shannon多样性指数类似:

式中:
Sobs——实际观测的OTU数目;
ni——第i个OTU所含的序列数;
N——所有序列数。
(3)Ace指数用来评估群落中 OTU数目,反映群落丰富度:

ni——含有i条序列的OTU序列数;
Srare——含有“abund”条序列或者少于“abund”的OTU数目;
Sabund——多于“abund”条序列的OTU数目;
abund——“优势”OTU的阈值,默认为10。
(4)Chao1指数多用来评估物种总数:
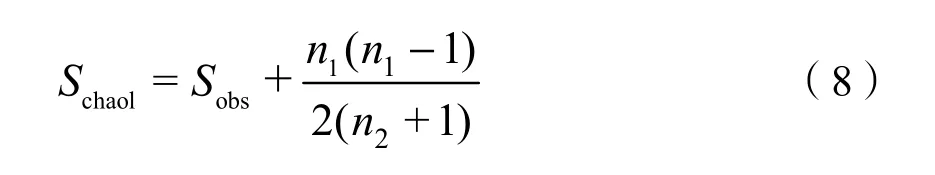
其中:
Sobs——实际观测的OTU数目;
n1——只含有一条序列的OTU数目;
Model Test of Hydrodynamics Behavior of Side-By-Side LNG Bunkering Operation……………LOU Danping, CHEN Xiaoying, YUAN Hongliang(3·7)
n2——只含有两条序列的OTU数目。
利用 R(v.4.1.0)语言“vegan”包进行冗余(Redundancy analysis,RDA)分析和相关性Heatmap分析。在QIIME软件中使用Mantel test对环境因子与微生物群落的相关性进行分析,并通过 R(v.4.1.0)语言“ggplot”包进行可视化分析。
1.4 数据处理与分析
应用SPSS 21.0软件进行不同处理间土壤理化性质的单因素方差分析,采用Duncan进行差异显著性分析。应用Origin Pro 2021b进行数据统计与作图。
2 结果与讨论
2.1 生物炭对土壤Cd形态转化的影响
稻秆生物炭作用下,土壤中4种形态Cd含量均发生了显著性变化,弱酸提取态和可还原态 Cd含量分别降低23.19%和21.64%(图1a、b),可氧化态和残渣态Cd含量分别提高25.62%和28.42%(图1c、d)。此外,在120 d土培期间,酸提取态和可还原态Cd含量表现出逐渐下降的趋势,并在第45天之后,含量变化趋于稳定,同时可氧化态和残渣态Cd含量有逐渐升高的趋势,在第28天后含量变化不显著。本实验进一步采用重金属的移动系数(Zahedifar,2020)评估土壤中Cd的潜在移动性。稻秆生物炭处理后,Cd移动系数显著降低,降幅达33.19%。以上这些结果说明,稻秆生物炭通过45 d的土培能够有效降低土壤酸提取态Cd含量,进而降低Cd危害程度。
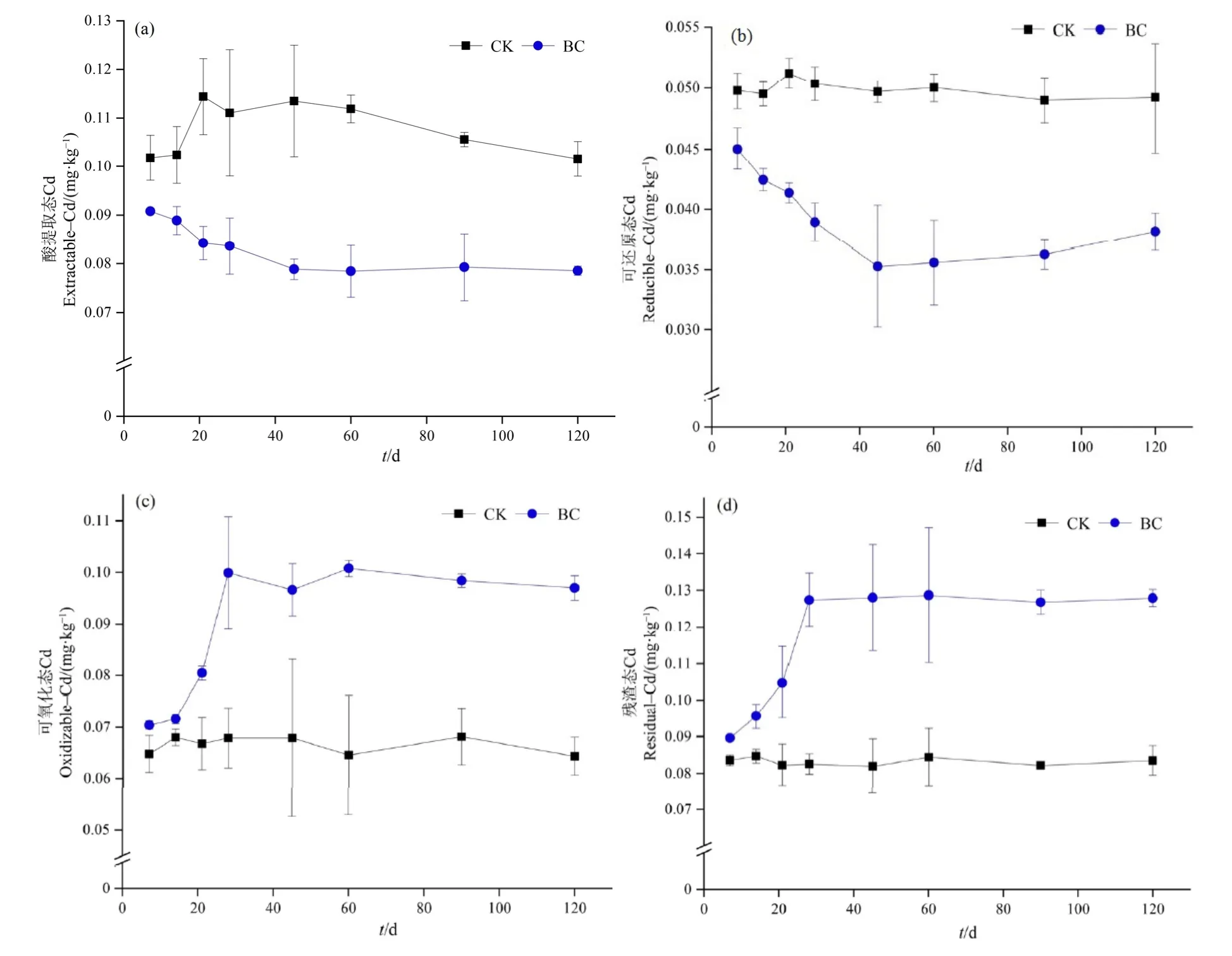
图1 生物炭对Cd形态含量的影响Figure 1 Influence of biochar additions on Cd-fractions content
吴萍萍等(2017)和李洪达等(2018)研究表明,生物炭均能显著降低酸提取态Cd含量和提高残渣态Cd含量。这可能是因为生物炭具有较为疏松的孔隙结构、较大的比表面积和丰富的含氧官能团,从而通过静电吸附、离子交换和官能团络合螯合等作用固定重金属(梅闯等,2021)。另一方面,生物炭还能通过改变土壤酸性环境等(Xiao et al.,2018),促进Cd由酸提取态向残渣态转化,增加稳定态重金属含量。
2.2 生物炭对土壤pH、CEC、SOM和速效养分的影响
稻秆生物炭(BC)处理后,土壤pH值、CEC、SOM、AN、AP和AK的含量均显著提高(图2),其中土壤pH值提升约3个单位(图2a),CEC和SOM含量分别提高9.74%和48.42%(图2b、c),另外,AN、AP和AK速效养分含量分别提高19.17%、49.24%和81.28%(图2d—f)。这些结果表明生物炭可能通过改变土壤pH、CEC、SOM、AN、AP和AK等性质,进而影响Cd化学形态的转化。此外,通过将土壤化学性质与4种Cd形态进行冗余分析(RDA)(图3),结果表明酸提取态Cd与SOM、AK、pH、CEC、AP呈负相关,而残渣态与这些因子呈正相关,其中SOM、AK和pH对Cd形态变化的解释度分别为92.5%、60.3%和41.2%(P<0.05)(表1),可能是影响Cd形态的主要因子。
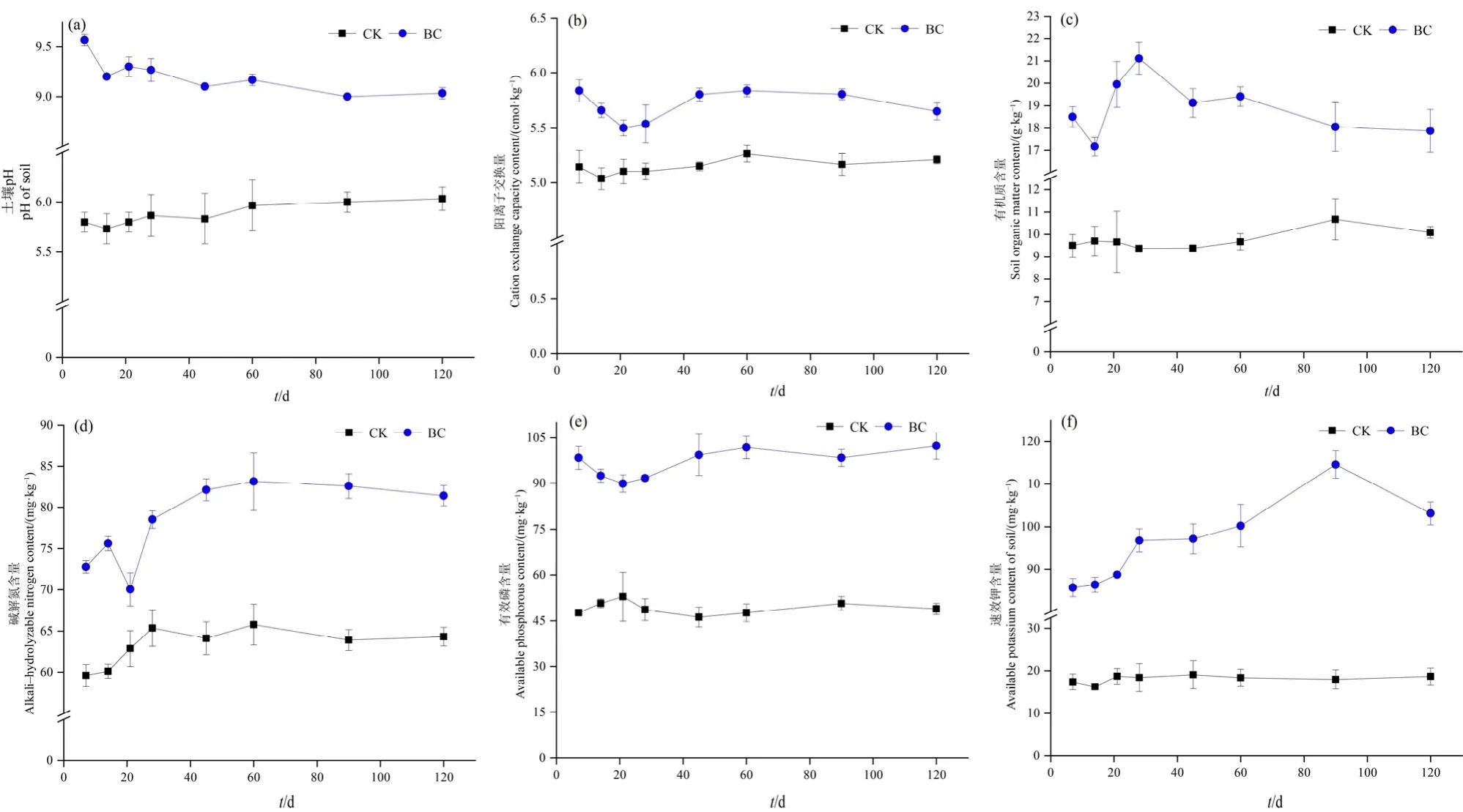
图2 生物炭对土壤化学性质的影响Figure 2 Influence of biochar additions on soil chemical properties
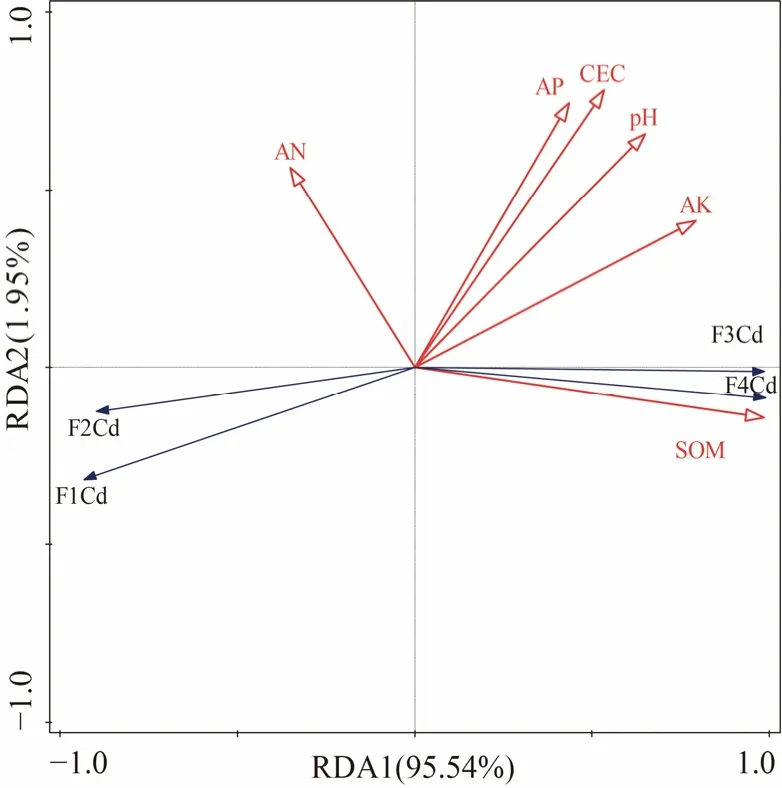
图3 Cd形态与土壤化学性质的冗余(RDA)分析Figure 3 Redundancy analysis between Cd-fractions and soil chemical properties

表1 各指标对Cd形态影响的解释度Table 1 Explanation of the influence of each index on Cd fractions
生物炭可以提高土壤 pH,这很可能是因为生物炭表面存在大量的碳酸盐、微量的金属氧化物和碱性官能团,进而降低土壤中H+离子含量(Yuan et al.,2011),同时,生物炭施入土壤后,表面可能发生氧化还原反应,导致生物炭结构中的含氧官能团种类和数量发生变化而改变其表面的电荷量,进而影响土壤CEC含量(Cui et al.,2016)。类似地,生物炭不仅可以提高有机质含量,还能够影响土壤中有效磷和速效钾等养分含量变化(Bhattacharjya et al.,2016;Berihum et al.,2017;Wang et al.,2017),进而在一定程度上影响重金属形态转化。譬如,吴萍萍等(2017)研究表明稻秆生物炭可以显著提高土壤中有机质含量,且有机质含量与残渣态Cd含量变化呈极显著正相关关系。陈乐等(2020)研究报道稻秆生物炭可以显著增加土壤速效钾含量,使其增加了11.9倍,相关性分析表明土壤速效钾含量与有效态Cd含量呈极显著负相关。进一步地,李光炫等(2021)研究表明在生物炭作用下,土壤pH值、速效氮、有效磷和有效钾等养分含量发生显著变化,而这些变化通过影响土壤微生物群落进而改变重金属形态,比如土壤 pH 值、速效养分与Actinophytocola、Lentzea、Paenarthrobacter等菌属呈极显著正相关,而有效态Cd则与这些菌属呈极显著负相关,同时菌属的丰度发生变化,在一定程度上说明土壤 pH值、速效养分等因素在重金属形态转化过程中发挥着重要的作用。
2.3 生物炭对土壤酶活性的影响
稻秆生物炭作用下,土壤过氧化氢酶、脲酶和蔗糖酶活性显著增强,分别提高71.59%、19.62%和27.69%(图4a—c),在土培过程中,过氧化氢酶活性表现为逐渐上升趋势,脲酶活性呈现先下降后上升的变化规律,蔗糖酶活性变化则不显著。这些酶活性差异可能与酶种类、重金属形态和土壤性质有关。吴春艳等(2006)研究表明重金属Cd对土壤酶活性的抑制效应表现为脲酶>蔗糖酶>过氧化氢酶。于寿娜(2008)研究结果显示,土壤中交换态Cd含量越高,脲酶活性越低,而残渣态Cd含量越高,脲酶活性越高。有研究报道表明土壤中水分含量的高低会显著影响过氧化氢酶活性,当pH值在6.5—7.0范围内时,土壤脲酶活性较高(Kandeler et al.,1997;孟立君等,2004)。重金属对土壤酶活性的作用机理主要是通过影响构成酶的蛋白分子进而改变酶活性,即激活或者抑制效应。另外,改变土壤酶活性的因素较为复杂,需要综合考虑土壤微生物群落、土壤养分、植物等多方面的影响(谭向平等,2022)。

图4 生物炭对土壤酶活性的影响Figure 4 Influence of biochar additions on enzyme activities in soil
2.4 生物炭对土壤微生物群落结构的影响
2.4.1 土壤细菌和真菌多样性指数的变化
从OTU水平上,通过Shannon指数、Simpson指数、Chao1指数和Ace指数来考察生物炭处理后土壤细菌和真菌的 α多样性。Shannon指数和Simpson指数反映了微生物群落的多样性,Chao1指数和Ace指数反映了微生物群落的丰富度。在生物炭处理后,相较于CK,土壤细菌(图5a)和真菌(图5b)Shannon指数均有所降低,但降幅不大,分别为1.99%和3.13%,而细菌和真菌Simpson指数均有所提高,增幅分别达到 16.42%和 27.34%。细菌的Chao1指数和Ace指数均有所下降,降幅分别达到8.78%和8.09%,真菌的Chao1指数和Ace指数变化幅度较小。细菌和真菌多样性指数的改变,说明生物炭添加后,土壤细菌和真菌群落的多样性有所增加,而细菌的丰富度有所下降。
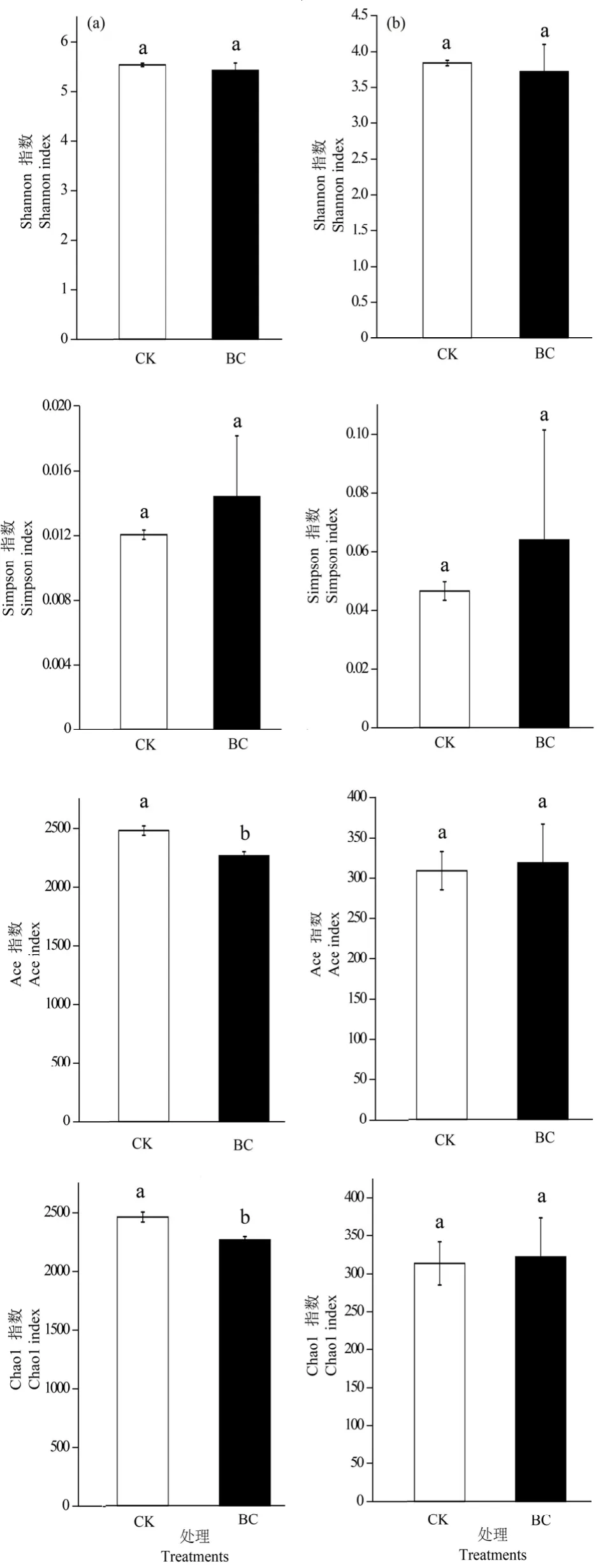
图5 生物炭对微生物多样性指数的影响Figure 5 Influence of biochar additions on the diversity indices of microbe in soil
2.4.2 细菌和真菌门水平物种丰度变化
添加稻秆生物炭后,在门水平上,土壤优势细菌群落可分为以下8个类群(相对丰度大于1%):Proteobacteria(27.76%)、Chloroflexi(21%)、Actinobacteria(15.09%)、Acidobacteria(13%)、Firmicutes(7.98%)、Bacteroidota(6.62%)、Patescibacteria(2.46%)、Gemmatimonadota(3.69%)(图6a)。生物炭作用后,土壤中 Proteobacteria、Acidobacteria、Gemmatimonadota等细菌丰度减少,而 Chloroflexi、Actinobacteria、Firmicutes、Patescibacteria等丰度增加。类似地,有研究报道Firmicutes是 Cd污染土壤中普遍存在的关键门类群之一(Wang et al.,2021)。Wang et al.(2021)等报道了在Cd污染土壤中Bacteroidetes和Firmicutes的丰度显著增加。黄家庆等(2020)研究表明,生物炭处理对 Cd污染土壤中 Firmicutes、Acidobacteria的丰度影响较小,而显著增加Chloroflexi的丰度。同样地,在门水平上,相对丰度大于1%的土壤真菌群落可分为以下4个类群:Ascomycota(63.03%)、Chytridiomycota(19.35%)、Unclassified(9.74%)、Basidiomycota(7.31%)(图6b)。生物炭处理后,土壤中 Ascomycota、Chytridiomycota、Basidiomycota等真菌丰度下降,Mortierellomycota(1.01%)丰度升高。Wang et al.(2021)报道了在Cd污染土壤中Basidiomycota和Mortierellomycota的丰度显著增加。

图6 门水平上土壤优势细菌和真菌的相对丰度变化Figure 6 Relative abundance of soil dominant microbe community at the phylum level
2.4.3 细菌和真菌属水平物种丰度变化
在属水平上,土壤细菌可分为15个类群(相对丰度大于1%),主要有:Sphingomonas、Marmoricola、Flavisolibacter、Bacillus、Intrasporangium、Stenotrophobacter、Microvirga、Mycobacterium、Nocardioides、Gemmatimonas、TM7a、Streptomyces、Luteimonas、Tellurimicrobium、Halobacillus等(图7a)。在重金属形态的转变过程中可能发挥重要作用的优势菌包括Bacillus和Streptomyces(Sahmoune,2018;Selvin et al.,2009)。类似地,黄家庆等(2020)研究发现,在Cd污染土壤中,Streptomyces的丰度变化幅度小。Wang et al.(2021)研究发现,生物炭可以显著提高 Cd污染土壤中Bacillus的丰度。同样地,土壤真菌群落在属水平上,可分为15个类群(相对丰度大于1%),主要有:Penicillium、Westerdykella、Talaromyces、Fusarium、Thielavia、Curvularia、Saitozyma、Aspergillus、Spizellomyces、Scolecobasidium、Psathyrella、Phoma、Chaetomium、Mortierella、Stachybotrys等(图7b)。其中,同样发现影响重金属形态转变的真菌菌属,如Aspergillus等丰度发生变化(Fazli et al.,2015)。以上研究表明,稻秆生物炭的添加可以显著改变土壤中细菌和真菌群落丰度,这些变化很可能在重金属Cd形态转化过程中发挥关键作用(Zhu et al.,2017)。
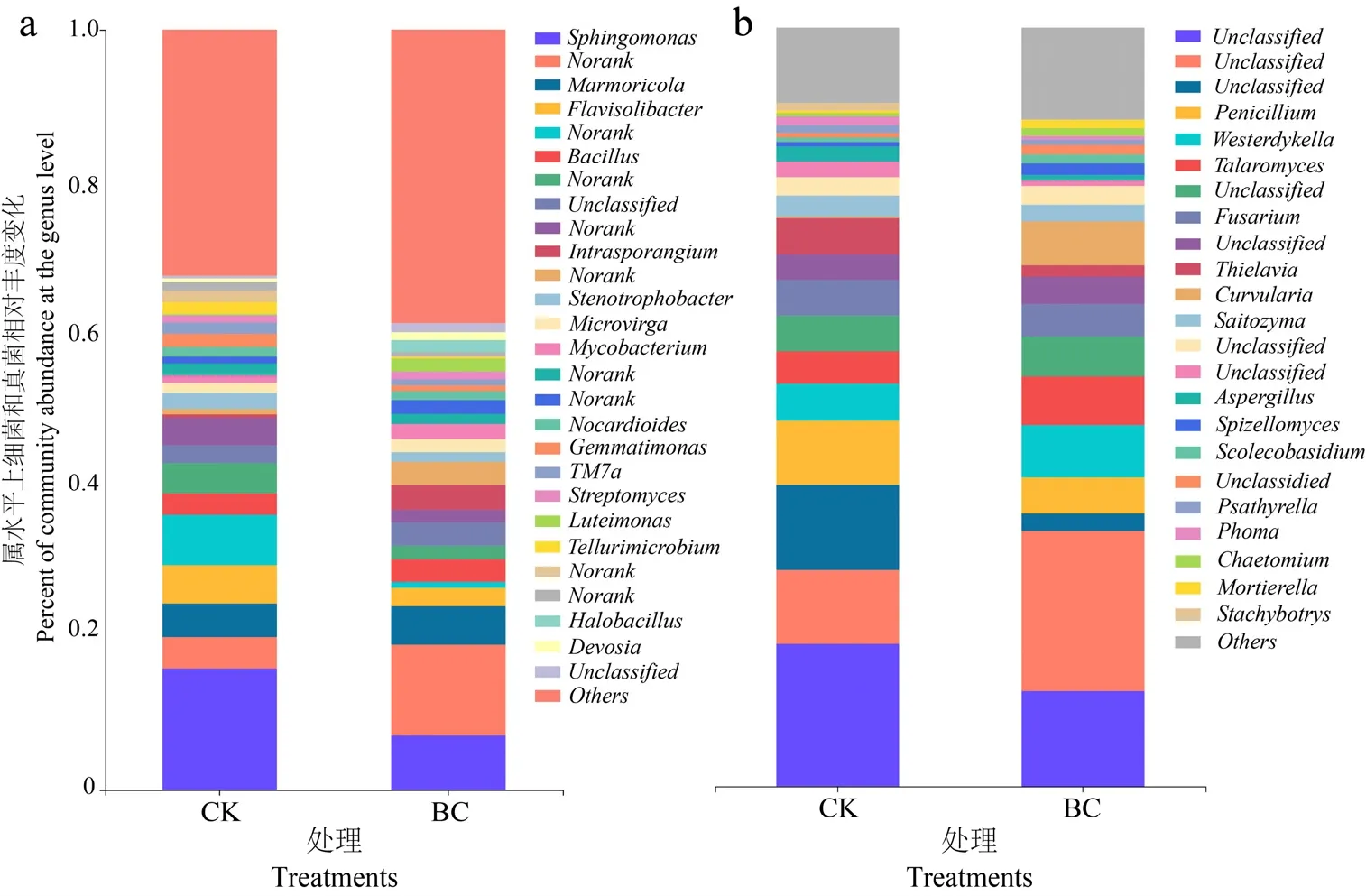
图7 属水平上土壤优势细菌和真菌的相对丰度变化Figure 7 Relative abundance of soil dominant microbe community at the genus level
2.4.4 土壤细菌和真菌群落与环境因子的相关性分析
为进一步认识土壤Cd形态、化学性质、酶活性和优势细菌或真菌的相关性,将其与OTU注释到的门水平上的10个细菌和真菌类群进行Mantel test分析(图8)。其中,环境因子主要包括土壤pH值、CEC、SOM、速效养分(AN、AP、AK)含量、酶活性(过氧化氢酶、脲酶和蔗糖酶)。细菌群落与土壤pH、SOM、AP和AK存在极显著相关性(P<0.001,R>0.5),而真菌群落与环境因子之间的相关性不高。本研究进一步对门水平上细菌和真菌各优势类群与环境因子的关系,进行 Spearman相关性分析(P<0.05),根据显著性作出热图,见图9。Heatmap结果表明,在细菌群落中(图9a),Acidobacteria、Actinobacteria、Gemmatimonadota、Myxococcota等与pH、SOM、AN和AK存在显著相关性,Others与土壤中各形态Cd之间存在极显著关系;而在真菌群落中(图9b),除AP、CA、UA 之外,Monoblepharomycota、Basidiomycota、Unclassified等与其他环境因子均存在一定相关性。这些结果表明,细菌群落相较于真菌群落,可能更容易受到环境因子的影响。进一步说明,稻秆生物炭可以通过影响土壤pH、SOM、AK、土壤酶活性以及功能细菌和真菌菌属丰度,进而不断影响 Cd形态的转变过程。
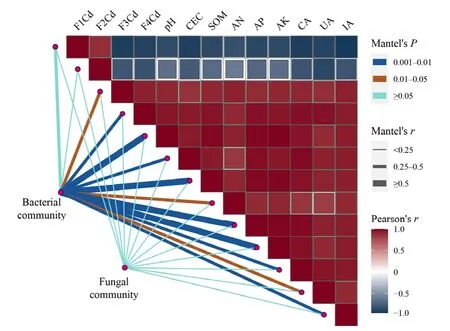
图8 细菌和真菌群落与环境因子的Mantel test分析Figure 8 Relationships between soil variables and microbial community structures

图9 门水平上土壤优势微生物类群与环境因子的Heatmap分析Figure 9 Correlation heat map of bacterial phyla and of fungal phyla with soil properties
3 结论
生物炭对轻度镉污染稻田土壤修复效果显著,在降低镉有效性的同时也改善了土壤环境,提高土壤中养分含量。本研究通过土培试验探讨了生物炭对Cd形态含量变化、影响Cd形态的关键因子和土壤细菌、真菌群落结构的变化等。主要结论如下:
(1)稻秆生物炭作用下,土壤酸提取态和可还原态Cd含量分别降低23.19%和21.64%,可氧化态和残渣态Cd含量分别提高25.62%和28.62%,这有利于促进重金属由不稳定态向稳定形态转变。
(2)稻秆生物炭能够显著影响土壤化学性质,包括土壤pH、CEC、SOM和AN、AP、AK等养分含量。RDA分析结果表明,土壤中SOM、AK和pH可能是土壤Cd形态转化的关键因素。另外,土壤中过氧化氢酶、脲酶和蔗糖酶活性分别提高71.59%、19.62%和27.69%。
(3)稻秆生物炭可提高土壤中细菌和真菌群落多样性,改变优势类群的丰度,其中影响重金属形态的功能菌种主要包括Bacillus、Streptomyces、Aspergillus等,而且细菌群落相较于真菌群落,可能更容易受到土壤化学性质的影响。
