双靶新辅助治疗HER-2阳性乳腺癌的疗效及MRI参数变化*
2022-04-16黄晓星王星蕊肖学红陈怡王志龙
黄晓星 王星蕊 肖学红 陈怡 王志龙
(中山市人民医院 1.MRI室;2.乳腺中心,广东 中山 528403)
乳腺癌是女性最常见的恶性肿瘤,位居女性恶性肿瘤发病的首位,严重威胁女性生命健康。研究[1]表明,部分乳腺癌患者存在人表皮生长因子受体-2(Human epidermal growth factor receptor-2,HER-2)过表达的情况,且HER-2过表达在乳腺癌的发生、发展过程中起到重要的作用。近年,随着抗HER靶向治疗药物曲妥珠单抗、帕妥珠单抗的陆续应用,逐渐成为HER-2阳性乳腺癌的标准化疗方案[2-3]。两者联合治疗能抑制HER-2及受体的异二聚化[4],进而有效抑制肿瘤进展,HER-2阳性乳腺癌患者的生存率因此得到明显改善。应用影像学检查方法准确评估肿瘤对药物的敏感性,有助于治疗方案的调整和改良。因此本研究通过分析双靶药物联合新辅助治疗对HER-2阳性乳腺癌的疗效,同时观察其磁共振成像(Magnetic resonance imaging,MRI)的参数变化,探讨MRI参数对HER-2阳性乳腺癌疗效的预测价值,以期为患者临床合理用药及疗效评估提供可靠的依据。
1 资料与方法
1.1 临床资料 选取2019年1月~2020年3月于本院收治的112例乳腺癌患者,根据治疗方式分为TCH组[多西他赛(T)+卡铂(C)+曲妥珠单抗(H)]和TCHP组[多西他赛(T)+卡铂(C)+曲妥珠单抗(H)+帕妥珠单抗(P)]各56例。纳入标准:①符合临床上乳腺癌的诊断标准[5],经组织学、病理学诊断为HER-2阳性[6]。②接受新辅助治疗方案。③MRI疗效评价完整。④患者对研究了解知情。排除标准:①妊娠期、孕期妇女。②影像学检查图像质量较差,无法测量数据。③对治疗药物成分过敏,对化疗等手术治疗有禁忌证。④合并其他恶性肿瘤。⑤同时参与其他临床实验。⑥临床病理资料不全。本研究经医院医学伦理委员会批准。
1.2 方法 治疗前患者行腋窝淋巴结清扫术,以及腋窝淋巴结空芯针穿刺活检。TCH组于末次化疗结束后1~2周进行新辅助治疗,多西他赛75 mg/m2,卡铂血药浓度-时间曲线下面积6 mg/(mL·min),曲妥珠单抗第一次8 mg/kg,之后6 mg/kg,每3周重复。TCHP组则接受双靶新辅助治疗,治疗方案为多西他赛75 mg/m2、卡铂血药浓度-时间曲线下面积(AUC)为6 mg/(mL·min)、曲妥珠单抗首次8 mg/kg,之后6 mg/kg;帕妥珠单抗第一次840 mg,之后420 mg/3周,双靶新辅助治疗6个周期后2周实施乳腺癌改良根治术,并进行病理学评估。MRI检查:MRI检查分别于术前及双靶新辅助化疗每2个周期后1周进行检查,使用荷兰Philips公司3.0T磁共振扫描仪,使用专用乳腺线圈,嘱咐患者取俯卧位,MRI平扫序列参数:①T1WI序列,TR569 ms,TE8 ms,层厚6 mm,层间距1 mm。②T2WI序列,TR3240 ms,TE105 ms,层厚6 mm,间距1 mm。③DWI序列,TR3052 ms,TE62 ms,层厚6 mm,间距1 mm。④DCE-MRI序列,TR4.2 ms,TE2 ms,层厚6 mm,间距1 mm。增强扫描时注射对比剂钆喷酸葡胺溶液,用量0.2 mL/kg,速率为2 mL/s,于7 s内快速静脉推注完毕。增强前先蒙片扫描,于增强对比剂注射完毕后开始连续动态扫描5个时相,每一时相间隔70 s。图像分析:阅片分析工作由两位资深放射科医师共同进行,当两者意见不同时则咨询上一级医师。图像数据处理:数据经传输至Philips工作站ISP后进行图像处理,先手动寻找病灶,选择强化最明显的区域设为感兴趣区(ROI),尽可能避开出血、液化、囊变、坏死区及避免病灶边缘容积效应等,通过软件测绘感兴趣区的表观弥散系数(Apparent diffusion coefficient,ADC)值和时间信号强度曲线(Time intensity curve,TIC),记录曲线上各时间点对应的静态指标,注意DWI图像中ROI选择扩散受限较显著及相邻的层面,若化疗每二个周期后无明显扩散受限,应在对应图像层面选取化疗前肿瘤所在部位测量,保持基本一致。同时测量注射对比剂后病灶最长径、达峰时间(达到最大信号强度的时间),测量3次取平均值,计算早期强化率(Early phase enhancement rate,EER)=(SI1min-SI0)/SI0。
1.3 疗效及安全性评估 ①病理疗效评估:根据Miller组织学分级[7],对比患者治疗前后空芯针穿刺标本和病理标本,G1:化疗无效,癌细胞形态、数目无变化;G2:轻度有效,癌细胞变性、坏死,反应面积<1/3;G3:中度有效,肿瘤细胞溶解,反应面积为治疗前标本细胞的1/3~2/3;G4:高度有效,肿瘤细胞溶解、坏死,反应面积>2/3;G5:病理完全缓解(Pathological complete remission,pCR),癌细胞全部坏死、消失,肿瘤被纤维组织、肉芽取代。本研究定义有效率=G3+G4+G5。②MRI疗效评估[8]。完全缓解(CR):未发现肿瘤残留;部分缓解(PR):治疗后肿瘤最长径缩小>30%;疾病稳定(SD):治疗后肿瘤最长径缩小未达PR或者是增大未达PD;疾病进展(PD):治疗后肿瘤最长径增大>20%。有效率=CR+PR。③安全性评估,由专业药师对患者临床不良反应进行记录,评估其治疗方案安全性。
1.4 随访 随访时间为1年,通过门诊、电话方式随访,术后1个月随访一次,之后3个月一次,6个月一次,全部HER-2阳性乳腺癌患者定期随访至2020年8月或至疾病有进展时截止。同时统计分析中位生存期以及1年生存率,生存期为入组至末次随访日期或死亡,以月为单位,已死亡者当作完全数据。
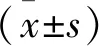
2 结果
2.1 两组患者一般资料比较 TCH组平均年龄(36.57±10.38)岁,BMI(22.37±3.08)kg/m2,肿瘤分期T1 10例、T2 35例、T3 11例;TCHP组平均年龄(35.89±11.02)岁,BMI(22.56±3.19)kg/m2,肿瘤分期T1 9例、T2 37例、T3 10例。两组组间一般资料比较差异均无统计学意义(均P>0.05)。
2.2 两组患者MRI检测疗效比较 TCHP组的MRI检测有效率高于TCH组(P<0.05),见表1。

表1 两组患者MRI检测疗效比较[n(×10-2)]Table 1 Comparison of the efficacy of MRI detection between the two groups of patients
2.3 两组患者病理疗效比较 TCHP组的病理检测有效率高于TCH组(P<0.05),见表2。
表2 两组患者病理疗效比较[n(×10-2)]Table 2 Comparison of pathological efficacy between the two groups of patients
2.4 两组患者MRI检测结果比较 术前及双靶新辅助化疗每二个周期后1周行MRI检查,分析最后一次化疗后的MRI检测结果显示,非pCR与pCR患者的达峰时间比较差异无统计学意义(P>0.05);而非pCR与pCR患者的ADC值、肿瘤最大长径、EER、TIC、强化模式比较差异有统计学意义(P<0.05),见表3。

表3 两组患者MRI检测结果比较Table 3 Comparison of MRI test results of the two groups of patients
2.5 MRI各参数对HER-2阳性乳腺癌患者pCR的预测价值 采用ROC曲线分析MRI各序列参数对HER-2阳性乳腺癌pCR的预测价值,ADC值、肿瘤最大长径、EER预测HER-2阳性乳腺癌患者pCR的AUC分别为0.802、0.755、0.767,临界值分别为1.18×103mm2/s、33.43 mm、109.98%;联合预测的AUC为0.891,且联合预测的AUC高于单一预测(P<0.05),见表4、图1。
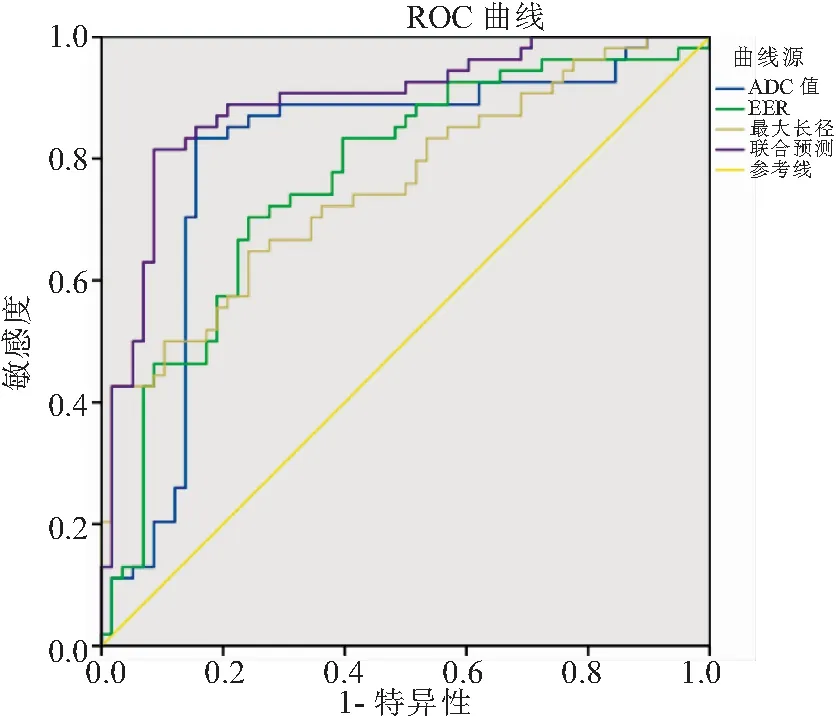
图1 MRI各参数及联合预测HER-2阳性乳腺癌pCR的ROC曲线Figure 1 The ROC curve of MRI parameters and the combined prediction of pCR for HER-2 positive breast cancer
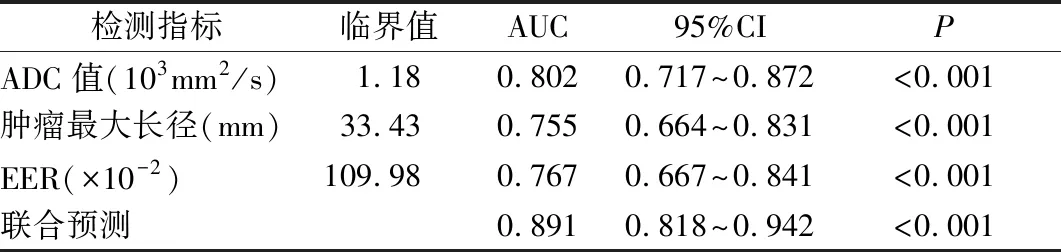
表4 MRI各参数对HER-2阳性乳腺癌患者pCR的预测价值Table 4 Predictive value of MRI parameters for pCR in patients with HER-2 positive breast cancer
2.6 两组患者1年生存率比较 所有患者随访截至2020年8月,无失访患者。结果显示,TCHP组患者的1年生存率为92.73%,TCH组患者的1年生存率为78.78%,TCHP组患者的1年生存率高于TCH组患者,差异有统计学意义(χ2=4.192,P=0.041),见图2。
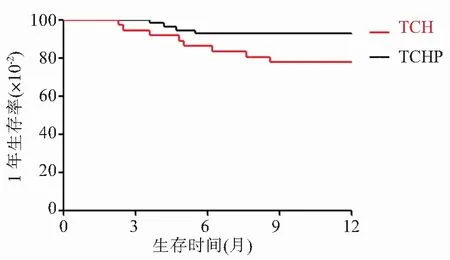
图2 TCHP组与TCH组患者的1年生存率Figure 2 1-year survival rate of patients in TCHP group and TCH group
2.7 两组患者安全性评估 治疗期间两组患者按计划完成治疗,未出现3级以上不良事件,其中TCH组患者有恶心、呕吐各2例,乏力1例,TCHP组出现1例恶心、1例乏力。两组不良事件发生率比较差异无统计学意义(P>0.05)。
2.8 治疗前后乳腺组织MRI影像学变化 治疗前行MRI平扫,浸润性导管癌Ⅱ级,ADC值1.19×10-3mm2/s(图3),TIC评估Ⅲ型(图4);该患者治疗6个周期后行MRI平扫,ADC值1.65×10-3mm2/s(图5),TIC评估Ⅱ型,未见脉管及神经束侵犯,淋巴结未见肿瘤(图6)。
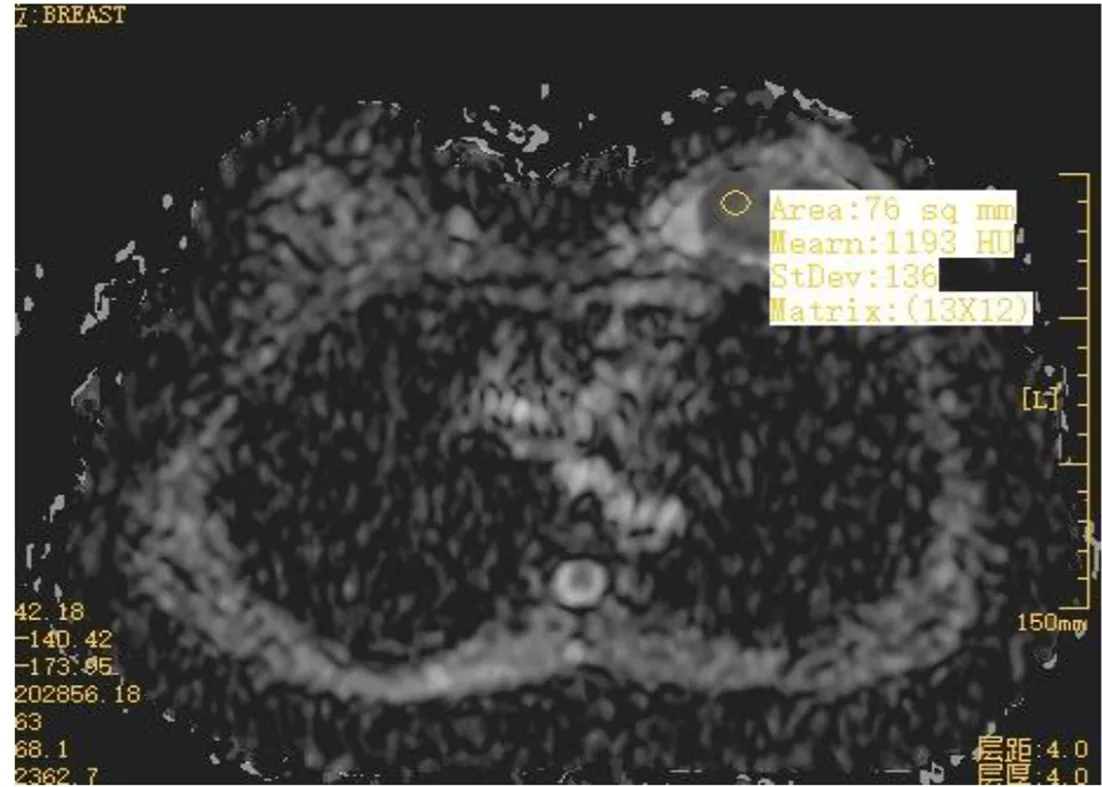
图3 治疗前MRI平扫Figure 3 MRI scan before treatment
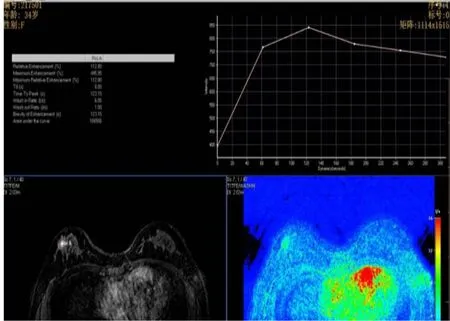
图4 治疗前MRI平扫时间-信号曲线Figure 4 MRI scan time signal curve before treatment
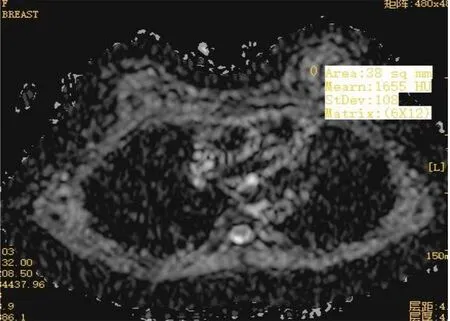
图5 治疗6个周期后MRI平扫Figure 5 MRI plain scan after 6 cycles of treatment
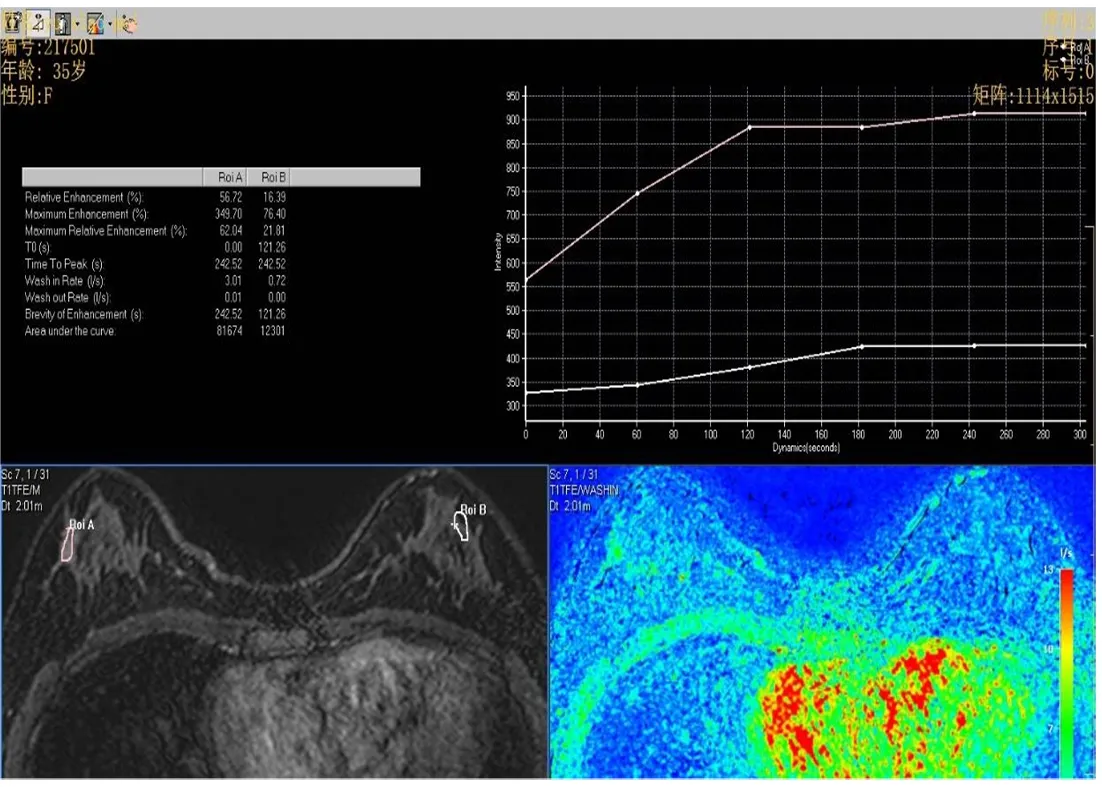
图6 治疗6个周期后MRI平扫时间-信号曲线Figure 6 After 6 cycles of treatment, MRI scanning time-signal curve
3 讨论
随着各种临床实践的不断发展,新辅助化疗的模式也从既往的单一化疗逐渐转变成基于不同乳腺癌分子亚型的新辅助化疗、新辅助抗HER-2靶向治疗联合化疗等[9-11]。新辅助治疗的目的是将不可手术的乳腺癌患者降期为可手术患者,首选对象多为不可手术乳腺癌患者(N2、T4及以上)。但目前的主要难点在于如何寻找合适的治疗方案帮助医师尽快有效地实施手术。有研究[12]表明,靶向药物曲妥珠单抗联合化疗的基础上加用帕妥珠单抗,可提高完全缓解率和五年无进展生存率。同样,2019年国家药品监督局批准帕妥珠单抗和曲妥珠单抗联合化疗的方案是HER-2阳性乳腺癌新辅助治疗的唯一双靶治疗方案。有专家[13-14]认为,需降期的患者可优选MRI作为新辅助治疗的评估方式。因而本研究联合影像学方面,综合分析双靶新辅助治疗HER-2阳性乳腺癌的疗效,为本研究创新之处。
随着研究不断深入,以及帕妥珠药物在国内投入临床使用,双靶向药物联合新辅助治疗(TCHP)方案已成为HER-2阳性乳腺癌的临床一线治疗方案[15-16]。近年的一项临床研究[17]表明,TCHP的pCR率可达66.2%。本研究接受TCHP方案的患者,pCR率为58.93%;而接受TCH方案的患者,pCR率为37.50%,与早前学者报道39%的pCR率较为接近[18]。提示TCHP方案具有较好的pCR率。同时本研究结果显示,TCHP组的有效率为82.14%,TCH组的有效率为58.93%,与较早前国内研究[19]的结果基本一致;而两组的MRI检查疗效评价结果中,TCHP组的有效率为78.57%,TCH组的有效率为60.71%。提示TCHP方案对HER-2阳性乳腺癌具有较好的有效率,并且TCHP方案不含蒽环类药物,对心肌毒性作用较低,适应范围较广,尤其是存在心脏功能疾病的乳腺癌患者。
关于MRI参数评估HER-2阳性乳腺癌新辅助治疗的疗效,既往研究[20-22]指出,相较阴性患者,HER-2阳性患者ADC值明显较高,淋巴细胞浸润更为显著。本研究典型病例亦体现这一点:ADC值从分子微观结构展示药物治疗前后肿瘤的变化,说明其对患者pCR具有较好的预测价值;与之类似,本研究所有患者行MRI检查的结果显示,除达峰时间外,pCR与非pCR患者的ADC值、肿瘤最大长径、EER、TIC、强化模式比较差异均有统计学意义(P<0.01)。在典型病例中,该患者接受TCHP治疗后,肿瘤血管趋向成熟,不成熟血管减少,TIC形态由高级别向低级别转变,提示肿瘤侵袭性减弱。由于TIC评估可能由于肿瘤组织密度略高于正常组织,曲线类型不典型,加上肿瘤侵袭性虽已减弱,却未见病理学明显改变,可能造成疗效评估失准。故而选取其中差异最显著的ADC值、肿瘤最大长径、EER来对HER-2阳性乳腺癌患者pCR的预测价值进行ROC曲线分析,结果显示上述参数值联合预测的AUC为0.891,明显高于单一预测,提示ADC值、肿瘤最大长径、EER联合预测HER-2阳性乳腺癌患者pCR价值较高,与早前的相关研究观点类似[23]。分析原因,可能是肿瘤最大长径在新辅助化疗初期的影像学变化迟于生理学的变化,且肿瘤周围因治疗而导致炎性反应增加产生水肿,MRI扫描时可能有假阳性结果,进而低估疗效;而三项参数值联合诊断,可弥补单一预测的不足,提高评估效能。这提示临床可将MRI多参数应用于乳腺癌患者的术后疗效评估,以期改良后期治疗方案。
最后,在对入组的HER-2阳性乳腺癌患者一年的随访过程中结果显示,接受TCHP治疗患者的1年生存率高于TCH治疗患者,且两组不良反应发生率比较差异无统计学意义(P>0.05)。表明本研究TCHP方案进行新辅助治疗的患者1年生存率较高,安全性较好。近些年关于新辅助治疗的安全性分析并不多见,且以回顾性分析为主[24-25],国外也有研究[26]显示,TCHP方案能较好地减少复发转移事件的发生率,生存率高。同时本研究尚存样本量偏少和未对远期疗效进行分析的局限性,今后有望开展更全面的研究以证实其临床价值。
4 结论
本研究结果显示,应用TCHP方案治疗HER-2阳性乳腺癌患者,疗效良好,1年生存率高,安全性较好,同时pCR与非pCR患者的MRI参数具有差异,ADC值、肿瘤最大长径、EER联合评估,可有效提高患者pCR的预测价值。
