慢病毒介导的FLOT2基因沉默影响结肠癌细胞生物学功能的影响及机制
2022-04-16伍班名张涛张秀容钟寒迪王桂林
伍班名 张涛 张秀容 钟寒迪 王桂林
(宜宾市第二人民医院 1.急诊科;2.检验科;3.胃肠外科,四川 宜宾 644000)
结肠癌是常见的恶性肿瘤之一,近些年的发病率和死亡率升高,严重威胁人们健康及生命[1]。基因治疗作为近年来一种新的肿瘤诊疗手段引起了广泛关注。基因治疗是通过向靶组织或细胞导入外源DNA或RNA片段,使致病基因表达水平降低或治疗基因表达增强,从而达到治疗的目的[2]。因此,寻找影响结肠癌发生发展的有效基因并对其功能确认,对于肿瘤治疗具有重要意义。近些年,脂筏结构蛋白2(Flotillin-2,FLOT2)基因引起了广大学者的关注。人FLOT2基因定位于17q11-12上,多项研究[3-5]发现,FLOT2的高表达可影响乳腺癌、鼻咽癌、口腔鳞状细胞癌等肿瘤细胞生长,可能成为抗肿瘤治疗靶点。另有研究[6]发现,结直肠癌组织及细胞FLOT2表达升高,其表达与浸润深度、淋巴结转移、远处转移等有关,但FLOT2对结肠癌细胞生物学特性及机制研究尚未明确。因此,本研究旨在通过将FLOT2 siRNA慢病毒载体转染结肠癌细胞,观察细胞增殖、侵袭迁移及凋亡率变化,并进一步研究其机制。
1 材料与方法
1.1 组织样本 选取2018年10月~2019年5月在我院行住院手术治疗的结直肠癌患者肿瘤及癌旁组织(距癌变部位大于5 cm)标本,共40对,其中男性16例,女性24例。所有组织切除后即刻送往实验室冲洗干净,然后放置在液氮罐中冷冻,在-80℃冰箱保存。所有患者经过病理确诊,且相关病历及治疗完整;术前均未行放化疗及靶向药物治疗等干预措施;患者无其他组织或器官的恶性肿瘤。样本采集经过患者知情同意,签署知情同意书,并经过医院伦理委员会批准。
1.2 试剂和仪器 胎牛血清、DMEM培养基、胰酶均购自美国Hyclone公司,RNA提取试剂盒购自北京天根生化科技有限公司,反转录试剂盒购自日本TAKARA公司,FLOT2、PCNA、cleaved caspase3、E-cadherin和Vimentin抗体均购自美国Abcam,MTT、DMSO均购自美国Sigma公司,Transwell小室购自美国corning公司,细胞凋亡试剂盒购自美国Invitrogen公司,PCR仪购自美国Bio-Rad公司,紫外分光光度计购自美国Perkin Elmar公司,酶标仪购自美国Thermo公司,流式细胞仪购自美国BD。
1.3 细胞及培养 人正常结肠上皮细胞NCM460及结肠癌LoVo、SW480及HT29细胞均购自美国ATCC。细胞常规复苏后,置于5%CO2、37℃恒温培养箱,使用含有10%胎牛血清的DMEM培养基培养。实验为生长至对数期的细胞。
1.4 qRT-PCR检测RNA表达水平 根据RNA抽提试剂盒说明提取组织及细胞总RNA,利用分光光度仪检测RNA的浓度及纯度,将总RNA逆转录为cDNA。设计FLOT2引物:F:5′-GGCTTGTGAGCAGTTTCTGG-3′,R:5′-TCGAAGGCTCGCTTAGAGTC-3′;内参GAPDH引物:F:5′-ACCACAGTCCATGCCATCAC-3′,R:5′-TCCACCACCCTGTTGCTGT-3′。PCR反应体系:SYBR Green 10 μL,上下游引物:各0.5 μL,cDNA 1 μL,加入ddH2O至20 μL。反应条件为95℃ 5 min,接着35个循环,95℃ 30 s,60℃ 30 s。采用2-△△Ct法计算FLOT2 mRNA相对表达水平。设置5个复孔,实验重复3次。
1.5 Western blot检测蛋白水平 细胞中加入适量RIPA裂解液,裂解反应结束后,离心,上清即为提取蛋白。蛋白与上样缓冲液混匀后在100℃变性5 min,取等量变性蛋白上样,经SDS-PAGE分离,电泳结束后转PVDF膜。洗膜,5%脱脂奶粉封闭膜,1 h后加一抗工作液,4℃孵育过夜,洗膜,加入HRP标记的二抗,37℃孵育1 h。洗膜,ECL显色,Bio-Rad扫描分析。以检测的目的蛋白与内参GAPDH灰度值比值作为目的蛋白相对表达量。实验重复3次。
1.6 分组及慢病毒转染 以2×105/孔接种生长至对数期的LoVo细胞和SW480细胞于24孔板,于培养箱内常规培养。实验分为空白组(细胞未感染)、si-NC组(空载体慢病毒感染)和si-FLOT2组(FLOT2 siRNA慢病毒感染)。观察到细胞达70%生长密度时,将病毒稀释液(MOI=30)依照分组加入到相应的孔内,感染5 d,细胞感染效率达到80%时,继续孵育48 h。加入4 μg/mL嘌呤霉素以筛选FLOT2表达沉默的细胞株。采用qRT-PCR及Western blot检测转染后的细胞FLOT2的感染效果。
1.7 MTT实验检测细胞增殖能力 取转染后处于生长至对数期的LoVo细胞和SW480细胞,制备成单细胞悬液,细胞计数后将浓度调整为1×104个/mL,96孔板每孔加100 μL细胞悬液,于培养箱内常规培养,每组5个复孔,设置24、48和72 h三个时间梯度加MTT液,每孔20 μL,培养箱内常规培养2 h,弃掉孔内上清,在每孔中加100 μL DMSO,结晶溶解后,酶标仪测定490 nm波长光密度值(OD)。实验重复3次。
1.8 Transwell实验检测侵袭、迁移能力 细胞侵袭检测:首先将Transwell小室底部膜上室面使用Matrigel稀释液包被,4℃风干。吸出残余在培养板中液体,按照50 μL/孔加无血清培养液,37℃,30 min。将小室放入培养板中,上室中加无血清培养基300 μL,室温静置30 min,以使基质胶再水化。细胞悬液制备前可饥饿处理细胞12~24 h,以进一步除去血清的影响。胰酶消化细胞,细胞计数后将密度调整为1×105个/mL,小室上室中加100 μL细胞悬液,下室中加含血清培养基500 μL,于培养箱培养24 h。使用棉签轻轻擦去上室内细胞及基质胶,取出小室,倒置风干后,0.1%结晶紫染色,37℃ 30 min取出。PBS清洗,显微镜下随机选择5个视野,照相,计数。实验重复3次。细胞迁移检测:实验步骤同细胞侵袭实验,差异在于Transwell小室底部膜上室面未铺Matrigel。
1.9 流式细胞术检测细胞凋亡实验 收集慢病毒感染48 h的各组LoVo细胞和SW480细胞,胰酶消化、计数细胞,使1 mL细胞悬液中至少含1×106个细胞,预冷PBS洗涤细胞,离心,加入300 μL结合缓冲液重悬细胞,使其浓度大于1×105/mL,避光环境分别加入5 μL的AnnexinV-FITC和PI工作液,混匀,室温避光反应15~20 min。上机检测前补加500 μL结合缓冲液,1 h内通过流式细胞仪检测各组细胞凋亡率。实验重复3次。
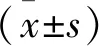
2 结果
2.1 结肠癌组织及细胞FLOT2的表达 通过qRT-PCR检测结直肠癌组织及人正常结肠上皮细胞NCM460及结肠癌LoVo、SW480及HT29细胞FLOT2的表达水平,Western blot检测结肠癌细胞FLOT2蛋白水平,与癌旁组织FLOT2水平比较,结直肠癌组织FLOT2表达水平明显升高(P<0.05),与NCM460细胞比较,FLOT2在三个结肠癌细胞mRNA及蛋白表达水平均明显升高(P<0.05),见图1、表1。

表1 不同结肠癌细胞FLOT2 mRNA及蛋白相对表达水平Table 1 The relative expression levels of FLOT2 mRNA and protein in different colon cancer cells

图1 Western blot检测结肠癌细胞FLOT2的表达Figure 1 Western blot detection of FLOT2 expression in colon cancer cells
2.2 慢病毒感染后LoVo细胞和SW480细胞FLOT2表达 慢病毒感染LoVo细胞和SW480细胞后,采用qRT-PCR及Western blot检测各组细胞FLOT2表达水平,结果显示,两株细胞空白组和si-NC组FLOT2表达比较差异无统计学意义(P>0.05),而si-FLOT2组FLOT2 mRNA及蛋白表达水平均明显低于空白组(均P<0.05),见图2、表2。
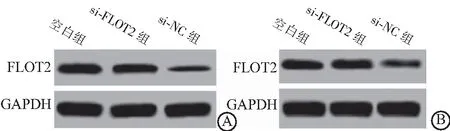
图2 慢病毒感染后LoVo细胞和SW480细胞FLOT2表达水平Figure 2 FLOT2 expression levels in LoVo cells and SW480 cells after lentivirus infection注:A.LoVo细胞;B.SW480细胞
表2 LoVo细胞和SW480细胞FLOT2 mRNA及蛋白相对表达水平Table 2 Relative expression levels of FLOT2 mRNA and protein in LoVo cells and SW480 cells
2.3 抑制FLOT2表达对LoVo细胞和SW480细胞增殖活力的影响 MTT法检测抑制FLOT2后的LoVo细胞和SW480细胞增殖能力,两株细胞si-NC组与空白组在三个时间点细胞增殖能力比较差异均无统计学意义(P>0.05),而si-FLOT2组从48 h起细胞增殖能力明显低于空白组(P<0.05),见表3。

表3 各组LoVo细胞和SW480细胞OD值Table 3 OD values of LoVo cells and SW480 cells in each group
2.4 抑制FLOT2表达对LoVo细胞和SW480细胞侵袭迁移能力的影响 Transwell小室检测FLOT2 siRNA慢病毒感染LoVo细胞和SW480细胞48 h的细胞侵袭迁移能力,结果显示,抑制LoVo细胞SW480细胞FLOT2表达后,细胞侵袭和迁移均降低,与空白组比较差异有统计学意义(P<0.05),见图3和表4。
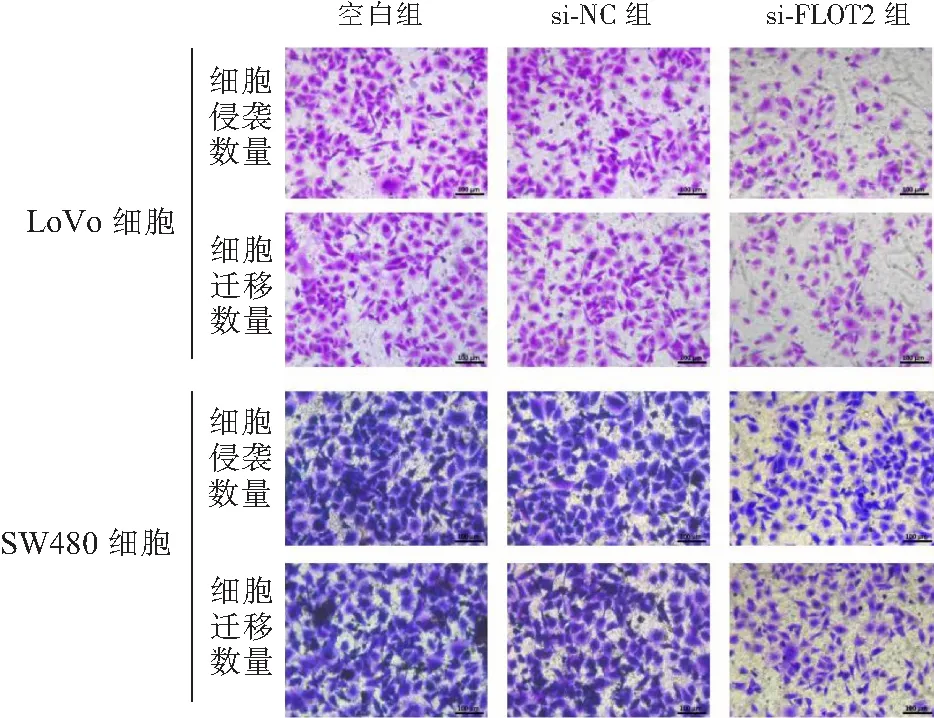
图3 Transwell检测细胞迁移和侵袭Figure 3 Transwell detects cell migration and invasion
2.5 抑制FLOT2表达对LoVo细胞和SW480细胞凋亡的影响 采用AnnexinV-FITC/PI双染法检测各组LoVo细胞和SW480细胞凋亡率变化,结果显示,抑制LoVo细胞和SW480细胞FLOT2表达,细胞凋亡率升高,与空白组比较差异有统计学意义(P<0.05),见表4和图4。

表4 各组LoVo细胞和SW480细胞侵袭数、迁移数及凋亡率Table 4 Invasion number,migration number and apoptosis rate of LoVo cells and SW480 cells in each group
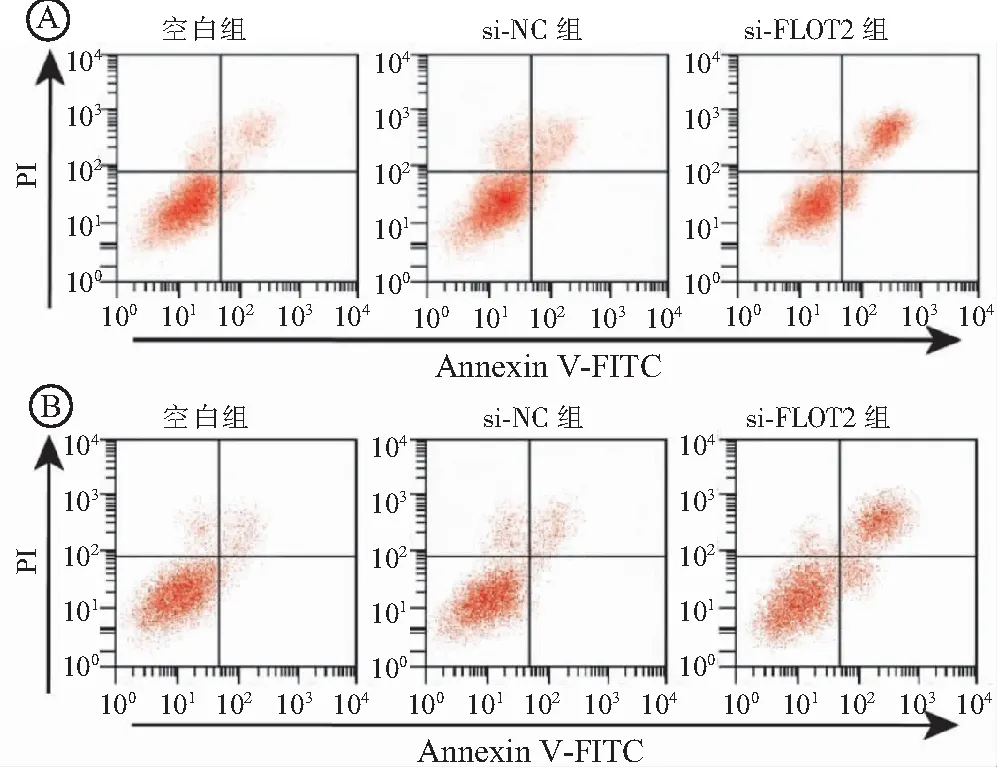
图4 流式细胞术检测抑制FLOT2表达对LoVo细胞和SW480细胞凋亡的影响Figure 4 Flow cytometry was used to detect the effect of FLOT2 inhibition on apoptosis of LoVo cells and SW480 cells注:A.LoVo细胞;B.SW480细胞
2.6 抑制FLOT2表达对LoVo细胞和SW480细胞增殖、凋亡、侵袭迁移相关蛋白表达的影响 采用Western blot检测各组LoVo细胞和SW480细胞与增殖、凋亡及EMT相关的PCNA、cleaved caspase3及E-cadherin和Vimentin表达,结果显示,抑制LoVo细胞和SW480细胞FLOT2表达后,PCNA和Vimentin表达降低,cleaved caspase3和E-cadherin表达升高,与空白组比较差异有统计学意义(P<0.05),见图5,表5、6。
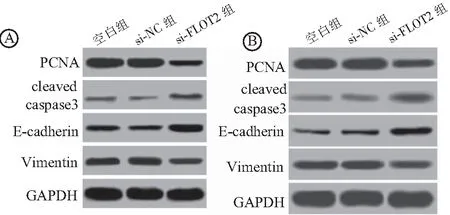
图5 Western blotting检测LoVo细胞(A)和SW480细胞(B)PCNA、cleaved caspase3、E-cadherin和Vimentin表达Figure 5 Expression of PCNA,Cleaved caspase3,E-cadherin and Vimentin in LoVo cells (A)and SW480 cells (B)were detected by Western blotting注:A.LoVo细胞;B.SW480细胞

表5 LoVo细胞PCNA、cleaved caspase3、E-cadherin和Vimentin蛋白相对表达量Table 5 Relative protein expression levels of PCNA,Cleaved caspase3,E-cadherin and Vimentin in LoVo cells

表6 SW480细胞PCNA、cleaved caspase3、E-cadherin和Vimentin蛋白相对表达量Table 6 Relative expression levels of PCNA,Cleaved caspase3,E-cadherin and Vimentin in SW480 cells
3 讨论
肿瘤发生、发展是一个多阶段、多基因改变、多因素协同作用的复杂过程,其中抑癌基因失活、癌基因过度表达是肿瘤发生的分子基础,对与肿瘤相关基因的分子生物学、调节机制及治疗方法研究具有重要意义[7-8]。多项研究证实,多种肿瘤中存在FLOT2的过表达,其表达与肿瘤进展有关,如Cao等[9]研究显示,胃癌中FLOT2表达升高,下调其表达可抑制癌细胞增殖、侵袭和迁移能力;李镇伽等[10]研究显示,胃癌中FLOT2表达升高,其表达与肿瘤大小、淋巴结转移、浸润深度、远处转移及AJCC分期相关,低表达FLOT2的胃癌患者5年总体生存率明显升高。miR-103a-3p、miR-485-5p通过靶向下调FLOT2表达抑制甲状腺癌细胞的增殖,促进凋亡[11-12]。既往研究[6]表明,FLOT2在结肠癌中高表达,但其表达对结肠癌细胞生长及机制研究尚未明确。因此,本研究检测不同结肠癌细胞FLOT2表达情况,发现结肠癌LoVo细胞FLOT2表达最高,因此选择作为研究对象。采用慢病毒RNA干扰技术沉默LoVo细胞和SW480细胞FLOT2表达,探究其生物学特性改变,结果显示,FLOT2表达受到抑制后,LoVo细胞和SW480细胞增殖及侵袭迁移均明显降低,凋亡率升高。提示FLOT2可能与结肠癌进展有关。
PCNA是DNA复制过程的必需因子,肿瘤中PCNA表达升高,已将其作为肿瘤是否增殖的标志物[13-14]。有研究显示,乳腺癌中FLOT2表达升高,抑制FLOT2的表达可降低PCNA表达[15]。caspase家族成员是细胞凋亡过程最为重要的蛋白类,而caspase3是caspase家族最为重要的一种,是多种凋亡途径中共同的下游效应部分,其活化后可使凋亡发生不可逆,因此被称为“死亡执行蛋白酶”[16]。肿瘤转移是一个包括基质降解、血管生成、运动增强、细胞黏性改变等的多步骤、多因子参与的复杂过程,目前肿瘤转移是在全世界范围内导致肿瘤患者死亡的一个首要原因[17-18]。近年来研究证实,上皮-间充质转换(Epithelial-Mesenchymal Transition,EMT)与肿瘤侵袭转移密切相关,是决定侵袭转移程度的一个关键因素[19]。E-cadherin是EMT发生的重要标志,其在包括结肠癌在内的肿瘤中表达减少可引起细胞活性增强及细胞间黏附力减弱[20-21]。有研究显示,食管癌中FLOT2高表达,其表达可促进癌细胞生长和侵袭能力[22];miR-449a可通过靶向FLOT2抑制TGF-β介导的EMT而抑制胃癌细胞侵袭[23];FLOT2可通过调节细胞周期和诱导肝细胞癌EMT促进肿瘤生长和转移[24]。本研究结果显示,LoVo细胞FLOT2表达受到抑制后,PCNA和Vimentin表达明显降低,cleaved caspase3和E-cadherin表达明显升高,提示FLOT2可能通过调节PCNA、spase3、E-cadherin和Vimentin表达影响结肠癌细胞增殖、凋亡、侵袭和迁移。核因子-κB(Nuclear factor-κB,NF-κB)的激活通过促进细胞增殖、血管生成、侵袭和转移,抑制细胞凋亡在结肠癌进展中起促进作用[25]。有研究[26]报道干扰FLOT2通过抑制NF-κB信号通路可诱导胃癌细胞凋亡。但FLOT2是否通过调控NF-κB信号通路调控结肠癌细胞生物学行为进一步研究。
4 结论
结肠癌细胞FLOT2表达升高,抑制FLOT2表达可抑制结肠癌细胞增殖、侵袭和迁移,促进细胞凋亡。FLOT2可能是结肠癌的潜在诊断标记物和治疗靶点,FLOT2在结肠癌中的具体作用机制需进一步研究。
