血清降钙素原联合C-反应蛋白检测在ICU重症伴有肺部感染患者治疗中的价值分析
2022-04-16陆敬山
陆敬山
(邳州市人民医院重症医学科,江苏邳州 221300)
肺部重症感染为ICU临床常见疾病,多见于神经系统疾病(如脑外伤、脑卒中)、多发伤、慢性阻塞性肺疾病等多种疾患的首发或继发感染,尤其多见于机械通气患者。具体是指致病菌侵袭人体,并在肺部、血液中繁殖,其生成物(毒素等)或代谢产物,易引起机体出现不正常反应。导致患者出现高热、寒颤等症状,严重影响患者健康[1-2]。临床上,病原菌培养是重症感染传统诊断方式,但病菌培养耗时较长,容易影响疾病诊断进展,甚至影响最佳治疗时机。因此,重症感染早期选择快速、精准的诊断方式,对于提高临床疗效、促进患者早日康复有明确价值[3]。血清PCT(降钙素原)、CRP(C-反应蛋白)为机体炎性反应指标,具有检测简便、快速、准确等优势,机体出现感染症状时,两者水平可呈现为高表达[4]。近年来,有学者在重症感染患者治疗中,应用血清PCT联合CRP检测,取得了良好效果,具有重要临床价值[5]。基于此,本文选取邳州市人民医院收治的102例ICU重症伴有肺部感染患者和51例非细菌感染组患者为分析研究对象,旨在探究血清PCT联合CRP检测在重症感染患者治疗中的临床诊断价值,详情报告如下。
1 资料与方法
1.1 一般资料 随机抽取2018年3月至2021年6月邳州市人民医院收治的102例ICU重症伴有肺部感染患者和51例非细菌感染组患者为研究对象。并依据感染程度不同,将102例感染患者分为重症感染组(41例)和局部感染组(61例)。重症感染组患者中男性23例,女性18例;年龄20~89岁,平均年龄(48.89±5.73)岁。局部感染组患者中男性35例,女性26例;年龄20~87岁,平均年龄(49.14±5.68)岁。非细菌感染组患者中男性36例,女性15例;年龄20~90岁,平均年龄(49.15±5.46)岁。3组患者的一般资料经分析比较,差异无统计学意义(P>0.05),具有可比性。本研究经邳州市人民医院医学伦理委员会批准,患者及家属知情并签署知情同意书。纳入标准:临床确诊为肺部重症感染。排除标准:①因其他疾病引起的血清PCT、CRP水平异常;②伴自身免疫性疾病;③近期接受过抗炎药物治疗。
1.2 检测方法 3组患者均接受PCT、CRP检查,具体方法:取患者清晨空腹状态下静脉血5 mL,置促凝管内,凝固后送离心,3 000 r/min,离心分离10 min,分离血清,采用免疫投射比浊法、免疫发光法测定血清PCT、CRP水平。阳性判断指标:血清PCT>0.05 ng/mL,血清CRP >5 mg/L。每位患者都进行单一PCT检测、单一CRP检测、PCT及CRP联合检测。诊断金标准:①体温>38 ℃,持续1 h以上,或中心温度不足36℃;②心率>90次/min,或呼吸频率>30次/min;③外周血WBC计数>1×1010/L或<4×109/L,血小板计数<1×1011/L;④感染病灶确切;⑤存在感染性休克或多器官衰竭。
1.3 观察指标 ①比较3组患者血清PCT、CRP水平;②对比单一PCT检测、单一CRP检测、PCT及CRP联合诊断重度感染的阳性率以及诊断效能(准确度、特异度、敏感度)。诊断阳性率=阳性例数/总例数×100%。诊断效能:A:真阳性;B:假阴性;C:假阳性;D:真阴性。准确度=[(A例数+D例数)/总例数]×100%;敏感度=[A例数/(A例数+B例数)]×100%;特异度=[D例数/(C例数+D例数)]×100%;阳性预测值:[A例数/(A例数+C例数)]×100%;阴性预测值:[D例数/(B例数+D例数)]×100%。
1.4 统计学分析 本试验数据经统计学软件SPSS 25.0处理,计数资料用[例(%)]表示,行χ2检验;计量资料用()表示,行单因素方差分析组间比较采用LSP-t 检验。P<0.05为差异有统计学意义。
2 结果
2.1 三组患者血清PCT、CRP水平比较 3组患者血清PCT、CRP水平比较,差异具有统计学意义(P<0.05);重度感染组患者的血清PCT、CRP水平高于局部感染组、非细菌感染组,差异具有统计学意义(P<0.05),详见表1。
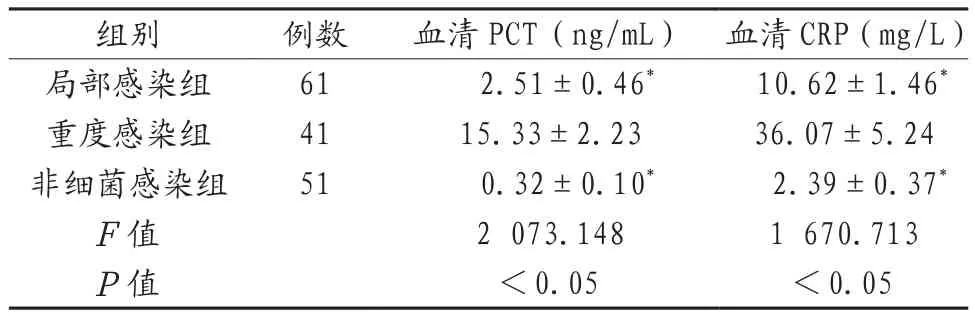
表1 3组患者血清PCT、CRP水平比较
2.2 单一PCT检测、单一CRP检测、PCT及CRP联合诊断阳性率的比较 对所有患者做了金标准检测,其中阳性61例,阴性92例。单一PCT检测、单一CRP检测、PCT及CRP联合诊断阳性率为35.95%、37.25%、44.44%,PCT及CRP联合诊断阳性率高于单一PCT检测、单一CRP检测,差异具有统计学意义(P<0.05),详见表2。

表2 单一PCT检测、单一CRP检测、PCT及CRP联合诊断阳性率的比较(例)
2.3 单一PCT检测、单一CRP检测、PCT及CRP联合诊断的诊断效能比较 PCT及CRP联合诊断准确度、特异度和敏感度均高于单一PCT检测、单一CRP检测,差异具有统计学意义(P<0.05),详见表3。
3 讨论
肺部重症感易诱发严重并发症,如:感染性休克、多器官功能衰竭等,严重时甚至会危及患者生命。尽早诊断重症感染疾病,对阻断病情发展,提高患者生存质量具有重要临床意义[6]。当前,临床对重症感染的诊断,常用症状观察、病原菌培养等,其中病原菌培养的方式需要耗费较长时间,可影响患者的早期诊断[7]。鉴于此,对高度疑似重症感染患者使用适宜、合理的诊断方式在临床中则十分必要。
有研究显示,血清PCT、CRP为机体常见炎症反应因子,若机体出现严重感染,其水平可显著升高。并且血清PCT、CRP水平与感染严重程度有关,即:PCT在系统性细菌感染、真菌感染时升高,而病毒感染不升高或轻度升高,PCT水平越高代表感染越严重[8-9]。因此PCT能够协助临床鉴别细菌感染和非细菌感染。CRP是一种与肺炎链球菌非特异性菌体的多糖成分C-多糖发生凝集反应并于急性感染时出现的蛋白质,为常见非特异性免疫应答分子,由肝细胞合成。若机体出现炎症、感染等症状时,CRP水平可显著升高,故CRP常用于临床各类感染性疾病检测中。PCT为降钙素前肽物,由氨基酸(116个)组成。PCT属于多肽技术,由甲状腺肿瘤细胞培养基中提取,最早用于甲状腺肿瘤诊断中[10-12]。正常机体中,PCT的正常范围是0~0.5 ng/L。近年来,随着临床研究的深入进行,发现全身感染程度与血清PCT水平有关,因此,通过血清PCT水平监测,能直观了解患者全身感染程度[13-14]。若机体被细菌侵袭感染,PCT在细菌感染后2~6 h可明显升高,24~48 h达到峰值,且持续36 h呈高表达状态,在达到高峰后其半衰期为12~24 h。PCT在血清中非常稳定,不受体内激素水平的影响。若此时使用相应抗菌药物治疗,则其血清PCT水平明显降低。其原因为,在正常非重症感染疾病患者体内,其CALC-1基因呈低表达。若机体合并细菌感染,CALC-1基因可呈异常高表达,进而对相应组织细胞产生刺激作用,导致机体大量释放PCT水平,故重症感染患者机体内血清PCT水平显著提升。因此,在重症感染疾病患者症状改善与进展中,了解血清PCT水平变化有确切的指导作用。并且血清PCT的半衰期较长(约28 h),有利于血清PCT标本的采集。

表3单一PCT检测、单一CRP检测、PCT及CRP联合诊断的诊断效能比较(%)
本研究结果证明,重度感染组患者的血清PCT、CRP水平高于局部感染组、非细菌感染组(P<0.05),这提示ICU重症伴有肺部感染患者的血清PCT、CRP水平呈高表达。同时,PCT及CRP联合检测在疾病的诊断阳性率、诊断准确度、特异度、敏感度均高于单一PCT检测、单一CRP检测(P<0.05),这提示血清PCT联合CRP检测诊断能提高诊断阳性率和诊断效能,有助于临床后续工作的开展。
综上所述,ICU重症伴有肺部感染患者机体内血清PCT、CRP水平呈异常高表达现象,采取血清PCT联合CRP检测具有明确的诊断价值,有助于重症感染疾病的早期诊断和治疗工作的顺利进行,值得临床积极推广应用。
