GOLM1调控PI3K/AKT/mTOR信号转导通路促进肺腺癌细胞增殖、侵袭和迁移的机制研究
2022-04-15朱海鹏蔡若南王俊巧
朱海鹏,胡 军,姜 敏,蔡若南,王俊巧,李 莉
1.克拉玛依市中心医院血液肿瘤科,新疆 克拉玛依 834000;2.克拉玛依市中心医院病理科,新疆 克拉玛依 834000
肺腺癌是最常见的非小细胞肺癌类型,其特征是淋巴细胞浸润密集,并且在早期容易发生转移[1]。尽管近年来对于肺腺癌的治疗策略已经得到很大改善,但肺腺癌患者的生存率仍然很低[2]。因此,寻找新的治疗靶点来改善肺腺癌的治疗至关重要。高尔基体膜蛋白1(Golgi membrane protein 1,GOLM1),是一种Ⅱ型跨膜蛋白,其与肿瘤进展、转移及免疫抑制相关[3]。据报道[4],miR-27a通过靶向下调GOLM1的蛋白表达,抑制肿瘤细胞的增殖和侵袭,并诱导其凋亡,从而抑制肺腺癌的发生、发展,表明GOLM1在肺腺癌中发挥着癌基因的作用,但其具体作用机制尚不明确。最近研究[5]发现,抑制磷脂酰肌醇3-激酶(phosphatidylinositol 3-kinase,PI3K)/蛋白激酶B(protein kinase B,AKT)/哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)信号转导通路可抑制肺腺癌H1975细胞系的增殖、侵袭。但GOLM1能否通过调控PI3K/AKT/mTOR信号转导通路影响肺腺癌细胞增殖、侵袭和迁移鲜见报道。因此,本研究主要探讨GOLM1对肺腺癌细胞增殖、侵袭和迁移的影响及其作用机制。
1 材料和方法
1.1 临床样本、细胞系及动物来源
收集2019年4月—2021年4月在克拉玛依市中心医院行手术切除,临床病历资料完整,病理学确诊为肺腺癌的癌组织及相应癌旁组织标本各90例。男性47例,女性43例。年龄27~82岁,中位年龄60岁。吸烟31例,不吸烟59例。分化程度:中/低分化56例,高分化34例。有淋巴结转移34例,无淋巴结转移56例。临床分期:Ⅰ/Ⅱ期59例,Ⅲ期31例。所有患者均签署知情同意书。
人肺上皮细胞BEAS-2B及人肺腺癌H460、A549、PG49、H1299细胞均购自中国科学院典型培养物保藏委员会细胞库,批号分别为CL-0496、CL-5013、CL-1067、CL-1915、CL-5008。
30只6~8周龄SPF级雄性BALB/c裸小鼠购自新疆医科大学实验动物中心,生产许可证号为SCXK(新)2018-0002。
本研究所有实验均得到克拉玛依市中心医院伦理委员会的批准。
1.2 主要试剂与仪器
GOLM1小干扰RNA(GOLM1small interfering RNA,si-GOLM1)及其阴性对照(si-NC)均购自广州市锐博生物科技有限公司,批号为C17052-3、C19013-5;胰岛素样生长因子-1(insulin-like growth factor-1,IGF-1)购自上海西唐生物科技有限公司,批号为F20451;RIPA裂解缓冲液、细胞计数试剂盒-8(cell counting kit-8,CCK-8)、二喹啉甲酸(bicinchoninic acid,BCA)试剂盒均购自上海昆盟生物科技有限公司,批号为SF-19173、SG-20674、SF-40237;RPMI-1640培养基、LipofectamineTM2000转染试剂盒、胎牛血清(fetal bovine serum,FBS)均购自上海恒斐生物科技有限公司,批号为E-EL-P1607、E-EL-0021、E-EL-0097;兔抗人GOLM1、PI3K、磷酸化PI3K(phosphorylated-PI3K,p-PI3K)、AKT、磷酸化AKT(phosphorylated-AKT,p-AKT)、mTOR、磷酸化mTOR(phosphorylated-mTOR,p-mTOR)、甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)多克隆抗体、羊抗兔二抗均购自广州易锦生物技术有限公司,批号为X0417、C0237、C0239、Z3429、Z3431、M0529、M0530、A10011、A10326;电化学发光(electrochemical luminescence,ECL)试剂盒购自苏州新赛美生物科技有限公司,批号为WB2046;CO2培养箱购自上海天能科技有限公司,型号为240i;光学显微镜购自无锡迈特斯精密科技有限公司,型号XQZ-2;凝胶成像系统、酶标仪均购自上海嘉鹏科技有限公司,型号为ZF1-IIN、Nano-800。
1.3 免疫组织化学法检测肺腺癌组织和癌旁组织中GOLM1的表达
取部分肺腺癌组织及其癌旁组织固定于4%的多聚甲醛溶液中,经梯度乙醇脱水、石蜡包埋后,用切片机切成厚度为5 μm的切片,将组织切片通过二甲苯脱蜡和一系列分级乙醇溶液再水化后,再将切片置于3%过氧化氢中温育20 min以阻断内源性过氧化物酶活性,利用柠檬酸盐缓冲液进行抗原修复,加入GOLM1兔抗人多克隆抗体(1∶500)在4 ℃下温育过夜,第2天,将切片与羊抗兔二抗于室温下温育1 h,再加入辣根过氧化物酶标记的链霉亲和素复合物温育1 h,二氨基联苯胺(diaminobenzidine,DAB)显色后用苏木精复染,脱水、透明并固定于普通光学显微镜下观察GOLM1在肺腺癌组织中的表达情况。结果评定参照参考文献[6]。染色程度:无染色记0分,淡黄色记1分,黄色记2分,棕黄色记3分;阳性细胞百分数:≤10%为0分,11%~25%为1分,26%~50%为2分,51%~100%为3分。两者相加为最终评分标准,0分为阴性,1分及以上为阳性。
1.4 细胞培养及蛋白质印迹法(Western blot)检测GOLM1的表达
将人肺上皮细胞BEAS-2B及人肺腺癌H460、A549、PG49、H1299细胞在RPMI-1640培养基中培养,该培养基中补充有10%FBS,所有细胞均在37 ℃、CO2体积分数为5%的加湿培养箱中培养24 h。取对数生长期的各细胞,使用RIPA裂解缓冲液提取细胞中的总蛋白,BCA试剂盒检测总蛋白的浓度,然后凝胶电泳分离等量的蛋白质并转移到聚偏氟乙烯膜上。将膜用5%脱脂牛奶封闭1 h,再将膜与兔抗人GOLM1(1∶500)、GAPDH(1∶1 000)一抗于4 ℃下温育过夜,第2天,将膜与羊抗兔二抗(1∶2 000)在室温下温育1.5 h。使用ECL试剂盒可视化蛋白质,以GAPDH为内部对照,通过ImageJ软件分析蛋白质的灰度值。
1.5 细胞分组及转染
取对数生长期的肺腺癌A549细胞,随机分为空白组(细胞未转染)、si-NC组(细胞转染si-NC)、si-GOLM1组(细胞转染si-GOLM1)、IGF-1组[7](10 μmol/L的PI3K/AKT/mTOR信号转导通路激活剂IGF-1处理30 min)和si-GOLM1+IGF-1组(10 μmol/L的IGF-1处理30 min后再转染si-GOLM1)。每组设置6个平行样。
1.6 CCK-8法检测肺腺癌A549细胞增殖
将各组肺腺癌A549细胞密度调整为1×104个/mL后,分别取200 μL细胞悬液加入到96孔板中,并在37 ℃下培养0、24和48 h。随后,将10 µL CCK-8溶液加入到每个孔中。在37 ℃下温育2 h后,使用酶标仪检测450 nm波长处的吸光度(D)值。
1.7 划痕实验检测肺腺癌A549细胞迁移
将各组肺腺癌A549细胞接种到6孔板中,并在37 ℃的潮湿环境中培养过夜。当细胞达到100%汇合度时,使用10 µL移液器吸嘴在单层细胞中轻轻地线性划痕,并用磷酸缓冲盐溶液(phosphate-buffered saline,PBS)洗涤细胞3次。将细胞在不含FBS的RPMI-1640培养基中于37 ℃下温育24 h,使用相差显微镜分别在0、24 h时观察细胞迁移情况并拍照,划痕愈合率=(0 h划痕宽度-24 h划痕宽度)/0 h划痕宽度×100%。
1.8 Transwell实验检测肺腺癌A549细胞侵袭
使用涂有基质胶的transwell小室在37 ℃下进行侵袭实验。利用无FBS的RPMI-1640培养基将细胞密度调整为4×105个/mL,取100 μL加入到transwell上室中,再向下室中加入600 μL含有10%FBS的RPMI-1640培养基,在37 ℃下温育24 h后,将膜下表面的细胞用甲醇固定20 min,结晶紫染色30 min。随机选择5个视野利用倒置光学显微镜观察侵袭细胞数目并拍照。
1.9 Western blot检测肺腺癌A549细胞中GOLM1及PI3K/AKT/mTOR信号转导通路相关蛋白表达
将各组肺腺癌A549细胞参照1.4中的方法进行Western blot,将一抗更换为兔抗人GOLM1(1∶500)、PI3K(1∶1 000)、AKT(1∶500)、mTOR(1∶500)、p-PI3K(1∶1 000)、p-AKT(1∶500)、p-mTOR(1∶500)、GAPDH(1∶1 000),其余步骤同1.4。
1.10 裸小鼠移植瘤实验
收获1.5中的各组细胞,将2×106个细胞注射到BALB/c裸小鼠右侧腋窝皮下,分别命名为空白组、si-NC组、si-GOLM1组、IGF-1组和si-GOLM1+IGF-1组,每组6只。注射6周后处死裸小鼠,收集肿瘤,测量皮下移植瘤的质量和体积。肿瘤体积(V):V=0.5×A×B2,其中A和B分别代表较长和较短的肿瘤直径。
1.11 统计学处理
使用SPSS 25.0软件对数据进行分析。计数资料采用例数和百分比表示,行χ2检验。计数资料采用±s表示,使用单因素方差分析进行多组间比较,进一步两组间的比较采用SNK-q检验。P<0.05为差异有统计学意义。
2 结果
2.1 肺腺癌组织中GOLM1表达及其与临床病理学特征的关系
将90例肺腺癌组织及其癌旁组织固定于4%多聚甲醛溶液中,利用免疫组织化学法检测肺腺癌组织和癌旁组织中GOLM1的表达情况。结果显示,肺腺癌组织中GOLM1的表达阳性率为83.33%(75/90),明显高于癌旁组织的15.56%(14/90)(χ2=82.699,P<0.001,图1)。其中肺腺癌组织中GOLM1阳性评分为1分的有7例,2分及以上的有68例,癌旁组织中GOLM1阳性评分为1分的有2例,2分及以上的有12例。分析GOLM1的表达阳性率与临床病理学特征之间的关系,结果显示,GOLM1表达与分化程度、淋巴结转移、临床分期显著相关(P<0.05),而与性别、年龄、是否吸烟无显著相关性(P>0.05,表1)。
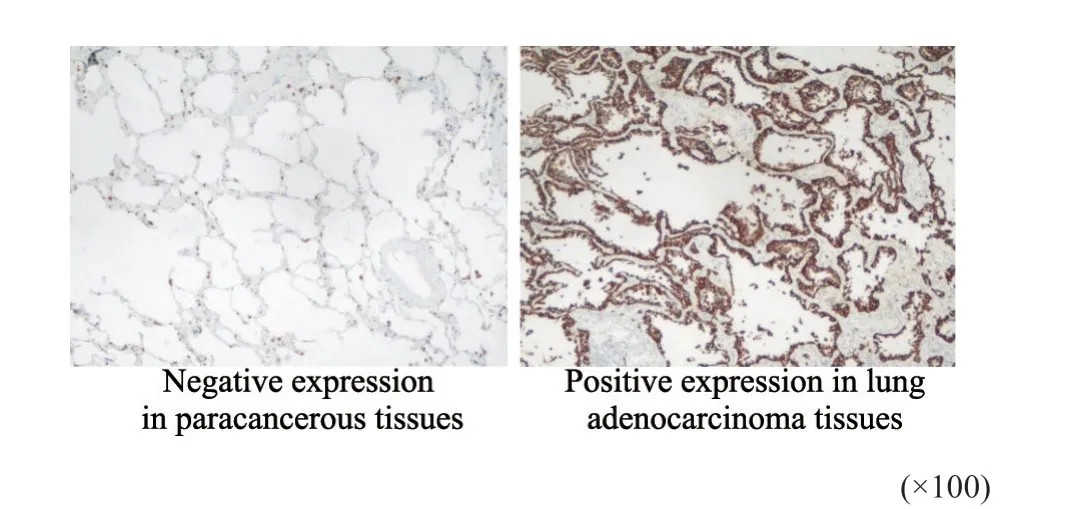
图1 免疫组织化学染色检测GOLM1表达Fig.1 Immunohistochemical staining to detect GOLM1 expression

表1 肺腺癌组织中GOLM1表达与临床病理学特征的关系Tab.1 Relationship between GOLM1 expression and clinicopathological characteristics in lung adenocarcinoma tissues [n (%)]
2.2 肺上皮细胞BEAS-2B和肺腺癌H460、A549、PG49、H1299细胞中GOLM1的表达比较
将肺上皮细胞BEAS-2B和肺腺癌H460、A549、PG49、H1299细胞在37 ℃、CO2体积分数为5%的加湿培养箱中培养24 h,采用Western blot检测GOLM1的相对表达水平,并进行灰度扫描分析。结果显示,与人肺上皮细胞BEAS-2B比较,人肺腺癌H460、A549、PG49、H1299细胞中GOLM1的相对表达水平显著升高(P<0.05,图2,表2),且肺腺癌A549细胞中GOLM1相对表达水平最高,因此选用肺腺癌A549细胞进行后续实验。

图2 Western blot检测各组细胞中GOLM1表达Fig.2 Detection of GOLM1 expression in each group of cells by Western blot
表2 各组细胞中GOLM1的相对表达水平比较Tab.2 Comparison of the relative expression levels of GOLM1 in each group of cells (±s,n=6)
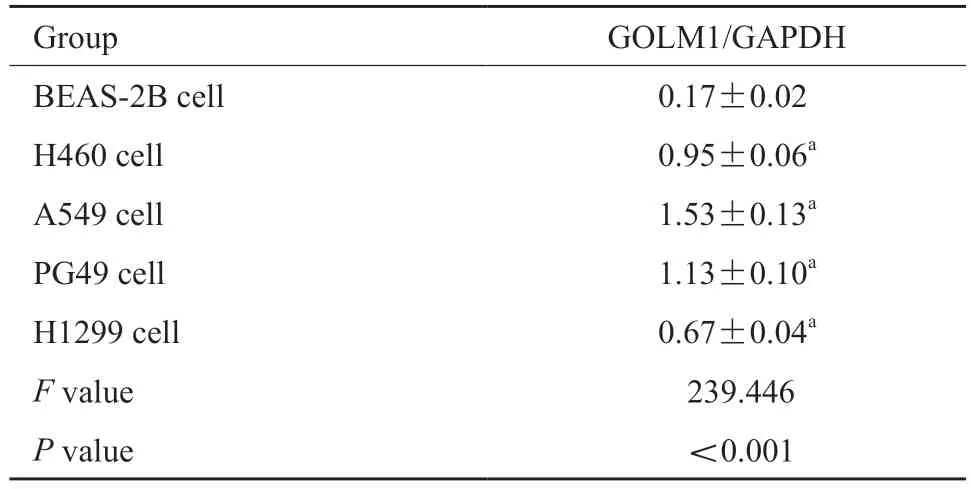
表2 各组细胞中GOLM1的相对表达水平比较Tab.2 Comparison of the relative expression levels of GOLM1 in each group of cells (±s,n=6)
a:P<0.05,compared with BEAS-2B cells.
2.3 各组肺腺癌A549细胞增殖能力的比较
将空白组、si-NC组、si-GOLM1组、IGF-1组和si-GOLM1+IGF-1组肺腺癌A549细胞以2×103个/孔的密度接种到96孔板中,分别在培养0、24和48 h时利用CCK-8法检测各组细胞在450 nm波长处的D值,结果显示,与空白组、si-NC组比较,si-GOLM1组肺腺癌A549细胞在同一时间点(24、48 h)的D值显著降低,IGF-1组肺腺癌A549细胞在同一时间点(24、48 h)的D值显著升高(P<0.05);与si-GOLM1组比较,si-GOLM1+IGF-1组肺腺癌A549细胞在同一时间点(24、48 h)的D值显著升高(P<0.05,表3)。
表3 各组肺腺癌A549细胞在0、24和48h时的D值比较Tab.3 Comparison of D values of lung adenocarcinoma A549 cells in each group at 0,24 and 48h (±s,n=6)
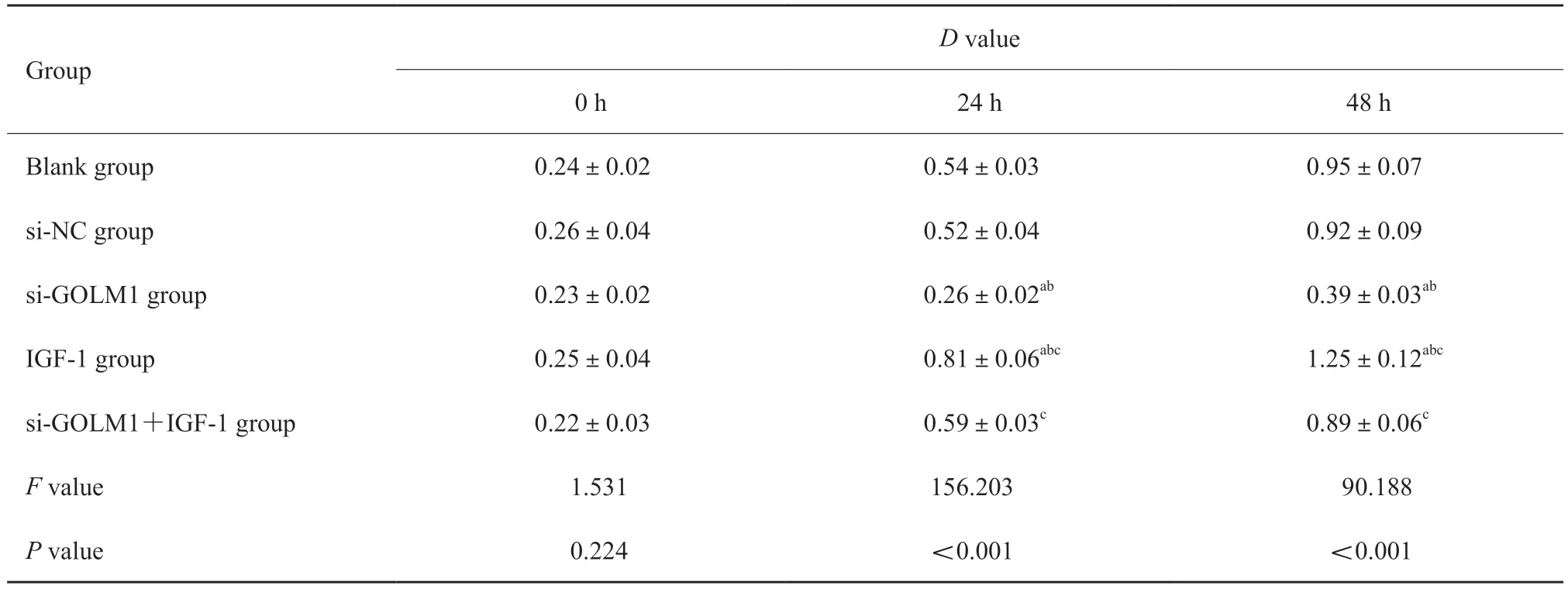
表3 各组肺腺癌A549细胞在0、24和48h时的D值比较Tab.3 Comparison of D values of lung adenocarcinoma A549 cells in each group at 0,24 and 48h (±s,n=6)
a:P<0.05,compared with blank group;b:P<0.05,compared with si-NC group;c:P<0.05,compared with si-GOLM1 group.
2.4 各组肺腺癌A549细胞迁移、侵袭能力比较
通过划痕实验检测各组肺腺癌A549细胞迁移,通过transwell实验检测各组肺腺癌A549细胞侵袭。结果显示,与空白组、si-NC组比较,si-GOLM1组肺腺癌A549细胞划痕愈合率及侵袭细胞数目显著降低,IGF-1组肺腺癌A549细胞划痕愈合率及侵袭细胞数目显著升高(P<0.05);与si-GOLM1组比较,si-GOLM1+IGF-1组肺腺癌A549细胞划痕愈合率及侵袭细胞数目显著升高(P<0.05,图3、4,表4)。

图3 各组肺腺癌A549细胞迁移能力比较Fig.3 Comparison of the migration ability of lung adenocarcinoma A549 cells in each group
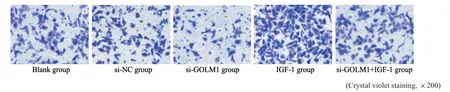
图4 各组肺腺癌A549细胞侵袭能力比较Fig.4 Comparison of the invasion ability of lung adenocarcinoma A549 cells in each group
表4 各组肺腺癌A549细胞划痕愈合率及侵袭细胞数目比较Tab.4 Comparison of scratch healing rate and number of invasive cells in lung adenocarcinoma A549 cells in each group (±s,n=6)
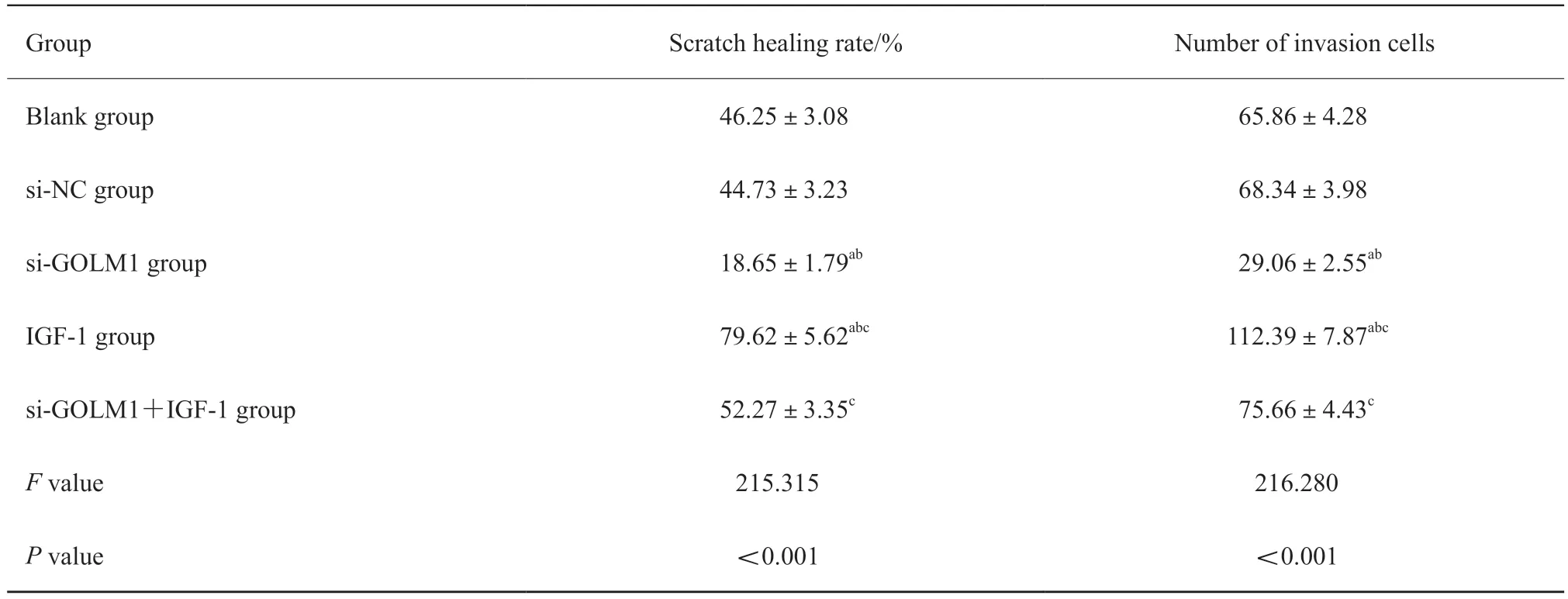
表4 各组肺腺癌A549细胞划痕愈合率及侵袭细胞数目比较Tab.4 Comparison of scratch healing rate and number of invasive cells in lung adenocarcinoma A549 cells in each group (±s,n=6)
a:P<0.05,compared with blank group;b:P<0.05,compared with si-NC group;c:P<0.05,compared with si-GOLM1 group.
2.5 各组肺腺癌A549细胞中GOLM1及PI3K/AKT/mTOR信号转导通路相关蛋白水平的比较
收集空白组、si-NC组、si-GOLM1组、IGF-1组、si-GOLM1+IGF-1组肺腺癌A549细胞,采用Western blot检测GOLM1、p-PI3K、PI3K、p-AKT、AKT、p-mTOR、mTOR蛋白的相对表达水平,并进行灰度扫描分析,结果见图5和表5。与空白组、si-NC组比较,si-GOLM1组肺腺癌A549细胞中GOLM1、p-PI3K/PI3K、p-AKT/AKT、p-mTOR/mTOR蛋白的相对表达水平显著降低(P<0.05),IGF-1组肺腺癌A549细胞中GOLM1的相对表达水平差异无统计学意义(P>0.05),p-PI3K/PI3K、p-AKT/AKT、p-mTOR/mTOR蛋白的相对表达水平显著升高(P<0.05);与si-GOLM1组比较,si-GOLM1+IGF-1组肺腺癌A549细胞中GOLM1蛋白的相对表达水平差异无统计学意义(P>0.05),而p-PI3K/PI3K、p-AKT/AKT、p-mTOR/mTOR的相对表达水平显著升高(P<0.05)。
表5 各组肺腺癌A549细胞中GOLM1及PI3K/AKT/mTOR信号转导通路相关蛋白水平比较Tab.5 Comparison of GOLM1 and PI3K/AKT/mTOR signaling pathway related protein levels in lung adenocarcinoma A549 cells in each group (±s,n=6)

表5 各组肺腺癌A549细胞中GOLM1及PI3K/AKT/mTOR信号转导通路相关蛋白水平比较Tab.5 Comparison of GOLM1 and PI3K/AKT/mTOR signaling pathway related protein levels in lung adenocarcinoma A549 cells in each group (±s,n=6)
a:P<0.05,compared with blank group;b:P<0.05,compared with si-NC group;c:P<0.05,compared with si-GOLM1 group.
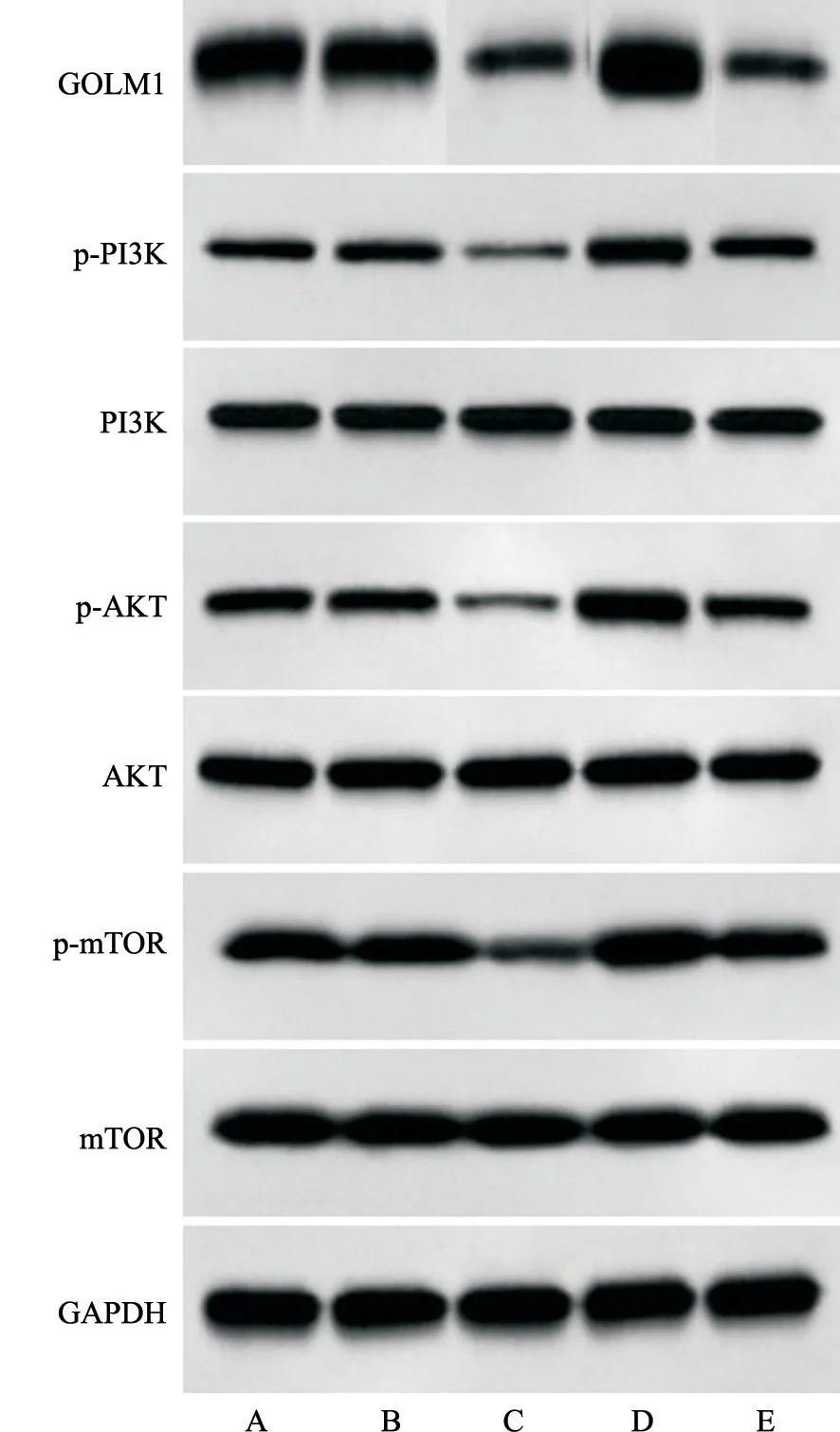
图5 Western blot检测各组肺腺癌A549细胞中GOLM1、p-PI3K、PI3K、p-AKT、AKT、p-mTOR和mTOR蛋白表达Fig.5 Western blot method was used to detect GOLM1,p-PI3K,PI3K,p-AKT,AKT,p-mTOR and mTOR protein expression in lung adenocarcinoma A549 cells in each group
2.6 各组裸小鼠移植瘤生长情况比较
收集空白组、si-NC组、si-GOLM1组、IGF-1组和si-GOLM1+IGF-1组的细胞,将2×106个细胞注射到裸小鼠右侧腋窝皮下,注射6周后处死裸小鼠,收集肿瘤,测量皮下诱导肿瘤的质量和体积,结果见图6和表6。与空白组、si-NC组比较,si-GOLM1组移植瘤的质量和体积显著降低,IGF-1组移植瘤的质量和体积显著升高(P<0.05);与si-GOLM1组相比,si-GOLM1+IGF-1组移植瘤的质量和体积显著升高(P<0.05)。
表6 各组裸小鼠移植瘤质量、体积比较Tab.6 Comparison of the mass and volume of transplanted tumors in BALB/c nude mice in each group (±s,n=6)

表6 各组裸小鼠移植瘤质量、体积比较Tab.6 Comparison of the mass and volume of transplanted tumors in BALB/c nude mice in each group (±s,n=6)
a:P<0.05,compared with nude mice blank group;b:P<0.05,compared with nude mice si-NC group;c:P<0.05,compared with nude mice si-GOLM1 group.
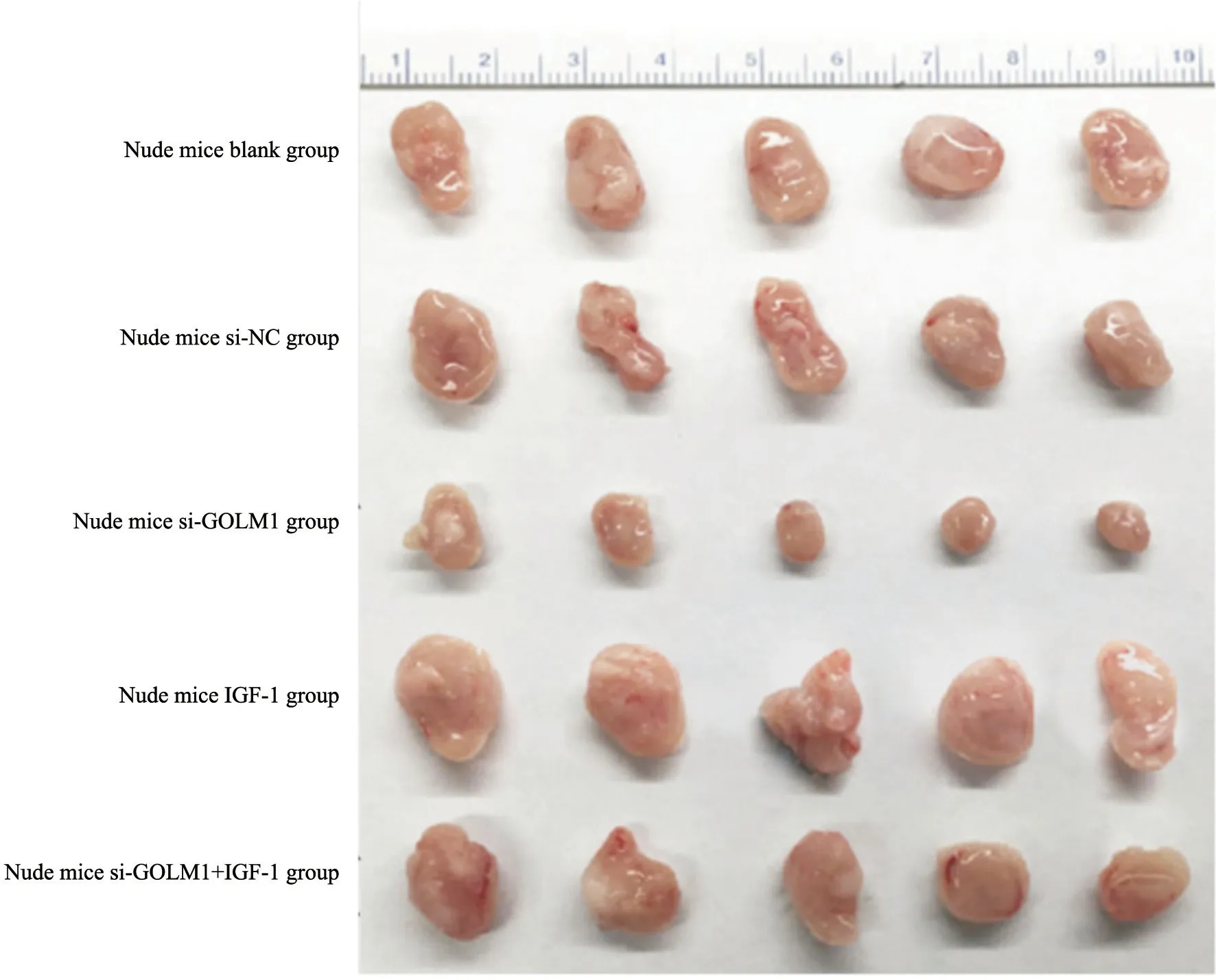
图6 各组裸小鼠移植瘤生长情况比较Fig.6 Comparison of the growth of xenagraft tumors in BALB/c nude mice in each group
3 讨 论
化疗、手术切除及放疗是肺腺癌的常规治疗方法,然而,由于这些治疗方法缺乏特异性,也会对邻近的正常细胞造成伤害[8]。因此,进一步寻找新的肺腺癌诊断标志物和治疗靶点具有重要意义。
GOLM1是一种常驻高尔基Ⅱ型跨膜蛋白,由单个N端跨膜结构域、一个C端结构域和卷曲螺旋结构域组成[9]。有研究[10]表明,GOLM1通过与表皮生长因子受体相互作用而与肝癌患者的远处转移和不良预后相关。GOLM1在宫颈癌组织中高表达,其高表达与肿瘤患者国际妇产科联盟(International Federation of Gynecology and Obstetrics,FIGO)分期、分化程度、淋巴结转移及深肌层浸润显著相关[11]。GOLM1基因在前列腺癌组织中高表达,且与患者的不良预后相关,可作为前列腺癌较好的诊断标志物[12]。GOLM1通过激活基质金属蛋白酶13信号转导通路增强非小细胞肺癌的侵袭性[13]。过表达GOLM1可促进肝癌细胞迁移和侵袭能力[14]。GOLM1在肺腺癌细胞中高表达,下调其表达可抑制肺腺癌细胞增殖,而上调其表达可促进细胞增殖[15]。本研究发现,GOLM1在肺腺癌组织中高表达,其高表达与肺腺癌患者的肿瘤分化程度、淋巴结转移及临床分期显著相关。GOLM1在肺腺癌H460、A549、PG49和H1299细胞中高表达,且在肺腺癌A549细胞中表达量最高,因此选用肺腺癌A549细胞为研究对象。与空白组、si-NC组比较,si-GOLM1组肺腺癌A549细胞中GOLM1的相对表达水平显著降低,证明细胞转染成功。沉默GOLM1可明显抑制肺腺癌A549细胞增殖、迁移与侵袭能力,提示GOLM1在肺腺癌中发挥着促癌作用,GOLM1可作为肺腺癌早期诊断的生物标志物及潜在的治疗靶点。
PI3K/AKT/mTOR信号转导通路在细胞存活和生长中起着关键作用,多项研究[16-17]表明,在恶性肿瘤细胞中,PI3K/AKT/mTOR信号转导通路的活性明显增强,因此抑制PI3K/AKT/mTOR信号转导通路的活性成为治疗癌症的有效策略。Deng等[18]研究发现,姜黄素联合多西他赛通过抑制PI3K/AKT/mTOR信号转导通路诱导食管鳞癌细胞凋亡和自噬,抑制其细胞增殖。炎士珂等[19]研究表明,小分子促纤溶活性化合物可以抑制肺腺癌细胞增殖活性,抑制其细胞迁移和侵袭,其机制是通过抑制PI3K/AKT/mTOR信号转导通路实现的。孟东雪等[20]阐明扶正抑瘤汤通过抑制PI3K/AKT/mTOR信号转导通路抑制肺腺癌A549细胞增殖,并促进细胞凋亡。丁志丹等[21]阐述贝母素乙可使肺腺癌A549细胞中的PI3K/AKT/mTOR信号转导通路激活受阻,进而抑制肿瘤细胞侵袭及迁移能力。本研究结果显示,与空白组、si-NC组比较,si-GOLM1组肺腺癌A549细胞中GOLM1、p-PI3K/PI3K、p-AKT/AKT及p-mTOR/mTOR蛋白的相对表达水平显著降低,推测沉默GOLM1可能通过抑制PI3K/AKT/mTOR信号转导通路抑制肺腺癌A549细胞增殖、迁移和侵袭。为验证该推测,本研究设置PI3K/AKT/mTOR信号转导通路激活剂IGF-1进行干预,结果发现,与空白组、si-NC组比较,IGF-1组肺腺癌A549细胞增殖、迁移及侵袭能力显著增强,表明IGF-1激活PI3K/AKT/mTOR信号转导通路后可促进细胞增殖、迁移及侵袭。而与si-GOLM1组比较,si-GOLM1+IGF-1组肺腺癌A549细胞增殖、迁移及侵袭相关指标均升高,再次证明沉默GOLM1可能通过抑制PI3K/AKT/mTOR信号转导通路抑制肺腺癌A549细胞增殖、迁移及侵袭。本研究通过体内实验和BALB/c裸小鼠移植瘤实验证实沉默GOLM1可抑制PI3K/AKT/mTOR信号转导通路的激活,从而抑制肺腺癌A549细胞增殖、迁移及侵袭。
综上所述,沉默GOLM1可抑制PI3K/AKT/mTOR信号转导通路的激活,从而抑制肺腺癌A549细胞增殖、迁移及侵袭。但GOLM1调控肺腺癌细胞增殖、迁移及侵袭的机制比较复杂,尚需进一步研究。
利益冲突声明:所有作者均声明不存在利益冲突。
