白三叶TrANS 基因生物信息学分析
2022-04-14张婷婷张鹤山许本波
张婷婷,张鹤山,许本波,刘 洋
(1.长江大学,湖北 荆州 434000;2.湖北省农业科学院畜牧兽医研究所/动物胚胎及分子育种湖北重点实验室,武汉 430064)
白三叶(Trifolium repens)是异源四倍体牧草豆科植物,广泛种植于湿润温带气候地区,为放牧动物提供高质量营养牧草。白三叶有生物固氮的环境效益,是世界范围内广泛使用的饲草[1]。白三叶也因其形态多样的叶片和优美的花序在城市园林建设中得到广泛应用。观赏性白三叶新品种培育越来越得到重视,国内外已经培育出了叶片具有不同色斑的白三叶新品种[1],中国农业科学院生物技术研究所培育出了“紫斑”白三叶并已推广利用。湖北省农业科学院畜牧兽医研究所课题组发现了一株花瓣为红色的白三叶突变体[2],并培育出新品系,但其花色形成机制仍需进一步研究。
花青素合成酶(Anthocyanidin synthase,ANS)作为花青素合成途径后期的关键酶,编码类黄酮途径中的双加氧酶,催化无色花青素生成花青素,在花青素合成过程中发挥了重要作用[3],已在多个物种中得到证实。如蜡梅(Chimonanthus praecox L.)CpANS基因的超表达显著提高拟南芥花青素和原花青素的合成能力,在植物体中具有催化底物白花矢车菊素生 成 花 青 素 的能 力[4]。草 莓(Fragaria ananassa Duch)的3 个转ANS基因株系(ANSL5、ANSL15 和ANSL18)都与果实花青素合成有关[5]。在紫色枣品种胎里红中,研究者发现ZjANS1 与花青苷含量呈极显著正相关,是胎里红果皮花青苷合成的关键基因,对胎里红果皮色素合成及颜色转变起着重要的作用[6]。在白三叶研究中,研究者也预测TrANS是白三叶类黄酮合成途径的候选基因[7],但白三叶中花青素合成酶基因TrANS对花青素或类黄酮控制的相关作用研究仍不清楚。
白三叶花青素合成途径中的调控基因相关的分子研究仍然较少。为更深入了解白三叶中TrANS基因的功能,本研究以白三叶转录组测序结果中的TrANS基因为研究对象,在DNAMAN、MEGA、Prot⁃Param、 SignalP5.0、 NetPhos3.1、 InterProscan、TMHMM2.0、SWISS-MODEL、PlantCare、NovoPro、PSORT Prediction 和SOPMA 等生物信息学软件上对TrANS进行生物信息学分析,对TrANS基因的理化性质及空间结构进行预测,为其功能研究奠定一定的基础。
1 材料与方法
1.1 材料
白三叶转录组测序中的TrANS序列。
1.2 方法
在DNAMAN6.0 软件上进行TrANS开放阅读框的查找、翻译。在在线工具ProtParam(https://web.expasy.org/protparam/)上预测TrANS 蛋白质的理化性质。在TMHMM2.0(https://services.healthtech.dtu.dk/service.php?TMHMM-2.0)上对TrANS 蛋白质的跨膜结构进行预测。在NetPhos3.1(https://services.healthtech.dtu.dk/service.php? NetPhos-3.1)上 对TrANS 蛋白质的磷酸化位点进行预测。在Sig⁃nalP5.0(https://services.healthtech.dtu.dk/service.php?SignalP-5.0)上对TrANS 蛋白质的信号肽进行预测。在NovoPro(https://www.novopro.cn/tools/disordered.html)上对TrANS 蛋白质的无序化特征进行预测。在SOPMA(https://npsa-prabi.ibcp.fr/cgibin/secpred_sopma.pl)上对TrANS 蛋白质的二级结构进行预测。在InterProscan(https://www.ebi.ac.uk/interpro/)上对TrANS 蛋白质的结构域进行预测。在SWISS-MODEL(https://swissmodel.expasy.org/)上对TrANS 蛋白质的三级结构进行预测。在Plant⁃Care (https://bioinformatics.psb.ugent.be/webtools/plantcare/html/)上对TrANS 蛋白质的启动子顺式作用元件进行预测。在NCBI(https://www.ncbi.nlm.nih.gov/)查找并下载TrANS 的同源序列,并在MEGA X 软件上进行序列比对并构建进化树。
2 结果与分析
2.1 TrANS 基因的理化性质及一级结构
TrANS基因的cDNA 长度为1 038 bp,正向链第一框即从第一个碱基开始,到最后一个碱基有最大的开放阅读框,开放阅读框编码了345 个氨基酸(图1),此即为TrANS 蛋白质的一级结构。TrANS 蛋白质的分子式为C1740H2736N452O504S22,分子质量(MW)为3.87 kDa,理论等电点为6.33。Lys 氨基酸有30 个,占总数的8.7%,数量最多;接下来为Leu,29 个,占8.4%;Glu 27 个,占7.8%;最少的是Trp 和Gln,有5个,占1.4%,正电氨基酸残基(Arg+Lys)有42 个,负电残基(Asp +Glu)45 个,所以该蛋白带有负电荷。280 nm 处的吸光度在1.017~1.033。不稳定系数为39.17,为稳定蛋白。脂肪系数为85.04,总平均疏水指数为-0.150,所以TrANS 蛋白为亲水性蛋白。没有跨膜结构和信号肽。无序化特征预测发现,在90~100 个氨基酸之间可能出现无序化结构,分值越高代表该位置为无序区的概率越大,0.5 作为无序区的分界线。有15 个丝氨酸(Ser)磷酸化位点,8 个络氨酸(Tyr)磷酸化位点,5个苏氨酸(Thr)磷酸化位点。

图1 TrANS 蛋白的一级结构
2.2 TrANS 蛋白的二级结构及结构域
TrANS 蛋白的二级结构中,α-螺旋最多,有143个,占41.45%;无规则卷曲有129 个,占37.39%;延伸链有47 个,占13.62%;β-折叠有26 个,占7.54%;没有β-桥、310 螺旋、弯曲区、π 螺旋、模糊状态以及其他状态等二级结构(图2)。在8~246 个氨基酸间可能存在Epimerase_deHydtase 或Epimerase 结构域,在7~318 个氨基酸间有NAD(P)-bd_dom_sf 或NAD(P)-binding Rossmann-fold domains 结构域,在8~302 个氨基酸之间有FR_SDR_e 结构域,在3~331个氨基酸之间有Nad Dependent Epimerase/dehydra⁃tase 或Dihydroflavonal-4-reductase 2 结 构 域,在1~337 个氨基酸之间有CATH-Gene3D entry 结构域。

图2 二级结构预测
2.3 TrANS 蛋白的三级结构
TrANS 蛋白的三级结构预测以3bxx.1.A 为模板进行同源建模,序列相似度为75%,GMQE 为0.88,QMEAND 为0.86 ± 0.05,符合同源建模的要求。三级结构预测结果如图3 所示,以α⁃螺旋和无规则卷曲为主,与二级结构的预测一致。
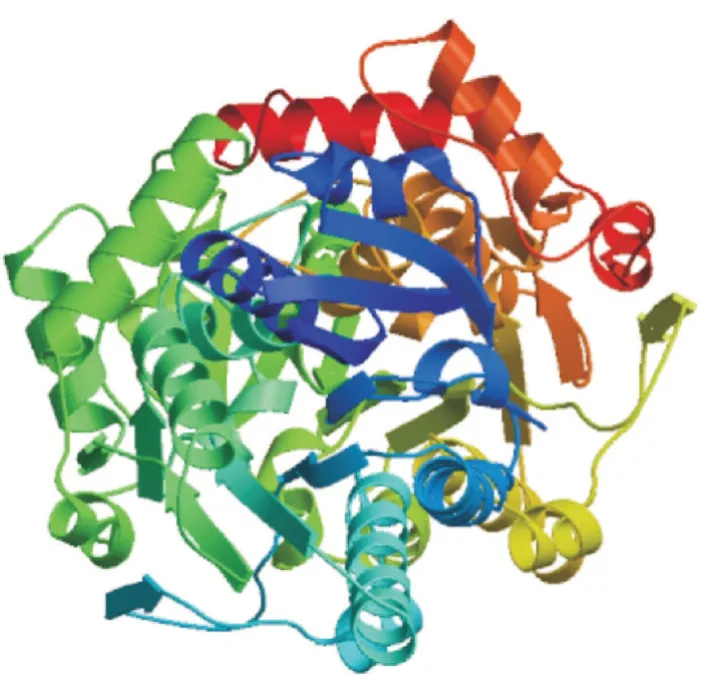
图3 三级结构预测
2.4 TrANS 基因的顺式作用元件
白三叶TrANS基因中,有9 种序列的顺式作用元件没有相关命名和功能研究,有25 种在其他生物体中有相关命名或功能研究。其中,AT~TATAbox、MYB、MYB-like sequence、MYC、Myb-binding site、STRE、Unnamed__1、Unnamed__2、Unnamed__4、W box、WRE3 和as-1 在别的物种中也有发现相同的启动子序列,但没有相关功能研究。AACA_motif在水稻(Oryza sativa)中参与胚乳特异性负表达;ABRE 在大麦(Hordeum vulgare)中是参与脱落酸反应的顺式作用元件;AE-box 在拟南芥(Arabidopsis thaliana)中是光响应模块的一部分;Box 4 在意大利荷兰芹(Petroselinum crispum)中是光响应的保守DNA 模块的一部分;CAAT-box 在烟草(Nicotiana glutinosa)、豌豆(Pisum sativum)和拟南芥中是启动子和增强子区域的共同顺式作用元件;CGTCA-mo⁃tif在大麦中是参与茉莉酸甲酯反应的顺式作用调节元件;G-box 在玉米(Zea mays)中参 与光响应;GARE-motif 是豌豆光响应元件的一部分;LTR 在大麦中参与低温响应;O2-site 在玉米中参与玉米醇溶蛋白代谢的调节;TATA-box 在甘蓝型油菜(Brassica napus)和拟南芥中是转录起始点的核心启动子元件;TGACG-motif 也是大麦中参与茉莉酸甲酯反应的顺式作用调节元件(图4)。

图4 顺式作用元件分布位点
2.5 TrANS 氨基酸的同源分析
在NCBI 对TrANS的氨基酸序列进行序列比对,发现TrANS氨基酸序列和红三叶(Trifolium pratense)的相似性最高,为94.03%,与蒺藜苜蓿(Medicago truncatula)的相似性为88.22%,与鹰嘴豆(Cicer ari⁃etinum)、百 脉 根(Lotus japonicus)、大 豆(Glycine max)、野大豆(Glycine soja)、丝茎黄耆(Lotus filicau⁃lis)、绿豆(Vigna radiata)、四季豆(Phaseolus vulgar⁃is)、赤小豆(Vigna umbellata)、鸡血藤(Spatholobus suberectus)、刺毛黧豆(Mucuna pruriens)、木豆(Caja⁃nus cajan)和红豆(Vigna angularis)的相似性依次为85.93% 、86.23% 、85.93% 、85.36% 、83.33% 、82.03% 、81.87% 、80.80% 、83.83% 、85.58% 、79.83%、80.52%。下载这14 条同源性的氨基酸序列,进行多序列比对,并构建进化树(图5)。从进化树中可以看出,白三叶中TrANS 和红三叶的亲缘关系最近,接下来是蒺藜苜蓿和鹰嘴豆,然后是百脉根和丝茎黄耆,和NCBI 中的序列相似度基本一致,说明结果准确可靠。进化树逐级分支,具有较多层级,说明ANS 蛋白的进化具有保守性和物种特异性。
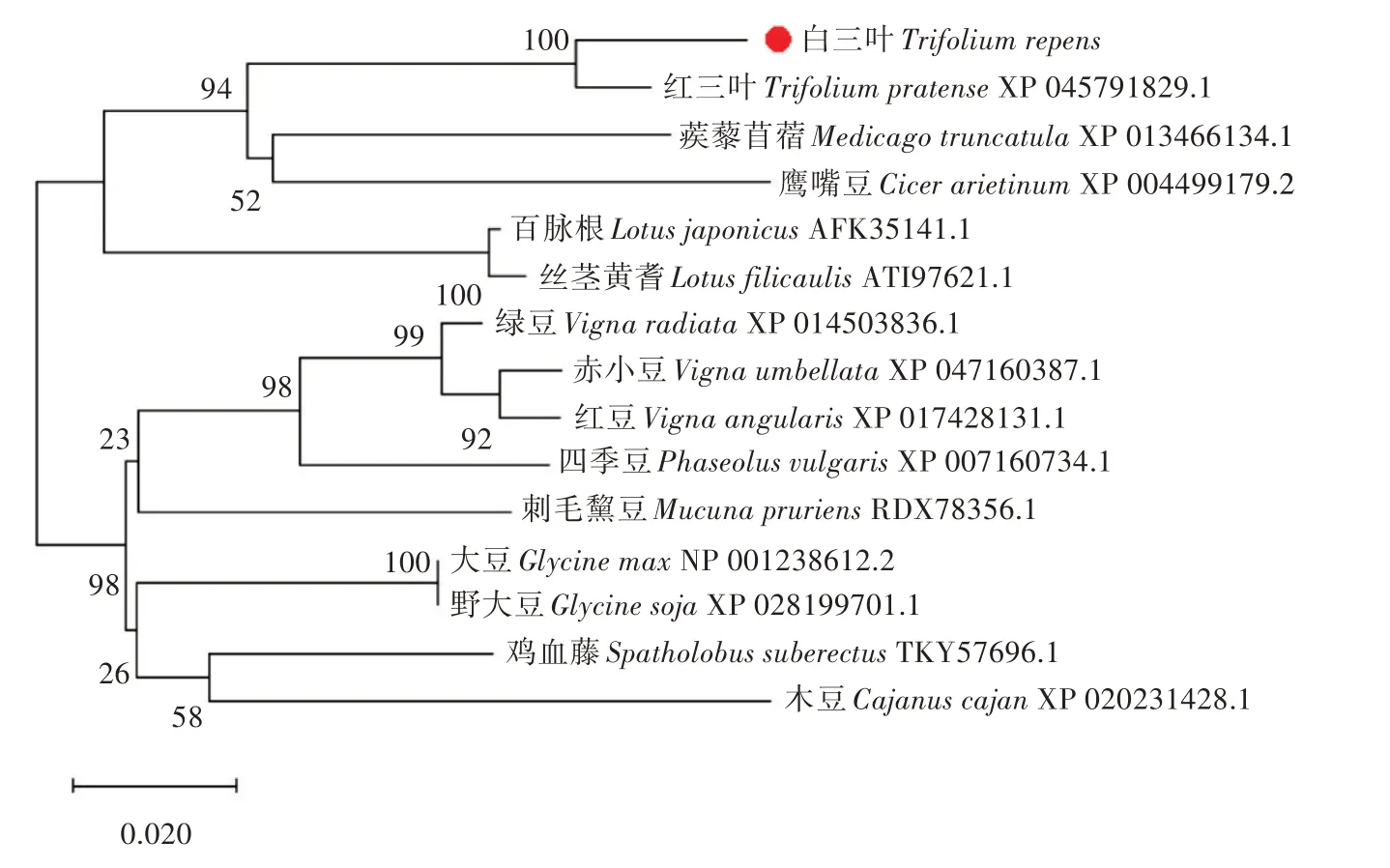
图5 系统进化树
3 小结与讨论
白三叶TrANS基因特征和蛋白的理化性质与其他物种中的ANS有相似性也有差异,如芒果皮的Mi⁃ANS理论分子质量明显高于白三叶,在甘薯中IbANS 不稳定,但在白三叶中为稳定蛋白;TrANS 的二级结构与其他物种中的二级结构组成类似;ANS基因的进化和物种有关,所以TrANS的亲缘关系和其他物种中ANS的亲缘关系不相同。芒果皮的Mi⁃ANS中包含1 262 bp 的全长cDNA,开放阅读框(ORF)为1 056 bp,编码351 个氨基酸的蛋白质,推导MiANS 氨基酸序列的理论分子质量为39.8 kDa,通过系统发育分析发现,编码该蛋白的基因与山葡萄、可可、桑树、荔枝等果树亲缘关系高[8]。芥菜型油菜BjANS的cDNA 序列长1 377 bp,具有1 077 bp的开放阅读框,编码一个由358 个氨基酸组成的推导多肽,预测分子质量为4.09 kDa,估计等电点为5.18,推测的BjANS 蛋白与拟南芥、菜青虫和甘蓝菜青虫ANS 蛋白具有91%~99%的氨基酸序列同源性[9]。甘薯(Ipomoea batatas)IbANS 蛋白的分子质量为4.05 kDa,总原子数有5 709 个,氨基酸有362 个,属于不稳定的亲水非分泌蛋白,和铁皮石斛一样,二级结构以α⁃螺旋和无规则卷曲为主,但无规则卷曲含量更多,与三浅裂野牵牛(Ipomoea trifida)亲缘关系 最 近[10]。白 三 叶TrANS基 因 的cDNA 长 度 为1 038 bp,整条链都是开放阅读框,编码合成了345 个氨基酸,TrANS 蛋白质的分子式为C1740H2736N452O504S22,分子质量为3.87 kDa,理论等电点为6.33,为带负电的亲水稳定不分泌蛋白,二级结构以α⁃螺旋和无规则卷曲为主,其α⁃螺旋含量更多。TrANS与同源基因的相似性均在70%以上,说明TrANS基因是一个较为保守的序列,ANS 蛋白的进化具有保守性和物种特异性。
白三叶TrANS基因的顺式作用元件缺少相关功能研究,但类似的顺式作用元件如MYB 在其他物种中有相关研究。大麦花青素的合成受MYB 和bHLH类转录因子的调控[11]。腊梅CpbHLH1 的表达与蜡梅花中花青素生物合成关键基因CpANS1呈负相关,CpbHLH1 不能直接抑制花青素合成相关基因的表达,但是可以通过抑制MYB-b HLH 复合体的活性来实现对花青素生物合成的抑制作用[12]。MYB和bHLH 对ANS基因都有调控作用,但白三叶TrANS中没有bHLH 启动子元件,预测TrANS中的MYB 元件对TrANS具有调控作用,进而调控白三叶的花青素途径。
ANS基因在花青素合成途径中有重要作用。可可(Theobroma cacao)的TcANS基因在烟草中过量表达导致花瓣中花青素和原花青素含量均增加,在拟南芥突变体中的过量表达补充了其种子原花青素缺陷的表型[13]。将水稻(Oryza sativa)OsANS基因在不积累花青素的水稻突变体中过量表达,可以获得含有黄酮类化合物和增强抗氧化能力的新型转基因水稻[14]。大量研究表明ANS基因和植物花青素合成有关,本研究为白三叶TrANS的后续功能研究奠定了理论基础。
