基于催化剂机理及特点的中学化学问题探讨
2022-04-14韩建丰高凌蕊
韩建丰 高凌蕊
首都师范大学第二附属中学(100037) 北京市广渠门中学(100062)
催化剂是中学化学知识点,同时更是工业生产的重要物质、化学科学研究开发的重点项目。《普通高中化学课程标准(2017年版2020年修订)》(以下简称“课标”)中与催化剂相关的描述有19处,2019年人教版教材的所有模块都有提及催化剂。“课标”明确指出:知道化学反应是有历程的,知道催化剂可以改变反应历程,理解催化剂对调控化学反应具有重要意义。
炼油、化工、制药等生产生活实际都会运用到催化剂,这些行业发展的最有效的动力之一是催化剂的技术发展[1],新催化剂和催化技术的发明会带来巨大的工业革命,提升化学反应速率和单位时间内原料利用率、增加产率等都与催化剂有关。因而,高考常在工业生产情境中考查学生理解和阐述催化剂相关问题,其中有关催化作用机理和催化剂特点的探讨是近年来试题考查热点。为引导学生厘清问题并深入理解催化剂对化学反应调控的作用,本文在实际情境中进行学习与探讨。
1 催化剂对工业生产的重要意义
催化剂加快了化学科学发展和社会进程[2]。19世纪初,铁基催化剂在合成氨中应用,促进氨的工业合成发展,化肥产量急速提升,为粮食种植和人口发展作出了巨大贡献;20世纪中叶,有机高分子材料工业因Ziegler-Natta催化剂而开创,开启了合成材料时代;同期,沸石分子筛由于具有独特尺寸、形状的孔道结构,成为性能优异的催化剂,引发了一系列的生产工艺变革;20世纪70年代,汽车尾气净化催化剂实现工业化生产,助力内燃机中化石燃料的污染处理。2021年,诺贝尔化学奖旨在表彰“不对称有机催化”研究这一催化工艺的革新对药物研究方面的开创性贡献。坚持可持续发展的新时代,催化剂的发展对于经济的直接与间接贡献可达GNP(国民生产总值)的20%~30%。我国高度重视新催化剂的研制、积极推动催化技术的发展,已在国家层面将催化剂作为化学科学研究的重点项目之一,以此解决资源消耗与综合利用、发展资源节约型农业、工业、交通运输及生活体系。
2 一般催化剂机理与催化剂特点
2.1 催化剂机理
IUPAC(国际纯粹与应用化学联合会)在2021年重新定义了催化剂概念:催化剂是指一种在不改变反应总标准吉布斯自由能变化的情况下提高反应速率的物质。这种作用称为催化作用,涉及催化剂的反应称为催化反应。
催化作用根据相(即物质状态)的不同在高中阶段主要分为两类[3]。
2.1.1 均相催化
若催化剂与反应物相同,则催化剂和反应物同处于一相,没有相界存在,称为均相催化作用。均相催化普遍在液相中进行,有选择性高、副反应少的特点。最常见的为均相酸碱催化,如酯类以OH-或H+作催化剂发生的酸性和碱性水解反应等。同时气相均相催化也是研究热点,主要研究反应物和催化剂均为气相时的化学变化,如臭氧可在氮氧化物等汽车尾气催化下分解,机理为:O+NO2=NO+O2、O3+NO=NO2+O2。
2.1.2 多相催化
若发生在两相界面上的催化作用,则称为多相催化。多相催化中的催化剂为多孔结构固态物质,反应物可以是液体或气体,在催化过程中多孔固体催化剂先对反应物分子发生化学吸附作用(类似于锁钥模型),通过固体的孔洞(锁孔)让匹配的反应物分子(钥匙)活化,反应的活化能降低,从而使反应速率加快。高中化学介绍的工业生产中的催化作用很多属于多相催化,如人造黄油的工业生产:不饱和高级脂肪酸甘油酯和氢气通过固态镍的催化作用转变成饱和高级脂肪酸甘油酯。镍就是一种多相催化剂,广泛应用于不饱和碳碳双键和碳碳三键与氢气的加成反应。
大多数催化反应中,催化剂参与反应,改变反应路径。原反应:M+N→MN(慢反应);催化机理:M+P→MP(快反应);MP+N→MN+P(快反应)。该式中M、N为反应物,MN为产物,P为催化剂,有催化剂情况的总表观活化能比原反应的总表观活化能低很多,根据阿伦尼乌斯公式k=Ae-E/RT,其中:k是速率常数,A是指前因子,E是活化能,R为摩尔气体常量,T为热力学温度[4],可知活化能降低速率常数k增大,从而使反应速率显著提高。因此,催化剂能有效提高化学反应速率。
2.2 催化剂特点
催化剂的特点主要有3个方面。
2.2.1 化学热力学上可以自发的反应才能被催化剂加快反应速率
若吉布斯自由能大于零,任何催化剂都不能让反应进行,更谈不上加快反应速率。另外需要通过计算确定化学反应的自发温度,例如高温或低温下自发,因催化剂在不同温度下催化效果(活性)不同,这对催化剂的选取有指导作用。最后要清晰理解催化剂只加速化学反应达到平衡,催化剂不能改变反应的限度和平衡常数。
2.2.2 催化剂应对主反应有选择性
化学反应在同样的反应物种类时,可能有多个反应同时发生,工业上一般称之为主反应和副反应,主反应的产物是工业产品,副反应产物需要进行分离,有必要应用催化剂选择性提高主反应的速率。因而高中常说的实际转化率和实际产率经常出现偏差,反应物实际转化率提高了,但目标产物的实际产率下降了,说明催化剂的选择出现了问题,需要寻找选择性更好的催化剂。因而需要理解加快主反应的反应速率和催化剂择性是一个整体。
2.2.3 催化剂有寿命
理想情况下,催化剂在总反应中看起来不被消耗。但实际反应过程中,催化剂经常因为高温分解或与杂质的化学反应导致催化剂发生不可逆转的改变,称之为催化剂中毒。如石油工业的催化重整、催化加氢都要使用催化剂(如Pt、Ni等),而原油中含有微量硫、氮化合物会使催化剂中毒,导致石油的综合利用出现阻碍[5],因而因催化剂中毒引起的一系列问题也经常会作为信息素材考查学生对这一问题的理解。
催化剂特点的考查,经常会以图表信息的形式出现,考查学生整理加工信息后对实际生产和速率与平衡理论出现差异的解释性阐述。
3 催化剂在高中学业水平测试中的考查
工业生产的复杂真实情境为高考命题提供了丰富素材,近年来高考中涉及到很多化工生产中催化剂机理和特点问题。
从题目呈现上分析,主要考点是从反应历程、活化能、化学反应速率、平衡移动、实际转化率及产率等角度分析催化作用。从题目素材分析,素材一般融合图像、表格,考査学生信息加工应用能力。题目呈现与题目素材都旨在考出学生的化学核心素养落实情况。
整理归纳近年来高考试题,笔者将与催化剂相关考点分为以下4类。
3.1 催化机理
高中化学教材中涉及到催化反应机理的反应较少且较为浅显,如乙醇的催化氧化、三价铁离子催化双氧水的分解。近年来的高考试题,更多是借助催化机理考查物质的量、方程式书写或方程式正误的判断、氧化还原反应等概念。
例1:[Rh(CO)2I2]-催化甲醇羰基化反应(见图1)。设问:错误的是(________)。
A.反应中间体有CH3COI。
B.总反应为CH3OH+CO=CH3CO2H。
C.Rh的成键数目在反应过程中不变。
D.有CH3OH+HI=CH3I+H2O反应发生。
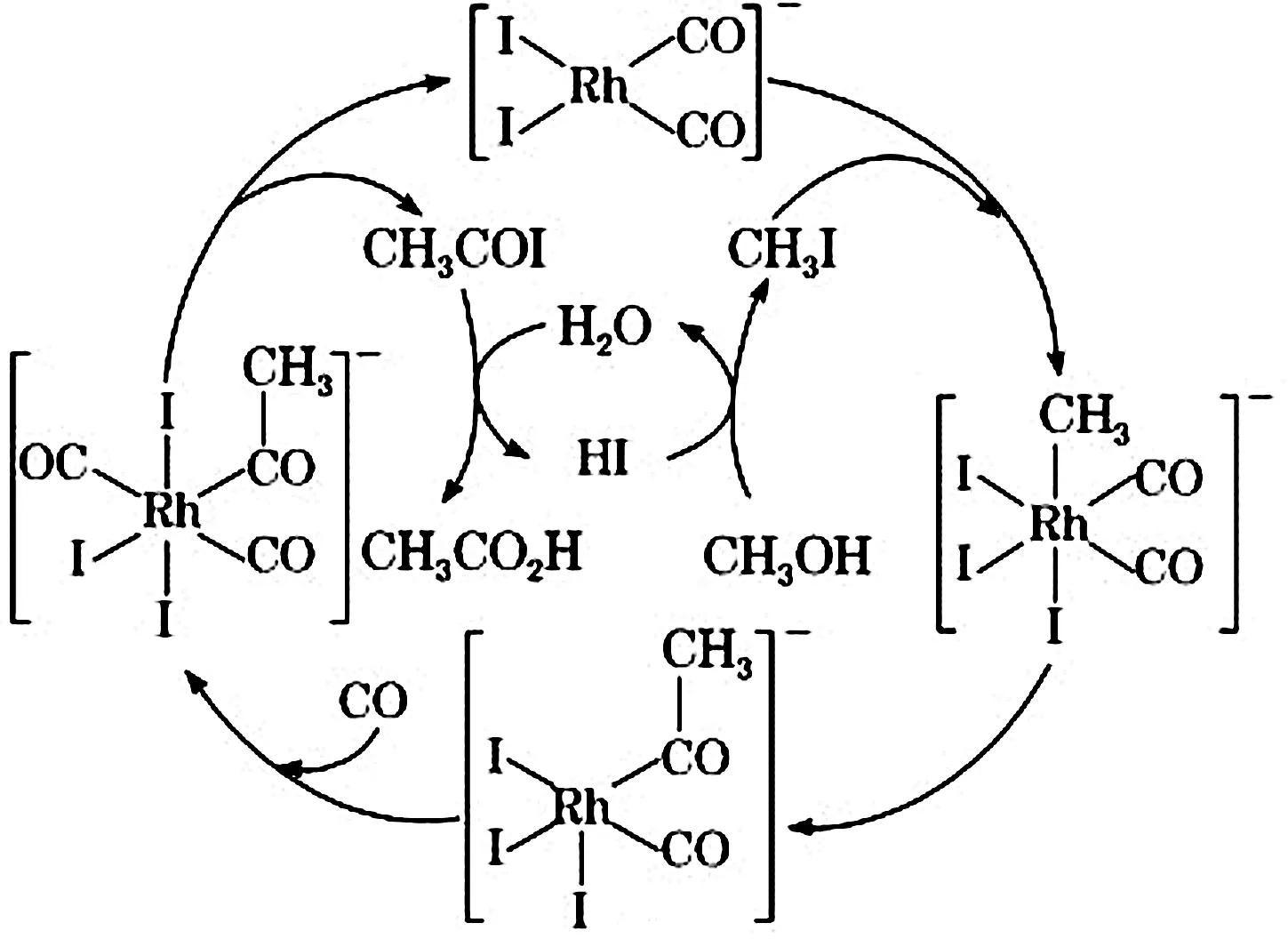
图1 甲醇羰基化图示
学生需要理解只要催化剂参与化学反应,在反应过程中就有旧键的断裂与新键的形成,转变中Rh的键数由6变5,Rh在反应过程中成键数目发生变化,故C错误。
3.2 工业生产应用
课本上有关催化剂在工业生产中的应用有不少例证,例如工业制取硝酸中氨气的催化氧化反应,Pt为催化剂;工业制取硫酸中二氧化硫的催化氧化反应中V2O5做催化剂等,但教材中并没有对催化剂的选择性和活性进行探讨,在备考过程中需要开拓学生视野。
例2:催化剂Cu/ZnO作用下,CO2和H2同时发生两个反应,存在竞争关系。I:CO2(g)+3H2(g)=CH3OH(g)+H2O(g)、II:CO2(g)+H2(g)=CO(g)+H2O(g)。生产中加入投料比为1∶2.2的反应物CO2和H2,控制压强,经过单位时间得到数据见表1。设问:画出反应I在无催化剂、有Cat.1和有Cat.2下“反应过程-能量”图像。

表1 相同时间内实验数据
学生在完成本题时需首先据表1数据算出生成CH3OH的CO2占全部CO2的含量:对比数据,Cat.1为12.3%×42.3%≈5.20%;Cat.2为10.9%×72.7%≈7.92%。通过计算结果知Cat.2的催化选择性优于Cat.1,Cat.2催化效果更好,反应的活化能更低。最后要注意,催化剂不改变反应物、生成物的总能量,图像中起点、终点相同。作图结果见图2。

图2 3种情况能量变化历程图
3.3 温度与催化剂活性
催化剂有各自的活化温度,温度过高或过低均致催化剂活性降低。如对温度十分敏感的生物催化剂(酶),常见例子为病人发烧时体温升高2~3 ℃就会导致胃蛋白酶活性降低从而引起食欲不振。
例3:有害的H2S和SO2需要进行工业处理……生物脱H2S的过程中涉及化学变化:FeSO4、O2、H2SO4在硫杆菌条件下生成Fe2(SO4)3、H2O。硫杆菌条件下FeSO4被氧化的速率是无菌时的5×105倍,该菌的作用是(____)。若反应温度过高反应速率下降,原因是(____)。
学生在作答时需了解到硫杆菌能极大加快反应速率,因此可判断硫杆菌为催化剂。根据催化剂特点判断反应温度过高,硫杆菌因蛋白质变性而催化性能减弱,反应速率明显下降。
3.4 自催化反应
化学有一类特殊催化反应:自催化反应,这类反应中的生成物对反应有催化作用。它的外显特点是初始反应速率小,随着起催化作用的产物的产生和浓度增大让反应速率急速攀升。如在化学反应原理模块中涉及到的草酸与酸性高锰酸钾的反应,反应开始速率小,随着反应进行,生成的催化剂Mn2+浓度增大,化学反应速率跳跃式增长。


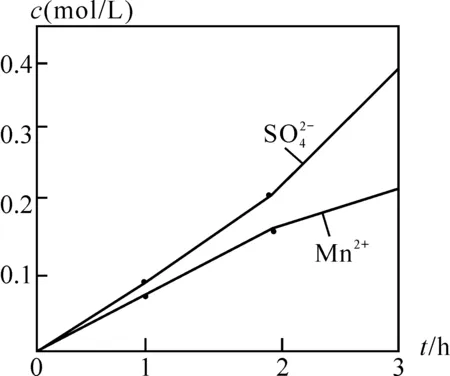
图3 离子浓度随时间变化
4 结束语
通过以上4种题型分析可知,学生在处理涉及催化剂的试题时需要掌握如下化学观念:催化剂机理——参与反应,改变反应历程,降低活化能,加快反应速率,减少到达平衡所需时间。催化剂特点——催化剂不改变焓变,不使平衡移动,催化剂有选择性。催化剂催化效果——催化剂中毒,活性受外界条件的影响,如温度、表面积等。
新高考重视真实情境下创设题目对学生进行考查,催化剂相关问题作为高考考查重点,应该引起学生的重视,以上催化剂机理、特点、化学史及相关题型需要学生灵活理解并能够应用。同时期望在真实问题的解决中落实核心素养培育,使学生对化学科学更感兴趣,在未来参与到祖国的化学学科建设中。
