蛋白质磷酸化对肌动球蛋白解离及其乙酰化水平的影响
2022-04-14张业军张德权侯成立摆玉蔷任驰王旭李欣
张业军,张德权,侯成立,摆玉蔷,任驰,王旭,李欣
蛋白质磷酸化对肌动球蛋白解离及其乙酰化水平的影响
张业军,张德权,侯成立,摆玉蔷,任驰,王旭,李欣
中国农业科学院农产品加工研究所/农业农村部农产品质量安全收贮运管控重点实验室,北京 100193
【】研究肌球蛋白重链和肌动蛋白磷酸化对其乙酰化水平、肌动球蛋白解离及ATP酶活性的影响,为通过调控磷酸化水平改善肉品嫩度提供理论依据。以羊背最长肌为材料制备肌肉匀浆液,采用碱性磷酸酶抑制剂(抑制去磷酸化)和蛋白激酶抑制剂(抑制磷酸化)调控其磷酸化水平,在4℃分别孵育0、0.5、4、12、24、48和72 h,利用SDS-PAGE电泳和荧光染色、蛋白质免疫印迹、ATP酶活性测定试剂盒分析蛋白质磷酸化水平、乙酰化水平、肌动球蛋白解离程度和ATP酶活性随孵育时间的变化;利用分子动力学模拟分析肌球蛋白重链和肌动蛋白磷酸化对肌动球蛋白结构的影响。碱性磷酸酶抑制剂处理组中肌球蛋白重链磷酸化水平在孵育4、12和72 h时显著高于对照组和蛋白激酶抑制处理组(<0.05),肌动蛋白磷酸化水平在孵育4、12、24、48和72 h时显著高于对照组和蛋白激酶抑制处理组(<0.05),表明肌球蛋白重链和肌动蛋白发生去磷酸化反应被碱性磷酸酶抑制剂所抑制。碱性磷酸酶抑制剂处理组中肌动蛋白乙酰化水平在孵育4、12、24、48和72 h时显著低于蛋白激酶抑制组(<0.05),肌球蛋白重链乙酰化水平呈无规律变化,表明肌动蛋白磷酸化抑制其乙酰化,肌球蛋白重链磷酸化对其乙酰化影响无明显规律。分子动力学结果表明,肌球蛋白重链第2、3、54位丝氨酸等位点和肌动蛋白第54位丝氨酸、第55位酪氨酸等位点磷酸化增加了肌动球蛋白结构的总能量、势能和动能,降低了键能,导致肌动球蛋白结构变得不稳定。在0—72 h孵育过程中,碱性磷酸酶抑制剂处理组的肌动球蛋白解离程度始终高于蛋白激酶抑制处理组,ATP酶活性低于蛋白激酶抑制处理组(<0.05),表明肌球蛋白重链和肌动蛋白磷酸化促进肌动球蛋白解离。肌球蛋白重链磷酸化直接促进肌动球蛋白解离,肌动蛋白磷酸化通过抑制其自身乙酰化促进肌动球蛋白解离。
磷酸化;乙酰化;肌球蛋白重链;肌动蛋白;解离
0 引言
【研究意义】肉的嫩度是影响消费者满意度和购买意愿的主要品质之一[1-2]。肌动球蛋白解离促进宰后肉的嫩化,与肉的嫩度呈正相关[3-4]。因此,肌动球蛋白解离一直是肉品领域的研究热点。【前人研究进展】肌球蛋白和肌动蛋白分别是粗肌丝和细肌丝的主要成分,动物屠宰后,二者结合形成肌动球蛋白。已有研究表明,肌动球蛋白解离受内源酶、钙离子浓度、ATP及其水解产物等内因和温度、磷酸盐及压力等外因影响[5-7]。除细胞内外环境因素外,Perrie等[8]研究发现肌球蛋白与肌动蛋白的结合还受蛋白质磷酸化影响。肌球蛋白调节轻链磷酸化改变肌球蛋白头部结构,使肌球蛋白球状头部远离粗肌丝,调节细肌丝与粗肌丝的相互作用[9-11]。研究发现宰后肌肉蛋白质磷酸化可能参与调控肉品品质,肉品领域对此开展了大量研究[12-14]。肌钙蛋白T和肌球蛋白轻链磷酸化修饰削弱了细肌丝与粗肌丝的相互作用,表明蛋白质磷酸化可能参与调控宰后肌肉僵直进程[15-16]。蛋白质乙酰化是另一种重要的蛋白质翻译后修饰,蛋白质乙酰化调节蛋白质功能,如细胞信号传导、酶活性和蛋白相互作用等。研究发现与肌肉收缩有关的蛋白质是在肌肉向肉转化过程中鉴定出的最大的乙酰化蛋白质簇之一,特别是鉴定到大量肌球蛋白重链和肌动蛋白乙酰化位点,表明肌球蛋白重链和肌动蛋白的乙酰化可能影响肌动球蛋白解离[17-18]。生命科学领域研究表明,蛋白质磷酸化和乙酰化之间存在交互作用,如人体抑癌基因蛋白的磷酸化增强其自身与乙酰转移酶的作用,促进其乙酰化[19];叉头框转录因子O3a乙酰化促进其与激酶的结合,有利于其被磷酸化等[20]。【本研究切入点】肌球蛋白重链和肌动蛋白是肌动球蛋白的重要组成部分,二者磷酸化如何调控肌动球蛋白解离,与其乙酰化水平是否存在交互作用,目前尚不清楚。因此,本研究通过体外孵育试验分析肌球蛋白重链和肌动蛋白磷酸化水平与其乙酰化水平以及肌动球蛋白解离之间的关系,初步探索肌球蛋白重链和肌动蛋白磷酸化修饰对其乙酰化以及肌动球蛋白解离的影响。【拟解决的关键问题】通过分析肌球蛋白重链和肌动蛋白磷酸化水平的改变对肌动球蛋白解离、肌动球蛋白ATPase活性及其乙酰化水平的影响,揭示肌球蛋白重链和肌动蛋白磷酸化和乙酰化共同调节肌动球蛋白解离的潜在机制,为肉品嫩度调控新技术的研发提供理论依据。
1 材料与方法
试验于2020年10—12月在中国农业科学院农产品加工研究所进行。
1.1 样品采集
选取12只体型相近、饲养管理方式相同的7月龄小尾寒羊和蒙古羊杂交公羊,按照随机顺序屠宰并依据屠宰顺序平均分为3组,每组4只羊,平均胴体重为(24.15±2.48)kg。宰后30 min内取下背最长肌,剔除筋膜及结缔组织后,将背最长肌切碎后装于冻存管液氮速冻,保存于-80℃备用。
1.2 试剂
免疫沉淀试剂盒、蛋白浓度测定试剂盒、Pro-Q和Ruby染色液购自赛默飞世尔科技(中国)有限公司;二硫代苏糖醇、十二烷基硫酸钠、甲叉双丙烯酰胺、四甲基乙二胺、三羟甲基氨基甲烷、丙烯酰胺、过硫酸铵、ATP酶活性测定试剂盒、肌动蛋白抗体购自西格玛奥德里奇(上海)贸易有限公司;碱性磷酸酶抑制剂(货号:4906837001,主要成分:D-甘露糖醇、二水合钼酸钠、聚乙二醇、(T-4)-钒酸钠、1-乙烯基-2-吡咯烷酮均聚物)和蛋白酶抑制剂(货号:04693116001,主要成分:二氢乙二胺四乙酸二钠、4-(2-氨基无乙基)苯磺酰氟盐酸盐)购自瑞士罗氏公司(Roche Group);肌球蛋白重链抗体购自安迪生物科技(上海)有限公司;乙酰化赖氨酸抗体购自杭州景杰生物科技股份有限公司;蛋白激酶抑制剂Go 6983(货号:HY-13689,主要成分:C26H26N4O3)、H-89(货号:HY-15979A,主要成分:C20H20BrN3O2S)、Bisindolylmaleimide I(货号:HY-13867,主要成分:C25H24N4O2)购自美国MedChemExpress(MCE)公司;电泳预制胶购自伯乐生命医学产品(上海)有限公司;硝酸纤维素膜购自颇尔(中国)有限公司;碳酸氢钠、碳酸钠、氯化钠、乙腈、乙酸、乙醇、二甲基亚砜等为国产分析纯试剂,购自国药集团化学试剂有限公司。
1.3 仪器与设备
Spectra Max 190全波长酶标仪,美国Molecular Devices公司;ML204/2电子天平、Mettler-Toledo pH计,上海梅特勒-托利多有限公司;Ultra Turrax Disperser S25分散器,艾卡(广州)仪器设备有限公司;高效冷冻离心机,上海力申科学仪器有限公司;恒温震荡金属浴,杭州奥盛仪器有限公司;MJ-Ⅱ霉菌培养箱,上海一恒科技有限公司;电泳设备、凝胶成像系统,伯乐生命医学产品(上海)有限公司;Discovery Studio 2019分子模拟软件,法国达索公司。
1.4 试验方法
1.4.1 样品制备 将3 g肌肉加入75 mL预冷的Weber-Edsall缓冲液(0.6 mol·L-1KCL、0.01 mol·L-1Na2CO3、0.04 mol·L-1NaHCO3,蛋白酶抑制剂50 mL/片,pH 7.2),用匀浆机在冰浴下匀浆3次(每次30 s,中间间隔10 s)。利用二喹啉甲酸(Bicinchoninic acid,BCA)蛋白定量试剂盒测定蛋白浓度后,使用Weber-Edsall缓冲液将蛋白浓度调整至4 mg·mL-1。
将所得蛋白匀浆液平均分为3份,分别添加碱性磷酸酶抑制剂(1片碱性磷酸酶抑制剂/10 mL蛋白匀浆液)、蛋白激酶抑制剂(0.6 μmol·L-1Go 6983、0.48 μmol·L-1H-89、0.2 μmol·L-1Bisindolylmaleimide I)和等量的二甲基亚砜。为与企业实际生产温度一致,在4℃下振荡孵育0、0.5、4、12、24、48和72 h,在每个孵育时间点留样,液氮速冻后于-80℃保存,用于蛋白质乙酰化和磷酸化水平的测定;再取0.5 mL蛋白匀浆液加入1 mL超纯水(使溶液中KCl的浓度变为0.2 mol·L-1)后在15 000×、4℃下离心20 min,收集上清液(含游离肌动蛋白),添加等体积上样缓冲液,混合后煮沸10 min,液氮速冻后于-80℃保存,用于肌动球蛋白解离程度测定;将沉淀溶解于150 μL KCl-Tris缓冲液(0.6 mol·L-1KCl、0.02 mol·L-1Tris-HCl,pH 7.2)中,液氮速冻后于-80℃保存,用于肌动球蛋白ATPase活性测定。
1.4.2 肌球蛋白重链和肌动蛋白免疫沉淀 免疫沉淀按照试剂盒的说明书进行。基本步骤如下:将10 μg抗体添加到250 μL蛋白溶液中,用免疫沉淀裂解缓冲液将抗体/样品混合物稀释至500 μL,4℃下孵育过夜。吸取25 μL(0.25 mg)Protein A/G磁珠,用缓冲液洗涤后利用磁力架除去上清液。将抗原样品/抗体混合物与磁珠混合,在室温下孵育1 h。用磁力架收集磁珠(含肌球蛋白重链或肌动蛋白),然后用缓冲液洗涤3次,超纯水洗涤1次。向离心管中加入50 µL上样缓冲液,并在室温下混合孵育10 min洗脱目标蛋白。最后,使用磁力架除去磁珠,将上样缓冲液(含目标蛋白)煮沸10 min。液氮速冻后于-20℃保存,用于乙酰化和磷酸化分析。
1.4.3 肌球蛋白重链和肌动蛋白磷酸化水平 浓缩胶浓度为4%,肌球蛋白重链使用7.5%的分离胶,肌动蛋白使用15%的分离胶,上样量为10 μL。初始电压为70 V,当溴酚蓝跑出浓缩胶后,将电压增至100 V直至电泳结束。磷酸化染色和全蛋白染色流程参考陈立娟等[21]的方法。使用凝胶成像仪拍照,利用Quantity One软件进行灰度值分析,肌球蛋白重链和肌动蛋白磷酸化水平为Pro-Q染色光密度值(P)和Ruby染色光密度值(T)之比。
1.4.4 肌球蛋白重链和肌动蛋白乙酰化水平 将15 μL样品上样至4%—20%的梯度预制胶上。初始电压为100 V,当溴酚蓝跑出浓缩胶后,将电压增至200 V直至电泳结束。电泳结束后,将硝酸纤维素膜和凝胶在转膜缓冲液中浸泡25 min。在100 V恒压条件下进行转膜,肌球蛋白重链转膜400 min,肌动蛋白转膜200 min。用含有Tween 20的Tris buffered saline(TBST)溶液洗涤膜3次后在室温下封闭1 h,然后与乙酰化赖氨酸抗体(1﹕1 000稀释于封闭液)在4℃下孵育20 h。用TBST溶液洗涤膜3次后与辣根过氧化物酶(horseradish peroxidase,HRP)标记的二抗(1﹕1 000稀释于封闭液)在室温下孵育5 h。用TBST溶液洗涤膜3次后,利用Electrochemiluminescence(ECL)化学发光法显色,通过凝胶成像仪和Quantity One软件分析灰度值,该灰度值为乙酰化肌球蛋白重链和肌动蛋白相对含量(A)。
在检测完乙酰化肌球蛋白重链和肌动蛋白后,将膜用TBST洗涤以去除ECL底物。然后在室温下用Western Blot Stripping Buffer洗涤膜20 min,去除结合在膜上的抗体。用TBST溶液洗涤膜3次后在室温下封闭1 h,然后与肌球蛋白重链抗体(1﹕1 000稀释于封闭液)/肌动蛋白抗体(1﹕500稀释于封闭液)在4℃下孵育过夜。用TBST溶液洗涤膜3次后与HRP标记的二抗(1﹕1 000稀释于封闭液)在室温下孵育1 h。显色流程同前,最终得到本底肌球蛋白重链和肌动蛋白相对含量(T)。A/T即为肌球蛋白重链和肌动蛋白的蛋白质乙酰化水平。
1.4.5 肌动球蛋白解离程度 肌动球蛋白解离程度的测定参考高星等[22]的方法。主要步骤包括:将10 μL样品上样至12%预制胶上,在200 V下电泳至溴酚蓝刚好跑出凝胶底部。电泳结束后,将硝酸纤维素膜和凝胶在转膜缓冲液中浸泡25 min。在100 V恒压条件下转膜80 min,用TBST溶液洗涤膜3次后在室温下封闭1 h,然后与肌动蛋白抗体(1﹕500稀释于封闭液)在4℃下孵育过夜。用TBST溶液洗涤膜3次后与HRP标记的二抗(1﹕1 000稀释于封闭液)在室温下孵育1 h。显色流程同前。
1.4.6 肌动球蛋白ATPase活性 按照试剂盒说明书进行测定。主要步骤包括:通过制备不同浓度(0—50 μmol·L-1)的磷酸盐溶液绘制标准曲线,用于样品磷酸盐含量的计算。在每个反应孔中加入20 μL分析缓冲液和10 μL ATP溶液(4 mmol·L-1),然后在试验孔中加入10 μL稀释10倍的样品,对照孔中加入10 μL分析缓冲液。将混合物在25℃下孵育30 min,加入200 μL终止液后在25℃下再孵育30 min,以终止酶促反应并生成比色产物。在620 nm下读取吸光度后根据说明书计算ATPase活性。
1.4.7 分子动力学分析 根据Chen等[23]的方法利用分子动力学模拟软件(Discovery Studio 2019)研究磷酸化对肌动球蛋白结构的影响。首先,从UniProt(https://www.uniprot.org/)获得羊(ID:W5PPG6)和(ID:W5NYJ1)的氨基酸序列。通过BLAST搜索相似序列,通过同源建模筛选、构建、评估和优化模型,确定用于绵羊MYH-1/ACTA-1蛋白结构模拟的模型。使用Z-Dock对接构建的绵羊MYH-1和ACTA-1,结合已有磷酸化位点的相关研究[24](表1),利用氨基酸突变功能将蛋白模型上的磷酸化丝氨酸、苏氨酸、酪氨酸位点突变为磷酸化状态,构建磷酸化肌动球蛋白。最后分别对原始状态和模拟磷酸化状态的肌动球蛋白进行分子动力学计算。

表1 本研究所用肌球蛋白重链和肌动蛋白磷酸化位点
S:丝氨酸,Y:酪氨酸,T:苏氨酸
S: Serine, Y: Tyrosine, T: Threonine
1.5 统计分析
使用SPSS Statistic 21.0进行单因素方差分析(ANOVA),采用Duncan多重比较进行差异显著性分析(<0.05),采用Microsoft Excel 2016软件绘图。
2 结果
2.1 体外孵育过程中肌球蛋白重链磷酸化水平变化
孵育不同时间点的肌球蛋白重链磷酸化水平如图1所示,3个处理组的磷酸化水平均呈先上升后下降的趋势,说明宰后早期肌肉中还存在少量的ATP,可支持短时间内磷酸化反应。随孵育时间延长,ATP被消耗,肌球蛋白重链磷酸化水平下降。磷酸酶抑制组的肌球蛋白重链磷酸化水平在孵育4、12和72 h时分别比对照组的肌球蛋白重链磷酸化水平高66%、62%和21%(<0.05),比激酶抑制组的肌球蛋白重链磷酸化水平分别高65%、63%和42%(<0.05)。说明碱性磷酸酶抑制剂可以有效地抑制肌球蛋白重链去磷酸化反应,而对照组和蛋白激酶抑制组去磷酸化反应未被抑制,因此,其肌球蛋白重链磷酸化水平低于磷酸酶抑制组。
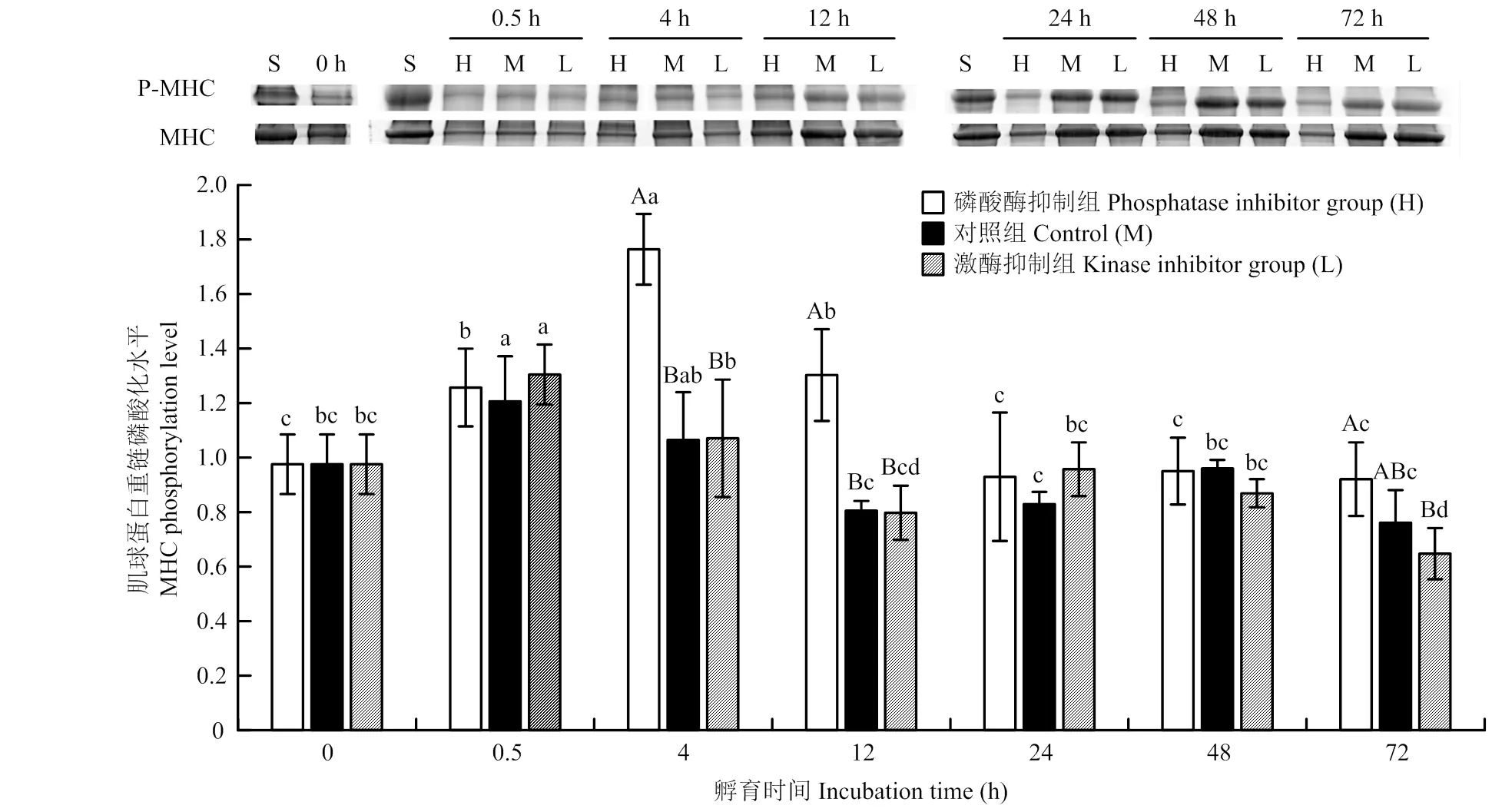
H、M、L分别为磷酸酶抑制组、对照组、激酶抑制组,S为标样。MHC和P-MHC分别为肌球蛋白重链和磷酸化肌球蛋白重链。不同小写字母表示同一处理组在不同时间点差异显著(P<0.05)。不同大写字母表示同一时间点不同处理组间差异显著(P<0.05)。下同
2.2 体外孵育过程中肌动蛋白磷酸化水平变化
孵育不同时间点的肌动蛋白磷酸化水平如图2所示,由于宰后早期肌肉中还存在少量的ATP,碱性磷酸酶抑制剂处理组的肌动蛋白磷酸化水平在孵育0.5—4 h时显著增加(<0.05),在孵育4—72 h间肌动蛋白磷酸化水平无显著差异(>0.05)。对照组和蛋白激酶抑制剂处理组的肌动蛋白磷酸化水平在孵育期间无显著变化(>0.05)。在孵育4—72 h,碱性磷酸酶抑制剂处理组肌动蛋白磷酸化水平显著高于对照组和蛋白激酶抑制剂处理组(<0.05),说明碱性磷酸酶抑制剂可以有效地抑制肌动蛋白去磷酸化反应。
2.3 体外孵育过程中肌球蛋白重链乙酰化水平变化
3个处理组的乙酰化水平整体上呈先上升后下降的趋势,说明宰后早期肌肉中还存在少量的乙酰辅酶A,可支持短时间内乙酰化反应,随孵育时间延长,乙酰辅酶A被消耗,肌球蛋白重链乙酰化水平下降。在孵育4 h时,碱性磷酸酶抑制剂处理组肌球蛋白重链乙酰化水平显著高于对照组(39%)和蛋白激酶抑制剂处理组(180%)(<0.05);在孵育24 h时,对照组肌球蛋白重链乙酰化水平比蛋白激酶抑制剂处理组高23%,蛋白激酶抑制剂处理组比碱性磷酸酶抑制剂处理组高85%(<0.05)。在其他孵育时间点,不同处理组肌球蛋白重链乙酰化水平无显著差异(>0.05)。在不同的孵育时间点之间,不同处理对肌球蛋白重链乙酰化水平的影响无明显规律(图3)。
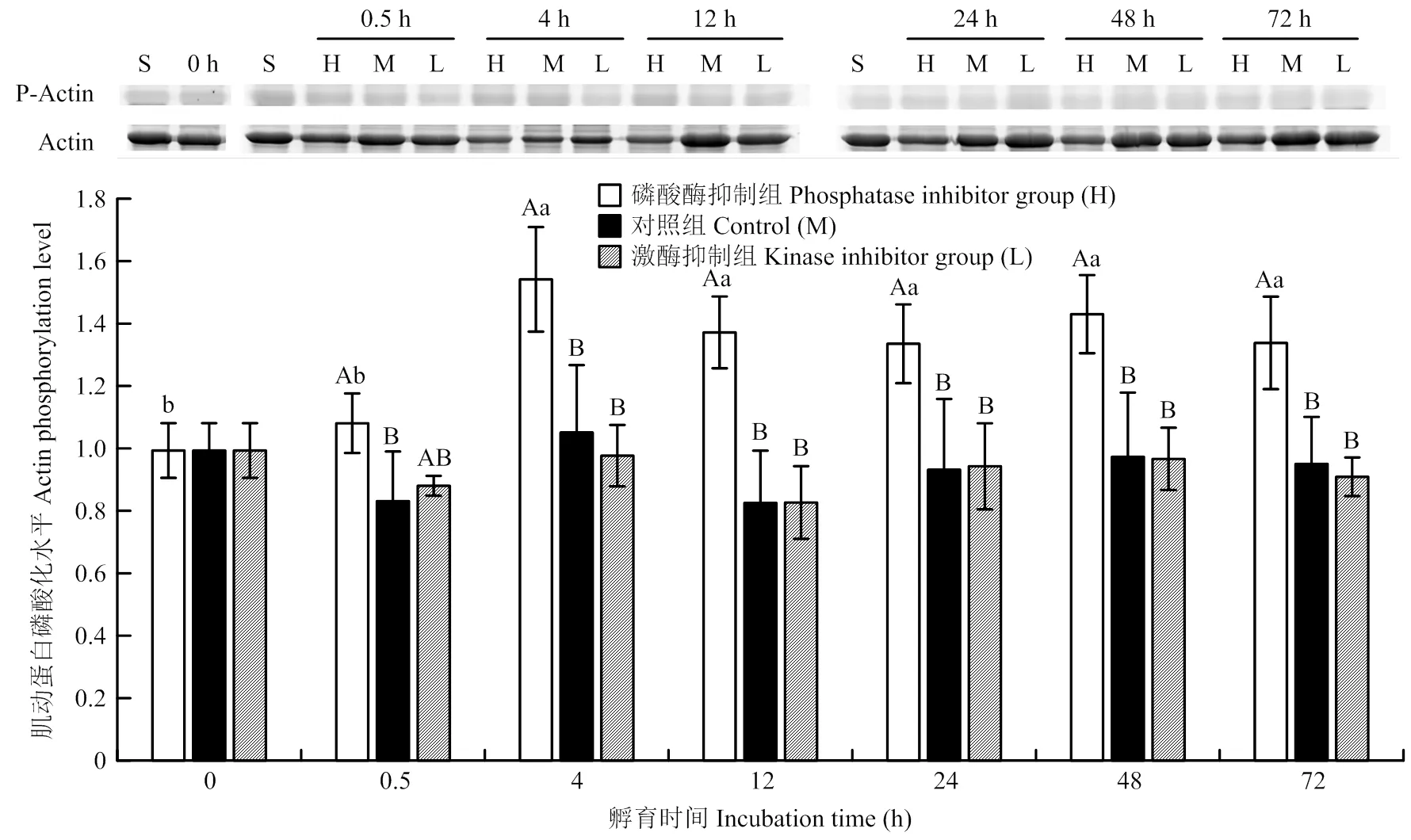
P-Actin为磷酸化肌动蛋白P-Actin is phosphorylated actin

Ac-MHC为乙酰化肌球蛋白重链Ac-MHC is acetylated myosin heavy chain
2.4 体外孵育过程中肌动蛋白乙酰化水平变化
由于宰后早期肌肉中还存在少量的乙酰辅酶A,可支持短时间内乙酰化反应,3个处理组的乙酰化水平均呈先上升后下降的趋势,随孵育时间延长,乙酰辅酶A被消耗,肌动蛋白乙酰化水平下降。在孵育4—72 h时,碱性磷酸酶抑制剂处理组肌动蛋白乙酰化水平显著低于对照组和蛋白激酶抑制剂处理组(<0.05),表明碱性磷酸酶抑制剂可能促进肌动蛋白乙酰化或抑制去乙酰化(图4)。

Ac-Actin为乙酰化肌动蛋白Ac-Actin is acetylated actin。下同 The same as below
2.5 体外孵育过程中肌动球蛋白解离程度变化
3个处理组的肌动球蛋白解离程度在孵育0—0.5 h均显著升高(<0.05),随孵育时间延长而逐渐下降。除0 h外,碱性磷酸酶抑制剂处理组的肌动球蛋白解离程度均显著高于对照组和蛋白激酶抑制剂处理组(<0.05)(图5),说明抑制去磷酸化作用可以减缓肌球蛋白与肌动蛋白之间横桥的形成。
2.6 体外孵育过程中肌动球蛋白ATPase活性变化
孵育0—24 h,3个处理组的肌动球蛋白ATPase活性均持续增加,孵育24—72 h时持续下降。除0 h外,碱性磷酸酶抑制剂处理组的肌动球蛋白ATPase活性均显著低于蛋白激酶抑制剂处理组(<0.05)(图6)。
2.7 肌动球蛋白的分子动力学分析
羊背最长肌肉中的肌球蛋白主要为2b型,编码基因为;肌动蛋白主要为-肌动蛋白编码基因-1[25-26]。因此,本研究选择这两种蛋白质进行分子动力学模拟。磷酸化后肌动球蛋白整体结构变得更加松散,肌球蛋白与肌动蛋白的结合紧密程度降低(图7)。磷酸化肌动球蛋白的总能、势能和动能均高于未磷酸化肌动球蛋白,磷酸化肌动球蛋白的键能低于未磷酸化肌动球蛋白的键能(表2)。
3 讨论
3.1 肌球蛋白重链和肌动蛋白磷酸化影响肌动球蛋白解离
肌球蛋白重链具有ATP水解酶活性,可水解ATP并产生肌肉收缩力,对稳定肌球蛋白的结构和功能起重要作用。宰后肌球蛋白与肌动蛋白结合形成大量肌动球蛋白使动物屠宰后出现尸僵,肌肉嫩度大大下降[27]。因此,宰后肌球蛋白与肌动蛋白的结合状态是影响肉嫩度的重要因素[28]。有研究表明肌球蛋白重链的磷酸化在调节肌球蛋白功能中起重要作用[29],肌球蛋白重链的苏氨酸磷酸化可能调节肌球蛋白组装。肌球蛋白重链磷酸化水平降低限制肌球蛋白依赖性收缩,表明肌球蛋白重链磷酸化促进肌动球蛋白解离[30]。Gao等[16]研究发现抑制肌球蛋白重链去磷酸化作用增加了肌动球蛋白解离程度,这与本研究中的肌球蛋白重链磷酸化水平降低,肌动球蛋白ATPase活性显著升高,肌动球蛋白解离程度显著降低的结果一致。肌动蛋白作为细肌丝直接与肌球蛋白头部结合的蛋白,其磷酸化同样对肌动球蛋白解离起调控作用。Chen[31]和Liu[32]等发现高嫩度羊肉中肌动蛋白磷酸化水平高于低嫩度羊肉,肌动蛋白53位酪氨酸磷酸化破坏了细肌丝的稳定性。肌动蛋白磷酸化影响其聚合和解聚过程,兔肌肉中肌动蛋白磷酸化水平随年龄增加而升高,这表明衰老引起的肌动蛋白磷酸化变化可能影响肌肉收缩[33-36]。因此,碱性磷酸酶抑制剂抑制肌球蛋白重链和肌动蛋白去磷酸化作用,破坏粗肌丝和细肌丝的稳定性,抑制肌球蛋白和肌动蛋白互作,导致肌动球蛋白解离程度增加,进而降低肌动球蛋白ATPase活性。

图5 不同处理组孵育过程中肌动球蛋白解离程度

图6 不同处理组孵育过程中肌动球蛋白ATPase活性

表2 不同磷酸化状态下肌动球蛋白分子动力学分析

红圈部分为肌球蛋白与肌动蛋白结合界面 Red circle part means binding interface of myosin and actin
3.2 蛋白质磷酸化影响肌动球蛋白结构
分子动力学是一种广泛用于蛋白质功能研究的计算机模拟试验,本研究通过分子动力学模拟对试验结果进行验证。结果表明,模拟磷酸化肌动球蛋白的总能量高于未磷酸化肌动球蛋白的总能量,键能低于未磷酸化肌动球蛋白的键能。总能量是势能和动能之和,总能量越接近零,物质越稳定。键能是打破化学键所需的能量,键能越大,物质越稳定[37]。说明肌球蛋白重链和肌动蛋白的磷酸化降低了肌动球蛋白的稳定性,使其更易发生解离。这可能是由于丝氨酸、苏氨酸和酪氨酸本身呈电中性,当它们磷酸化之后,由于磷酸基团带负电荷而使它们呈负电性,从而削弱了肌动球蛋白结构的稳定性。因此,肌球蛋白重链和肌动蛋白磷酸化通过降低肌动球蛋白结构稳定性促进肌动球蛋白解离。
3.3 肌球蛋白重链和肌动蛋白磷酸化影响其乙酰化
近年来的研究表明,蛋白质乙酰化也参与调控宰后肉品品质形成过程,宰后早期肌浆蛋白乙酰化与持水性负相关,与红度值正相关;肌原纤维蛋白乙酰化水平与剪切力正相关[38]。当蛋白质乙酰化与磷酸化发生在同一蛋白质上时可能存在交互作用以影响蛋白功能,两种修饰的交互作用方式主要包括位点竞争、修饰对修饰酶本身活性的调控、底物蛋白修饰后影响其与修饰酶的结合等[39]。由于磷酸化和乙酰化发生在不同类型的氨基酸上,因此二者之间不存在位点竞争。因此,磷酸化对乙酰化的调控方式主要包括:乙酰转移酶或去乙酰化酶本身发生磷酸化修饰而影响其活性;底物蛋白发生磷酸化而影响其与乙酰转移酶或去乙酰化酶的结合。Samant等[40]研究发现,心肌中肌球蛋白重链的乙酰化增强肌球蛋白与肌动蛋白之间的相互作用,调节ATPase的活性以及粗细肌丝的相对滑动,但本研究中,不同磷酸化水平处理组的肌球蛋白重链乙酰化水平呈现无规律变化,因此,肌球蛋白重链磷酸化可能对其乙酰化水平无明显影响,肌球蛋白重链磷酸化直接促进肌动球蛋白解离。Liu等[24]研究结果表明肌动蛋白在第325位丝氨酸发生磷酸化,而肌动蛋白第326和328位赖氨酸的乙酰化会改变与原肌球蛋白和肌球蛋白的静电结合,导致原肌球蛋白介导的肌动蛋白与肌球蛋白结合的抑制作用削弱[41-44]。有研究表明,体外模型中肌动蛋白乙酰化抑制肌动球蛋白解离,而本研究中碱性磷酸酶抑制剂处理组的肌动蛋白乙酰化水平显著低于对照组和激酶抑制组[45]。因此,在本研究中,肌动蛋白磷酸化可能通过抑制乙酰转移酶与肌动蛋白的结合,下调肌动蛋白乙酰化水平,促进肌动球蛋白解离,从而改善肉品嫩度。
4 结论
碱性磷酸酶抑制剂抑制肌球蛋白重链和肌动蛋白去磷酸化,肌球蛋白重链磷酸化与其乙酰化变化无明显关联,肌动蛋白乙酰化受其磷酸化抑制。肌球蛋白重链磷酸化降低ATP酶活性,直接促进肌动球蛋白解离;肌动蛋白磷酸化通过抑制其自身乙酰化促进肌动球蛋白解离。
[1] HOLMAN B W B, DAMIAN C, KILGANNON A K, HOPKINS D L. Using shear force, sarcomere length, particle size, collagen content, and protein solubility metrics to predict consumer acceptance of aged beef tenderness. Journal of Texture Studies, 2020, 51(4): 559-566. doi: 10.1111/jtxs.12523.
[2] CASSENS A M, ARNOLD A N, MILLER R K, GEHRING K B, SAVELL J W. Impact of elevated aging temperatures on retail display, tenderness, and consumer acceptability of beef. Meat Science, 2018, 146: 1-8. doi: 10.1016/j.meatsci.2018.07.024.
[3] TAYLOR R G, GEESINK G H, THOMPSON V F, KOOHMARAIE M, GOLL D E. Is Z-disk degradation responsible for postmortem tenderization? Journal of Animal Science, 1995, 73(5): 1351-1367. doi: 10.2527/1995.7351351x.
[4] WANG D Y, ZHANG M H, DENG S Y, XU W M, LIU Y, GENG Z M, SUN C, BIAN H, LIU F. Postmortem changes in actomyosin dissociation, myofibril fragmentation and endogenous enzyme activities of grass carp () muscle. Food Chemistry, 2016, 197: 340-344.
[5] OKITANI A, ICHINOSE N, KOZA M, YAMANAKA K, MIGITA K, MATSUISHI M. AMP and IMP dissociate actomyosin into actin and myosin. Bioscience, Biotechnology, and Biochemistry, 2008, 72(8): 2005-2011. doi: 10.1271/bbb.80128.
[6] OKITANI A, ICHINOSE N, ITOH J, TSUJI Y, ONEDA Y, HATAE K, MIGITA K, MATSUISHI M. Liberation of actin from actomyosin in meats heated to 65℃. Meat Science, 2009, 81(3): 446-450. doi: 10.1016/j.meatsci.2008.09.008.
[7] BHAT Z F, MORTON J D, MASON S L, BEKHIT A E D A. Role of calpain system in meat tenderness: A review. Food Science and Human Wellness, 2018, 7(3): 196-204. doi: 10.1016/j.fshw.2018.08. 002.
[8] PERRIE W T, SMILLIE L B, PERRY S V. A phosphorylated light chain component of myosin from skeletal muscle. Cold Spring Harbor Symposia on Quantitative Biology, 1973, 37: 17-18. doi: 10.1101/sqb. 1973.037.01.006.
[9] ALAMO L, WRIGGERS W, PINTO A, BÁRTOLI F, SALAZAR L, ZHAO F Q, CRAIG R, PADRÓN R. Three-dimensional reconstruction of tarantula myosin filaments suggests how phosphorylation may regulate myosin activity. Journal of Molecular Biology, 2008, 384(4): 780-797. doi: 10.1016/j.jmb.2008.10.013.
[10] BRITO R, ALAMO L, LUNDBERG U, GUERRERO J R, PINTO A, SULBARÁN G, GAWINOWICZ M A, CRAIG R, PADRÓN R. A molecular model of phosphorylation-based activation and potentiation of tarantula muscle thick filaments. Journal of Molecular Biology, 2011, 414(1): 44-61. doi: 10.1016/j.jmb.2011.09.017.
[11] KASZA K E, FARRELL D L, ZALLEN J A. Spatiotemporal control of epithelial remodeling by regulated myosin phosphorylation. PNAS, 2014, 111(32): 11732-11737. doi: 10.1073/pnas.1400520111.
[12] 陈立娟, 李欣, 李铮, 李培迪, 李仲文, 张德权. 蛋白质磷酸化调控羊肉肌原纤维蛋白的功能. 中国农业科学, 2016, 49(7): 1360-1370.
CHEN L J, LI X, LI Z, LI P D, LI Z W, ZHANG D Q. Protein phosphorylation on the function of myofibrillar proteins in mutton muscle. Scientia Agricultura Sinica, 2016, 49(7): 1360-1370. (in Chinese)
[13] 张艳, 李欣, 李铮, 李蒙, 刘永峰, 张德权. 冰温贮藏对羊肉中蛋白质磷酸化水平的影响. 中国农业科学, 2016, 49(22): 4429-4440. doi: 10.3864/j.issn.0578-1752.2016.22.015.
ZHANG Y, LI X, LI Z, LI M, LIU Y F, ZHANG D Q. Effects of controlled freezing point storage on the protein phosphorylation level. Scientia Agricultura Sinica, 2016, 49(22): 4429-4440. doi: 10.3864/ j.issn.0578-1752.2016.22.015. (in Chinese)
[14] 李蒙, 李铮, 李欣, 杜曼婷, 宋璇, 张德权. 磷酸化水平对肌红蛋白稳定性的影响. 中国农业科学, 2017, 50(22): 4382-4388. doi: 10.3864/j.issn.0578-1752.2017.22.014.
LI M, LI Z, LI X, DU M T, SONG X, ZHANG D Q. Effect of phosphorylation level on myoglobin stability. Scientia Agricultura Sinica, 2017, 50(22): 4382-4388. doi: 10.3864/j.issn.0578-1752.2017. 22.014. (in Chinese)
[15] 高星, 李欣, 李铮, 丁武, 张德权. 肌动球蛋白磷酸化对其解离的影响. 食品科学, 2017, 38(9): 21-26. doi: 10.7506/spkx1002-6630- 201709004.
GAO X, LI X, LI Z, DING W, ZHANG D Q. Effect of phosphorylation on actomyosin dissociation. Food Science, 2017, 38(9): 21-26. doi: 10.7506/spkx1002-6630-201709004. (in Chinese)
[16] GAO X, LI X, LI Z, DU M T, ZHANG D Q. Dephosphorylation of myosin regulatory light chain modulates actin-myosin interaction adverse to meat tenderness. International Journal of Food Science and Technology, 2017, 52(6): 1400-1407.
[17] JIANG S W, LIU Y S, SHEN Z L, ZHOU B, SHEN Q W. Acetylome profiling reveals extensive involvement of lysine acetylation in the conversion of muscle to meat. Journal of Proteomics, 2019, 205: 103412. doi: 10.1016/j.jprot.2019.103412.
[18] ZHOU B, SHEN Z L, LIU Y S, WANG C T, SHEN Q W. Proteomic analysis reveals that lysine acetylation mediates the effect of antemortem stress on postmortem meat quality development. Food Chemistry, 2019, 293: 396-407. doi: 10.1016/j.foodchem.2019.04.122.
[19] HOFMANN T G, MÖLLER A, SIRMA H, ZENTGRAF H, TAYA Y, DRÖGE W, WILL H, SCHMITZ M L. Regulation of p53 activity by its interaction with homeodomain-interacting protein kinase-2. Nature Cell Biology, 2002, 4(1): 1-10. doi: 10.1038/ncb715.
[20] LI Z, BRIDGES B, OLSON J, WEINMAN S A. The interaction between acetylation and serine-574 phosphorylation regulates the apoptotic function of FOXO3. Oncogene, 2017, 36(13): 1887-1898. doi: 10.1038/onc.2016.359.
[21] 陈立娟, 李欣, 杨扬, 陈丽, 倪娜, 张德权. 不同嫩度羊肉肌浆蛋白质磷酸化水平随宰后成熟时间变化的研究. 现代食品科技, 2015, 31(4): 95-101. doi: 10.13982/j.mfst.1673-9078.2015.4.016.
CHEN L J, LI X, YANG Y, CHEN L, NI N, ZHANG D Q. Analyzing the changes in sarcoplasmic protein phosphorylation with respect to postmortem ageing times in mutton with different levels of tenderness. Modern Food Science and Technology, 2015, 31(4): 95-101. doi: 10.13982/j.mfst.1673-9078.2015.4.016. (in Chinese)
[22] 高星, 李欣, 李铮, 杜曼婷, 张彩霞, 张德权, 丁武. 宰后肌肉中肌球蛋白磷酸化调控肌动球蛋白解离作用机制. 中国农业科学, 2016, 49(16): 3199-3207. doi: 10.3864/j.issn.0578-1752.2016.16.013.
GAO X, LI X, LI Z, DU M T, ZHANG C X, ZHANG D Q, DING W. The mechanism of myosin phosphorylation regulating actomyosin dissociation of skeletal muscle during postmortem. Scientia Agricultura Sinica, 2016, 49(16): 3199-3207. doi: 10.3864/j.issn.0578-1752.2016. 16.013. (in Chinese)
[23] CHEN X R, WANG X T, HAO M Q, ZHOU Y H, CUI W Q, XING X X, XU C G, BAI J W, LI Y H. Homology modeling and virtual screening to discover potent inhibitors targeting the imidazole glycerophosphate dehydratase protein in. Frontiers in Chemistry, 2017, 5: 98. doi: 10.3389/fchem.2017.00098.
[24] LIU M S, WEI Y C, LI X, QUEK S Y, ZHAO J, ZHONG H Z, ZHANG D Q, LIU Y F. Quantitative phosphoproteomic analysis of caprine muscle with high and low meat quality. Meat Science, 2018, 141: 103-111. doi: 10.1016/j.meatsci.2018.01.001.
[25] SCHIAFFINO S, REGGIANI C. Fiber types in mammalian skeletal muscles. Physiological Reviews, 2011, 91(4): 1447-1531. doi: 10.1152/ physrev.00031.2010.
[26] KARLSSON A H, KLONT R E, FERNANDEZ X. Skeletal muscle fibres as factors for pork quality. Livestock Production Science, 1999, 60(2/3): 255-269. doi:10.1016/S0301-6226(99)00098-6.
[27] 尹靖东. 动物肌肉生物学与肉品科学. 北京: 中国农业大学出版社, 2011.
YIN J D. Animal Muscle Biology and Meat Quality. Beijing: China Agricultural University Press, 2011. (in Chinese)
[28] 李胜杰, 徐幸莲, 周光宏. 宰后肌动球蛋白解离对肉品嫩度的影响研究进展. 食品科学, 2010, 31(21): 442-445.
LI S J, XU X L, ZHOU G H. Research advances in the influence of actomyosin dissociation on postharvest meat tenderness. Food Science, 2010, 31(21): 442-445. (in Chinese)
[29] EGELHOFF T T, LEE R J, SPUDICH J A.myosin heavy chain phosphorylation sites regulate myosin filament assembly and localization. Cell, 1993, 75(2): 363-371.
[30] NORWOOD TORO L E, WANG Y R, CONDEELIS J S, JONES J G, BACKER J M, BRESNICK A R. Myosin-IIA heavy chain phosphorylation on S1943 regulates tumor metastasis. Experimental Cell Research, 2018, 370(2): 273-282. doi: 10.1016/j.yexcr.2018.06. 028.
[31] CHEN L J, LI X, NI N, LIU Y, CHEN L, WANG Z Y, SHEN Q W, ZHANG D Q. Phosphorylation of myofibrillar proteins in post-mortem ovine muscle with different tenderness. Journal of the Science of Food and Agriculture, 2016, 96(5): 1474-1483. doi: 10.1002/jsfa.7244.
[32] LIU X, SHU S, HONG M S S, LEVINE R L, KORN E D. Phosphorylation of actin Tyr-53 inhibits filament nucleation and elongation and destabilizes filaments. Proceedings of the National Academy of Sciences of the United States of America, 2006, 103(37): 13694-13699.
[33] GANNON J, STAUNTON L, O'CONNELL K, DORAN P, OHLENDIECK K. Phosphoproteomic analysis of aged skeletal muscle. International Journal of Molecular Medicine, 2008, 22(1): 33-42.
[34] PAPAKONSTANTI E A, STOURNARAS C. Association of PI-3 kinase with PAK1 leads to actin phosphorylation and cytoskeletal reorganization. Molecular Biology of the Cell, 2002, 13(8): 2946-2962. doi: 10.1091/mbc.02-01-0599.
[35] CARLIER M F, PANTALONI D. Control of actin dynamics in cell motility. Journal of Molecular Biology, 1997, 269(4): 459-467. doi: 10.1006/jmbi.1997.1062.
[36] HOWARD P K, SEFTON B M, FIRTEL R A. Tyrosine phosphorylation of actin in dictystelium associated with cell-shape changes. Science, 1993, 259(5092): 241-244.
[37] KARPLUS M. Molecular dynamics simulations of biomolecules. Accounts of Chemical Research, 2002, 35(6): 321-323. doi: 10.1021/ ar020082r.
[38] ZHANG Y J, LI X, ZHANG D Q, REN C, BAI Y Q, IJAZ M, WANG X, ZHAO Y X. Acetylation of sarcoplasmic and myofibrillar proteins were associated with ovine meat quality attributes at early postmortem. Food Science of Animal Resources, 2021, 41(4): 650-663. doi: 10.5851/kosfa.2021.e22.
[39] HABIBIAN J, FERGUSON B S. The crosstalk between acetylation and phosphorylation: emerging new roles for HDAC inhibitors in the heart. International Journal of Molecular Sciences, 2018, 20(1): 102. doi: 10.3390/ijms20010102.
[40] SAMANT S A, PILLAI V B, SUNDARESAN N R, SHROFF S G, GUPTA M P. Histone deacetylase 3 (HDAC3)-dependent reversible lysine acetylation of cardiac myosin heavy chain isoforms modulates their enzymatic and motor activity. The Journal of Biological Chemistry, 2015, 290(25): 15559-15569. doi: 10.1074/jbc.M115. 653048.
[41] VISWANATHAN M C, BLICE-BAUM A C, SCHMIDT W, FOSTER D B, CAMMARATO A. Pseudo-acetylation of K326 and K328 of actin disruptsindirect flight muscle structure and performance. Frontiers in Physiology, 2015, 6: 116. doi: 10.3389/fphys.2015.00116.
[42] SCHMIDT W, VISWANATHAN M, FOSTER D B, CAMMARATO A. Acetylation of k326 and k328 on actin boosts contractile properties of muscle in vitro and. Biophysical Journal, 2017, 112(3): 483a.
[43] SCHMIDT W, VISWANATHAN M, BLICE-BAUM A C, FOSTER D B, CAMMARATO A. Pseudo-acetylation of actin residues k326 and k328 disrupts drosophila flight performance and muscle structure. Biophysical Journal, 2015, 108(2): 421a-422a.
[44] SCHMIDT W M, FOSTER D B, CAMMARATO A. Acetylation of actin k328 contributes to a loss in tropomyosin-mediated inhibition of myosin binding. Biophysical Journal, 2019, 116(3): 457a.
[45] ZHANG Y J, LI X, ZHANG D Q, BAI Y Q, WANG X. Effects of acetylation on dissociation and phosphorylation of actomyosin in postmortem ovine muscle during incubation at 4℃. Food Chemistry, 2021, 356: 129696. doi: 10.1016/j.foodchem.2021.129696.
Effects of Protein Phosphorylation on the Dissociation and Acetylation Level of Actomyosin
ZHANG YeJun, ZHANG DeQuan, HOU ChengLi, BAI YuQiang, REN Chi, WANG Xu, LI Xin
Institute of Food Science and Technology, Chinese Academy of Agricultural Sciences/Key Laboratory of Agro-products Quality & Safety in Harvest, Storage, Transportation, Management and Control, Ministry of Agriculture and Rural Affairs, Beijing 100193
【】The objective of this study was to investigate the effects of myosin heavy chain and actin phosphorylation on their acetylation levels, actomyosin dissociation, and ATPase activity, so as to provide a theoretical basis for improving meat tenderness by regulating protein phosphorylation level.【】The homogenate of sheep longissimus dorsi muscle was incubated with alkaline phosphatase inhibitor (inhibiting dephosphorylation) and protein kinase inhibitor (inhibiting phosphorylation) at 4℃ for 0, 0.5, 4, 12, 24, 48, and 72 h to regulate the phosphorylation levels of myosin heavy chain and actin. The protein phosphorylation level was measured by SDS-PAGE and fluorescent staining, and the acetylation level and actomyosin dissociation degree were measured by Western blotting. The ATPase activity was measured using an assay kit. The influence of myosin heavy chain and actin phosphorylation on the structure of actomyosin was analyzed by molecular dynamics simulation.【】The phosphorylation level of myosin heavy chain in the alkaline phosphatase inhibitor treatment group was significantly higher than that in the control and protein kinase inhibitor treatment groups at 4, 12, and 72 h of incubation (<0.05). The phosphorylation level of actin was significantly higher than that in the control and protein kinase inhibition treatment groups at 4, 12, 24, 48, and 72 h of incubation (<0.05), which indicated that alkaline phosphatase inhibitors could inhibit the dephosphorylation of myosin heavy chain and actin during incubation in vitro. The acetylation level of actin in the alkaline phosphatase inhibitor treatment group was significantly lower than that in the protein kinase inhibitor treatment group after incubation for 4, 12, 24, 48, and 72 h (<0.05), while the acetylation level of myosin heavy chain changed irregularly. The results indicated that the phosphorylation of actin inhibited its acetylation, while the phosphorylation of myosin heavy chain had no obvious regularity on its acetylation. The results of molecular dynamics showed that the phosphorylation of the 2nd, 3rd and 54th serine positions of the myosin heavy chain and the 54th and 55th tyrosine positions of actin increased the total energy, potential energy, and kinetic energy of actomyosin. However, the bond energy of actomyosin was reduced, which caused the unstable structure of actomyosin. The dissociation degree of actomyosin in the alkaline phosphatase inhibitor treatment group was always higher than that of the protein kinase inhibitor treatment group during 0-72 h incubation (<0.05). The ATPase activity was always lower than that in the protein kinase inhibitor treatment group during 0-72 h incubation (<0.05). The myosin heavy chain and actin phosphorylation promoted actomyosin dissociation.【】The phosphorylation of myosin heavy chain directly promoted the dissociation of actomyosin, while the phosphorylation of actin promoted the dissociation of actomyosin by inhibiting its acetylation.
phosphorylation; acetylation; myosin heavy chain; actin; dissociation

10.3864/j.issn.0578-1752.2022.07.014
2021-07-09;
2021-10-09
国家自然科学基金重点项目(32030086)、中国农业科学院科技创新工程(CAAS-ASTIP-2021-IFST-03)
张业军, E-mail:zhangyejun1126@163.com。通信作者李欣,Tel:010-62819392;E-mail:xinli.caas@gmail.com
(责任编辑 赵伶俐)
