罗非鱼湖病毒对稀有鲫(Gobiocypris rarus)的感染研究
2022-04-13吕月凤王英英曾伟伟李莹莹尹纪元石存斌王雅慧
吕月凤,王英英,曾伟伟,王 庆,李莹莹,尹纪元,杨 广,石存斌,王雅慧,李 波,4
(1.天津农学院水产学院,天津 300384;2.中国水产科学研究院珠江水产研究所/农业部水产药物开发重点实验室/广东省水产动物免疫技术重点实验室,广州 510385;3.佛山学院生命科学与工程学院/广东省动物分子设计与精密育种重点实验室,广东 佛山 440605;4.上海海洋大学水产与生命科学学院,上海 201306)
罗非鱼是世界上第2 大淡水养殖鱼类[1],仅次于鲤科鱼类,每年全球产量约450万t,在超过100个国家养殖[2]。自2009 年开始,由罗非鱼湖病毒(TiLV)感染引起的新发烈性疫病罗非鱼湖病毒病(TiLVD)在全球多个国家相继暴发,对全球的罗非鱼养殖业构成了重大威胁[3-4]。截至目前,TiLV 的致病机理尚未明确,亦缺乏有效的防治措施。
目前的研究表明,TiLV 不仅感染罗非鱼及其变种,也可感染其他鱼类,如施氏魮、丝足鲈、孔雀鲈、河鲤[5]、爪哇鲤、鲶鱼等。目前TiLV 易感宿主都是大型鱼类,小型鱼类斑马鱼是最常用鱼类动物模型,有学者研究表明斑马鱼对TiLV 不敏感[6]。稀有鮈鲫属鲤科鮈鲫属,因其体形小、生命力强、饲养简单、不易染病,属于周年连续产卵鱼类,被认为是一种优良的实验鱼类。笔者前期试验表明,稀有鮈鲫对TiLV 敏感。本研究以稀有鮈鲫为研究对象,探索TiLV-2017A 株对稀有鮈鲫的感染特性,以期为为罗非鱼湖病毒病的病原学研究及防治技术开发奠定基础。
1 材料与方法
1.1 稀有鮈鲫和病毒
健康的稀有鮈鲫,中国科学院水生生物研究惠赠;罗非鱼湖病毒毒株(TiLV-2017A),德国动物健康研究所Sven Bergmann博士惠赠[7]。
1.2 鱼体攻毒和样品采集
感染组的稀有鮈鲫腹腔注射20 μL 浓度为105.67TCID50·mL-1的TiLV-2017A,对照组注射20 μL PBS液。分别在注射后第1、2、3、4和5天随机取9条稀有鮈鲫麻醉后处死,取鳃、脾脏、肾脏和肠道,检测白细胞介素-8(IL-8)、NK 细胞增强因子(NF-κB)、白细胞介素-1β(IL-1β)、Mx 蛋白(Mx)、Toll 样 受 体3(TLR3)、髓 样 分 化 因 子(MyD88)、α-干扰素(IFN-α)和Toll样受体5(TLR5)等免疫相关基因相对表达量。注射后第1、3、5、7、9、11、13 和15 天随机取3 条稀有鮈鲫麻醉后处死,分别取肝脾肾混样,用于测TiLV-2017A 在稀有鮈鲫体内不同时间的病毒载量变化。注射后第5 天,取3 条稀有鮈鲫(濒死鱼)进行组织切片,将试验鱼麻醉后处死,纵切剖开后整条用Bouin’s 固定剂固定,用于组织切片制备。
1.3 RNA提取及病毒载量分析
将组织样品匀浆,提取总RNA,反转录为cDNA。使用荧光定量试剂盒在ABI 7500 荧光定量仪上进行qRT-PCR,设置3次生物学重复。
1.4 免疫基因表达分析
研究中测定免疫相关基因的引物序列见表1。qRT-PCR 反应过程:95 ℃5 min,95 ℃5 s,60 ℃30 s,40个循环。

表1 免疫相关基因的引物序
SYBR Green 实时荧光定量PCR 的检测结果由ABI 7500 Real-Time PCR System 自带软件进行分析,相对表达量用ΔΔCT法进行计算。
1.5 组织切片观察
将Bouin’s 固定剂固定的稀有鮈鲫,在梯度浓度乙醇水溶液中脱水,然后与二甲苯混合,进行组织包埋、切片、染色。在光学显微镜下观察并拍照分析。
1.6 统计分析
所有的统计分析都是用SPSS 22.0 版软件进行的。试验鱼与对照鱼之间基因表达水平的差异用t检验进行分析,P<0.05 表示差异显著,P<0.01 表示差异极显著。图表用GraphPad Prism 6 软件生成,试验数据以“平均值±标准差(SD)”表示。
2 结果与分析
2.1 临床症状和死亡率
对照组稀有鮈鲫在试验期间无任何症状,健康无死亡鱼。感染组稀有鮈鲫在感染后第7天开始出现反应迟钝、腹下点状和片状出血、腹胀和眼球混浊等症状(见图1),与感染TiLV-2017A 的罗非鱼症状一致。感染组稀有鮈鲫的死亡率为10%。

图1 稀有鮈鲫感染TiLV-2017A后的临床症状
2.2 病毒载量检测
感染组稀有鮈鲫肝脾肾混样中病毒载量见图2。该病毒在第4天开始缓慢增殖,然后在第13天达到峰值,病毒拷贝数为1.582×108拷贝数·μL-1。

图2 稀有鮈鲫感染TiLV-2017A后肝脾肾混样组织中病毒载量
2.3 免疫相关表达基因检测
为了研究TiLV-2017A 株感染后稀有鮈鲫组织内免疫相关基因的变化,以稀有鮈鲫的脾脏、肾脏、肠和鳃组织为样本,测定其IFN-α、IL-1β、IL-8、Mx、MyD88、NF-κB、TLR3和TLR5基因的相对表达量,结果见图3。
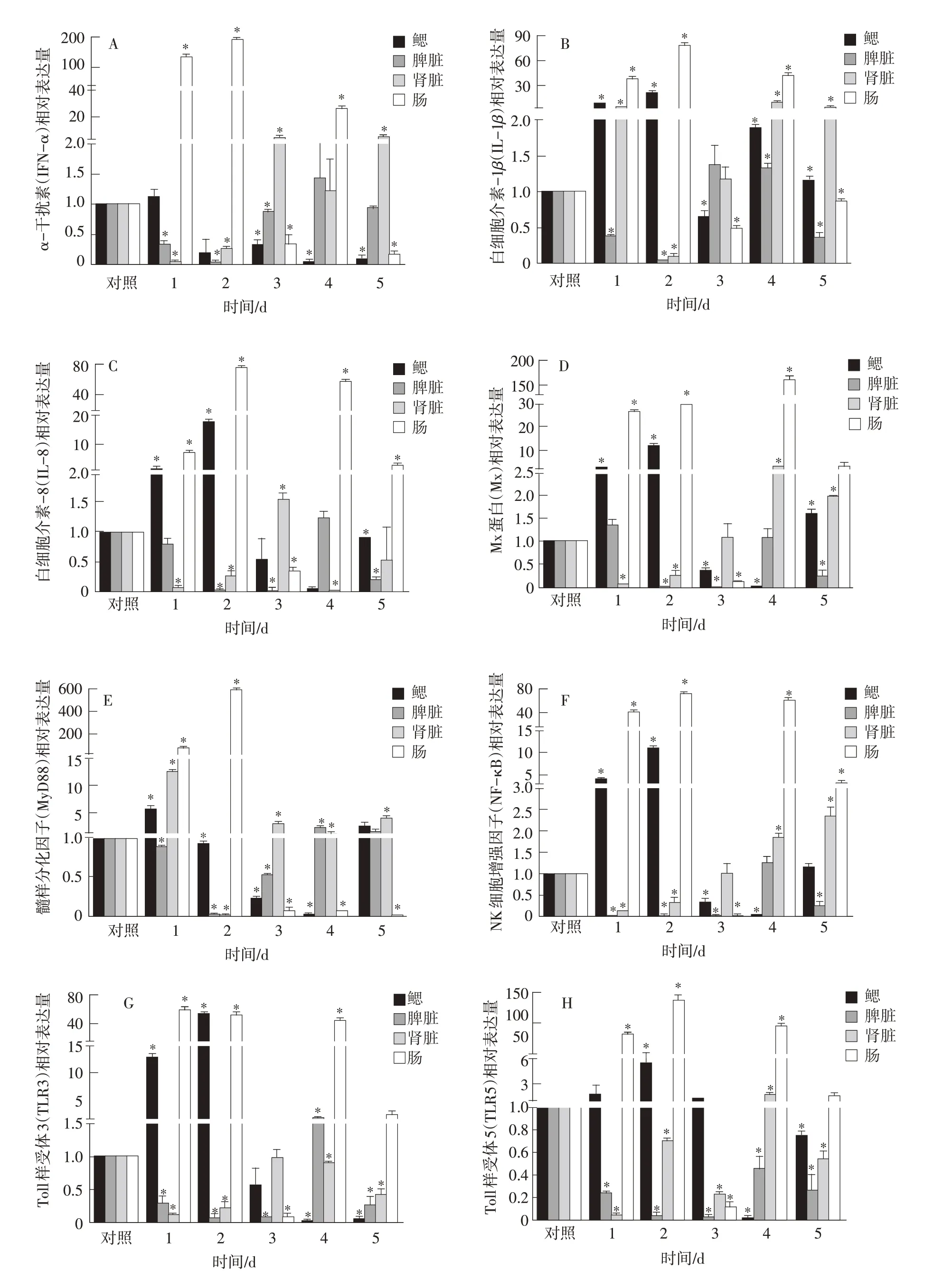
图3 稀有鮈鲫TiLV-2017A株感染后脾脏、肾脏、鳃、肠道组织中免疫相关基因的相对表达量
由图3可知,脾脏、鳃、肾脏和肠组织中IL-8基因的表达水平均上调,在肠组织中上调显著,相对表达水平达到74.790倍。鳃、肠和肾脏中NF-κB基因的表达水平上调。IL-1β的基因表达在脾脏、鳃、肾脏和肠组织中均上调。肠组织中Mx 的表达水平显着增加,在第4天增加了165.897倍。脾脏、鳃和肠中TLR3的mRNA 表达上调,在鳃中显著上调54.538 倍,在肠组织中显著上调61.133 倍。MyD88的表达水平在肠中显著上调。肾和鳃中IFNα的mRNA水平显著降低,并且在肠中显著上调。肠中TLR5基因的表达在第2天显著增加140.611倍。
2.4 组织病理切片观察
为观察TiLV-2017A 感染稀有鮈鲫后的组织病理变化,取感染后第5 天稀有鮈鲫的肝脏、脾脏、肾脏、头肾和鳃组织,经过固定、脱水、包埋、切片和苏木素-伊红染色后置于光学显微镜下观察,结果发现稀有鮈鲫肝脏、脾脏、肾脏、鳃和头肾均出现明显的病理变化,见图4。

图4 稀有鮈鲫感染TiLV-2017A后第5天组织病理学研究
由图4 可知,肝脏中肝细胞肿大和空泡化,细胞间隙增大,肝窦萎缩;脾脏中淋巴细胞增多,噬铁血黄素明显增多;肾小管细胞间隙变大且肾组织中噬铁血黄素增多;感染鱼头肾可见大量嗜碱性的肿大细胞,且组织结构松散,大量细胞发生核固缩,红细胞浸润;鳃组织中鳃丝部分断裂,鳃丝溃烂不成形和上皮细胞脱落。
3 讨论与结论
稀有鮈鲫是一种小型的实验动物,具有生长速度快、易繁殖、遗传背景清晰的特点,可感染草鱼呼肠孤病毒等水生动物病毒。笔者前期研究发现稀有鮈鲫可感染TiLV。本研究的目的是通过测定稀有鮈鲫感染TiLV 后的临床症状、病毒载量和免疫相关因子相对表达量的变化情况,进而研究稀有鮈鲫感染TiLV的致病机制。
稀有鮈鲫感染TiLV-2017A 第7 天,鱼体开始出现明显的临床症状,腹侧及腹下皮肤点状和片状出血,内脏出血,腹部鼓胀有腹水,眼部出现眼睛突出、晶状体浑浊,游动不规则伴有神经症状。测定稀有鮈鲫感染TiLV-2017A 毒株后肝脏、脾脏和肾脏混样组织第1、3、5、7、9、11、13和15天时的病毒载量,结果表明稀有鮈鲫在感染TiLV-2017A 后的第13 天病毒载量达到峰值,为1.582×108拷贝数·μL-1。该结果与胡虎子[8]在罗非鱼感染TiLV的研究结果基本一致。
K.K.Mugimba 等[9]研究了两种促炎细胞因IL-1β和TNF-α在TiLV 感染的红罗非鱼和灰罗非鱼脑、头肾和肝脏中的表达,均在各组织中有不同程度的上调。在斑马鱼腹腔注射TiLV试验中启动IL-1β、TNF-α、TLR3、IL-8、TFNγ1-2 和Mx 等相关免疫基因的表达[6]。在本研究中以稀有鮈鲫的肝脏、脾脏、肠和鳃组织为样本,测定其感染TiLV-2017A 后 体 内IL-8、NF-kB、IL-1β、TNF-α、Mx、TLR3、MyD88、IFNα 和TLR5 基因的相对表达量。脾脏、鳃、肾脏和肠组织中各基因的表达水平均有不同幅度的上调。因此说稀有鮈鲫可以作为研究TiLV 与宿主相互作用的病毒免疫逃逸模式鱼。病理切片结果与李嘉波等[10]的这5 个组织H.E染色结果一致。肝细胞肿大和空泡化,肝窦萎缩;脾脏中淋巴细胞增多,噬铁血黄素明显增多;肾组织中噬铁血黄素增多;鳃组织中鳃丝部分断裂,鳃丝溃烂不成形和上皮细胞脱落;头肾可见大量嗜碱性的肿大细胞,且组织结构松散,大量细胞发生核固缩,红细胞浸润。
笔者前期研究[11]表明,感染了TiLV-2017A 的罗非鱼的死亡率高达100%。然而,在本研究中,TiLV-2017A 感染稀有鮈鲫死亡率为10%左右,而大多数鱼能抵抗病毒而存活,稀有鮈鲫在感染TiLV后如何发挥其抗病毒作用需要进一步研究。
