吡拉西坦片溶出度的测定方法研究
2022-04-13聂延君张乃斌徐玉文
聂延君,张乃斌,吴 敏,陈 真,徐玉文*
(1. 山东省食品药品检验研究院 仿制药研究与评价重点实验室 山东省仿制药一致性评价工程技术研究中心,山东 济南 250101;2. 山东省公共卫生临床中心,山东 济南 250000)
吡拉西坦属于γ-氨基丁酸(GABA)的环形衍生物,为脑代谢改善药,可用于多种原因所致的记忆减退及轻、中度脑功能障碍,也用于儿童智能发育迟缓[1-5]。吡拉西坦片收载于《中国药典》2020年版二部,国外药典未收载该品种,日本橙皮书和FDA溶出曲线数据库也均未收载吡拉西坦溶出度测定相关信息和方法。《中国药典》现行标准中未收载溶出度检查,无法准确反映药物体外溶出情况。吡拉西坦原料药在水中易溶,溶解度约为519.4 mg/ml(37 ℃),在不同pH溶液中的溶解度相差不大。本研究通过考察不同溶出方法、溶出介质、转速和取样时间点等条件,建立了吡拉西坦片的溶出度测定方法,并对6家企业样品的溶出度及溶出曲线等进行了比较。本文建立的方法具有较好的区分力,为吡拉西坦片质量控制和标准提高提供了重要依据。
1 仪器与试药
1.1 仪器
岛津LC-20AT高效液相色谱仪(日本岛津公司);自动溶出仪(瑞士SOTAX公司);CP225D电子天平(德国Sartorius公司);真空脱气仪(天津市天大天发科技有限公司)。
1.2 试药
吡拉西坦片分别由A~F 6家企业提供;吡拉西坦原料药(江西跃华药业有限公司,批号:20180951);吡拉西坦对照品(中国食品药品检验研究院,批号:100386-201703,含量:100.0 %);乙腈为色谱纯,盐酸、冰醋酸、醋酸钠、磷酸氢二钾、氢氧化钠等均为分析纯。
2 方法与结果
2.1 溶液制备
2.1.1 对照品溶液制备 精密称取吡拉西坦对照品适量,加水溶解并制成0.12 mg/ml的溶液,作为对照品溶液。
2.1.2 供试品溶液制备 取溶出液,滤过,精密量取续滤液适量,加水稀释,制成每1 ml中约含吡拉西坦0.12 mg的溶液,作为供试品溶液
2.2 溶出量测定[6]
采用高效液相色谱法(HPLC),色谱柱为C18,流动相为0.1 %磷酸氢二钾溶液(用磷酸调节pH至6.0±0.05)-乙腈(95:5);检测波长为205 nm,流速为1.0 ml/min。精密量取供试品和对照品溶液各20 μl注入色谱仪,记录峰面积,以外标法计算吡拉西坦溶出量,即得。
2.3 方法学验证
2.3.1 线性关系 精密称取吡拉西坦对照品50.15 mg,置50 ml量瓶中,加乙腈-水(5:95)溶解并稀释至刻度,摇匀,作为对照品贮备液(1 mg/ml)。分别精密量取适量,用乙腈-水(5:95)稀释制成每1 ml含吡拉西坦0.02,0.06,0.09,0.12,0.15,0.18 mg的溶液,作为线性溶液。分别精密量取20 μl,进样,记录色谱图。以浓度为横坐标,以峰面积为纵坐标,进行线性拟合。结果,吡拉西坦在0.02~0.18 mg/ml范围内线性关系良好,回归方程:y=40 439x+209 742,相关系数(r)为0.9993。
2.3.2 准确度 按处方量称取空白辅料适量,加乙腈-水(5:95)溶解并过滤,取续滤液作为空白辅料溶液。分别称取吡拉西坦对照品适量,用空白辅料溶液稀释,分别制成每1 ml含吡拉西坦0.06,0.12,0.18 mg的溶液,每个浓度配制3份,精密量取20 μl,进样,记录色谱图。结果回收率平均值为100.1 %。说明此方法中吡拉西坦的回收率良好。结果见表1。

表1 回收率试验结果
2.3.3 稳定性试验 取0.12 mg/ml的吡拉西坦对照品溶液,分别于0,2,4,6,8 h进样,记录色谱图。结果,吡拉西坦在8 h内稳定性良好。结果见表2。

表2 稳定性结果
2.3.4 滤膜吸附试验 分别采用离心和滤膜过滤两种方式处理供试品溶液,结果两种方法溶液峰面积相差不大,滤膜对峰面积影响较小,因此采用滤膜过滤处理供试品溶液。结果见表3。

表3 供试品溶液经离心和过滤处理后峰面积
2.4 溶出度测定方法的建立
2.4.1 pH值-溶解度曲线 取9支具塞试管,分别精密加入pH 1.0盐酸溶液,pH 2.0盐酸溶液,pH 4.0醋酸盐缓冲溶液,pH 5.5醋酸盐缓冲溶液,pH 6.0磷酸盐缓冲液,pH 6.8磷酸盐缓冲液,pH 7.4磷酸盐缓冲液,pH 8.0磷酸盐缓冲液各5 ml,分别加入过量吡拉西坦原料药,制成饱和溶液,置37 ℃水浴中振荡过夜[7],按2.2项下色谱条件测定溶解度并绘制吡拉西坦pH值-溶解度曲线。取纯化水作为溶出介质同法操作,计算吡拉西坦在水中的溶解度。结果表明,吡拉西坦原料在水中的溶解度为519.4 mg/ml,在pH 1.0~8.0溶出介质中,溶解度分布在503.4~568.7 mg/ml之间,受pH影响较小,略成S形分布,整体相差不大。吡拉西坦片规格有0.4 g和0.2 g两种,以900 ml作为溶出介质体积,均能满足漏槽条件。结果见表4。

表4 吡拉西坦在不同pH条件下的溶解度(37 ℃)
2.4.2 溶出度测定方法选择 取A、B、C企业样品各一批,以水900 ml为溶出介质,分别采用篮法和桨法,转速为50 r/min。结果本品在两种溶出装置中测得的结果基本一致。篮法和桨法作为口服固体制剂最常用的两种方法[8],各国药典均有收载,其中片剂溶出度的首选方法为桨法,本着通用性强、耐用性好、广泛普及的原则[5],本品选用采用桨法作为溶出方法。结果见表5。

表5 溶出度测定方法比较
2.4.3 转速选择[9]取A~C 3家企业样品,考察在50 r/min和75 r/min两种转速条件下的溶出曲线差异。结果在75 r/min转速条件下,3家样品溶出速率较快,30 min时达到平台期。转速调整为50 r/min时,溶出速率减缓,各企业样品30 min的溶出度有较大区别,B企业样品溶出明显减缓,呈现出较大区分力,因此转速拟定为50 r/min。结果见表6。

表6 两种转速下的溶出量比较
2.4.4 溶出介质的选择 分别选取0.1 mol/L HCl、pH 4.0 醋酸盐缓冲液、pH 6.8 磷酸盐缓冲液和水4种溶出介质,比较同一企业样品在4种不同介质中的溶出行为差异。结果表明样品在4种溶出介质中15 min的溶出量均可达85 %以上,20 min后达平台期,4条溶出曲线基本一致。虽然水在不同地区的pH可能略有不同[6],但根据吡拉西坦pH值-溶解度曲线,pH对吡拉西坦的溶解度影响较小,本着环保经济、易操作的原则,选取水作溶出介质。另外比较多家企业溶出曲线发现,以水为溶出介质,仍具有很好的区分力,能满足质量控制的要求[10]。见表7。
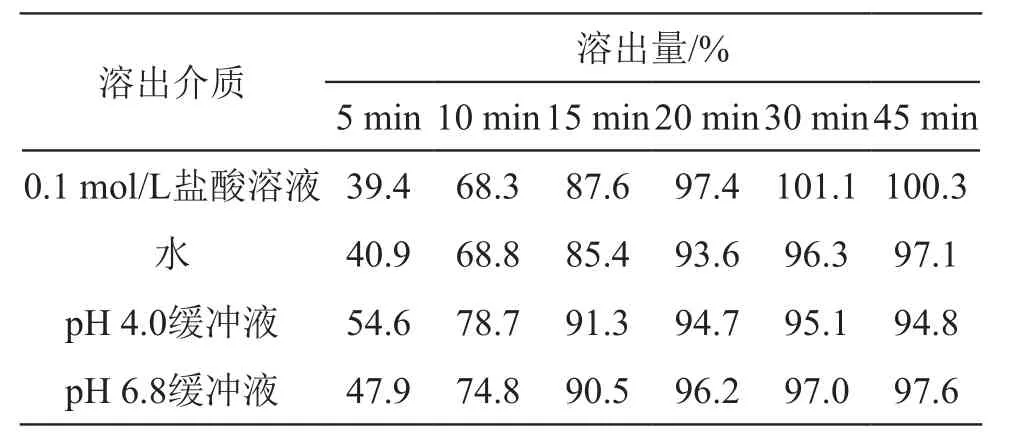
表7 4种溶出介质的溶出结果比较
综上,吡拉西坦片溶出度测定方法为:以水900 ml为溶出介质,转速为50 r/min,依法[6]操作,经30 min时取溶出液,按2.1.2项下方法制备供试品溶液,按2.1.1项下方法制备对照品溶液,按2.2项下方法进样测定。
2.5 溶出曲线的测定
取A~F 6家企业样品,依法操作,取样时间点调整为5,10,15,20,30,45 min,分别取溶液10 ml,滤过,同时补液;分别精密量取供试品溶液和对照品溶液各20 μl,注入液相色谱仪,记录色谱图,按外标法计算溶出量。以时间为横坐标,累积溶出量为纵坐标,绘制溶出曲线。结果见表8。结果显示,15 min时A、E企业样品的溶出量大于85 %,30 min时仅D企业样品溶出量不足85 %,该企业样品在45 min时溶出量仍低于85 %。根据溶出曲线结果,将吡拉西坦片溶出度限度设定为30 min时溶出量不低于标示量的85 %。

表8 6家企业样品溶出曲线
2.6 6家企业样品考察
按已确定方法测定A~F 6家企业样品的溶出度,结果,B和D两家企业样品溶出度不合格,其中D企业样品溶出缓慢,且溶出量较低,说明该企业制备工艺或处方存在一定问题,见表9。

表9 溶出度测定结果
3 讨论
吡拉西坦片现行标准中未设定溶出度检查,无法客观反映样品的体外溶出情况。对于固体制剂,体外溶出试验应尽可能反映其在体内的释放和吸收情况,因此应选择合适的、具有较强区分能力的溶出介质[11-12]。本文考察不同溶出方法、转速、溶出介质和取样时间点等,确定了吡拉西坦片溶出度测定方法。该方法具有较好的区分力,6家企业样品中有2家样品溶出度低于拟定限度(85 %),其中一家企业的平均溶出度仅为55 %,整体溶出度较差,反映出该企业在制剂处方或制备过程中存在一定问题,因此,增订溶出度检查项十分必要,同时也可为企业筛选处方,改进工艺提供依据。
