茶树精油抗沙门氏菌活性研究
2022-04-13匡秀华王秋珍樊克锋张梦涵张春辉
匡秀华,王秋珍,2,樊克锋,张梦涵,张春辉
(1 河南牧业经济学院 动物医药学院,河南 郑州 450000;2 中国农业大学 动物医学院,北京 100000)
植物精油又称挥发油、香精油,是芳香植物次生代谢产物。植物精油为油状液体,不溶于水,有香味,相对分子量小、且具有一定的生物活性[1],由100种以上的成分构成。一般而言,植物精油含有醇类、醛类、酸类、酚类、丙酮类、萜烯类[2],主要有提供细胞营养、净化空气和杀菌、天然防腐、提高免疫等功能[3]。在畜禽生产领域,植物精油不仅可以减少畜禽用饲料营养成分损失,增强畜禽体内消化酶活性及机体免疫力,而且还可以增强畜禽生产性能、抗应激能力,降低畜禽生产成本损耗[4]。
茶树精油(tea tree oil,TTO)是从互叶白千层的新鲜枝叶中提取出来的一种无色至淡黄色的植物精油。研究表明,茶树精油具有抗细菌和真菌[5-7]、抗病毒[7-9]、抗炎[10-11]、抗肿瘤[11]、抗氧化[12]和杀虫作用[13-15],其抑菌作用强于薰衣草[16]。国内外对茶树精油的应用多集中在食品添加剂和洗护用品领域[10],对其在动物养殖过程中对细菌的抗菌及药用机理研究甚少。
沙门氏菌(Salmonella)属肠杆菌科,是一种常见的食源性致病菌和人畜共患病病原菌,能够引起伤寒、急性肠胃炎、败血症等多种疾病。抗生素是临床治疗各种细菌感染性疾病的常用药物,在畜禽养殖过程中不合理使用抗生素不仅会导致细菌的耐药性,而且还存在食品安全和公共卫生安全风险。2020年农业农村部的减抗限抗政策,使中兽药的应用和研究成为热点。本研究对茶树精油的抗沙门氏菌SH17活性进行初步分析,为茶树精油作为药物开发与推广应用提供理论基础。
1 材料与方法
1.1 试验材料
1.1.1 试验菌株 本试验所用的沙门氏菌SH17,由河南农业大学药理教研室提供。通过PCR扩增与测序分析、血清学鉴定、耐药因子与毒力因子检测,结果表明沙门氏菌SH17为鼠伤寒沙门氏菌(Typhimurium),携带TEM、DHA、gyrA、gyrB、parC、parE、oqxA、oqxB耐药因子,含有invH、fimA、spvB毒力因子。
1.1.2 试验试剂 2,3,5-三苯基氯化四氮唑(TTC,T8170B,Beijing Solarbio Science),甘油(20190112,天津市富宇精细化工有限公司),总蛋白定量(考马斯亮蓝法,A045-2-2,南京建成生物工程研究所),碱性磷酸酶(AKP)检测试剂盒(A059-2-2,南京建成生物工程研究所),磷酸二氢钾(20191107,国药集团化学试剂有限公司),磷酸氢二钠 (20191107,天津市风船化学科技有限公司),氢氧化钠 (20191009,天津市化学试剂三厂),二甲基亚砜(DMSO,20191008,天津市大茂化学试剂厂)。Mueller-Hinton琼脂(2017114,青岛高科园海博生物技术有限公司),Mueller-Hinton肉汤(20180828,青岛高科园海博生物技术有限公司)。
1.1.3 试验药物 茶树精油,(密度0.906,纯度98%,吉安林业科学研究所),恩诺沙星(批号E0786,纯度>98%,TCI),氟苯尼考(批号F0811,纯度>98%,TCI),庆大霉素(批号G0383,纯度≥99%,TCI),阿莫西林(批号A129660,纯度≥98%,阿拉丁),克拉维酸钾(批号C10190946,纯度50%,麦克林),磺胺异噁唑(批号U0098,纯度>98%,TCI),甲氧苄啶(批号C10404816,纯度98%,麦克林),头孢噻呋(纯度≥98%,河南牧翔动物药业有限公司),四环素(批号824G022,纯度≥98%,Solarbio)。
茶树精油的配制:将茶树精油与DMSO按照1∶19体积比混合时,DMSO对菌液的生长状况无影响[12]。取茶树精油溶于DMSO,质量浓度为843 500 μg/mL。
按照CLSI方法[17],将恩诺沙星、氟苯尼考、庆大霉素、四环素、头孢噻呋、阿莫西林均配制成质量浓度为5 120 μg/mL备用;磺胺异噁唑/甲氧苄啶配制成质量浓度为48 640/2 560 μg/mL备用;阿莫西林/克拉维酸配制成质量浓度为5 120/2 560 μg/mL备用。
1.1.4 试验设备 生化培养箱(LDZX-75KBS),上海新苗医疗器械制造有限公司;多功能酶标仪(Varioskan Thermo Scientific)、小型高速离心机(5K24R Eppendof)、电导仪(DDS-12DW),上海般特仪器有限公司。
1.2 试验方法
1.2.1 细菌菌液的制备 将沙门氏菌SH17接种至Mueller-Hinton肉汤中,37 ℃下过夜培养,用新鲜Mueller-Hinton肉汤将其浊度调至0.5麦氏单位,再以1∶100继续稀释,稀释后的菌液备用。
1.2.2 药物敏感性试验 用微量二倍肉汤稀释法进行。在96孔中先加入沙门氏菌SH17菌液260 μL,再分别加入茶树精油或质量浓度不同的抗生素30 μL,然后再加入2,3,5-三苯基氯化四氮唑(TTC)10 μL,混合均匀,37 ℃培养18~20 h。将大肠杆菌ATCC25922作为阳性对照,不含任何药物和茶树精油的沙门氏菌SH17作为阴性对照。结果判定标准参考CLSL M11-A7[17],茶树精油最小抑菌浓度(MIC)的判定以TTC变色为准。
1.2.3 茶树精油最小杀菌浓度(MBC)测定 根据MIC的测定结果,以不含任何抗生素和茶树精油的沙门氏菌SH17作为对照,取无菌生长的茶树精油质量浓度分别为10 540,21 090,42 180,84 350 μg/mL的4个孔里面的液体100 μL涂布在Mueller-Hinton琼脂板上,37 ℃培养24 h。 以在Mueller-Hinton琼脂板上细菌生长减少99%所对应的茶树精油质量浓度为MBC值[18]。
1.2.4 茶树精油对沙门氏菌SH17耐药性的影响 (1)含不同质量浓度茶树精油沙门氏菌SH17菌液的准备。用Mueller-Hinton肉汤将过夜复苏的沙门氏菌SH17菌液浊度调至0.5麦氏单位,再以1∶100的比例用Mueller-Hinton肉汤将菌液稀释,备用。
以药敏试验的结果为基础,取上述菌液于试管中,再分别向试管中加入茶树精油,使其质量浓度分别为0,2 635,5 270,10 540 μg/mL。然后于37 ℃摇床中160 r/min振荡培养,分别在振荡培养0,0.5,1,2,3,4,5,6,7,8 h取样。
(2)茶树精油对沙门氏菌SH17生长曲线的影响。参照文献[19]的方法,用1.2.4(1)中制备的菌液,在600 nm处测定细菌的吸光度(OD),以不加药的沙门氏菌SH17菌液作为对照,绘制沙门氏菌SH17的生长曲线。
(3)茶树精油对沙门氏菌SH17细胞壁的影响。正常情况下碱性磷酸酶(alkaline phosphatas,AKP)不能透过细胞壁渗出至细胞外,检测不到其活性,因而其活性可以作为反映沙门氏菌SH17细胞壁是否完整的依据。
用1.2.4(1)中制备的菌液,按照参考文献[20]的方法,依据碱性磷酸酶(AKP)检测试剂盒的说明方法进行加样。在520 nm处测定混合液的OD值,以AKP活性的变化反映药液对细菌细胞壁的影响。
(4)茶树精油对沙门氏菌SH17胞外蛋白质量浓度的影响。用1.2.4(1)中制备的菌液,参照参考文献[20],用考马斯亮蓝法进行测定,按试剂盒的说明书进行试验操作。
(5)茶树精油对沙门氏菌电导率的影响。电导率是电解质溶液导电能力的表现,与溶液中离子浓度成正比。因而可以通过测定电导率来探究菌体细胞内容物的外溢情况,间接反映细胞壁的破坏情况[21]。按参考文献[21]的方法并改良,用1.2.4(1)中制备的菌液,用电导仪测不同时间茶树精油与沙门氏菌SH17共孵育的电导率,反映细菌细胞膜通透性的变化,探究茶树精油对沙门氏菌SH17细胞壁的影响。
(6)茶树精油对沙门氏菌SH17生物膜的影响。按参考文献[22]的方法,将1.2.4(1)中制备的菌液与药物吹打混匀,分别取300 μL于96孔板中,以肉汤作为空白对照,37 ℃恒温培养36 h。之后吸弃96孔板中的液体,每孔加入200 μL甲醇静置15 min。吸弃甲醇,每孔加入300 μL无菌PBS进行清洗,重复3次。PBS清洗后,待其自然晾干,每孔加入250 μL 10 g/L的结晶紫溶液,静置15 min。吸弃结晶紫溶液,用无菌PBS清洗3次,每孔加入250 μL体积分数30%乙酸溶解,30 min后,570 nm波长下测其OD,分析茶树精油对沙门氏菌SH17生物膜的影响。
1.2.5 茶树精油对沙门氏菌SH17鞭毛动力的影响 参照文献[23]的方法并改良。菌液制备:用Mueller-Hinton肉汤将过夜复苏的菌液浊度调至0.5麦氏单位,再以1∶100的比例用Mueller-Hinton肉汤将菌液稀释,备用。取10 μL枪头吸取上述备用的沙门氏菌SH17菌液,扎在含不同质量浓度(0,2 635,5 270,10 540 μg/mL)茶树精油的半固体培养基中央,静置3~5 min后,于37 ℃过夜培养18~20 h,观察并记录结果。
2 结果与分析
2.1 最小抑菌浓度(MIC)与最小杀菌浓度(MBC)
茶树精油和抗生素对沙门氏菌SH17的MIC见表1。由表1可以看出,沙门氏菌SH17对茶树精油的MIC为10 540 μg/mL;对阿莫西林/克拉维酸、恩诺沙星、四环素敏感;对磺胺异噁唑/甲氧苄啶、氟苯尼考、头孢噻呋、庆大霉素的敏感性较低,表现出耐药性。

表1 沙门氏菌SH17对茶树精油和抗生素敏感性试验结果
根据MIC的试验结果,吸取无菌生长的茶树精油质量浓度分别为10 540,21 090,42 180,84 350 μg/mL的孔中100 μL菌液,分别涂布Mueller-Hinton琼脂平板。结果显示,从茶树精油质量浓度为10 540 μg/mL的孔中取出的菌液涂布琼胎平板上培养后仅有微量菌生长;涂市其余茶树精油质量浓度的琼脂平板无菌生长,推断茶树精油对沙门氏菌SH17的MBC为10 540 μg/mL。
2.2 茶树精油对沙门氏菌SH17耐药性的影响
2.2.1 茶树精油对沙门氏菌SH17生长曲线的影响 茶树精油对沙门氏菌SH17生长曲线的影响如图1所示。由图1可知,在培养0~1 h,沙门氏菌SH17在4种含不同质量浓度茶树精油的菌液中的生长曲线无明显差别;培养1~6 h,含2 635 μg/mL茶树精油对沙门氏菌SH17的抑制作用较小,远不如茶树精油质量浓度为5 270 和10 540 μg/mL处理;在6 h后,2 635 μg/mL茶树精油对沙门氏菌SH17的抑菌作用增强;在1~8 h,茶树精油质量浓度为5 270和10 540 μg/mL处理对沙门氏菌SH17的生长抑制作用较强,其菌液OD600浮动较小,一直在0.05~0.15浮动。茶树精油质量浓度为10 540 μg/mL时,仍有极少量细菌生长,和MIC、MBC的定义相符[18]。

图1 茶树精油对沙门氏菌SH17生长曲线的影响
2.2.2 茶树精油对沙门氏菌SH17细胞壁的影响 由图2可知,加入茶树精油的菌液中碱性磷酸酶活性高于不加茶树精油的菌液,这表明,茶树精油破坏了沙门氏菌SH17的细胞壁结构,使菌体内的碱性磷酸酶释放,从而起到抑菌作用。从图2还可以看出,在培养1~3 h,在茶树精油质量浓度为0,2 635,5 270,105 40 μg/mL时,沙门氏菌SH17碱性磷酸酶活性呈上升趋势;在3~4 h,各质量浓度茶树精油处理的沙门氏菌SH17碱性磷酸酶活性呈下降趋势。
从图2还可以看出,碱性磷酸酶变化具有周期性,可能是由于沙门氏菌SH17生长的周期性所导致的。随着茶树精油质量浓度的增加,碱性磷酸酶活性升高且变化趋势类似,表明茶树精油的质量浓度与沙门氏菌SH17碱性磷酸酶活性具有一定关系,即随着茶树精油浓度的增加,沙门氏菌SH17的碱性磷酸酶活性也随之增加。
2.2.3 茶树精油对沙门氏菌SH17胞外蛋白质量浓度的影响 茶树精油对沙门氏菌SH17胞外蛋白质量浓度的影响如图3所示。由图3可知,当茶树精油质量浓度为0,2 635,5 270,10 540 μg/m L时,沙门氏菌SH17胞外蛋白质量浓度具有初始值。在0~1 h,随着培养时间的延长,沙门氏菌SH17胞外蛋白质量浓度呈急剧上升趋势。虽然1~2 h和3~4 h,2 635,5 270,10 540 μg/mL茶树精油使沙门氏菌SH17胞外蛋白质量浓度呈下降趋势;但随培养时间的延长沙门氏菌SH17胞外蛋白质量浓度总体缓慢上升。随着茶树精油质量浓度的升高,沙门氏菌SH17胞外蛋白质量浓度也随之增加。试验结果表明,不同质量浓度的茶树精油作用于沙门氏菌SH17后,可能会对其细胞壁和细胞膜产生影响,从而导致其胞外蛋白质量浓度增加。
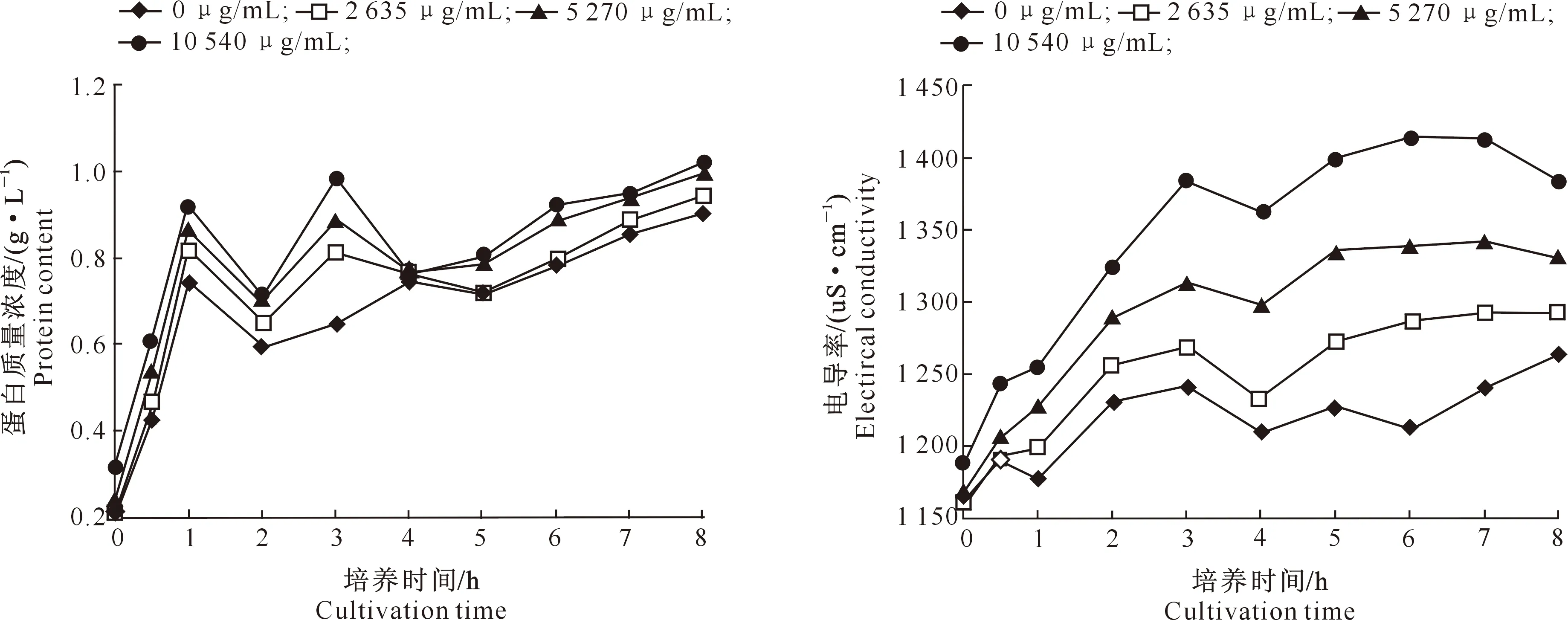
图3 茶树精油对沙门氏菌SH17胞外蛋白质量浓度的影响
2.2.4 茶树精油对沙门氏菌SH17电导率的影响 由图4可以看出,所有处理沙门氏菌SH17菌液的电导率变化曲线基本一致,均随着培养时间的延长整体呈上升趋势;在培养3~4 h时,各菌液的电导率都有所下降,这主要是受沙门氏菌SH17的生长周期影响所致。加入茶树精油之后菌液的电导率明显高于不加茶树精油菌液,且随着茶树精油质量浓度的增加,菌液的电导率逐渐上升。
2.2.5 茶树精油对沙门氏菌SH17生物膜的影响 茶树精油对沙门氏菌SH17生物膜的影响如图5所示。
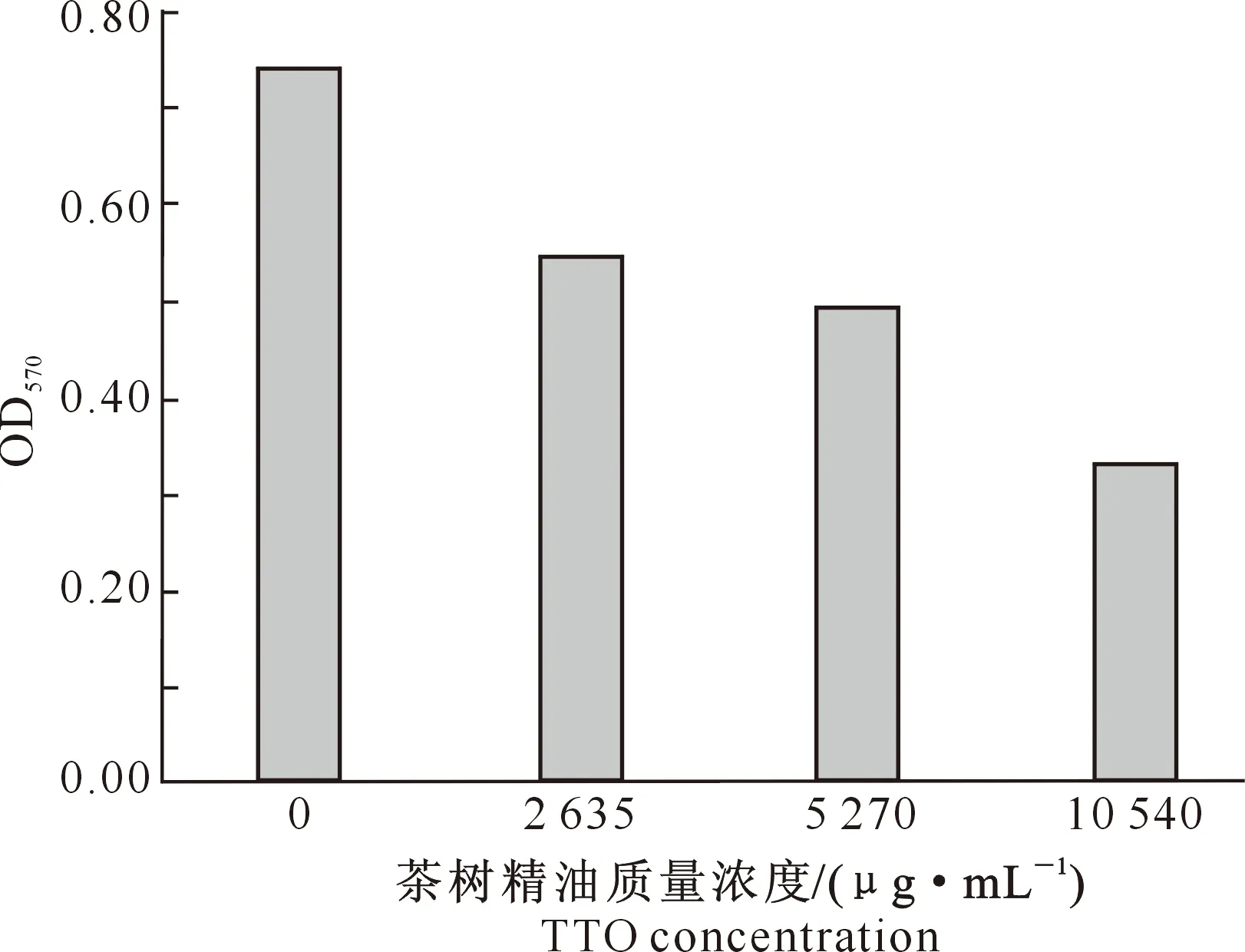
图5 茶树精油对沙门氏菌SH17生物膜的影响
由图5可知,随着茶树精油质量浓度的增大,其对沙门氏菌SH17形成生物膜的清除作用逐渐增强。当茶树精油质量浓度为10 540 μg/mL时,对沙门氏菌SH17的生物膜抑制最为明显;与0 μg/mL茶树精油相比,其对沙门氏菌SH17生物膜形成抑制率提高大约50%。有研究表明,茶树精油对表皮葡萄球菌、金黄色葡萄球菌生物膜的清除作用较强,且随着茶树精油质量浓度越大,对表皮葡萄球菌、金黄色葡萄球菌生物膜的清除能力越大[24]。这与本研究结果一致。
2.3 茶树精油对沙门氏菌SH17鞭毛动力的影响
茶树精油对沙门氏菌SH17鞭毛动力的影响如图6所示。

图6 茶树精油对沙门氏菌SH17鞭毛动力的影响
由图6可知,沙门氏菌SH17在不含茶树精油的空白对照培养基表面呈圆环状生长,基本长满培养皿,且向下在琼脂中心部位沿着插入位置向外周扩散;当茶树精油质量浓度为2 635 μg/mL时,沙门氏菌SH17仍有一定程度的运动性,但相对于不含茶树精油的空白对照而言,其在培养基表面的生长运动痕迹明显缩小,且沙门氏菌SH17仅沿着插入培养基的位置生长;当茶树精油质量浓度为5 270,10 540 μg/mL时,在培养基平面观察不到沙门氏菌SH17的运动痕迹,说明茶树精油对沙门氏菌SH17鞭毛动力有明显抑制作用,且随着茶树精油质量浓度的增加,其对沙门氏菌SH17鞭毛动力的抑制作用增强。
3 讨 论
研究表明,茶树精油对革兰氏阴性菌和革兰氏阳性菌均有抑制作用,其对鸡沙门氏菌、绿脓杆菌MIC分别为0.3%,0.25%~2%[25];对大肠埃希菌和金黄色葡萄球菌的MBC分别是0.25%和2~4 mg/mL[6-7],茶树精油对金黄色葡萄球菌的抑制效果与其质量浓度呈正相关[7];茶树精油对单增李斯特菌的MIC为1~2 mg/mL[8]。本试验中,茶树精油对临床分离有耐抗生素表型的沙门氏菌SH17的MIC和MBC均为10 540 μg/mL,提示茶树精油抑菌作用和杀菌作用可同时发挥作用。与文献报道数值上的差异,可能与选用的菌株有关。研究表明,不同产地的2种茶树精油对大肠杆菌、白色念珠菌、绿脓杆菌和金黄色葡萄球菌均有抑制作用,但存在差异,广西产TTO的MIC为2.64~41.18 mg/mL,澳大利亚产TTO的MIC为1.32~21.09 mg/mL,二者都含有较多的4-萜烯醇[20]。茶树精油含松油烯-4-醇(44.4%)、柠檬烯、γ-松油烯、α-松油烯等[26];通过GC-MS从3个厂家的茶树精油中共分离鉴定出22种化合物,其主要成分为(-)-α-蒎烯、α-松油烯、1,2,3,5-四甲基苯、 D-柠檬烯、桉叶油醇、γ-萜品烯、α-萜品烯、(-)-4-萜品醇、α-松油醇等,且3个厂家的茶树精油均对金黄色葡萄球、大肠杆菌和白色念珠菌有较强的抑菌效果,且α-松油醇、α-萜品烯、γ-萜品烯、D-柠檬烯含量的高低会影响抑菌效果[27]。
低质量浓度(0.5 mg/mL)茶树精油可抑制单增李斯特菌的生长[8],与本试验5 270 μg/mL茶树精油对沙门氏菌SH17生长曲线的抑制结果相似。茶树精油不仅抑制金黄色葡萄球菌的生长,而且也使菌体总蛋白含量降低,当茶树精油质量浓度升至2 MIC时,这种抑制作用更明显,呈现出剂量依赖关系,推测可能是茶树精油破坏了金黄色葡萄球菌细胞膜的完整性[28]。当细菌细胞壁的完整性被破坏时,AKP被释放到培养介质中;正常情况下,细菌细胞壁完整时无法检测到AKP;因而可通过检测细菌培养介质中是否含有AKP来判断细菌细胞壁是否受损[29]。当细菌细胞壁被破坏后,其内容物被释放出来,造成细菌菌体内总蛋白含量下降,而胞外蛋白含量增加,电导率增加。茶树精油可能破坏了沙门氏菌SH17的细胞壁,从而导致AKP活性、胞外蛋白质量浓度和电导率均增加。这种现象在研究中药和/或提取物对沙门氏菌的作用时也可观察到,如肉桂醛对沙门氏菌的作用[30]。这提示中药的提取物,包括精油类和单体活性成分,对细菌的作用机制可能是相似的。
本试验中,5 270和10 540 μg/mL茶树精油对沙门氏菌SH17生物膜抑制较明显。研究表明,19.2 μg/mL茶树精油作用铜绿假单胞杆菌20 h后,其生物膜完全被清除[31]。缺失bapA基因可导致沙门氏菌失去生物被膜的形成能力,其编码的bapA蛋白是生物膜形成的必需蛋白;在体外培养上皮细胞模型中发现,Ⅰ型菌毛、Lpf和Pef也有助于生物膜的形成[32]。2~4 mg/mL茶树精油有较好的抗金黄色葡萄球菌悬浮菌和生物被膜的活性,通过抑制PIA的合成及eDNA的释放从而有效抑制金黄色葡萄球菌生物被膜的形成,且茶树油对icaA,sarA,cidA,hla等生物被膜相关基因有抑制作用[7]。这对下一步如何深入研究茶树精油对革兰氏阴性菌生物膜的抑制机制提供了思路。
本试验结果显示,2 635 μg/mL茶树精油可使沙门氏菌SH17运动力下降,5 270 和10 540 μg/mL茶树精油则完全抑制了沙门氏菌SH17的运动,表明茶树精油对沙门氏菌SH17的鞭毛动力有抑制作用。沙门氏菌致病过程中需要bcfD、stfH、fimH等毒力基因发挥定殖、粘附作用[33-34]。这些毒力基因主要为沙门氏菌T3SS分泌系统,其中flgK、flhB、flhA、fgI、fliL和fliN同时影响鞭毛形成和运动性;motB影响运动性,但不影响鞭毛形成[35]。有研究表明,低质量浓度(8~16 μg/mL)非抗生素舍曲林可有效降低沙门氏菌的体外生长活力;0.2 μg/mL舍曲林可使沙门氏菌聚集运动能力显著降低,致使舍曲林对T3SS的毒力基因hilA、invF、prgH的转录有显著抑制作用[36]。沙门氏菌与丁香醛共孵育后,T3SS入侵效应蛋白和调节蛋白表达显著下调;经RT-PCR分析,丁香醛可抑制hilD-hilC-rstA-hilA基因调控路径,降低下游效应蛋白和调节蛋白的表达[32]。本试验仅观察到了茶树精油对沙门氏菌SH17鞭毛动力有抑制作用,但具体对沙门氏菌SH17哪个基因有影响尚待进一步研究。
