草原短尾羊Brachyury蛋白多克隆抗体制备
2022-04-13霍雨佳智达夫刘默凝窦傲蕾王家业曹贵方
杨 光,霍雨佳,苏 红,智达夫,刘默凝,窦傲蕾,王家业,曹贵方
(1 内蒙古农业大学兽 医学院,内蒙古 呼和浩特 010018;2 内蒙古自治区基础兽医学重点实验室,内蒙古 呼和浩特 010018)
草原短尾羊(prairie short-tail sheep)是内蒙古自治区特有的绵羊品种,因其肉质风味独特,一直深受消费者喜爱。Brachyury是哺乳动物胚胎发育时期中胚层细胞的标志基因,该基因编码的转录因子Brachyury蛋白不仅在初级中胚层细胞发挥作用,还与脊索瘤、肺癌和软骨肉瘤等恶性癌症密切相关[1-2]。Zhi等[3]研究表明,Brachyury基因c.G334T错义突变可能是造成绵羊短尾表型的主要原因;研究还发现,Brachyury突变也会造成小鼠尾部变短,而Brachyury纯合突变的小鼠会在第10.5天因尿囊无法正常形成而致死[4-6]。Guillomot等[7]研究指出,绵羊BrachyurymRNA仅在胚胎时期表达,但未对Brachyury蛋白在胚胎时期的表达量进行研究。Brachyury蛋白的表达对哺乳动物原条的形成至关重要,且与上皮细胞间充质转化(epithelial-to-mesenchymal transition,EMT)细胞群的发生相关,EMT细胞群是内胚层和中胚层细胞的前体,并决定哺乳动物胚胎轴向结构的延伸[8-9]。Brachyury蛋白在EMT细胞群中瞬时表达,对此类细胞的细胞外基质建立具有重要作用[10-11]。在小鼠研究中发现,转录因子Brachyury蛋白表达始于胚胎发育中的原肠时,止于中胚层细胞伴随EMT作用迁移至胚胎的侧部时[10]。在胚胎发育后期,Brachyury蛋白仅在胚胎的尾端中表达[12]。当WNT信号通路(Wnt/β-catenin pathway)和FGF信号通路(Fgf pathway)激活Brachyury蛋白表达后,Brachyury激活wnt3a和Fgf4/8基因的表达[12-14],二者维持了体轴延伸过程中中胚层祖细胞的聚集。在Brachyury基因杂合突变小鼠中,由于中胚层祖细胞的聚集作用减弱,出现胚胎后部发育截断的现象[15-16],从而造成了短尾表型。在其他研究[12,17]中也发现了Brachyury蛋白的靶基因wnt3a和Fgf4/8突变同样会造成短尾表型,以上研究暗示Brachyury蛋白在胚胎轴向延伸中的作用。
目前,市面上缺少绵羊Brachyury蛋白多克隆抗体,本试验克隆草原短尾羊Brachyury基因CDS全长,并将其连接至pEASY®-Blunt E1载体中进行原核表达,再将重组蛋白免疫日本大耳白兔,制备Brachyury蛋白多克隆抗体,旨在为草原短尾羊短尾形成机制研究提供重要的试验材料。
1 材料与方法
1.1 材 料
6周龄日本大耳白兔,购自内蒙古医科大学实验动物中心;草原短尾羊,购自呼伦贝尔市鄂温克族自治旗锡尼河镇苏和巴特尔家庭牧场,公羊母羊自然交配当天记为胚胎0.5 d,按计划时间(胚胎16,20,25和30 d)对草原短尾母羊宰杀并采集子宫,用含有1%双抗的生理盐水将胚胎从子宫内冲出,迅速放入液氮中保存。
SOB无菌液体培养基、SOC无菌液体培养基、TB无菌液体培养基、RosettagamiB(DE3)感受态细胞、包涵体洗涤液、包涵体溶解液、动物全蛋白提取试剂盒、SanPrep质粒DNA小量抽提试剂盒、SanPrep 柱式 DNA 胶回收试剂盒、PageRuler 预染蛋白Marker,均购自上海生工公司;pEASY®-Blunt E1 Expression Kit、Trans 10 Chemically Competent Cell、ProteinFind®Anti-His Mouse Monoclonal Antibody、ProteinFind®Goat Anti-Rabbit IgG(H+L)、ProteinFind®Anti-GAPDH Mouse Monoclonal Antibody,均购自北京全式金生物技术有限公司;2×Phanta Max Master Mix(Dye Plus)、HiScript Ⅲ 1st Strand cDNA Synthesis Kit (+gDNA wiper)、高敏型ECL 化学发光检测试剂盒,均购自诺南京唯赞生物公司;RNA fast 200总RNA极速抽提试剂盒,购自上海飞捷生物公司;BCA蛋白浓度测定试剂盒(增强型),购自碧云天生物公司;透析袋MD 25(8000-14000D)、ELISA 套装试剂盒,购自北京索莱宝公司;试验所用DNA Marker,购自TaKaRa公司;弗氏不完全佐剂(incomplete Freund’s adjuvant,IFA)、弗氏完全佐剂(complete Freund's adjuvant,CFA)和剩余生化试剂,均购自美国Sigma公司。
1.2 草原短尾羊Brachyury基因CDS全长克隆
从液氮中取出草原短尾羊16 d的胚胎,研成粉末后提取总RNA,使用NanoDropTM2000荧光分光光度计对其浓度和污染降解等情况进行鉴定,将总RNA进行反转录成cDNA,备用。
以NCBI中绵羊Brachyury(XM_027972732.1)作为参考序列,使用Oligo 7软件设计引物,上游引物序列为:5′-CGGCTAGCCGATGACCTCCCC-GGGCACCG-3′(划线部分为NheⅠ限制酶切位点),下游引物序列为:5′-TTTGATATCTCACATGGACGGGGGCGACACG-3′(划线部分为EcoR Ⅰ限制酶切位点)。以cDNA为模板,PCR扩增Brachyury基因CDS全长。PCR反应体系:cDNA模板1 μL,上、下游引物各2 μL,ddH2O 20 μL,2×Phanta Max Master Mix(Dye Plus)25 μL。PCR反应程序:95 ℃预变性3 min;95 ℃变性15 s,68 ℃退火15 s,72 ℃延伸70 s,30个循环;72 ℃延伸5 min。PCR产物经1%琼脂糖凝胶电泳后进行胶回收。
1.3 原核表达载体pEASY®-Blunt E1-Brachyury的构建与鉴定
将胶回收的Brachyury基因CDS全长序列连接至pEASY®-Blunt E1载体,构建原核表达载体pEASY®-Blunt E1-Brachyury。将pEASY®-Blunt E1-Brachyury导入Trans 10大肠杆菌感受态细胞中,用SOB无菌液体培养基(含100 μg/mL氨苄青霉素)于37 ℃、200 r/min条件下扩增培养1 h。取菌液涂布于LB固体培养基中,置37 ℃生化培养箱中倒置培养14 h后,挑取单克隆菌落加入SOB无菌液体培养基(含100 μg/mL氨苄青霉素)中, 37 ℃、200 r/min条件下扩增培养16 h,对菌液进行质粒提取,对提取的重组质粒进行NheⅠ和EcoRⅠ双酶切鉴定,并送往上海生工公司测序。将测序后的重组质粒序列输入Bio-Sof网站(http://www.bio-soft.net/sms/codon_plot.html)进行稀有密码子预测。
1.4 重组Brachyury蛋白的诱导表达与纯化
将测序比对正确的pEASY®-Blunt E1-Brachyury质粒导入RosettagamiB(DE3)大肠杆菌中,使用TB无菌液体培养基(含100 μg/mL氨苄青霉素)在37 ℃、200 r/min条件下扩增培养14 h。将培养好的菌液倒入50 mL TB无菌液体培养基(含100 μg/mL氨苄青霉素)中继续培养,待菌液在600 nm处吸光值为0.5至0.8时,向其中加入IPTG溶液(终浓度为0.4 mmol/L), 37 ℃、200 r/min条件下诱导表达3或4 h。将诱导表达的菌液于4 ℃、10 000 r/min离心10 min,弃上清液,用10 mL PBS溶液重悬沉淀,用超声破碎仪破碎1 h。破碎条件为:40 W工作15 s,停5 s;将破碎后的溶液在4 ℃、10 000 r/min离心10 min,收集上清液,对沉淀进行洗涤和溶解;对溶解后的沉淀和上清液进行SDS-PAGE电泳和考马斯亮蓝染色。试验同时设 插入pEASY®-Blunt E1的RosettagamiB(DE3)菌株、未导入pEASY®-Blunt E1-Brachyury载体质粒的RosettagamiB(DE3)菌株和未加IPTG诱导表达的RosettagamiB(DE3)重组表达菌株为对照。电泳完成后将胶块放入1 mmol/L KCl溶液中浸泡10 min;在白色条带显出后,将对应在49 ku的白色条带切下放入透析袋中,并向透析袋中加入2 mL蛋白质电泳缓冲液,将透析袋放入含有蛋白质电泳缓冲液的电泳槽中60 V电泳12 h;电泳后将透析袋放入PBS溶液中脱盐6 h,期间每隔1 h更换1次PBS溶液;将透析袋取出后在其表面覆盖PEG粉末进行蛋白质浓缩,待透析袋内溶液浓缩为约1 mL时停止,测定蛋白质浓度。
1.5 重组Brachyury蛋白多克隆抗体的制备及血清效价的鉴定
将重组Brachyury蛋白稀释至0.2 mg/mL,与等体积的弗氏完全佐剂混匀和乳化,采用皮下多点注射对兔子进行初次免疫,同时设立未免疫的兔子为对照组。在初次免疫14 d后进行第2次免疫,第2次免疫所用佐剂为弗氏不完全佐剂,注射体积为第1次的1/2;第2次免疫7 d后进行第3次免疫,注射体积为第1次的1/4,佐剂与第2次免疫相同;第3次免疫7 d后取兔耳缘静脉血,用于检测血清抗体效价。将重组Brachyury蛋白稀释至10 μg/L,加入酶标板各孔,200 μL/孔,4 ℃包被过夜;次日弃液后向孔中加入250 μL封闭液,将血清抗体作为一抗按照1∶87.5,1∶175,1∶350,1∶750,1∶1 500,1∶3 000,1∶6 000稀释后加入,100 μL/孔,37 ℃孵育2.5 h;再向各孔加入二抗ProteinFind®Goat Anti-Rabbit IgG(H+L)100 μL,在室温下反应1 h后弃液洗涤。最后向每孔加入100 μL TMB底物显色液,37 ℃反应15 min后加入50 μL终止反应液,用酶标仪在450 nm处测量酶标板中各孔的吸光值(OD450)。
1.6 草原短尾羊各个时期胚胎中Brachyury蛋白表达测定
使用动物全蛋白提取试剂盒提取草原短尾羊16,20,25和30 d胚胎组织全蛋白,以血清多克隆抗体作为一抗,以ProteinFind®Goat Anti-Rabbit IgG(H+L)作为二抗采用Western blot法检测Brachyury蛋白在不同阶段胚胎中的表达量,试验设GAPDH蛋白为内参,以ProteinFind®Anti-GAPDH Mouse Monoclonal Antibody作为一抗,ProteinFind®Goat Anti-Rabbit IgG(H+L)作为二抗,用Western blot法检测胚胎组织全蛋白样品中GAPDH蛋白的含量。
2 结果与分析
2.1 Brachyury基因CDS全长的克隆及原核表达载体的鉴定
PCR反应产物经1%琼脂糖凝胶电泳检测,结果(图1)显示目的条带长度为1 000~2 000 bp,与预期目的片段大小(1 335 bp)相符。
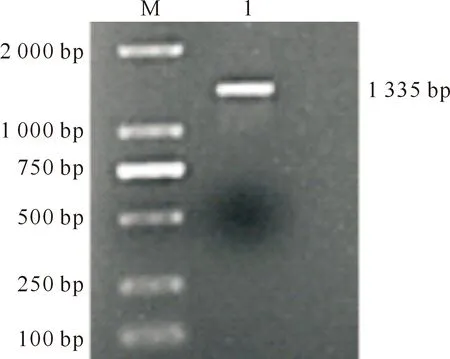
M.DL 2000 Marker;1.Brachyury基因CDS全长
pEASY®-Blunt E1-Brachyury质粒经NheⅠ和EcoR Ⅰ双酶切后,得到2条条带,位置分别为5 716和1 335 bp(图2),与预期条带大小符合。结果表明,原核表达载体pEASY®-Blunt E1-Brachyury构建成功。
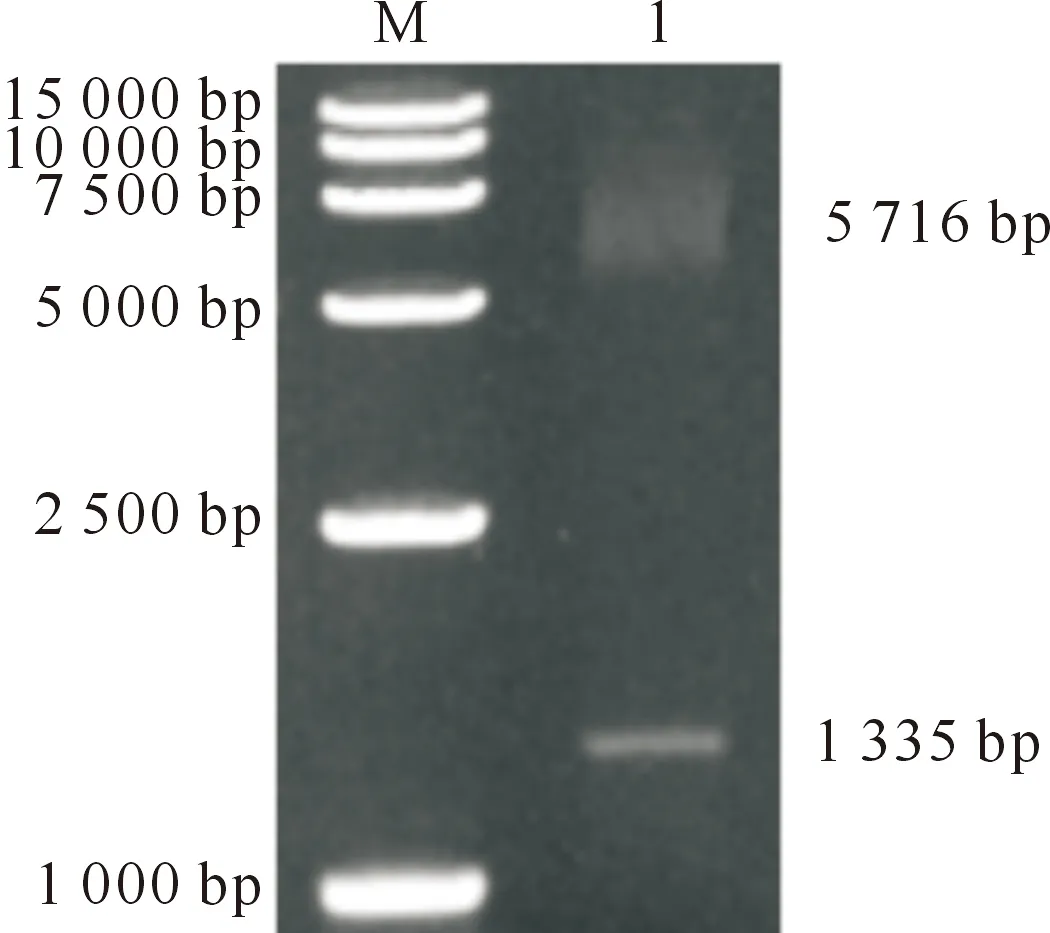
M.DL 15000 Marker;1.pEASY®-Blunt E1-Brachyury质粒双酶切产物
2.2 Brachyury基因序列对比及稀有密码子预测
对BrachyuryCDS序列中所含稀有密码子数量进行统计,结果如图3所示。由图3可知,CGA 1个、CGG 3个、AGG 4个、AGA 2个、GGA 5个、GGG 10个、AUA 0、CUA 2个、CCC 18个和ACG 4个;其中CCC和ACG连续有1个、AGG和AGG连续有1个、GGA和GGG连续有1个、CUA和GGA 连续有1个、CUA和CCC 连续有1个。由于稀有密码子较多可能会降低蛋白表达水平,所以选择RosettagamiB(DE3)感受态细胞作为宿主进行原核表达。

黑色方框表示稀有密码子
2.3 重组Brachyury蛋白的诱导表达、纯化及鉴定
如图4-A所示,IPTG诱导3和4 h的菌液沉淀均在43~55 ku有条带出现,符合预期条带大小(49.16 ku),其中IPTG诱导4 h的菌液沉淀中Brachyury蛋白表达量较大,表明该条件下重组Brachyury蛋白主要以包涵体形式表达。使用ProteinFind®Anti-His Mouse Monoclonal Antibody作为一抗,对切胶纯化后的融合蛋白进行Western blot检测,结果(图4-B)显示在49.16 ku处有单一条带,与预期结果相符。上述结果表明,重组Brachyury蛋白诱导表达成功。

A.重组Brachyury蛋白的诱导表达:M.PageRuler预染蛋白Marker;1.插入pEASY®-Blunt E1的RosettagamiB(DE3)菌株;2.未导入pEASY®-Blunt E1-Brachyury载体质粒的RosettagamiB(DE3)菌株;3.未加IPTG诱导表达的RosettagamiB(DE3)重组表达菌株;4,5.分别为IPTG诱导3 h的菌液上清液和沉淀;6,7.分别为IPTG诱导4 h的菌液上清液和沉淀。B.重组Brachyury蛋白的纯化鉴定:M.PageRuler预染蛋白Marker;1.重组Brachyury蛋白
2.4 重组Brachyury蛋白多克隆抗体的效价
iELISA检测结果(表1)显示,重组Brachyury蛋白多克隆抗体效价为1∶1 500。
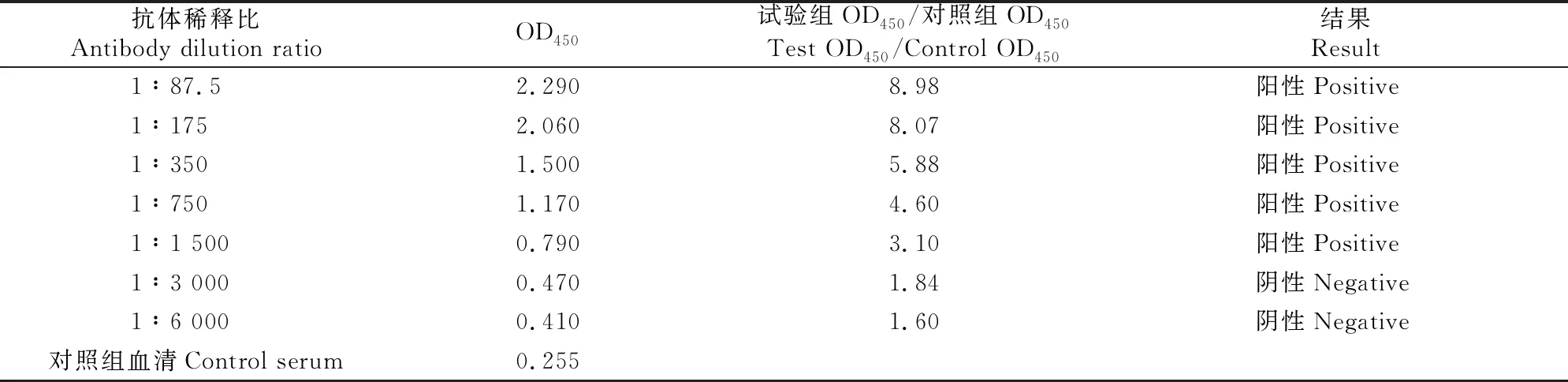
表1 重组Brachyury蛋白多克隆抗体效价的 iELISA检测结果
2.5 草原短尾羊不同时期胚胎中Brachyury蛋白的表达水平
以制备的重组Brachyury蛋白多克隆抗体作为一抗,对草原短尾羊16,20,25和30 d胚胎中Brachyury蛋白的表达水平进行Western blot鉴定,结果(图5)显示在49.16 ku处出现单一的目的条带,表明所制备的血清多克隆抗体有良好的免疫原性,可以特异识别草原短尾羊胚胎中的Brachyury蛋白,其中草原短尾羊16 d胚胎中Brachyury蛋白表达量最高。
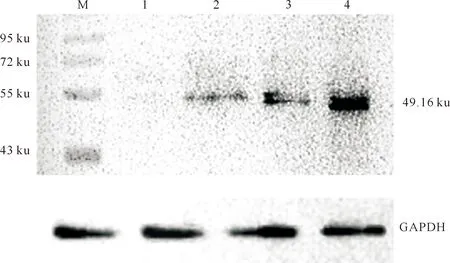
M.PageRuler预染蛋白Marker;1~4分别为30,25,20,16 d胚胎
3 讨 论
有研究指出,哺乳动物的体节延伸离不开神经中胚层祖细胞的EMT作用,在此作用中Brachyury蛋白维持体轴正常的延伸[18]。Carolina等[19]研究表明,Brachyury蛋白下游靶基因包括参与EMT作用的基因,结合草原短尾羊群体中存在的尾椎骨畸形[3,20]现象以及基因组重测序结果可以推测:Brachyuryc.G334T 错义突变影响了下游靶基因与蛋白的结合,引起体轴延伸异常,从而导致绵羊短尾表型。在其他短尾动物的研究中[21-23]也有相似结论。将草原短尾羊与小鼠的Brachyury蛋白氨基酸序列对比后发现,突变位点所在区域的同源性较高,对小鼠Brachyury基因的第334位进行G→T点突变后均出现短尾表型[24-25],且为杂合个体,纯合突变小鼠在胚胎10.5 d时停止发育;但与小鼠不同的是,草原短尾羊中Brachyury纯合突变个体却可以存活[26],这一差异现象背后所涉及的分子机制还有待深入探究。
此外有研究指出,绵羊短尾性状还与尾部脂肪沉积量有关[27-29],但此类研究中所筛选到的候选基因并不完全一致,这可能与绵羊种类[29-31]和研究中所参考基因组序列版本[29,31-32]不同有关,但仍可推测造成短尾性状的原因并不唯一,尾部脂肪沉积较少和尾椎骨畸形两种表型背后的分子机制是否存在关联,也有待后续探究。
本试验采用切胶方式纯化蛋白,与镍柱纯化相比,操作更为简便,且所纯化重组Brachyury蛋白中杂蛋白的相对含量较低。此外,本试验所得到的重组Brachyury蛋白主要以包涵体形式存在,上清液中所含有的重组Brachyury蛋白较少,下一步试验应继续优化诱导条件,使可溶性重组蛋白表达量增多,继续探究突变与野生型Brachyury蛋白二级结构的差异。
目前对绵羊胚胎各个时期Brachyury蛋白表达量变化的研究较少,其中一部分原因由于市面缺少绵羊Brachyury抗体。本研究克隆Brachyury基因CDS,由于该序列存在一定数量的稀有密码子,可能造成蛋白表达量较少,所以使用RosettagamiB(DE3)菌株作为原核表达宿主,并构建pEASY-Blunt E1-Brachyury原核表达载体,诱导纯化重组Brachyury蛋白,3次免疫日本大耳白兔后制备抗体血清。将其作为一抗对草原短尾羊不同时期胚胎进行Western blot检测后发现,目的条带单一,可以特异识别短尾羊胚胎中的Brachyury蛋白,且草原短尾羊16 d胚胎中Brachyury蛋白的表达量最高。
