人血浆与大鼠同/异源性血浆诱导TRALI大鼠模型比对研究*
2022-04-13宓文静李丽玮李兴龙李志强
宓文静 李丽玮 李兴龙 李志强
输血相关性急性肺损伤(transfusion-related acute lung injury,TRALI)是一种输注血液成分后出现与左心衰竭无关的以急性呼吸窘迫为主要表现的临床综合病征,由BIERMAN于1950年首先报道[1]。根据美国食品药品管理局(FDA)的调查报告,2012~2016年,TRALI所致死亡占输血相关性死亡的34%[2]。目前我国对于TRALI临床认识有限,存在不少误诊及漏诊病例[3]。因此,正确诊断及预防TRALI对于输血安全性提升具有十分重要的临床意义。为了进一步深入研究TRALI的发生与发展,需建立可靠的TRALI动物模型[4-7]。2013年李丽玮等根据“二次打击学说”应用人血浆诱导建立TRALI动物模型,并对其进行了相关研究[8]。然而,国内外对输注同种同源性血浆和同种异源性大鼠血浆是否可诱导建立TRALI动物模型的比对性研究报道甚少。本文旨在输注人与同种同源性/同种异源性大鼠血浆诱导建立TRALI动物模型的可行性、有效性、重复性和稳定性等方面进行研究,比对各自在诱导建立TRALI动物模型间的差异性。
材料与方法
1 研究对象 选取雄性Sprague Dawley大鼠(简称:SD大鼠)25只,体重(250±25) g,购于上海西普尔-必凯实验动物公司(SCXK(沪)2018-0006)。雄性Brown Norway大鼠(简称:BN大鼠)6只,体重(130±30) g,购于北京维通利华实验动物技术有限公司(SCXK(京)2016-0006)。所有大鼠均饲养于上海交通大学附属第六人民医院动物房(SYXK(沪)2016-0020)无特定病原体(Specific Pathogen Free,SPF级)环境下,标准颗粒饲料、饮水、垫料等物品均经无菌处理。
2 血浆分离 ①大鼠血浆分离:随机选取SD大鼠和BN大鼠各6只,分别腹腔注射3%戊巴比妥2 mL/kg麻醉后于腹主动脉取血,每只大鼠取血8~10 mL,并以1∶9加入CPDA保存液,4℃条件下储存7 d后,3 000×g离心5 min,每份取上层血浆约5 mL,并分装为5份(1 mL/份),储藏于-80℃的冰箱中备用,输注前于56℃的水浴箱中灭活补体。②人血浆分离:随机选取来自某血液中心AB型全血(含全血400 mL、CPDA保存液56 mL),无菌条件下留取血样30 mL, 4℃条件下储存21天后,3000×g离心5 min,留取血浆,并分装为5份(1 mL/份),储藏于-80℃的冰箱中备用,输注前于56℃的水浴箱中融化并灭活补体[8]。
3 试剂 脂多糖(lipopolysaccharide,LPS)(Sigma 公司,批号 L2880),3%戊巴比妥(Sigma公司),大鼠脑钠肽(brain natriuretic peptide,BNP)Elisa试剂盒(Abcam公司,批号:ab108816)
4 模型建立 剩下19只SD大鼠随机分为5组:①SD血浆实验组(n=5):SD大鼠腹腔内注射LPS 2 mg/kg,回笼2 h后腹腔内注射3%戊巴比妥2 mL/kg充分麻醉并行股静脉插管,PE管内以50%肝素抗凝,缓慢抽取大鼠10%的血液(约1 mL),并予枸橼酸钠抗凝后留存备用。而后缓慢输注SD大鼠血浆1 mL,速度控制于2 mL/h。②BN血浆实验组(n=5):股静脉内输注BN大鼠血浆1 mL,余同SD血浆实验组。③人血浆实验组(n=5):股静脉内输注人血浆1 mL,余同SD血浆实验组。 ④正常对照组(n=2):股静脉内输注生理盐水1 mL,余同SD血浆实验组。⑤阳性对照组(n=2):股静脉内输注LPS 1 mL,余同SD血浆实验组。输注完毕后观察大鼠表现,6 h后将大鼠以颈椎脱臼法处死,迅速打开大鼠胸腔,并于右心室取血,加入CPDA保存液后备用。取血后取下大鼠肺组织,并保留部分气管。
5 肺组织湿干重比测定 取下SD大鼠右肺中叶,用吸水纸充分吸干肺组织表面水分,称重得湿重。置于60℃烘箱中72 h,使其干燥,再次称重得干重,计算湿/干重比(wet to dry weight ratio,简称:W/D)。
6 肺组织病理染色及评分 取大鼠肺组织常规石蜡包埋、切片、苏木精-伊红染色法,观察病理变化按改良的标准评分并计总分[8]。
7 BNP检测 将大鼠输血浆前后留取的血液离心后分离上层血浆,ELISA法测定血浆中的BNP水平。
结 果
1 临床表现 SD血浆组5只大鼠中有1只出现呼吸不规则及少量湿啰音,余4只大鼠无症状;BN血浆组5只大鼠中有3只大鼠出现呼吸急促、不规则,其中2只大鼠肺部听诊闻及湿啰音及哮鸣音,余2只大鼠无症状;人血浆组5只大鼠均出现呼吸增快、不规则,肺部听诊闻及湿啰音,4只大鼠闻及哮鸣音;阳性对照组2只大鼠出现呼吸明显增快,肺部听诊可闻及湿啰音及哮鸣音,出现口鼻分泌物增多等表现;正常对照组2只无症状。见表1。
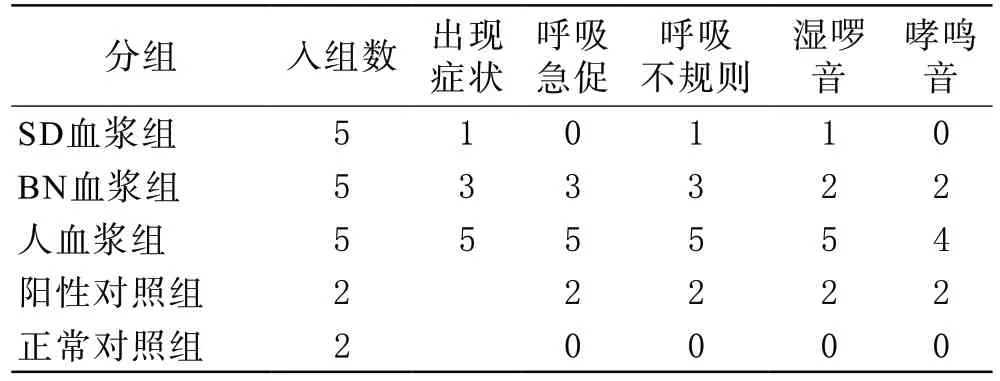
表1 各组大鼠临床表现
2 肺组织大体观察 SD血浆组大鼠肺组织表面光滑,未见明显病变。BN血浆组大鼠肺组织表面光滑,右肺上中下叶均出现暗红色病变区域。人血浆组大鼠肺组织表面光滑,左肺及右肺上中下叶均出现暗红色病变。正常对照组大鼠肺组织表面光滑,未见明显病变。阳性对照组大鼠肺组织表面出现凹凸不平的灰白色炎症性表现,见图1a-e。
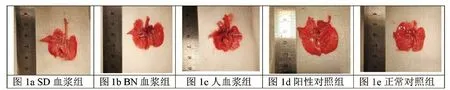
图1 肺组织大体标本
3 肺组织湿/干重比测定 SD血浆组与人血浆组的肺组织湿/干重比之间差异有统计学意义(P<0.05),BN血浆组分别与人血浆组、SD血浆组、正常对照组的肺组织湿/干重比之间差异无统计学意义(P>0.05),见表2。

表2 各组肺组织湿干重比
4 肺组织病理染色 SD血浆组大鼠肺泡间隔轻微增宽,肺组织间隙无明显红细胞渗出,肺泡腔内红细胞及纤维蛋白渗出少,支气管壁轻微增厚。BN血浆组大鼠肺泡间隔可见增宽,肺组织间隙有红细胞渗出,肺泡腔内红细胞及纤维蛋白渗出,支气管壁增厚。人血浆组大鼠肺泡间隔明显增宽,肺泡壁之间见红细胞渗出,肺泡腔内可见红细胞渗出,支气管壁明显增厚,伴中性粒细胞浸润。阳性对照组大鼠肺泡间隔明显增宽,肺泡壁损伤、断裂,结构紊乱,组织间有渗出的红细胞,肺泡腔内可见红细胞及纤维蛋白,支气管壁明显增厚,中性粒细胞浸润。正常对照组大鼠肺泡大小均匀,结构完整,肺泡间隔未见明显增宽或轻微增宽,微血管未见充血和淤血,肺泡腔内无红细胞或纤维蛋白渗出,支气管壁未见明显增厚,见图2a-e。

图2 肺组织病理变化
5 肺组织病理评分 SD血浆组分别与BN血浆组、人血浆组、阳性对照组的肺损伤程度病理评分差异均有统计学意义(P<0.05),SD血浆组与正常对照组病理评分差异无统计学意义(P>0.05);BN血浆组与人血浆组的肺损伤程度病理评分差异无统计学意义(P>0.05),BN血浆组分别与阳性对照组、阴性对照组的肺损伤程度病理评分差异均有统计学意义(P<0.05);人血浆组与阳性对照组的肺损伤程度病理评分差异均无统计学意义(P>0.05),而与正常对照组病理评分差异有统计学意义(P<0.05),见表3。

表3 各组大鼠肺损伤病理评分
6 大鼠血浆BNP测定 SD血浆组、BN血浆组、人血浆组、阳性对照组和正常对照组大鼠实验前后BNP均未见明显变化,相互比较差异均无统计学意义(P>0.05);实验前后BNP差值,各组两两比较,差异均无统计学意义(P>0.05),见表4。
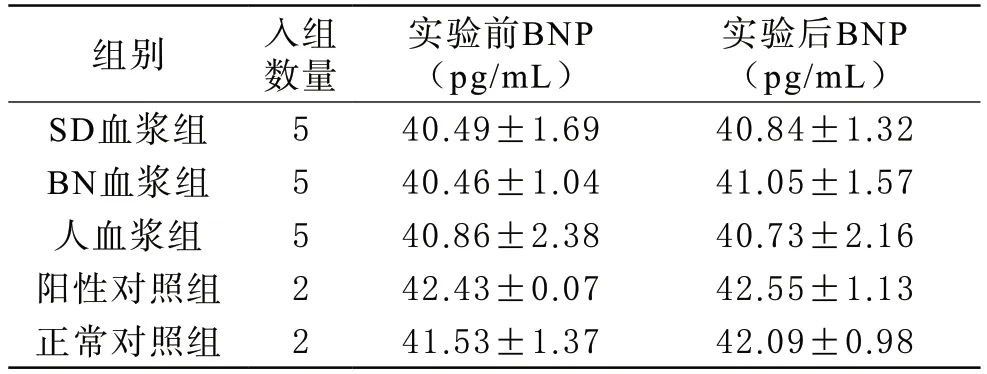
表4 各组大鼠输血前后BNP变化
讨 论
输血相关性急性肺损伤是输血相关性死亡的主要原因之一[2],直到目前TRALI的发病机制尚不明确,主要有二次打击学说、抗原抗体学说、阈值学说等[4]。国内外学者主要基于二次打击学说[5-8]进行相关研究。研究发现患者在输血前出现严重感染、休克、心血管疾病、血液系统恶性肿瘤、机械通气等因素后,导致循环中的中性粒细胞被激活,从而增加患病易感性[9]。输注血液制剂后,特异性抗原抗体反应(主要是白细胞)和生物活性物质作用于肺血管的内皮细胞,使肺循环中的白细胞尤其是嗜中性粒细胞被进一步激活,释放大量炎性介质,导致肺血管内皮细胞受损和肺泡毛细血管膜通透性增加,发生非心源性肺水肿[10]。据文献报道血液在存储过程中也会发生若干可逆和不可逆的变化,如pH值降低,三磷酸腺苷、2,3-二磷酸甘油含量减低,蛋白质、脂质变性,钾离子、血红蛋白以及其他细胞内成分释放至细胞外,以及细胞膜和细胞骨架的改变等。这些生物活性成分也可激活中性粒细胞促发TRALI[11]。
本实验基于“二次打击学说”原理,研究分别输注人血浆与同种同源性大鼠血浆及异源性大鼠血浆是否能诱导建立TRALI大鼠模型,明确其可行性、有效性、重复性和稳定性。本实验所选用SD大鼠来源于Wistar大鼠,毛色为白色,同品系大鼠之间互相排斥情况极弱。BN大鼠来源于野生大鼠,毛色为棕色,与SD大鼠亲缘关系较远,有文献报道使用BN大鼠建立移植物急性排斥反应模型[11]。故本实验中选用BN大鼠。另外,血液成分的储存时间也与TRALI发生具有相关性。有研究证明大鼠血液较人血液更易发生储存期内相关理化性质的变化,在相同条件下储存7天的大鼠红细胞与储存28天的人红细胞发生的储存期变化相似[10]。为了使血浆诱导建立模型效果更佳,本实验研究采用人血浆是储存21天的人全血分离制备;SD大鼠及BN大鼠血浆分别采用SD大鼠及BN大鼠储存7天后全血分离制备。
本研究表明输注人血浆组大鼠均出现明显的TRALI相关临床症状;输注BN血浆组大鼠中只有60% 出现不同程度的TRALI相关临床症状;输注SD血浆组大鼠几乎均未出现TRALI相关临床症状。另外,输注人血浆组大鼠肺组织湿/干重比及肺损伤病理评分与输注SD血浆组大鼠有明显区别;输注BN血浆组与SD血浆组大鼠在肺损伤病理评分也有明显不同。特别值得一提的是本研究各组实验前后BNP浓度未出现明显变化,进一步表明各组大鼠出现相关临床症状与病理变化均与输血量及速度引起循环超负荷征象无关。
总之,输注人血浆能有效诱导建立TRALI SD大鼠模型,且具有重复性和稳定性;输注BN大鼠血浆的SD大鼠只有部分出现TRALI相关临床表现且病理损伤变化较轻,而输注SD大鼠血浆的几乎不能诱导SD大鼠产生TRALI相关变化。然而,为何人血浆比BN大鼠和SD大鼠血浆诱导建立TRALI SD大鼠模型效果更佳,其机制有待于今后扩大样本量进行深入研究。
利益冲突所有作者均声明不存在利益冲突
