蛋白质-多酚复合物的形成机制及其功能性变化研究进展
2022-04-12赵钜阳袁惠萍孙昕萌
赵钜阳,袁惠萍,孙昕萌
(哈尔滨商业大学旅游烹饪学院,黑龙江哈尔滨 150030)
多酚类物质是广泛存在于食物中的一类重要的植物化学物质[1],目前相关研究已表明这些多酚类物质在多种疾病中具有较强的抗氧化[2]以及抑菌[3]、抗衰老[4]等功效。在食品体系中,多酚可与蛋白质通过可逆和不可逆的方式发生相互作用形成复合物,进而影响蛋白质结构、功能和生物利用度等[5-6]。相互作用方式影响蛋白质与多酚结合程度,另外,不同的反应条件下多酚与蛋白的结合程度也受到一定的影响,因此由于蛋白质与多酚种类、二者反应条件不同,均会影响多酚与蛋白质的结合位点、结合程度,二者形成的复合物结构也不同,进而导致复合物的功能性以及营养学等方面性质发生改变[7-8]。蛋白质的结构影响功能性(溶解性、乳化性、凝胶性等),利用其功能性可拓宽蛋白质的应用范围,因此为更好地了解蛋白质与多酚的相互作用,拓宽其应用,学者需借助研究方法更为清晰的了解互作机理,研究二者之间功能性等变化。
近些年来,已有较多学者研究蛋白质与多酚相互作用机制[9],已经明确二者之间的相互作用方式,但未能形象地总结二者的研究方法[10],研究蛋白质-多酚复合物的功能及营养学特性等方面的综述也不系统。基于此,本文综述了近年来有关于蛋白质-多酚复合物形成机制,介绍了可逆和不可逆的两种相互作用方式,及其对蛋白质结构特性、食品感官及营养学特性等方面影响的研究进展,以期为未来蛋白质-多酚复合物的发展提供参考意见。
1 蛋白质-多酚复合物的形成机制
蛋白质-多酚复合物的作用类型主要是可逆和不可逆相互作用作用[11],其中可逆相互作用主要指非共价相互作用,其复合物主要以自组装的形式形成,目前此方面国内外学者研究较多;不可逆相互作用主要指共价相互作用,其复合物主要在加热、碱性或酶催化条件下形成,针对此方面研究相对较少[12]。
1.1 可逆相互作用
可逆相互作用指的是非共价相互作用,包括氢键、疏水相互作用、范德华力和离子相互作用[13]。目前研究主要集中在可逆相互作用,这主要是由于缺乏合适的方法来测定复合物的结构。一般来说,蛋白质-多酚复合物的形成主要依赖于氢键(图1a)和疏水相互作用(图1b),其次是其他相互作用(如离子键)(图1c)。针对可逆相互作用方面学者已经进行了关于多酚与唾液蛋白、牛血清白蛋白、β-乳球蛋白、卵清蛋白、溶菌酶、乳铁蛋白和酪蛋白等方面的研究[14]。
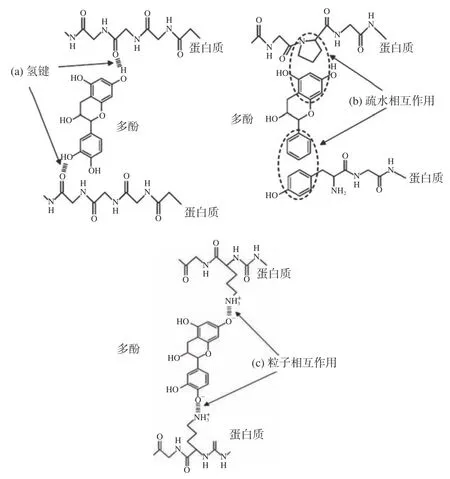
图1 蛋白质和多酚的非共价相互作用位点[15]Fig.1 Non-covalent interaction sites of protein and polyphenol[15]
1.2 不可逆相互作用
不可逆相互作用指的是共价相互作用[16],共价相互作用制造蛋白质-多酚复合物的常用方法的原理如图2 所示。碱性反应是多酚和蛋白质结合常用的非酶方法之一,多酚在碱性(pH9.0)及有氧的条件下被氧化形成半醌,然后再重排成醌。这些中间产物易与蛋白质侧链中的亲核残基(蛋氨酸、赖氨酸、色氨酸和半胱氨酸)反应,可以形成蛋白质和多酚之间的共价交联(C–N 或C–S)[17](图2a)。Gu 等[18]发现自由基诱导产生的共轭物比碱性方法形成的共轭物具有更高的抗氧化活性。此外,反应可在室温下进行,不会产生有毒产物或分解抗氧化剂[19]。因此,该方法被认为是制备具有生物活性高的蛋白质-多酚复合物的有效合成方法。
酶法是一种环境友好、特异性高的方法,其合成的复合物具有较强的自由基清除活性。然而,所用的制备和程序复杂且昂贵[18]。首先酚酶诱导多酚氧化成邻二酚,随后,在氧气条件下,邻二酚酶(漆酶)将邻二酚转化为邻醌[17](图2b),活性醌可与蛋白质链中的亲核氨基酸残基相互作用形成交联蛋白质或聚合物。
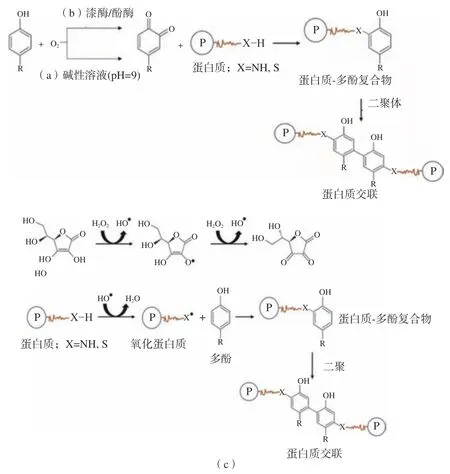
图2 蛋白质和多酚的共价相互作用机理[15]Fig.2 Covalent interaction mechanism of protein and polyphenol[15]
对于非酶法,采用自由基接枝(图2c)、抗坏血酸和过氧化氢,非酶法简单快捷,应用广泛。首先,位于蛋白质侧链上的氨基酸被自由基氧化,然后自由基通过共价键与多酚反应,形成较强的相互作用以及高稳定性的蛋白质-多酚复合物。
2 蛋白质-多酚复合物对蛋白质结构及功能性的影响
2.1 蛋白质-多酚复合物对蛋白质结构的影响
多酚的加入会对蛋白质的结构产生影响,从而引起蛋白质功能性发生变化[20-22]。蛋白质的一级、二级、三级结构会由于多酚而发生变化,其中二级结构中的α-螺旋的含量减少,向无规则卷曲转变,蛋白质较不稳定。Li 等[23]研究水稻蛋白与花青素的相互作用,SDS-PAGE 结果表明,花青素不会影响蛋白质的一级结构,但水稻蛋白二级结构发生改变β-折叠含量的增加和其它结构(α-螺旋、β-转角和无规则卷曲)的减少以及酰胺Ⅱ带的光谱位移。皮俊翔等[24]研究茶多酚对面筋中的面筋蛋白的影响,研究结果表明茶多酚使面筋蛋白游离氨基和自由巯基的含量增加,蛋白二级结构向无序化转化,并同时使蛋白质中色氨酸残基逐渐暴露。Chen 等[25]研究发现pH 可使乳清分离蛋白中游离巯基含量降低和二硫键含量增加,α-螺旋和β-折叠含量减少,而β-转角和无规则卷曲含量增加。Chen 等[26]研究发现预热处理的花青素-3-O-葡萄糖苷的结合使大豆分离蛋白(SPI)的二级结构发生变化,α-螺旋和无规卷曲结构减少,β-折叠和β-转角增加,能显著提高花青素-3-O-葡萄糖苷的热稳定性和氧化稳定性。Jiang 等[27]花青素与SPI 共价结合后,α-螺旋和β-折叠的含量减少,从而改变了SPI 的二级结构,且由于多肽链的展开,SPI 的三级结构也受到了影响。
2.2 蛋白质-多酚复合物对蛋白质功能性的影响
蛋白质和多酚之间的相互作用影响蛋白质的二级和三级结构[28],进而改变蛋白质的表面疏水性,从而增强蛋白质的亲水性。蛋白质亲水/疏水平衡的变化可能会影响蛋白质-多酚复合物的溶解性,进而影响其他重要功能特性。目前对于蛋白质-多酚复合物对蛋白质的功能性质造成影响的研究主要集中在蛋白质的起泡性、溶解性、凝胶性、乳化性等。影响蛋白质与多酚相互作用的主要因素有两个,包括外在(pH 和温度[29])和内在(多酚和蛋白质的结构和类型[30])因素。
2.2.1 溶解性 蛋白质溶解度是确定蛋白质在不同食品体系中的各种功能的一个重要性质[31],蛋白质与多酚的结合对蛋白的溶解性具有两面性。一方面研究表明多酚的加入会提高蛋白质的溶解性,例如,乳清分离蛋白和酪蛋白与绿原酸非共价作用后,蛋白质溶解度可增加[32]。Hasni 等[33]研究茶多酚与酪蛋白之间的相互影响,结果表明茶多酚与蛋白质之间的相互作用力是氢键、疏水键,二者发生交联作用,改变蛋白质的电荷,提高溶解性。另一方面,多酚的加入会降低蛋白质的溶解性。Prigent 等[32]研究发现添加原花青素后,在pH4.0~6.0 范围内,蛋白质溶解度降低,其原因是带电荷的多酚类物质的附着可能会改变蛋白质的电性,特别是当pH 在蛋白质等电点附近时,可能会改变蛋白质的溶解度曲线。除此之外,若结合的多酚为非极性时,则会导致蛋白质表面疏水性增加,致使其溶解性降低。非极性多酚类物质的结合增加了蛋白质的表面疏水性,这不仅可以增加其表面活性,还可以降低其溶解性。多酚和蛋白质之间的反应可能促进蛋白质的交联,这也可能降低其溶解性。但是二者复合后会促使多酚的溶解性提高,因此可以通过蛋白质-多酚复合作为多酚输送载体。Chen 等[34]研究姜黄素与未加热和加热(75~95 ℃)大豆蛋白的络合,与在水中的游离姜黄素相比,姜黄素的溶解性在水中的络合度超过98000 倍。
2.2.2 乳化性 为了稳定食品乳状液,通常在食品体系中加入乳化剂以保证乳状液的稳定性[35]。蛋白质与多酚的复合是修饰蛋白质功能的有效途径,合成具有优良乳化性能的蛋白质-多酚复合物。目前已有大量研究表明多酚的加入可提高蛋白质的乳化性和乳化稳定性。江连洲等[36]研究热处理的SPI 与花青素相互作用机制,发现花青素的加入可提高SPI 乳化性、乳液稳定性等性能。Anwika 等[37]研究SPI-茶多酚复合物显著提高SPI 的乳化能力,可达43%,乳化稳定性可达59%。以绿茶多酚提取物添加量0.75%制备的SPI-茶多酚复合物具有较好的乳化性能。不同的多酚类型对蛋白质-多酚复合物乳化性也有差异,Liu 等[38]采用自由基接枝法合成了乳铁蛋白-多酚(EGCG、绿原酸和没食子酸)复合物,其乳化性能优于未改性的乳铁蛋白,与乳铁蛋白-EGCG 复合物和乳铁蛋白-没食子酸复合物相比,乳铁蛋白绿原酸复合物显示出更高的乳化性能。
2.2.3 凝胶性 多酚能与蛋白质相互作用形成蛋白质-多酚复合物,产生具有改进性质的凝胶。一般来说,蛋白质的氧化不可避免地发生在肉制品中,与加工过程中天然肉肌肉的破坏有关[39]。当多酚类物质被加入肉制品,蛋白质被氧化,随后产生醌。因此,氨基酸基团和醌的反应导致凝胶性能增强,从而形成弹性凝胶网络。蛋白质-多酚复合物的凝胶与添加多酚的量具有一定的影响。Cao 等[40]研究了不同浓度的没食子酸对氧化肌原纤维蛋白质凝胶特性的影响,当没食子酸浓度分别为6 和30 μmol/g 时,肌原纤维蛋白质的胶凝势提高了近50%,这与蛋白质的展开及二硫键的形成有关。然而,当没食子酸浓度为150 μmol/g 时,会诱导肌原纤维蛋白质的聚集,形成不溶性聚合物,导致凝胶结构变差。李立敏等[41]研究表明,添加适量的茶多酚能显著改善羊肉肌原纤维蛋白的凝胶性能,凝胶的微观结构致密、间隙小、形状规则、分布均匀。
2.2.4 其他性质 多酚会影响蛋白质-多酚复合物的起泡性等性质。Sui 等[42]研究不同浓度的花青素对蛋白质结构的影响,结果表明花青素提高了大豆分离蛋白的乳化和发泡性能。岳鑫[43]研究发现红松种鳞多酚提高了乳清蛋白的起泡性,当红松种鳞多酚添加量为0.8%时,乳清蛋白的起泡性达到最佳,并且红松种鳞多酚增强了乳清蛋白的持油性和持水性。此外,蛋白质-多酚复合物的形成可提高蛋白的抗氧化能力,如Xiang 等[44]研究发现与游离态的姜黄素相比,在1%和8%的蛋白质含量下,SPI、经谷氨酰胺酶处理的大豆蛋白及其与姜黄素的复合物均表现出显著的DPPH 自由基清除活性,这可能是由于游离形式的姜黄素在水中溶解度和稳定性较差。蛋白质-多酚复合物的形成有助于进一步提高多酚的抗肿瘤能力,如陈飞平[45]研究发现大豆蛋白-姜黄素复合物可提高姜黄素对HepG2 细胞的增殖抑制活性。
3 蛋白质-多酚复合物对营养学特性及食品感官特性的影响
3.1 蛋白质-多酚复合物对蛋白和多酚营养学特性影响
蛋白质的营养学特性主要包含其人体胃肠道消化性的变化和营养价值评估。其中食源蛋白质的营养价值取决于其蛋白质来源、氨基酸组成、必需氨基酸的比例、加工条件等因素[46]。目前已有相关研究表明蛋白质-多酚复合物的形成影响蛋白质的消化特性及营养学特性[47],例如多酚-蛋白质共价复合物的形成会改变蛋白质的氨基酸分布,蛋白质与水解酶的相互作用会干扰蛋白质在体内的消化与吸收。牛奶蛋白质与咖啡酸在加热过程中发生相互作用,形成复合物,导致牛奶营养价值降低,表现为可用赖氨酸和硫醇基团的数量减少,这与咖啡酸氧化导致醌产生以及随后与氨基酸形成络合物有关[48]。高粱中主要高粱蛋白(高粱醇溶蛋白)与单宁发生相互作用,形成复合物,导致高粱蛋白质消化率降低[49]。
另一方面,蛋白质-多酚复合物不仅可影响蛋白的营养学特性,也会显著影响多酚的营养学特性,这主要表现为多酚生物利用度的提高。Kadam 等[50]模拟体外模拟胃肠消化,结果表明复合后姜黄素的生物利用率由67%提高到95%。Francisco 等[51]研究发现槲皮素负载的玉米醇溶蛋白纳米颗粒在胃肠消化过程中较为稳定,提高了槲皮素的生物利用度。Jing 等[52]研究茶多酚-蛋清蛋白复合物对蛋清蛋白消化率的影响,发现茶多酚-蛋清蛋白复合物显著提高了消化率,其原因可能是复合物松散表面结构为消化酶提供了更多的反应位点。Liu 等[53]研究发现,与游离的白藜芦醇相比,α-乳清蛋白、壳聚糖和白藜芦醇三者间复合物的生物可利用度明显提高50%以上。
3.2 蛋白质-多酚复合物对食品感官的影响
多酚与蛋白质的共价作用会引起食品体系混浊、颜色、风味等的变化,多酚和蛋白质的共价作用会使体系的浊度降低。蛋白质-多酚复合物可引起食品体系浑浊,例如油菜籽蛋白产品的颜色变暗和不良风味的出现与其中多酚和蛋白质的作用也有密切的关系。
蛋白质-多酚复合物可影响食品体系的颜色,其颜色主要依赖于多酚以及蛋白质与多酚相互作用。曾亮等[54]研究发现,儿茶素在贮藏期间能显著改变鸭胸肉的白度、红度和黄度,对肉的白度和黄度有较好的影响,对肉的红度有负面影响。刘芝君等[55]研究发现,添加茶多酚能抑制脂肪氧化变质,能使腊肉保持较好的颜色。
蛋白质-多酚复合物可影响食品体系的风味。生活中比较常见的涩味和植物多酚的存在有着密不可分的关系[56]。涩味是与食用富含酚类化合物的食品和饮料(例如茶、可可、葡萄酒和精选水果)有关的风味之一[57]。酚类化合物和唾液淀粉酶之间的相互作用导致涩味,用蛋白对葡萄酒进行细化以减轻其涩味是一种常见的酿酒工艺。葡萄酒的颜色变化与形成更稳定的色素(例如吡喃花色素、白藜芦醇四聚体和葡萄花青素的衍生物)有关。微氧化处理包括红酒与氧气的接触,稳定颜色并改善风味和香味,影响酚类化合物结构,从而改变涩味[58]。除了涩味外,还可影响食品体系的其他风味。梁慧等[59]研究了茶多酚对鸡氧化性脂肪诱导的蛋白质变性的影响,结果表明,茶多酚能抑制鸡肉氧化脂肪的降解,延长鸡肉的货架期。
4 蛋白质-多酚复合物形成机制的常见研究方法
多酚和蛋白质的结合方法可通过计算结合常数来确定力的类型,分析结合前后蛋白质构象变化。除紫外可见吸收光谱、荧光光谱、傅立叶红外光谱等常规方法外,分子对接、圆二色谱、拉曼光谱、核磁共振、等温滴定量热法等新方法逐渐被用来分析多酚与蛋白质的相互作用机理。
4.1 分子对接
分子对接是利用计算机软件进行处理的技术,通过分子对接可以得到多酚与蛋白质相互作用的最佳结合自由能、结合位点和作用力类型,对结合位置和结合亲和力能更准确的预测,可大大减少昂贵的实验工作[60]。胡淼等[61]通过分子对接的方法模拟了矢车菊素-3-葡萄糖苷分别与11S 蛋白、7S 蛋白的最优结合构象,它们之间存在较强疏水作用力的同时,部分结构之间也形成了氢键,有助于复合体系的形成(图3)。范金波等[62]利用荧光光谱法结合分子对接探究咖啡酸与牛血清白蛋白相互作用机制,分子对接结果表明两者结合的主要驱动力为氢键、静电相互作用和疏水相互作用,结合位点为位点I。Fu 等[63]采用分子对接研究了酸性和中性pH 环境下花青素-3-O-葡萄糖苷与卵清蛋白的相互作用,结果表明,二者间的作用力主要是氢键和范德华力。
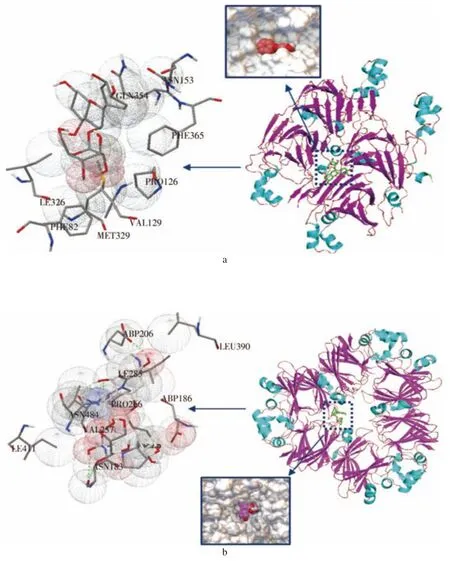
图3 11S 蛋白(a)、7S 蛋白(b)与矢车菊素-3-葡萄糖苷的对接结构结构图[61]Fig.3 docking structure of 11S protein(a)and 7S protein(b)with cyanidin-3-glucoside[61]
4.2 圆二色谱
蛋白质的远紫外圆二色谱反映了蛋白质二级结构的特征,可用来分析α-螺旋、β-转角等构象含量,因此通过圆二色谱可分析蛋白质-多酚复合物近紫外圆二光谱(>250 nm)酪氨酸和色氨酸等残基微环境,进而判断蛋白的三级结构的变化[64]。多酚与蛋白质复合后,最常见的表现是其α-螺旋含量减少,无规则卷曲结构的增加,这说明多酚的加入会促使蛋白结构展开,向不稳定、不规则的结构转变。朱颖等[65]利用圆二色谱研究发现了大豆蛋白和花青素非共价相互作用后,其α-螺旋相对含量减少,β-折叠相对含量上升的现象。Chen 等[66]利用圆二色谱研究表明,pH 显著增加了负峰的强度,并引起了峰波长的蓝移,β-折叠和α-螺旋向β-转角和无规则卷曲转变。徐洁琼[67]利用圆二色谱研究热处理下β-乳球蛋白及与茶多酚复合物的二级结构含量,发现β-转角和α-螺旋向β-折叠和无规则卷曲转变。
4.3 拉曼光谱
拉曼光谱可以得到蛋白质侧链的微环境以及多肽链骨架构型的信息[68]。虽然拉曼光谱结果反映的是蛋白质二、三级结构的变化,但是多酚与蛋白质复合后,其拉曼光谱结果较为复杂,并未有较为统一的规律,这可能是由于不同来源的蛋白质与多酚微环境复杂,会影响光谱信噪比。例如Bhattacharya 等[69]利用拉曼光谱研究发现,EGCG 结合后蛋白质的螺旋含量随着无序结构的增加而减少。然而谢凤英等[70]得到的拉曼光谱结果正相反,其研究荞麦多酚与米糠蛋白复合后可通过破坏二硫键提高米糠蛋白的稳定性。此外,由于拉曼光谱主要集中于蛋白质的二级结构,因此若体系里多酚含量较大时,其特征峰几乎未见。如Liu 等[71]对利用拉曼光谱分析负载白黎芦醇和姜黄素的纳米颗粒,并未观察到多酚官能团特征峰。
4.4 荧光光谱
荧光光谱可通过内源性荧光光谱图中荧光强度的变化分析蛋白质-多酚复合物酪氨酸和色氨酸等残基微环境,还可通过Stern-Volmer 方程分析获得酚类化合物与蛋白质亲和性的结合常数、结合位点和结合力类型,进而探究多酚-蛋白的结合机制。此外,同步荧光光谱通过设置改变激发波长分别获得色氨酸和酪氨酸的微环境变化;三维荧光光谱既可通过峰a 获得酪氨酸和色氨酸残基的微环境,又可通过峰b 获得蛋白质多肽链的骨架结构变化。Li 等[72]利用内源性荧光光谱研究发现疏水键和氢键是水稻蛋白-花青素复合物形成的主导力,并且二者之间是静态淬灭。江连洲等[36]通过内源性和三维荧光光谱研究发现花青素与热处理的SPI 的荧光淬灭机制为静态淬灭,色氨酸和酪氨酸的微环境发生改变。操强等[73]利用内源性、同步和三维荧光光谱研究发现白藜芦醇使卵白蛋白氨基酸微环境发生变化,进而导致蛋白质三级结构发生改变,其淬灭为动态淬灭,作用力为氢键和范德华力。
4.5 核磁共振
核磁共振主要用于确定分子的结构,可监测到蛋白质信号的化学位移变化,目前核磁共振和分子模型的结合也被成功地用于在分子水平上理解蛋白质与多酚复合物结合过程。Silva 等[74]利用核磁共振技术研究唾液蛋白与食物单宁的分子相互作用,结果发现单宁-蛋白质的主要驱动力是疏水键。Eaton等[75]利用核磁共振测定了EGCG 对人血清白蛋白的亲和力,结果表明几乎所有的EGCG 都是在血液中与白蛋白结合运输的,这也解释了EGCG 在体内的广泛组织分布和化学稳定性。Faurie 等[76]利用核磁共振测定唾液肽、多酚和多糖之间的解离常数和结合位点数,得到化学位移的变化、核磁共振波峰面积的变化和形成复合物的大小。
4.6 等温滴定量热法
等温滴定量热法研究多酚-蛋白质相互作用的主要优点是可获得每个样品产生的有关焓、熵、亲和力、比热容和化学计量的信息,进而通过多酚-蛋白质结合常数、相互作用类型等洞悉二者复合机制[77]。王颖等[78]利用ITC 研究射干苷与5 种蛋白的相互作用,得到反应的化学计量比、结合常数焓变和熵等热力学参数,结果表明射干苷与5 种蛋白(除胰蛋白酶外)发生了相互作用,生成复合物。Pattanayak 等[79]利用ITC 研究鞣花酸与人血清蛋白相互作用,两者相互作用是自发进行的,主要作用力是疏水作用和氢键。Kilmister 等[80]采用等温滴定法研究了原花青素低聚物与牛血清白蛋白的结合,原花青素低聚物的分子量影响其与牛血清白蛋白的结合,焓变和结合常数随着低聚物尺寸的增大而增大。
5 结论与展望
蛋白质-多酚复合物可以通过共价和非共价相互作用形成,制备具有高生物活性的蛋白质-多酚复合物的常见方法是自由基接枝法。蛋白质-多酚复合物的形成受环境条件(温度和pH)以及蛋白质和多酚的类型或结构的强烈影响,因而其表现出抗氧化活性和乳化性能也不同,实际应用时,可通过控制相互作用的多酚、蛋白质种类、比例及环境条件,调控并开发出具有良好营养、功能、感官和生物活性更好的新型食品配料产品。虽然目前此方面的研究较多,但由于多酚与蛋白质种类繁多,加上反应条件不尽相同,因此蛋白质影响酚类的确切机制与规律尚不明确统一。虽然酚类化合物的强化可以改善健康食品的特性,但在不同加工处理下,酚类化合物与食品成分(尤其是蛋白质)的相互作用可能会对复合物结构、抗氧化效率和蛋白质消化率产生较大的负面影响。因此,未来需要对不同基质和不同加工条件下的蛋白质-多酚相互作用进行更深入的研究,以指导开发富含营养和健康益处的富含酚类功能性蛋白食品。
