Fuchs角膜内皮营养不良患者淋巴细胞永生化细胞系的建立及验证
2022-04-12高飞胡泽斌段然慧左甜甜董喆黄杰
高飞,胡泽斌,段然慧,左甜甜,董喆,黄杰
Fuchs 角膜内皮营养不良(Fuchs endothelial corneal dystrophy,FECD)又称为滴状角膜,是角膜内皮进行性的损伤。角膜后弹力层增厚,细胞外基质赘疣沉积,最终发展成为角膜内皮失代偿为特征的进行性遗传角膜疾病[1]。在美国,40 岁以上人口约有 5% 患有此病。在亚洲,大约 70%Fuchs 角膜内皮营养不良患者含有TCF4 的重复序列扩增,而且含有 CTG 重复扩增的患者表型更严重。这一扩增将使患病风险增加 30 倍以上[2]。CTG 重复数目小于或等于 37 为正常,在 37 ~ 52 之间表明与 Fuchs 角膜内皮营养不良相关,超过 52 为 Fuchs 角膜内皮营养不良高风险[3-4]。以上重复序列扩增所导致的疾病在临床诊断中面临着巨大的挑战,表型相似性高。根据其临床症状、影像学表现等辅助检查进行分型确诊面临非常多的困难,只有通过基因突变检测才可区分各种突变型别。基因诊断是确诊和分型的金标准。TCF4 基因 CTG 重复扩增所导致的角膜营养不良的发病进程约为 10年以上,而角膜移植是挽救患者视力的唯一有效方法。因此,尽早进行基因筛查以明确病因是治疗 Fuchs 角膜内皮营养不良的有效手段。TCF4 基因突变类型与发病关系如图1 所示。
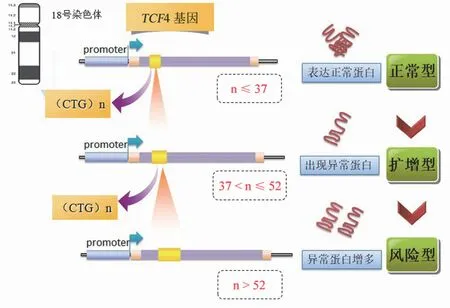
图1 TCF4 基因型与发病关系[3]
据国内外报道,FECD 是白内障手术后角膜内皮细胞功能失代偿的重要原因[5],导致术后效果不理想。因此在临床行白内障手术前进行基因筛查以排除 FECD 是有必要的。鉴于该类患者的样本获得困难且具有研究意义,对 FECD临床样本进行永生化细胞系的培养以获得稳定的研究用样本来源是至关重要的。
1 材料与方法
1.1 材料
1.1.1 样本来源 通过与中南大学医学遗传学研究中心合作获取临床样本,患者均签署知情同意书。样本信息详见表1。
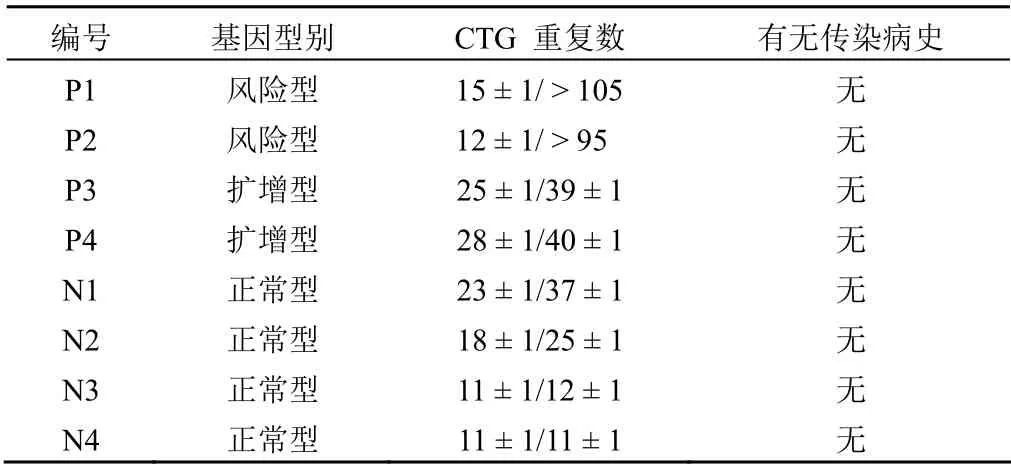
表1 8 例细胞株样本信息
1.1.2 试剂耗材 核酸提取用试剂盒购自宝生物工程(大连)有限公司;永生化细胞系建立所需试剂购自美国 Gibco Life Technologies 公司;永生化细胞系验证所需试剂盒购自广州市达瑞生物技术股份有限公司;NanoDrop one 微量分光光度计为美国 ThermoFisher 公司产品。
1.2 方法
1.2.1 EBV 病毒液制备 采用 RPMI1640 + 1 × 双抗培养液培养 B95-8 细胞至 100 ml,饥饿细胞 5 ~ 7 d 后于-80 ℃ 冰箱冻存,反复冻融 3 次后,2000 r/min 条件下离心 10 min,取离心后的上清液用 0.2 μm 滤膜过滤并放置于 -80 ℃ 冰箱待用。
1.2.2 分离 Fuchs 角膜内皮营养不良患者淋巴细胞 使用肝素抗凝管采集患者外周静脉全血 5 ml 并转移至离心管中,分别吸取 2 ml RPMI1640 培养基及 4 ml 淋巴细胞分离液加入含有外周血的离心管内,充分混匀后在2500 r/min 条件下离心 15 min,然后吸取白色的淋巴细胞层至另一试管中混匀备用。
1.2.3 淋巴细胞的永生化培养转化 使用 RPMI1640 培养基将分离的淋巴细胞洗涤 2 次后在 1000 r/min 条件下离心 15 min,弃去上清并加入 EBV 病毒液 1.5 ml 及环孢菌素 A 0.2 ml,置于 5% 二氧化碳培养箱内于 37 ℃ 培养24 h 后使用显微镜观察,期间根据细胞聚集生长的状况进行加液或换液,当永生化细胞的生长数量达到 3 × 106个/ml后,将细胞吹匀备用。
1.2.4 永生化细胞系的冻存 细胞冻存前 24 h,需进行细胞换液;将转化完成的细胞收集到离心管后,于 1000 r/min离心 10 min,弃去上清;分装于冻存管中,每管需加入 1 ml冻存液,置于 -70 ℃ 2 h 后,于液氮中长期保存。
1.2.5 永生化细胞系的质量及稳定性观察 冻存细胞复融并传 6 代后镜下观察细胞形态及细胞生长环境。
1.2.6 永生化细胞系的分子生物学验证 将 Fuchs 角膜内皮营养不良永生化细胞系取出复苏后提取 DNA,再进行荧光 PCR-毛细管电泳检测。
2 结果
2.1 永生化细胞系的质量及稳定性控制结果
8 份细胞株样本在复苏并培养 7 d 时,在显微镜下可见表面光滑的淋巴细胞发生增大和聚团,且细胞周边有胞质突出的现象(图2);30 d 及冻融传代后,显微镜下可见淋巴细胞生长为密集的细胞团且外壁有不规则毛刺状(图3、图4),表明细胞成功转化为淋巴母细胞样永生化细胞。
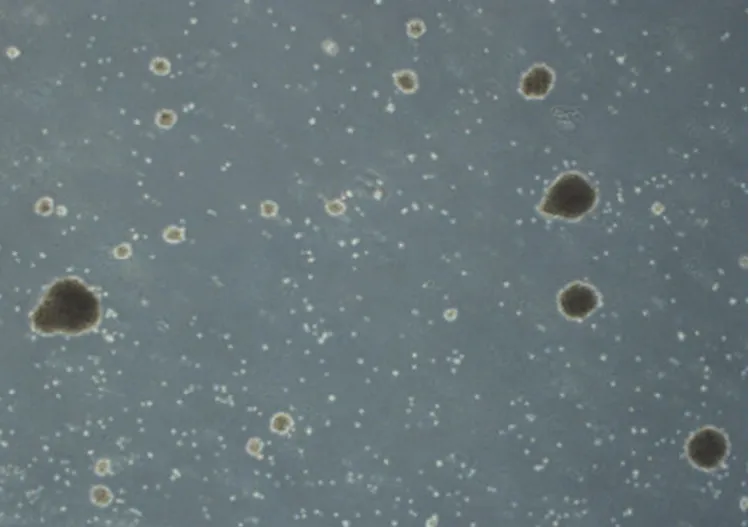
图2 永生化转化第 7 天结果(40 × 显微镜下观察)
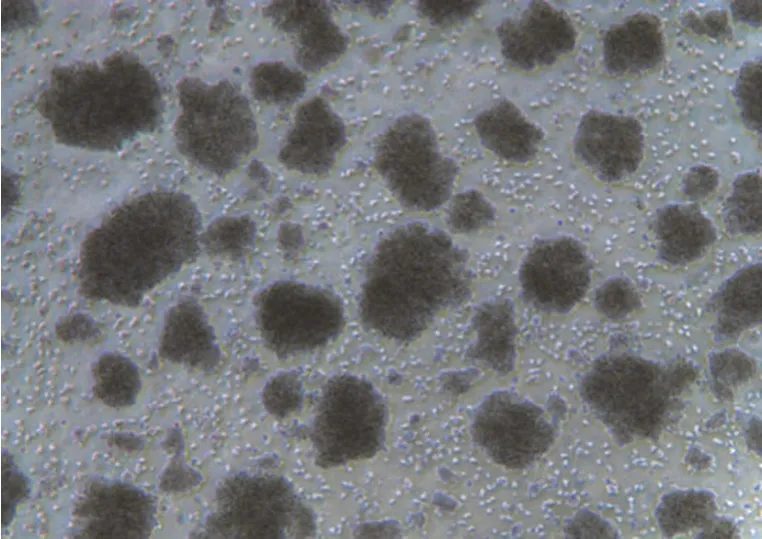
图3 永生化转化第 30 天结果(40 × 显微镜下观察)
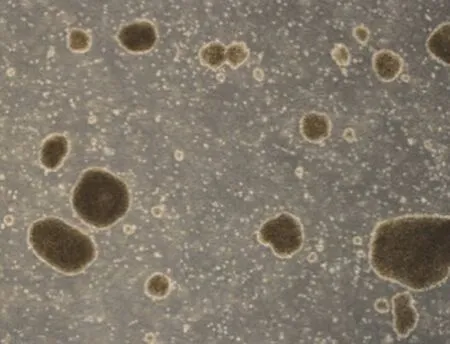
图4 复融并传 6 代后结果(40 × 显微镜下观察)
2.2 永生化细胞系分子生物学验证结果
提取 8 份永生化细胞株样本的 DNA,提取的 DNA采用 NanoDrop 核酸蛋白测定仪测定OD260/OD280和OD260/OD230值,确定 DNA 的质量和浓度;同时,对样本进行荧光 PCR-毛细管电泳法检验分析,分析结果显示全部阳性样本的碱基序列与样本 CTG 重复数一致。检测结果见表2、图5。
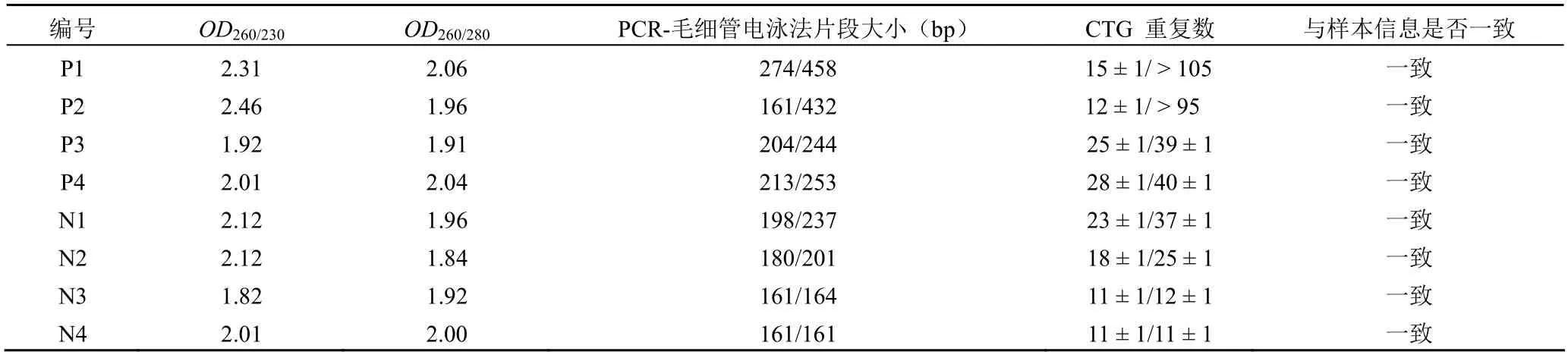
表2 8 份 FECD 样本永生化验证结果
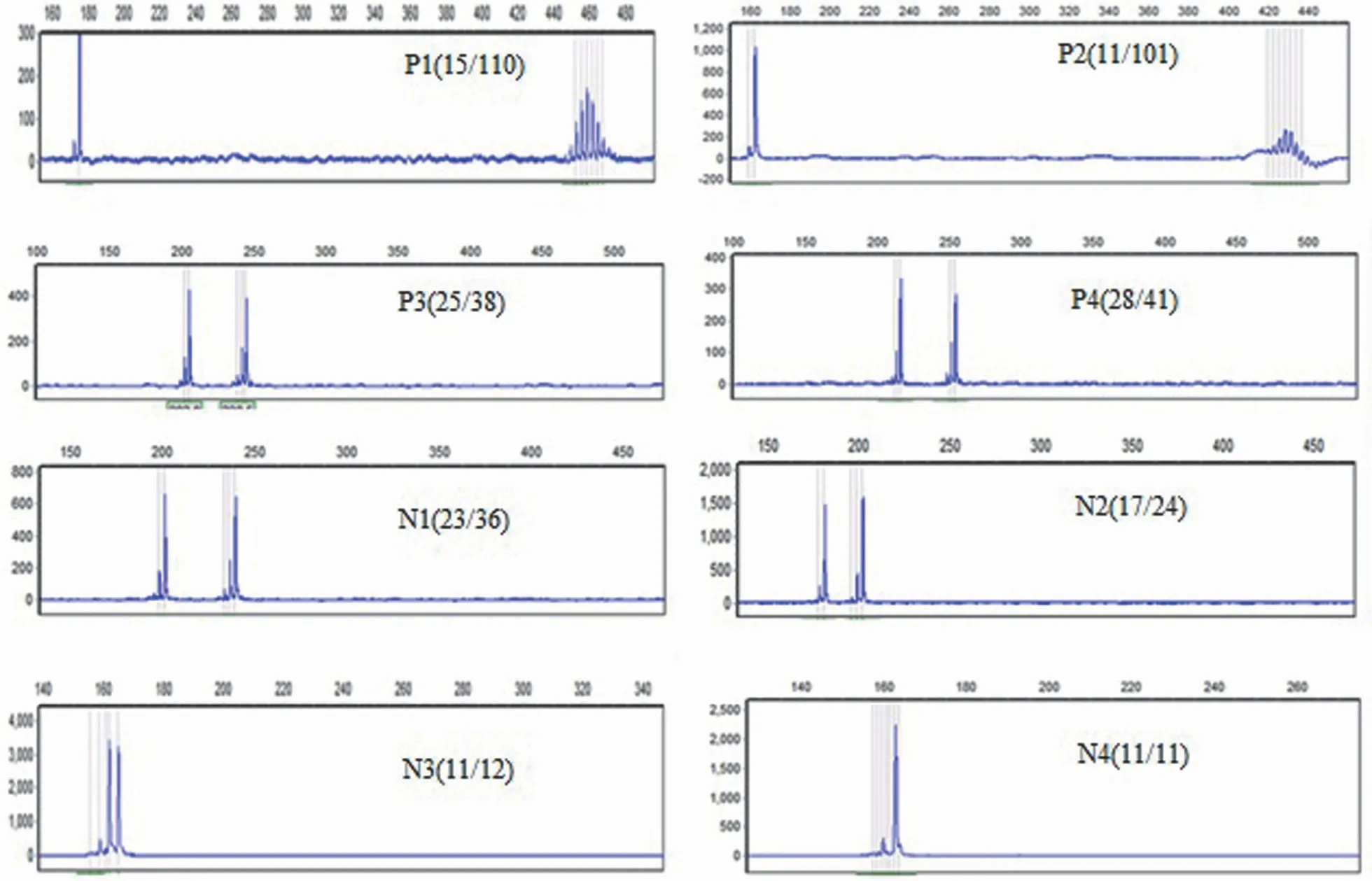
图5 8 份 FECD 样本的永生化细胞系荧光 PCR-毛细管电泳结果
3 讨论
永生化淋巴细胞系是一类包含人类全基因组用于人类基因研究的重要细胞资源,也是人类遗传疾病资源保存与应用的技术手段及首选方法[6]。目前,全球较大规模的细胞遗传资源保藏机构包括美国国家人类基因突变细胞中心、英国生物样本库和美国国立卫生研究院等,上述机构均采用永生化转化技术作为最主要的遗传资源保存方法[7]。永生化细胞系具备一些明显的优势:转化所需样本量少、转化所需实验设备简单、转化方法规范易操作;更为重要的是采用取之不尽的人类细胞资源用于遗传性疾病研究的这一方式具有一定的创新性和实用性。
研究采集的样本是经肝素钠抗凝的 FECD 各突变型别的人外周血;经反复实验明确了低密度接种法,即采用转化细胞的密度为 1 × 105个/ml,该密度可以减少 T、B 细胞的接触,从而增加细胞转化的成功率,具有一定的创新性;同时,通过加入环孢菌素 A 进一步抑制 T 细胞活性,最终成功建立了包含 FECD 各突变类型的永生化细胞系并完成了永生化细胞的传代、冻存及复苏。同时对建系成功的永生化细胞抽提 DNA 后进行了可准确读取 CTG 重复数的荧光 PCR-毛细管电泳法验证,并进行细胞显微镜下观察,结果表明永生化状态下的TCF4 基因组 DNA 的遗传稳定,可作为稳定的研究用样本资源为相关科研机构的参考物质研制及后续的 FECD 临床检验与疾病筛查奠定坚实的基础。
